Method Article
ניתוח פעילות תאי T אנושיים במסגרת תרבית משותפת אלוגנית של תאי גידול שטופלו מראש
In This Article
Summary
הפרוטוקול הנוכחי מתאר זרימת עבודה ניסויית המאפשרת ניתוח ex vivo של גירוי תאי T אנושיים במערכת תרבית משותפת אלוגנית עם תאי גידול שטופלו מראש.
Abstract
תאי T ציטוטוקסיים ממלאים תפקיד מפתח בחיסול תאי הגידול ולכן נחקרים באופן אינטנסיבי באימונולוגיה של סרטן. התדירות והפעילות של תאי T ציטוטוקסיים בתוך גידולים ומיקרו-סביבת הגידול שלהם (TME) הם כיום סמנים ביולוגיים פרוגנוסטיים ומנבאים מבוססים היטב עבור סוגי גידולים רבים. עם זאת, ידוע היטב כי שיטות שונות לטיפול בגידול, כולל הקרנות, כימותרפיה, אימונותרפיה וטיפול ממוקד, מווסתות לא רק את החיסון של הגידול אלא גם את מערכת החיסון עצמה. כתוצאה מכך, האינטראקציה בין תאי גידול לתאי T דורשת מחקר אינטנסיבי יותר בהקשרים טיפוליים שונים כדי להבין באופן מלא את התפקיד המורכב של תאי T במהלך הטיפול בגידול. כדי לענות על צורך זה, פותח פרוטוקול לניתוח הפעילות ויכולת ההתפשטות של תאי T ציטוטוקסיים אנושיים (CD8+) בתרבית משותפת עם תאי גידול שטופלו מראש. באופן ספציפי, תאי CD8+ T מתורמים בריאים מוכתמים בסמן ההתפשטות הלא רעיל carboxyfluorescein diacetate succinimidyl ester (CFSE) ומגורים באמצעות לוחות מצופים CD3/CD28. לאחר מכן, תאי T עוברים תרבית משותפת עם תאי גידול שטופלו מראש. כקריאה, התפשטות תאי T מכומתת על ידי מדידת התפלגות אותות CFSE והערכת הביטוי של סמני הפעלת פני השטח באמצעות ציטומטריית זרימה. ניתן להשלים זאת עוד יותר על ידי כימות שחרור ציטוקינים באמצעות בדיקת אימונוסורבנט מקושר לאנזים (ELISA). שיטה זו מקלה על הערכת השינויים הנגרמים על ידי הטיפול באינטראקציה בין תאי גידול לתאי T, ומספקת בסיס לניתוחים מפורטים יותר של שיטות הטיפול בגידול והאימונוגניות שלהם בסביבה אנושית ex vivo . בנוסף, הוא תורם להפחתת ניתוחים פרה-קליניים in vivo .
Introduction
כיום, מתברר יותר ויותר כי צמיחתם והתקדמותם של גידולים תלויים מאוד במניפולציה ודיכוי יעילים של מערכת החיסון של המארח. תאים שעברו טרנספורמציה מופיעים מדי יום, אפילו באורגניזם בריא. עם זאת, היווצרות גידולים מקרוסקופיים היא אירוע נדיר למדי, שכן תאים שעברו טרנספורמציה מתעוררים מוסרים מהאורגניזם ביעילות גבוהה. להסרת תאים ממאירים, סוגים שונים של תאים חיסוניים כגון תאי T ציטוטוקסיים, תאי T הורגים טבעיים (NK), תאי NK או מקרופאגים נכנסים לפעולה 1,2,3. עם זאת, לפעמים עשויים להופיע שיבוטי תאים שעברו טרנספורמציה ששורדים במצב שיווי משקל עם מערכת החיסון של המארח, המאופיינת באסטרטגיות דיכוי חיסוני שונות של שיבוט תאי הגידול4. בסופו של דבר, חלק מהתאים שעברו טרנספורמציה רוכשים פונקציות נוספות המאפשרות לתאי הגידול לדכא באופן פעיל את התגובה החיסונית, מה שמוביל כתוצאה מכך לצמיחת הגידול. דיכוי חיסוני זה מתווך על ידי מנגנונים רבים, הכוללים ביטוי של ליגנדים מדכאי חיסון על תאי הגידול או גיוס פעיל או תחול של אוכלוסיות תאי חיסון רגולטוריים או מדכאי חיסון. מושג זה שנקרא עריכה חיסונית מדגים את תפקיד המפתח של אפנון חיסוני במהלך היווצרות הגידול וצמיחתו5.
לפיכך, אין זה מפתיע שמערכת החיסון מהווה כיום מוקד מרכזי לא רק בטיפול בסרטן אלא גם כגורם מנבא ופרוגנוסטי בישויות גידול רבות ובמסגרות טיפוליות. במהלך השנים האחרונות, מעכבי מחסום חיסוני (ICIs) עלו כאפשרויות טיפוליות מבטיחות בישויות סרטן מוצקות שונות, כגון קרצינומה של תאי קשקש בראש וצוואר (HNSCC) או סרטן ריאות של תאים לא קטנים (NSCLC) במטרה לווסת את המיקרו-סביבה של הגידול (TME) לקראת תגובה חיסונית יעילה יותר נגד הגידול ודיכוי חיסוני מופחת של תאי הגידול6. מעכבי המחסום החיסוני שואפים להגביר את הרג תאי הגידול בתיווך תאי T על ידי התמקדות במולקולות מחסום חיסוני כגון אלה של חלבון המוות המתוכנת 1 (PD-1) וציר הליגנד 1 שלו (PD1/PD-L1). עובדה זו מדגישה את תפקיד המפתח של תאי T בחסינות נגד גידולים. ב-HNSCC, למשל, ICIs אושרו בהצלחה כטיפול קו ראשון ב-HNSCC7 חוזר וגרורות. בהתאם לכך, נוכחותם של תאי T ציטוטוקסיים ב-TME, כמו גם ביטוי PD1 ו-PD-L1 על תאי הגידול ותאי T בהתאם, יכולים לשמש כסמנים ביולוגיים מנבאים ב-HNSCC 8,9,10.
למרות שלתאי T יש תפקיד מכריע באימונולוגיה של הגידול ובטיפול בגידול, עדיין יש לטפל בשאלות פתוחות רבות לגבי האינטראקציות שלהם עם הגידול. כיום, ידוע כי התגובה החיסונית של הגידול היא תהליך דינמי וכי האימונוגניות של הגידולים יכולה להשתנות במהלך המחלה והטיפולים. שיטות טיפול שונות, כגון כימותרפיה (CT), טיפול בקרינה (RT) או טיפול ממוקד (TT), ידועות במיוחד כמווסתות את הפנוטיפ האימונולוגי של תאי הגידול. RT יכול להניע את הוויסות של מולקולות מחסום חיסוני ברקמת הגידול ולשנות את תדירות התאים החודרים לגידול11,12. TT, לעומת זאת, יכול גם לתמוך בשינויים חיוביים בתוך הגידול וה-TME על ידי אפנון ישיר של התגובה החיסונית הנרכשת 13,14,15,16. עם זאת, מודולציות אלה מאתגרות למחקר בחולים, מכיוון שהדבר ידרוש בדיקה חוזרת של רקמת הגידול במהלך הטיפול. לפיכך, יש צורך במערכות מודל ניסיוניות חד משמעיות כדי לחקור את הפנוטיפ האימונולוגי הדינמי של תאי גידול ותאי T, וחשוב מכך, את האינטראקציות ביניהם.
לפיכך, לצורך ניתוח פעילות תאי T והאינטראקציות בין תאי גידול ותאי T, יש צורך בבדיקת תרבית משותפת מקיפה ex vivo שקל ליישם בכל מעבדה המבוססת על עבודת תרבית תאים פשוטה וניתוחי זרימה ציטומטריים נפוצים. בהתבסס על הספרות הקיימת והקיימת, עד כה לא פורסם פרוטוקול קל לשימוש ונפוץ לגבי תרבית משותפת של תאי T ותאי גידול. למרות שלאחרונה פורסמו מספר מבחני תרבית משותפת לתאי T ואורגנואידים של גידולים, טכניקת תרבית התאים התלת-ממדית עדיין אינה מיושמת כיום כטכניקה סטנדרטית בכל מעבדה. לפיכך, אנו מספקים פרוטוקול לשימוש בתרבית תאים דו-ממדית, שעשויה להיות מבוססת גם על תרבית תאים תלת-ממדית בעתיד. פרוטוקולים אחרים של תרבית משותפת דו-ממדית הם לרוב מורכבים יותר, מכיוון שהם דורשים, למשל, התמרה של תאי גידול עם לוציפראז17 או מתאימים רק לממאירות המטולוגית (תרבית משותפת של תאי T ללא התאמה עם תאי לוקמיה)18. בבדיקה המתוארת כאן, תאי T מתורמים בריאים רגילים מבודדים מדם היקפי ומגורים עם נוגדנים נגד CD3 ו-CD28. לאחר מכן, תאי ה-T עוברים תרבית משותפת עם תאי גידול שטופלו (מראש) על מנת לנתח את יכולת ההתפשטות של תאי ה-T כמו גם את פעילותם באמצעות זרימה ציטומטרית. לפיכך, ניתן לסנן בקלות את ההשפעות של שיטות טיפול שונות על הפנוטיפ החיסוני של תאי הגידול, כגון RT, CT או TT, אשר בתורו משפיע על פעילות תאי T והתפשטותם, ולהשתמש בהן כבסיס לניתוחים מכניסטיים עמוקים יותר ולניתוחים פרה-קליניים נבחרים רצופים. הבדיקה המתוארת כאן מציעה הגדרה קלה לשימוש, מכיוון שאין צורך במכשירים, טכניקות או חומרים לא שגרתיים. בנוסף, ניתן להתאים את הבדיקה בקלות לקווי תאי גידול שונים או תת-קבוצות ספציפיות של תאי T (למשל, תאי CD4+ T). באמצעות טכניקה זו מושגת סטנדרטיזציה ושחזור גבוהים.
Protocol
בדיקה זו כוללת משיכת דם וגידול תאים ראשוניים אנושיים. לכן, הצבעה אתית היא חובה לניתוחים אלה. כל התוצאות המוצגות בכתב יד זה מכוסות על ידי האישור האתי של ניסוי IMMO-NHD, והתקבלה הסכמה מדעת בכתב מכל התורמים. האישור ניתן על ידי מועצת הביקורת המוסדית של אוניברסיטת פרידריך-אלכסנדר-ארלנגן-נירנברג ב-9 בנובמבר 2022 (מספר בקשה 21-415-B). תאי הגידול HSC4 המשמשים במחקר זה הם מקו תאים זמין מסחרית.
בדיקה זו מדגימה את כל השלבים של בדיקת התרבות המשותפת של תאי T ותאי גידול, תוך שימוש בקו התאים של קרצינומה של תאי קשקש בראש ובצוואר האנושי (HNSCC) HSC4 במסגרת טיפול הכוללת רדיותרפיה (RT) ושני מעכבי קינאז ספציפיים. כתוצאה מכך, פרמטרים כגון מספרי תאים, זמני טריפסיניזציה ותוכניות טיפול הם ספציפיים לסביבת קו-תרבית זו ויש להתאים אותם לקווי תאי גידול אחרים (ראה גם סעיף הדיון). כל שלבי הצנטריפוגה בוצעו בטמפרטורת החדר. במחקר זה, מעכבי הקינאז AZD0156 ו-VE-822 שימשו כדי למקד את מערכת תיקון נזקי ה-DNA (DDR) של תאי HSC4. AZD0156 (Selleckchem) מעכב את החלבון המוטנטי של אטקסיה טלנגיאקטזיה (ATM), בעוד ש-VE-822 (Selleckchem) מכוון לחלבון אטקסיה טלנגיאקטזיה וחלבון הקשור ל-Rad3 (ATR). שני המעכבים נדונו כסוכנים פוטנציאליים להגברת הרגישות לקרינה בתאי הגידול. הם מומסים בדימתיל סולפוקסיד (DMSO) ומאוחסנים בטמפרטורה של -20 מעלות צלזיוס. איור 1 מספק תרשים זרימה של מבחן ex vivo , המפרט את התרבות המשותפת של תאי גידול שטופלו מראש עם תאי CD8+ T אנושיים מגורים CD3/CD28. הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
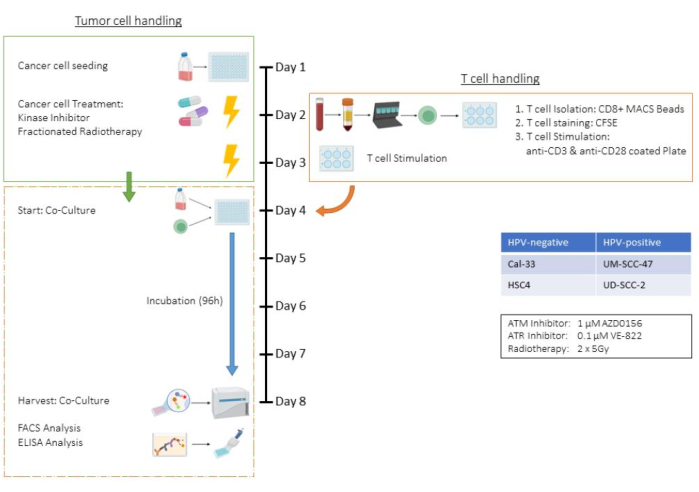
איור 1: תרשים זרימה של בדיקת ex vivo של תאי גידול שטופלו מראש בתרבית משותפת עם (CD3/CD28) תאי CD8+ T אנושיים מגורים. יום 1: זריעה של תאי גידול HSC4. יום 2: טיפול בתאי גידול ובידוד, צביעת CFSE וזריעה לתוך צלחות מצופות CD3/CD28 של תאי CD8+ T אנושיים. יום 3: טיפול בתאי הגידול. יום 4: ספירת בארות מייצגות של תאי גידול. קציר וספירה של כל תאי ה-T. גידול משותף של תאי T ותאי גידול HSC4 ביחס של 1:1. יום 5-יום 8: דגירה משותפת. יום 8: קציר תרבית משותפת, הקפאת סופרנטנטים, צביעה מבוססת נוגדנים וניתוח התאים על ידי ציטומטריית זרימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
1. זריעת תאי גידול (יום 1)
הערה: תזמון: שעה אחת. תאי גידול HSC4 אנושיים נזרעים מבקבוקי תרבית תאים T75 לצלחות של 96 בארות.
- יש להשליך את הסופרנטנט (D10 Medium) מבקבוק תרבית התאים.
- שטפו תאי גידול עם 5 מ"ל של 37 מעלות צלזיוס PBS חם. השליכו את PBS.
- מכיוון שתאי גידול HSC4 נוטים להיצמד בחוזקה לצלוחיות תרבית תאים, מומלץ טריפסיניזציה דו-שלבית כדי להבטיח שכל התאים מנותקים. לשם כך, הוסיפו 3 מ"ל טריפסין והניחו את הבקבוק על צלחת חימום בחום של 37 מעלות צלזיוס למשך 3 דקות, ואז השליכו את הטריפסין בעזרת פיפטה.
- הוסיפו עוד 3 מ"ל טריפסין, הניחו את הבקבוק על צלחת החימום והמתינו עד להשגת תרחיף חד-תאי. בדוק מיקרוסקופית אם יש תרחיף חד-תא.
- עצור את הטריפסין על ידי הוספת הנפח הכפול של D10 Medium (DMEM בתוספת 10% סרום בקר עוברי ו-1% פניצילין-סטרפטומיצין), השהה מחדש ביסודיות והעביר את התאים לצינור צנטריפוגה של 50 מ"ל.
- קבע את מספר התאים של תרחיף תא בודד, ולאחר מכן חשב את הכמות הכוללת של תאי הגידול לפי הנפח הכולל. תא תא נויבאואר מומלץ לקביעת ספירת התאים.
- צנטריפוגה צינור הצנטריפוגה של 50 מ"ל המכיל את תאי הגידול ב-300 x גרם למשך 5 דקות בטמפרטורת החדר. השליכו את הסופרנטנט.
- השעו מחדש תאי גידול HSC4 בנפח מתאים של D10 Medium כדי להגיע לריכוז של 15,000 תאים במדיום של 200 מיקרוליטר.
- על פי הטיפולים המתוכננים בתאי גידול, זרע לכל מצב לפחות 3 בארות המכילות 15,000 תאי גידול HSC4 במדיום של 200 מיקרוליטר בשתי צלחות של 96 בארות (דגימה אחת, תאי גידול 1x בקרה בלבד, ספירת תאים אחת ליום התרבית המשותפת).
הערה: מספר התא תלוי בקו התא ובזמן ההכפלה. יש לבחון את מספר התאים לטיפולים שונים בניסויים מקדימים כדי למנוע מפגש של 100% במהלך הדגירה. - דגירה של תאים למשך 24 שעות בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 ולחות רוויה.
2. טיפול בתאי גידול (יום 2)
הערה: תזמון: 3-5 שעות. לאחר זמן דגירה של 24 שעות, ניתן לטפל בתאי HSC4 שנזרעו בעבר על פי תוכנית הטיפול הרצויה. במקרה מופתי זה, תאי הגידול מטופלים במעכב ATM או ATR. כאן, בנוסף, אחת משתי צלחות של 96 בארות מוקרנת גם עם 2x 5 Gy לאחר מכן.
- הכן מעכבי קינאז כדי לקבל ריכוז של 1 מיקרומטר AZD0156 (מעכב ATM) ו-0.1 מיקרומטר VE-822 (מעכב ATR) לטיפול בתאי גידול.
- לטפל בתאי הגידול בהתאם, למשל, לטפל בשורה אחת של דגימות עם 3.1 מיקרוליטר של מעכב ATM ושורה שנייה עם 3.1 מיקרוליטר של מעכב ATR בכל צלחת.
- לאחר 3-5 שעות דגירה בטמפרטורה של 37 מעלות צלזיוס, יש להקרין צלחת אחת עם 5 Gy.
- לאחר הדגירה של 24 שעות נוספות, יש להקרין שוב את אותה צלחת עם 5 Gy.
3. בידוד תאי T (יום 2)
הערה: תזמון: 4 שעות. תאי CD8+ T מבודדים מגנטית עם מיקרו-חרוזים נגד CD8 מ-PBMCs לאחר צנטריפוגה של שיפוע צפיפות של דם היקפי (PB) שמקורו בתורמים בוגרים בריאים. לאחר מכן תאי ה-T המבודדים מוכתמים ב-CFSE ומודגרים בצלחת באר מצופה CD3/CD28 לגירוי. כדי להיות מסוגל לעבוד ידידותי למשאבים ולחומרים בשלבים מאוחרים יותר, חשוב להעריך את כמות תאי ה-T הדרושים לניסויי התרבות המשותפת. בתלות בתורם, ניתן לבודד בין 50,000,000 ל-100,000,000 PBMCs מכ-45 מ"ל של דם EDTA. כ-10% מכלל ה-PBMCs הם תאי CD8+ T.
- צנטריפוגה של שיפוע צפיפות
- להעביר 3-5 צינורות דם EDTA של 9 מ"ל שמקורם בתורם בריא לשתי צינורות צנטריפוגה של 50 מ"ל.
- מלאו את שני צינורות הצנטריפוגה ל -50 מ"ל עם PBS + 2% FBS.
- הכן שישה צינורות צנטריפוגה (עם שיבוץ פלסטיק להפרדת PBMCs) ומלא כל אחד מהם ב -15 מ"ל של מדיום שיפוע צפיפות קר + 4 °C.
- שכבו בזהירות את מדיית שיפוע הצפיפות עם 12-15 מ"ל של הדם המדולל משלב 3.1.2.
- צנטריפוגה ב-1200 x גרם למשך 10 דקות (אין צורך בהאטה).
- הכנת צלחת 6 בארות לגירוי תאי T
- הכן נוגדנים: הכן תמיסה נגד CD3 (שיבוט OKT3) של 1 מ"ג/מ"ל עם PBS. הכן תמיסה נגד CD28 (שיבוט 28.2) של 0.1 מ"ג/מ"ל עם PBS.
- המלצה: לנצל את הזמן במהלך הצנטריפוגה (שלב 3.1.5) להכנת תמיסות ציפוי ואת ציפוי הבארות עצמו לגירוי תאי T.
- ערבבו 5 מיקרוליטר של תמיסת נוגדנים CD3 עם 4.995 מיקרוליטר של PBS ו-50 מיקרוליטר של תמיסת נוגדנים CD28 עם 4.950 מיקרוליטר של PBS (ריכוז סופי: 1 מיקרוגרם/מיקרוליטר).
- הוסף 1.000 מיקרוליטר משתי תמיסות הנוגדנים לכל באר של צלחת 6 הבארות.
- מצפים 2 או 3 בארות, בהתאם לכמות הצפויה של תאי T, של צלחת 6 הבארות ודוגרים לפחות שעתיים ב-37 מעלות צלזיוס.
- הכנת מדיום תאי T
הערה: הכנת 100x L-ליזין: ממיסים 200 מ"ג L-ליזין הידרוכלוריד ב-50 מ"ל מים מזוקקים בצינור צנטריפוגה של 50 מ"ל. עקרו את התמיסה באמצעות מסנן מזרק של 0.2 מיקרומטר והעבירו אותה לצינור חדש של 50 מ"ל באמצעות מזרק זלוף של 50 מ"ל. אחסן את התמיסה בטמפרטורה של 4-8 מעלות צלזיוס והשתמש בה תוך 3 חודשים. הכנה של 15 מ"מ L-ארגינין: ממיסים 26 מ"ג L-ארגינין ב-10 מ"ל DPBS. יש לעקר את התמיסה באמצעות מסנן מזרק של 0.2 מיקרומטר ולהעביר אותה לצינור חדש באמצעות מזרק של 10 מ"ל. אחסן את התמיסה בטמפרטורה של 4-8 מעלות צלזיוס והשתמש בה תוך 3 חודשים.- השתמש בזמן הצנטריפוגה כפי שהוזכר בשלב 1.5 כדי להכין את מדיום תאי ה-T.
- הכן כ-10-30 מ"ל של מדיום תאי T, תלוי בכמות הצפויה של תאי T.
- יש לערבב את מדיום ה-RPMI נטול L-ארגינין ו-L-ליזין עם 10% FBS מומת בחום, 1% פניצילין-סטרפטומיצין, 1% L-ארגינין, 1% L-ליזין ו-1% L-גלוטמין. דוגמה: 25.8 מ"ל מדיום RPMI + 3 מ"ל FBS + 0.3 מ"ל עט/סטרפטוקוקוס + 0.3 מ"ל L-ארגינין + 0.3 מ"ל L-ליזין + 0.3 מ"ל L-גלוטמין.
- יש לאחסן את המדיום הנותר בטמפרטורה של 4 מעלות צלזיוס למשך היומיים הבאים לשימוש ביום הרביעי - תחילת תרבית משותפת. לכל ריצה חדשה של הניסוי כולו, מומלץ להכין מדיום תרבית טרי.
- בידוד PBMC
- לאחר צנטריפוגה (שלב 3.1.5) העבירו את הסופרנטנט לארבעה צינורות צנטריפוגה חדשים של 50 מ"ל והשליכו את הצינורות המשומשים.
- מלאו את צינורות הצנטריפוגה עד 50 מ"ל עם PBS + 2% FBS.
- צנטריפוגה בחום של 300 x גרם למשך 8 דקות בטמפרטורת החדר.
- השליכו את הסופרנטנט, השעו מחדש את כדור התא ב-1 מ"ל של PBS + 2% FBS כל אחד, ושלבו אותם לשני צינורות צנטריפוגה.
- מלאו את הצינורות ל-50 מ"ל עם PBS + 2% FCS.
- צנטריפוגה בחום של 120 x גרם למשך 10 דקות בטמפרטורת החדר.
- השליכו את הסופרנטנט, השעו בזהירות את כדור התא ב-1 מ"ל של PBS +2% FBS, ושלבו את שני הכדורים בבז אחד.
- מלאו את צינור הצנטריפוגה ל -50 מ"ל עם PBS + 2% FBS.
- ספרו את המספר הכולל של PBMCs באמצעות תא ספירה של נויבאואר. המלצה: לדלל את תרחיף התא 1:10 עם טריפן כחול לספירה.
- הפרדה של תאי CD8+ T
הערה: השתמש ב-CD8 MicroBeads אנושי יחד עם עמודות הפרדה מגנטית (MS) ומאגר מיון תאים מופעל מגנטי (MACS+) כדי להפריד מגנטית תאי CD8+ T בהתאם לפרוטוקול היצרן (ראה טבלת חומרים).- צנטריפוגה את ה- PBMCs (לאחר ספירת תאים) ב -300 x גרם למשך 10 דקות.
- השליכו את הסופרנטנט והשעו מחדש את גלולת התא ב-80 מיקרוליטר של מאגר MACS+ (500 מ"ל PBS בתוספת 10 מ"מ EDTA ו-0.5% BSA) לכל 107 תאים (לדוגמה, 60,000,000 PBMCs מושעים מחדש במאגר 6 x 80 μL = 480 μL).
הערה: דוגמה: 465 מ"ל PBS + 10 מ"ל (0.5 מ') EDTA ו-25 מ"ל BSA-Stock. - הוסף 20 מיקרוליטר של מיקרו-חרוזי CD8 לכל 107 תאים וערבב בזהירות על ידי פיפטינג למעלה ולמטה. יש לדגור למשך 15 דקות בחום של 4 מעלות צלזיוס.
- לאחר הדגירה יש לשטוף את התאים על ידי הוספת 2 מ"ל של מאגר MACS+ לכל 107 תאים.
- צנטריפוגה ב-300 x גרם למשך 10 דקות בטמפרטורת החדר. השליכו את ה-supernatant והשעו מחדש את התאים ב-1,000 מיקרוליטר של מאגר MACS+.
- הצב שני עמודי MS במגנט והנח שני צינורות צנטריפוגה של 15 מ"ל מתחת.
- הכן את העמודות עם מאגר 500 μL MACS+. המאגר עובר דרך העמודים וניתן לאסוף אותו בצינורות הצנטריפוגה שמתחת. ניתן לבצע שלב זה גם במקביל לשלב 3.5.6.
- לאחר מכן, צינור את מתלה התא באופן שווה לתוך עמודות MS המוכנות. ניתן לאסוף את הזרימה באותם צינורות צנטריפוגה. כעת הוא מכיל את כל התאים השליליים ל-CD8 ללא תווית.
- שטוף את העמודות על ידי הוספת 3x 500 μL של מאגר MACS+. הוסף חיץ חדש על גבי העמודים רק ברגע שהם התייבשו או הפסיקו לטפטף.
- סמן את התאים הסופיים שנאספו כ"זרימה דרך" או "CD8 שלילי" ושלב אותם בצינור צנטריפוגה יחיד אחד. מאוחר יותר ניתן להשתמש בזה כדי למדוד את טוהר הבידוד באמצעות ציטומטריית זרימה.
- קח צינור צנטריפוגה חדש של 15 מ"ל שכותרתו "תאי CD8+ T". העמודים מוסרים מהמגנט ומונחים על צינור הצנטריפוגה.
- שטוף את שתי העמודות המכילות את תאי ה-T החיוביים CD8 המסומנים מגנטית עם 1,000 מיקרוליטר של מאגר MACS+ כל אחד. לכן, הכניסו את המאגר לעמודים והתחילו מיד לדחוף בזהירות את התמיסה מהעמודים באמצעות הבוכנה שסופק על ידי היצרן.
הערה: עשה זאת עבור שתי העמודות, איסוף 2 מ"ל של מתלה כולל של תאי T בצנטריפוגה. - ספור את המספר הכולל של תאי T באמצעות תא ספירה של נויבאואר. המלצה: השתמש בדילול של 1:4 עם טריפאן כחול.
- צביעה של תאי T עם CFSE
- צנטריפוגה את תאי ה-T המבודדים ב-300 x גרם למשך 5 דקות.
- במהלך הצנטריפוגה, הכינו את תמיסת הצביעה CFSE על ידי ערבוב של 1.1 מיקרוליטר של תמיסת CFSE ב-10 מ"ל של PBS. הריכוז הסופי צריך להיות 1 מיקרומטר.
- השליכו את הסופרנטנט והשעו מחדש את כדור התא ב-1,000 מיקרוליטר של PBS. צנטריפוגה ב -300 x גרם למשך 5 דקות.
- השליכו את הסופרנטנט והשעו מחדש את גלולת התא בתמיסת צביעה CFSE של 2000 מיקרוליטר (1 מיקרומטר). יש לדגור למשך 20 דקות בחום של 37 מעלות צלזיוס.
- צנטריפוגה את התאים המוכתמים ב -300 x גרם למשך 5 דקות. השליכו את הסופרנטנט והשעו מחדש את כדור התא ב-1,000 מיקרוליטר של PBS.
- צנטריפוגה ב -300 x גרם למשך 5 דקות. השליכו את הסופרנטנט והשעו מחדש את כדור התא בכמות המתאימה של מדיום תאי T כדי להגיע לריכוז של 1.5-2 x 106 תאי T בכ-3-4 מ"ל של מדיום תאי T.
- זריעה של תאי T לצלחת של 6 בארות
- השלך את תמיסת הציפוי מצלחת 6 הבארות.
- זרע 1.5-2 מיליון תאי T מבודדים ומוכתמים במדיום תאי T של 3-4 מ"ל לבאר.
- דגירה של תאי T ב-37 מעלות צלזיוס ו-5% CO2 במשך 48 השעות הבאות
הערה: התאם את צפיפות הזריעה תמיד ל -1.5 תאי מיו / 3 מ"ל. הימנע מזריעת תאי T בצפיפות נמוכה יותר. צפיפות גבוהה יותר אפשרית, אך יש לבדוק אותה.
4. הופעת תרבות משותפת (יום 4)
הערה: תזמון: 2 שעות. לאחר קביעת ספירת התאים של תאי הגידול HSC4, תאי T מתווספים לצלחות 96 הבארות ביחס של 1:1.
- קצירת באר אחת לכל מצב לקביעת ספירת תאים מייצגת
- השליכו את הסופרנטנט של הבאר שנזרע למופת לקביעת ספירת התאים.
- ראשית, יש לשטוף תאים עם 100 מיקרוליטר PBS, ואז להשליך את ה- PBS.
- מוסיפים 100 מיקרוליטר טריפסין ומדגרים למשך 5 דקות על צלחת חימום. לאחר מכן השעו ובדקו את המתלה החד-תאי מתחת למיקרוסקופ; אם התאים לא מתנתקים, הוסף עוד 50 מיקרוליטר טריפסין.
- ברגע שכל התאים התנתקו, עצור את תגובת הטריפסין על ידי הוספת 100 מיקרוליטר (או 150 מיקרוליטר אם נוספו 50 מיקרוליטר נוספים של טריפסין לפני כן) של מדיום D10 והשהה מחדש.
- העבירו את כל הנפח של 200 מיקרוליטר מהבאר לצינור דגימה של 1.5 מ"ל והשתמשו ב-100 מיקרוליטר כדי למדוד את ספירת התאים. זכור להתאים את מספר התא הנמדד לנפח הדגימה.
- צביעה של תאי גידול HSC4 בצבע מעקב אחר תאים פלואורסצנטיים לא רעיל
- הכן את עוקב התאים (ראה טבלת חומרים) על ידי המסת 2 מיקרוליטר ב-20 מ"ל PBS (ריכוז סופי 0.1 מיקרומטר לפי היצרן).
- הוצא את מדיום D10 מכל הבארות המכילות תאי גידול והשליך אותו.
- הוסף 200 מיקרוליטר מתמיסת מעקב התאים לבארות תאי הגידול. יש לדגור למשך 20 דקות בחום של 37 מעלות צלזיוס.
- לאחר הדגירה יש להשליך את תמיסת הצביעה ולשטוף על ידי הוספת 100 מיקרוליטר PBS. לאחר מכן, השליכו גם את ה-PBS.
- מוסיפים 200 מיקרוליטר מדיום D10 טרי.
- קציר תאי T (צלחת 6 בארות)
- השעו בזהירות את תאי ה-T במדיום שלהם; רוב תאי ה-T נמצאים בתרחיף וניתן לקצור אותם פשוט על ידי הוצאתם מהבאר שלהם.
- בדוק מיקרוסקופית אם הבארות ריקות; אם לא, קצרו באמצעות 1,000 מיקרוליטר טריפסין, הניחו את הצלחת על צלחת חימום בטמפרטורה של 37 מעלות צלזיוס עד שתאי ה-T התנתקו, ואז עצרו את התגובה על ידי הוספת 1,000 מיקרוליטר של PBS או מדיום תאי T (אופציונלי).
- ספרו את תאי ה-T באמצעות תא ספירה של נויבאואר. לאחר מכן צנטריפוגה את תאי ה- T ב -300 x גרם למשך 5 דקות.
- השעו מחדש את תאי ה-T במדיום תאי T (השתמשו באותו מדיום שהוכן ביום השני לבידוד תאי T) לריכוז סופי של 10,000 תאי T לכל 20 מיקרוליטר.
- הוספת תאי T לתאי גידול HSC4 (צלחת 96 בארות)
- הוסף את הכמות הרצויה של תאי T לבארות תאי הגידול בהתאם לספירת תאי הגידול שנקבעה בעבר ביחס של 1:1.
- שמור על תא גידול אחד היטב בכל מצב נקי מתאי T כבקרת "תאי גידול בלבד". בקרת "תא הגידול היחיד" מאפשרת שער מדויק של נתוני הזרימה.
- הוסף 200 מיקרוליטר של תרחיף תאי T לבאר ריקה כפקד "תא T בלבד" (200,000 תאי T). בקרת "תא T בלבד" זו מאפשרת שער מדויק של נתוני הזרימה.
- דגירה של התרבות המשותפת למשך 96 שעות (37 מעלות צלזיוס, 5% CO2)
5. כימות התפשטות תאי T על ידי זרימה ציטומטרית (יום 7)
הערה: תזמון: 3 שעות. לאחר דגירה של התרבית המשותפת במשך 96 שעות נוספות, הבארות נקצרות ומוכתמות על ידי תערובת נוגדנים המכילה נוגדנים שונים בהתאם להשערת המחקר (לדוגמה, נוגדנים נגד CD3, CD8, HLA-DR ו-CD25). לאחר מכן, התאים מנותחים על ידי ציטומטריית זרימה רב-צבעונית.
- הכן ורשום אצווה של צינורות FACS וצינורות מיקרו-צנטריפוגה עבור כל באר לקציר.
- קצירת תאים
- השעו מחדש את התאים בתווך שלהם והעבירו אותם לצינורות ה-FAKS.
- שטפו את התאים באמצעות 100 מיקרוליטר PBS, ואז העבירו את זה לצינורות ה-FACS.
- מוסיפים 100 מיקרוליטר טריפסין לבארות ודוגרים על צלחת החימום (37 מעלות צלזיוס) למשך 5 דקות.
- השעו מחדש את התאים, ואז שלטו במיקרוסקופ אם כל התאים מנותקים. אם כן, העבירו את תרחיף התאים הטריפסינים לתוך צינורות ה-FACS.
- בדוק במיקרוסקופ אם כל הבארות ריקות; אם לא, חזור על שלבים 5.2.3-5.2.4.
- איסוף הסופרנטנט של התרבות המשותפת לניסויים נוספים
- צנטריפוגה הצינורות מלאים בתאים ב -300 x גרם למשך 5 דקות.
- הזרימו בזהירות כ-300 מיקרוליטר של הסופרנטנט מהצינורות לתוך אצווה אחרת של צינורות מיקרו-צנטריפוגה להקפאה בטמפרטורה של -20 מעלות צלזיוס. מאוחר יותר ניתן להשתמש בסופרנטנט לביצוע, למשל, בדיקות ELISA על מנת לכמת ציטוקינים מופרשים.
- צביעת התאים בנוגדנים לביצוע ציטומטריית זרימה
- הכן תערובת נוגדנים: הוסף 5 מיקרוליטר של anti-CD3-Krome Orange, 0.5 μL של anti-CD8-PerCE-Cyp5.5, 1 μL של anti-HLA-DR-APCVio770, 2.5 μL של anti-CD25-PE-Dazzle ל-91 מיקרוליטר של מאגר PBS/FACS.
- הוסף 200 מיקרוליטר של מאגר FACS (PBS בתוספת 2% FBS ו-2% EDTA) לכל צינור והשהה מחדש.
- שוב צנטריפוגה ב -300 x גרם למשך 5 דקות. השליכו את הסופרנטנט והשעו מחדש את התאים ב-100 מיקרוליטר מתערובת הנוגדנים שהוכנה קודם לכן (שלב 5.4.1). דגירה למשך 30-45 דקות בחום של 4 מעלות צלזיוס במקרר מוגן מפני אור.
- לאחר הדגירה, צנטריפוגה ב -300 x גרם למשך 5 דקות. השליכו את הסופרנטנט והשעו מחדש את התאים ב-100 מיקרוליטר של מאגר FACS.
- בצע ציטומטריית זרימה על ציטומטר המסוגל להבחין בין כל הנוגדנים הפלואורסצנטיים הנ"ל ואות CSFE.
6. אסטרטגיית שער וניתוח נתונים
- אי הכללת כפולות וזיהוי אוכלוסיית תאי T הנכונה (איור 2A).
- אל תכלול את אוכלוסיית הכפילים על סמך פורוורד לעומת אזור פיזור צדדי (FSC-A לעומת SSC-A) (סינגלטים).
- תרשים "סינגלטים" לזיהוי תאי T על סמך קדימה לעומת אזור פיזור צדדי (FSC-A לעומת SSC-A) (תאי T).
הערה: להחרגת הגודל הטוב ביותר, מדוד דגימות "תאי T בלבד" ו"תאי גידול בלבד" במקביל (איור 2B). - התווה את ביטוי CD3 כנגד SSC-A כדי להבחין בין תאי T. יתר על כן, ניתן לזהות את תאי ה-T החיוביים ל-CD8 על ידי התוויית אות ה-CD8 כנגד ה-SSC-A. כל תאי ה-T הם CD3+/CD8+ (תאי CD8+ T) (איור 2A).
- התוויית אות CFSE של כל "תאי CD8+ T" כהיסטוגרמה.
הערה: שער של תת-האוכלוסייה הלא-פרוליפרטיבית (אות ה-CFSE הגבוה ביותר), תת-האוכלוסייה המתפשטת (כל תאי ה-T עם אות CFSE מופחת), ותת-האוכלוסייה המתפשטת ביותר (כל תאי ה-T של שיא ה-CFSE האינטנסיבי הרביעיאו פחות).
- ניתוח סמני פני שטח הקשורים לפעילות באוכלוסיית תאי T
- בצע את שלבי השער (שלב 6.1) (איור 3A).
- אפשרות א': בחר את "תאי CD8+ T" כקלט ונתח אותם עבור ביטוי CD25 או HLA-DR שלהם על ידי התוויית הקרינה של סמן פני השטח המתאים כנגד מאפייני SSC-A.
הערה: אם ניתן לזהות תת-אוכלוסייה מובהקת עם CD25 גבוה, מומלץ לסגור שער לאוכלוסייה עם CD25 גבוה. אותו הדבר חל על שער/ניתוח של HLA-DR על תאי T (איור 3B). - אפשרות ב': בחר את "תאי CD8+ T" כקלט ונתח אותם עבור ביטוי CD25 או HLA-DR שלהם על ידי התוויית הקרינה של סמן פני השטח המתאים כנגד מאפייני SSC-A.
הערה: אם לא ניתן לזהות תת-אוכלוסייה מובחנת (תלוי בסמן פני השטח המנותח), אז מומלץ לנתח את השינוי של עוצמת הקרינה הממוצעת (MFI) של כל אוכלוסיית תאי ה-T (איור 3C).
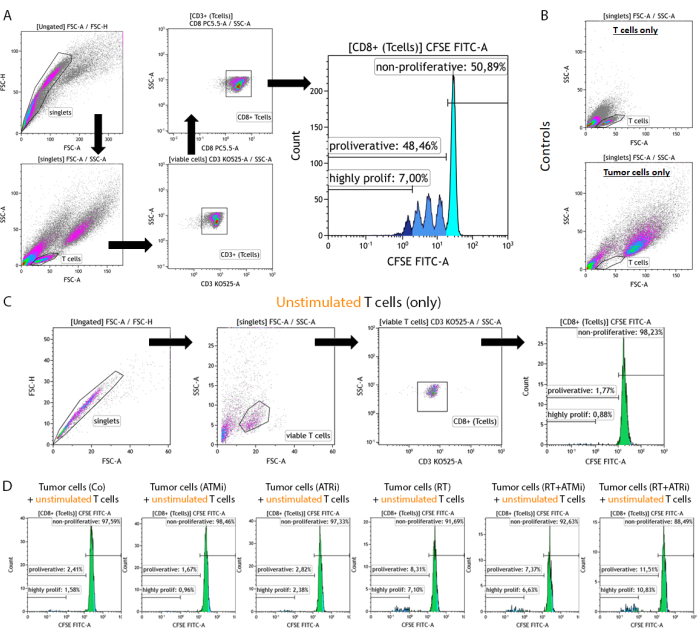
איור 2: אסטרטגיית שער של תאי T מוכתמים ב-CFSE ומגורים מראש לניתוח ההתפשטות לאחר 96 שעות של תרבית משותפת עם תאי גידול HNSCC שטופלו מראש. תאי T ותאי גידול נקצרים 96 שעות לאחר תרבית משותפת מצלחת של 96 בארות, מוכתמים באמצעות סמן משטח ספציפי לתאי T, ונמדדים באמצעות מכשיר ציטומטריית זרימה. (A) כפולים לא נכללו על סמך FSC-A/FSC-H, ותאי T היו מגודרים ראשונים לפי גודל (FSC-A/SSC-A). תאי T נותחו עוד יותר עבור ביטוי CD3 (anti-CD3 Krome Orange) ו-CD8 (anti-CD8 PerCP-Cy5.5) שלהם. תאי CD3+/CD8+ T תווו בהיסטוגרמה, ועוצמת האות של CFSE נותחה. אות CFSE מייצג תת-קבוצות של תאי T עם התנהגות התפשטות מגוונת. תאי T עם אות ה-CFSE הגבוה ביותר הוגדרו כ"לא מתפשטים". כל תת-האוכלוסיות שהראו אובדן אות CFSE, שנגרם על ידי חלוקת תאים המובילה למחצית האות, בשיאים ברורים סוכמו כ"שגשוגים". תאי T שהתפצלו יותר משלוש פעמים (יותר משלושה שיאי אות CSFE) הוגדרו כ"מתרבים מאוד". (B) כביקורת, דגימות שמורכבות רק מתאי T מגורים מראש ורק תאי גידול שטופלו מראש נמדדות בנוסף. ניתן להבחין בין תאי T ותאי גידול HSC4 לפי גודל באמצעות FSC-A לעומת תאי גידול HSC4 אות SCC-A. יתר על כן, תאי CD8+ T לא מגורים נותחו כדי לבדוק את הפעלת תאי T על סמך גידול משותף עם תאי גידול אלוגניים בלבד. (C) כביקורת, נכללה דגירה של תאי T מוכתמים ב-CFSE ללא גירוי במשך 96 שעות במקביל לתרבית המשותפת. (D) תאי T לא מגורים, צבועים ב-CFSE טופחו יחד עם תאי גידול שטופלו מראש. אחרי 96 שעות, תאים נקצרו, ואות CFSE נמדד באמצעות ההליך הסטנדרטי. תאי T לא מגורים לא הראו התפשטות לבד או לאחר גידול משותף עם תאי גידול שטופלו מראש. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
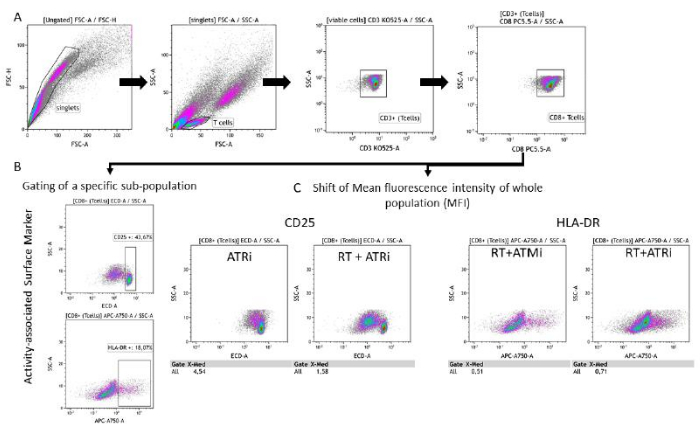
איור 3: אסטרטגיית שער של ביטוי סמני פני השטח (CD25 ו-HLA-DR) הקשורה לפעילות תאי T לאחר 96 שעות של גידול משותף עם תאי HNSCC שטופלו מראש. (A) כפולים לא נכללו בהתבסס על מאפייני FSC-A/FSC-H שלהם, ותאי T היו מגודרים ראשונים לפי גודל (FSC-A/SSC-A). תאי T נותחו עוד יותר עבור ביטוי CD3 (anti-CD3 Krome Orange) ו-CD8 (anti-CD8 PerCP-Cy5.5) שלהם. ניתן לבצע שער של סמני הפעילות CD25 (anti-CD25 PEDazzle594) ו-HLA-DR (anti-HLA-DR APC-Vio770) על פני תא ה-T בשתי הגדרות שונות. (B) שער של כל תאי CD8+ T עבור אחוז תת-אוכלוסייהספציפית של CD25 גבוה או HLA-DR גבוה בהתבסס על עלילות צפיפות. (C) לחלופין, מדידה של הסטת MFI של כל אוכלוסיית תאי CD8+ T מתבצעת עבור שני סמני הפעילות. מוצגות תמונות מייצגות מניתוח ביטוי סמני פני השטח של תאי T לאחר גידול משותף עם תאי גידול HSC4. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות
תאי גידול HSC4 שמקורם ב-HNSCC נזרעו והודגרו בן לילה. לאחר 24 שעות, התאים טופלו במעכב קינאז. לאחר 3 שעות, שתי המנות הראשונות של 5 Gy לכל שבריר הוחלו. לאחר 24 שעות, המנה השנייה הוחלה, והתאים הודגרו שוב למשך הלילה. במקביל, 48 שעות לפני תחילת התרבות המשותפת, בודדו תאי T מדמו של תורם בריא. ראשית, PBMCs בודדו באמצעות צינורות צנטריפוגה בשיפוע צפיפות ומדיום הפרדה סטרילי. PBMCs נספרו באמצעות תא ספירת תאים, ותאי CD8+ T בודדו באמצעות ערכת בידוד תאי CD8+ T. תאי CD8+ T מבודדים נצבעו לאחר מכן ב-CFSE (1 מיקרומטר) ולאחר מכן נספרו. תאי T נזרעו בלוחות באר מצופים מראש CD3 / CD28 בצפיפות של 1.5 x 106 תאים / 3 מ"ל. לאחר 48 שעות של גירוי, תאי ה-T נקצרו, נספרו והושעו מחדש בצפיפות של 10,000 תאים/10 מיקרוליטר. בנוסף, בארות מייצגות של תאי הגידול שנזרעו נקצרו ונספרו, והמדיום הוחלף בכל הבארות הנותרות. תאי T נוספו לתאי הגידול ביחס של 1:1. התרבית המשותפת נקצרה אחרי 96 שעות, הסופרנטנט אוחסן בטמפרטורה של -20 מעלות צלזיוס, והתאים נצבעו ונמדדו על-ידי זרימה ציטומטרית (איור 1).
תאי T זוהו על ידי אי הכללת גודל וחיוביות CD3/CD8. CFSE של תאים חיוביים CD3+/CD8+ הראה התפלגות של תאי T שאינם מתרבים (אות CFSE גבוה) ותת-אוכלוסיות מובחנות של תאי T מתרבים (אובדן עוצמת אות CFSE). שיעור תאי ה-T המתרבים נמדד באופן מופתי עבור קו תאי HSC4 HNSCC (איור 4A). כל תאי ה-T שהראו לפחות חלוקה אחת הוגדרו כ"מתרבים". תאי T שהראו יותר מ-3 חלוקות הוגדרו כ"שגשוג גבוה" (איור 4B). עבור קו התאים השלילי ל-HPV HSC4, זוהתה עלייה קלה בקצב ההתפשטות כאשר תאי T טופחו יחד עם תאי גידול מוקרנים. RT ו-RT בתוספת עיכוב ATR הביאו לעלייה משמעותית בשגשוג תאי T רצופים בהשוואה לתרביות משותפות של תאי HSC4 שטופלו בעיכוב ATM עם תאי T. לגבי החלק ה"שגשוג ביותר" של תאי T, טיפול מקדים בתאי HSC4 עם RT בתוספת עיכוב ATR היה היעיל ביותר בגירוי התפשטות תאי T (איור 4B).
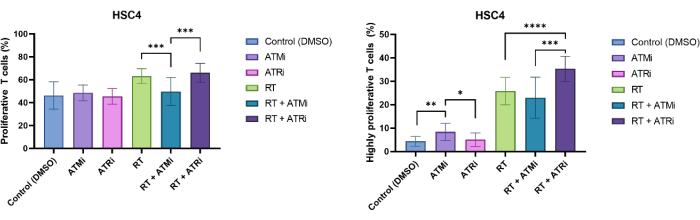
איור 4: התפשטות של תאי T מוכתמים ב-CFSE לניתוחים של שינויים תלויי טיפול ב-HSC4 בשגשוג תאי T. (A) שיעור תאי T מתרבים לאחר 96 שעות של תרבית משותפת עם תאי גידול HSC4 שליליים ל-HPV שטופלו מראש. התפשטות תאי T הייתה נמוכה משמעותית לאחר תרבית משותפת עם RT+ATMi שטיפלה בתאי גידול HSC4 בהשוואה לטיפול ב-RT או RT בתוספת ATRi. (B) RT של תאי גידול HSC4 גרם לחלק גבוה יותר של תאי T מתרבים מאוד (יותר משלוש חלוקות תאים). לאחר תרבית משותפת של תאי גידול HSC4 שטופלו מראש ב-RT+ATRi עם תאי T, אחוז תאי ה-T המתרבים ביותר היה הגבוה ביותר. העמודות מציגות נתונים מארבעה ניסויים בלתי תלויים עם תאי T מארבעה תורמים עצמאיים ובריאים (n = 4; ממוצע ± SD). (*p≤ 0.05, **p≤ 0.01, ***p≤ 0.001, ****p≤ 0.0001; מובהקות סטטיסטית נבדקה על ידי השוואת כל תנאי הניסוי מול כל אחד מהם באמצעות Mann-Whitney-U דו-זנבי עבור נתונים שאינם מפוזרים באופן נורמלי). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
ניתן להשתמש באובדן CFSE מבוסס התפשטות כדי לכמת את קצב התפשטות תאי T. יתר על כן, מספר סמנים על פני התא מתוארים כקשורים לפעילות תאי T, כגון CD25 ו-HLADR. לכן, בוצע ניתוח של CD25 ו-HLA-DR על פני השטח של כל תאי CD3+ ו-CD8+ T על ידי זרימה ציטומטרית (איור 5). ניתן לכמת את הביטויאם ניתן לזהות תת-אוכלוסיותגבוהות CD25 או HLA-DR מובהקות, וניתן להבחין ביניהם על ידי שער התאים החיוביים ביותר הללו (איור 3B). אם לא ניתן לזהות תת-אוכלוסיות מובהקות, ניתן למדוד את עוצמת הקרינה הממוצעת (MFI) של כל האוכלוסייה, ולכמת תזוזות מבוססות מצב של MFI (איור 3C).
לדוגמה, הביטוי שזוהה על ידי MFI של CD25 ו-HLA-DR נותח לאחר 96 שעות של תרבית משותפת עם תאי גידול HSC4 שטופלו מראש (איור 5). לאחר תרבית משותפת של תאי T עם תאי גידול HSC4 שטופלו ב-RT, הביטוי של CD25 על תאי T היה מווסת מאוד. יש לציין כי טיפול מקדים בתאי הגידול עם ATMi בלבד הביא לירידה משמעותית בביטוי של CD25 בהשוואה לטיפול מקדים ב-ATRi. בסביבה המשולבת עם RT, למרות ש-RT הביא לירידה בביטוי של CD25 בתאי T, השילוב של RT עם ATMi הביא לביטוי מוגבר של CD25 בהשוואה ל-RT בתוספת ATRi (איור 5A). לגבי הביטוי של HLA-DR על תאי T, RT הוביל בדרך כלל לוויסות מוגבר של HLA-DR, אך שוב, בשילוב עם ATMi או ATRi, נצפתה התנהגות שונה (איור 5B). תאי T בתרבית משותפת עם תאי HSC4 שטופלו מראש בשילוב של RT+ATRi הגדילו את הביטוי של HLA-DR בהשוואה ל-RT בלבד או RT+ATMi.
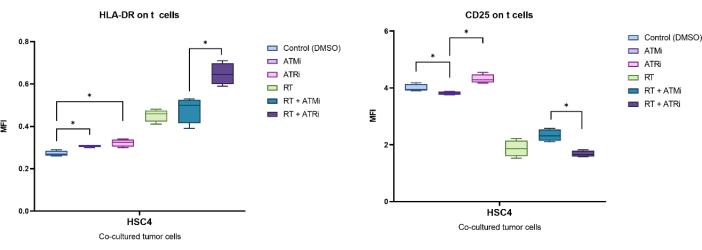
איור 5: ביטוי סמני ההפעלה CD25 ו-HLA-DR על פני תאי T לאחר 96 שעות של תרבית משותפת עם תאי גידול HSC4 שטופלו מראש. הביטוי של CD25 ו-HLA-DR נותח על סמך השינוי של ה-MFI של כל אוכלוסיית תאי ה-T. RT של HSC4 הביא לירידה בביטוי של CD25 בתאי T ולביטוי מוגבר של HLA-DR. השילוב של RT עם ATMi הביא לדפוסי ביטוי שונים באופן משמעותי בהשוואה ל-RT פלוס ATRi. תרשימי הקופסה מציגים נתונים מארבעה ניסויים בלתי תלויים עם תאי T מארבעה תורמים עצמאיים ובריאים (n = 4; ממוצע ± SD). הנתונים נותחו על ידי השוואת כל תנאי הניסוי זה מול זה באמצעות מבחן Mann-Whitney-U דו-זנבי עבור נתונים שאינם מפוזרים באופן נורמלי (*p≤ 0.050). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
נתונים אלה מצביעים באופן מופתי על כך שהטיפול בתאי גידול, במקרה זה של תאי HSC4 HNSCC, משפיע על האימונוגניות של תאי הגידול. ניתן לנטר זאת על ידי גידול משותף של תאי הגידול עם תאי T מגורים מראש, מה שמוביל להתנהגות התפשטות מגוונת וביטוי של סמני הפעלה על תאי T אנושיים בהתבסס על משטר הטיפול בתאי הגידול המיושם.
Discussion
הפרוטוקול המוצג כאן מציע שיטה מהירה וקלה לניתוח יכולת ההתפשטות של תאי T יחד עם מצב ההפעלה שלהם במסגרת תרבית משותפת עם תאי גידול שטופלו מראש. לפיכך, ניתן לסנן בקלות את ההשפעות של שיטות טיפול שונות, כגון RT, CT או TT, על פעילות תאי T והתפשטותם, ולבנות את הבסיס לניתוחים אימונולוגיים עמוקים יותר של גישות מבטיחות. התוצאות המייצגות המוצגות בכתב יד זה מוכיחות כי בדיקת תרבית משותפת של תאי T אלוגניים מתפקדת היטב. הבדלים משמעותיים בשגשוג תאי T, כמו גם בפעילות תאי T, נצפו עבור תרבית משותפת עם תאי HSC4 אנושיים שטופלו מראש באופן דיפרנציאלי (HNSCC) (איור 4 ואיור 5). נמצא כי הטיפול ב-HSC4 עם RT לבד או בשילוב עם TT הביא לשגשוג מוגבר של תאי T, במיוחד ביחס לחלק הפרוליפרטיבי מאוד של תאי T (איור 4). בהתאם לכימות קצב ההתפשטות, מצב ההפעלה של תאי ה-T הושפע גם הוא באופן דיפרנציאלי ממשטרי הטיפול השונים. לסיכום, היישום של RT הביא להפחתת ויסות חזק של ביטוי CD25 בתאי T, בעוד שהביטוי של HLA-DR היה מווסת. RT גורם לנזק ל-DNA בתאי הגידול המוקרנים, מה שמוביל בתורו לתגובות לחץ תאיות הכוללות שחרור של מולקולות וציטוקינים הקשורים ללחץ ונזק, כמו גם ביטוי של ליגנדים על פני התא המווסתים את מערכת החיסון19.
השילוב של RT עם TT בצורה של מעכבי תיקון DNA משפר עוד יותר ושומר על השפעות אלה, מכיוון שתאי הגידול אינם יכולים לתקן ביעילות את נזק ה-DNA שנגרם על ידי RT. זה עשוי לקדם ולשמור עוד יותר על הפרשת גורמים אימונוגניים וביטוי של ליגנדים על פני התאהאימונוגני 20. בהתאם לכך, הראינו בעבר כי הטיפול בתאי גידול (HNSCC) עם מעכבי RT ונזק ל-DNA משנה את הפנוטיפ החיסוני על פני תא הגידול. האפנולציה של הפנוטיפ החיסוני כללה ויסות של המולקולה הממריצה-חיסונית ICOS-L וכן את המולקולה המדכאת את מערכת החיסון PD-L111. בתגובה לאפנון זה של הפנוטיפ החיסוני של תאי הגידול, תאי T עשויים לווסת את ביטוי סמני ההפעלה גם על פני התא שלהם. יתר על כן, RT ידוע כממריץ שחרור של ציטוקינים פרו-דלקתיים, כגון IFNγ או IL-6, אשר בתורם משפיעים על התפשטות ופעילות תאי T21. הביטוי של סמני הפעלה בתאי T הוא תהליך דינמי ביותר. נתונים מ-Zimmerman et al.22 הראו כי CD25 מתבטא מאוד 24 שעות לאחר הגירוי אך מווסת שוב לאחר 96 שעות לאחר הגירוי. זה עולה בקנה אחד עם הממצאים שלנו. לעומת זאת, HLA-DR הוא סמן הפעלה בשלב מאוחר ובדרך כלל קודמת לו עלייה של CD25 ו-CD6923. יש לציין כי השילוב של RT + ATRi מוביל לעלייה משמעותית בוויסות של HLA-DR על תאי T בהשוואה ל- RT + ATMi. ממצא זה עולה בקנה אחד עם עבודתם של דיליון ועמיתיו שהדגימו השפעות סינרגטיות של ATRi + RT בהשראת TME24 דלקתי. אפנון פחות בולט של פעילות תאי T והתפשטותם הושג על ידי טיפול בתאי הגידול עם מעכבי קינאז בלבד (איור 5). ייתכן שהסיבה לכך היא העובדה שמעכבי תיקון ה-DNA ATMi ו-ATRi מתפקדים כמשפר את נזק ה-DNA הנגרם על ידי RT וכתוצאה מכך אינם אימונוגניים במיוחד כאשר הם מיושמים כמונותרפיה. כבר הדגמנו את הרעילות המינימלית של ATMi או ATRi בלבד11. לסיכום, התוצאות מאשרות את הפוטנציאל האימונוגני של RT (ו-TT עם מעכבי נזק ל-DNA) ומצביעות עוד על כך שמערכת ניסויית זו מתאימה לסינון היכולות החיסוניות של שיטות טיפול שונות בתאי סרטן ראש וצוואר אנושיים.
למרות שהשיטה המוצגת כאן קלה וחזקה, ישנם כמה שלבים קריטיים בפרוטוקול שיש לקחת בחשבון מראש. יש צורך בנוכחות ריכוזי EDTA גבוהים במהלך תהליך הבידוד, כמו גם במהלך ניתוח הזרימה הציטומטרי של תאי ה-T. לפיכך, מומלץ לאסוף את דם התורם לתוך צינורות איסוף מצופים EDTA ולהשתמש במאגר MACS בתוספת 10 מ"מ EDTA כדי להבטיח בידוד יעיל של תאי T ויצירת תרחיף חד-תאי הומוגני להערכה ציטומטרית זרימה. בנוסף, להרכב מדיום תאי ה-T יש חשיבות רבה ליכולת ההתפשטות של תאי T. לאחר בדיקת הרכבים שונים של מצעי תרבית, מדיום עם ריכוזים נמוכים של L-ארגינין ו-L-ליזין מביא לאות התפשטות תאי T הטוב ביותר, שכן L-ארגינין הוא קריטי לחילוף החומרים וההישרדות של תאי T ויש לספק אותו בריכוז מתאים25,26. עם זאת, יש לזכור כי תמיסות L-ארגינין ו-L-ליזין אינן יציבות לטווח ארוך ולכן יש להשתמש בהן תוך 3 חודשים. לגירוי אופטימלי, יש להכין את מדיום תאי ה-T בתוספת חומצות האמינו טרי לכל ניסוי גידול תאי T. יתר על כן, מספרי התאים של תאי ה-T, כמו גם אלה של תאי הגידול, הם גורמים קריטיים שיש לקחת בחשבון מכיוון שהם משפיעים על קריאת הניסוי.
עבור תאי הגידול, מצד אחד, רצוי מפגש תאים של 70% עד 80% בסוף ניסוי התרבות המשותפת. צמיחת יתר של תאי הגידול עלולה לגרום להפרשת גורמים המעכבים את צמיחת התאים ובהמשך תשפיע גם על קצב התפשטות תאי T. מכיוון שצמיחת תאי הגידול תלויה מאוד בקו התאים הבודד, אנו ממליצים לבדוק ביסודיות את התנהגות הצמיחה של קו תאי הגידול המתאים בצלחות באר שונות ובמשטרי הטיפול השונים. יתר על כן, יש לתרבית משותפת של תאי הגידול ותאי ה-T ביחס של 1:1. לכן, חובה לזרוע באר נוספת של תאי גידול לכל מצב טיפול, שניתן להשתמש בה לקביעת ספירת התאים ביום תחילת התרבות המשותפת. כך, ניתן להבטיח שמספר מתאים של תאי T ייזרע למצבי הטיפול השונים. לגבי מספר התאים של תאי ה-T, יש לקחת בחשבון שכמות תאי ה-T שניתן לבודד מתורם בריא היא מאוד אינדיבידואלית. תאי T מהווים כ-45% עד 70% מה-PBMCs של תורם בריא27. לפיכך, יש להעריך את הכמות הנדרשת של תאי T כבר בזמן שאיבת הדם. יתר על כן, צפיפות תאי ה-T חשובה ליעילות הפעלת תאי ה-T ולהישרדותם. כתוצאה מכך, יש לזרוע את תאי ה-T בריכוז של לפחות 1.5 מיליון תאים לבאר של צלחת של 6 בארות ב-3 מ"ל של מדיום תאי T לגירוי הראשוני לפני תחילת התרבות המשותפת. צפיפות תאי T גבוהה יותר אפשרית, אך יש להימנע מצפיפות נמוכה יותר. ניתן להעריך את הפעלת תאי ה-T גם באופן מורפולוגי תחת המיקרוסקופ, שכן תאי T מופעלים נוטים ליצור אשכולות תאים.
מכיוון ששיטה זו היא מערכת ניסויית פשוטה לחקר היכולות החיסוניות של קווי תאי גידול שונים ושיטות טיפול, יש לה כמה מגבלות שיש לקחת בחשבון. ראשית, בדיקה זו מבוססת על מערכת אלוגנית, כלומר תאי ה-T התורמים אינם מותאמים ל-HLA עם קו תאי הגידול המתאים. לפיכך, אי התאמה זו של HLA עשויה כבר לגרום לגירוי של תאי T ובהמשך לשגשוג תאי T ללא גירוי נוסף מהטיפול בתאי הגידול28. כדי לכמת את ההשפעה הלא רצויה הזו, תאי T מבודדים עברו תרבית משותפת עם קו תאי HSC4 ללא גירוי מוקדם עם נוגדנים CD28 ו-CD3. נמצא כי כמעט ולא נגרמה התפשטות בסביבה זו, מה שמצביע על כך שלחוסר ההתאמה של HLA יש השפעות מינוריות בלבד על הפעלת תאי T בסביבה ניסויית ספציפית זו. חוץ מזה, נמצאו הבדלים משמעותיים בשגשוג והפעלה של תאי T בהתבסס על הטיפול בתאי הגידול למרות ההגדרה האלוגנית. עם זאת, לצורך ביסוס בדיקה זו, יש לבדוק ולכמת את ההתפשטות הפוטנציאלית המושרה על ידי אלוגניה של תאי T פעם אחת בתחילת הניסויים. הבקרות המומלצות "רק תאי T" ו"רק תאי גידול" נחוצות לשער מספיק והן חובה בכל שכפול של הניסויים. עם זאת, יש לזכור שמערכת תרבית משותפת אלוגנית חסרה זיהוי אנטיגן ספציפי לגידול. לפיכך, ייתכן שמערכת זו לא תשקף במדויק את התגובה האנטי-גידולית הספציפית כפי שהיא תתרחש in vivo בחולים 29,30. לשיפור נוסף, סביבה מתוחכמת יותר תהיה גישה אוטולוגית של קו-תרבות. במסגרת זו, יש לטפח ביופסיות גידול שמקורן בחולה ולהביא אותן לתרבית עם תאי T המבודדים מהדם ההיקפי של אותו מטופל28. גישה ניסויית זו, עם זאת, עשויה להיות מאתגרת לא רק במונחים של תרבית תאי גידול ראשוניים אלא גם מבחינת הזמינות של חומר ביולוגי שמקורו בחולה. מגבלה נוספת שיש לקחת בחשבון היא היחס בין תאי הגידול לתאי ה-T בתרבית המשותפת. מכיוון שהיחס המומלץ בין התאים הוא 1:1, היחס אינו משקף את המצב הפיזיולוגי של ה-TME בחולים31. עם זאת, יש לקבל מגבלה זו, שכן עם ספירת תאי T נמוכה יותר, השינויים בקצב ההתפשטות ובמצב ההפעלה אינם ניתנים לכימות.
בתחום האימונולוגיה של הגידולים, בדיקה זו מציעה את ההזדמנות לסנן את האימונוגניות של שיטות טיפול שונות במסגרת ניסוי קל ומהיר במבחנה . לכן, לא רק שניתן לחסוך זמן על ידי סינון מוקדם של הגישות המבטיחות ביותר מבחינת חיסוניות, אלא גם ניסויים in vivo . ניתן לצמצם מודלים של בעלי חיים, מכיוון שרק תוכניות טיפול מבטיחות עשויות להיות מיושמות במודלים של בעלי חיים כדי לשקף את מערכת החיסון בכללותה באורגניזם. יתר על כן, מכיוון שבדיקה זו מבוססת על תאים ראשוניים אנושיים וקווי תאי סרטן אנושיים, התוצאות עשויות להיות ניתנות לתרגום לקליניקה יותר מאשר בדיקות המבוססות על מערכות מודלים ומינים אחרים.
בעתיד, בדיקה זו עשויה להיות מווסתת ומותאמת כדי לענות על שאלות מחקר ספציפיות יותר. לדוגמה, אפשר לכלול טיפול בתאי T כדי לשקף תרחיש טיפול קרוב יותר למצב בחולים. מכיוון שתאי T מגיבים לגידול נמצאים בעיקר ב-TME, הם מושפעים באותה מידה מטיפולים מקומיים כגון RT וסביר להניח שהם מושפעים גם מטיפולים מערכתיים כגון CT או TT32. שיפור נוסף של הבדיקה הוא גידול משותף של תאי T עם ספרואידים של גידול מקווי תאי גידול או אפילו גידול משותף עם אורגנואידים של גידול שמקורם בחולה. תרביות תלת מימדיות אלה דומות יותר למבנה של גידול בחולה28. לבסוף, ניתן להתאים בקלות את קריאת הניסוי באמצעות זרימה ציטומטרית על מנת לחקור מולקולות נוספות על פני תאי T או על ידי ניתוח ביטוי מולקולות מחסום חיסוני על תאי הגידול. בנוסף לקביעת הפנוטיפ החיסוני של תאי T, ניתן להשתמש בסופרנטנטים של תרבית התאים מניסויי התרבות המשותפת לכימות של ציטוקינים או כימוקינים המופרשים כדי לקבל תובנות נוספות על פעילות תאי T. לסיכום, פרוטוקול זה מספק בדיקת תרבית משותפת מקיפה, חזקה וקלה של תאי T ותאי גידול המאפשרת בדיקת אימונוגניות של שיטות טיפול שונות בסרטן. מכיוון שבדיקה זו ניתנת להתאמה לשאלות מחקר ספציפיות, היא מתאימה היטב ליישום בתחום הרחב של אימונולוגיה של גידולים.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
מחקר זה מומן בחלקו על ידי המרכז הבין-תחומי למחקר קליני בארלנגן (IZKF Erlangen) וה-Bayerisches Zentrum für Krebsforschung (BZKF).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
References
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378 (2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150 (2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151 (2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114 (2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610 (2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899 (2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661 (2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076 (2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., Verhoeckx, K. . The impact of food bioactives on health: In vitro and ex vivo models. , 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716 (2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082 (2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222 (2022).
- Wang, W., Green, M., Rebecca Liu, J., Lawrence, T. S., Zou, W., Zitvogel, L., Kroemer, G. . Oncoimmunology: A practical guide for cancer immunotherapy. , 23-39 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved