Method Article
전처리된 종양 세포의 동종 공동 배양 환경에서의 인간 T 세포 활성 분석
요약
본 프로토콜은 전처리된 종양 세포를 사용한 동종 공동 배양 시스템에서 인간 T 세포 자극의 생체 외 분석을 가능하게 하는 실험 워크플로우를 설명합니다.
초록
세포독성 T세포는 종양세포를 제거하는 데 중요한 역할을 하기 때문에 암 면역학에서 집중적으로 연구되고 있습니다. 종양 내 세포독성 T세포의 빈도와 활성, 그리고 종양 미세환경(TME)은 이제 수많은 종양 유형에 대한 잘 확립된 예후 및 예측 바이오마커입니다. 그러나 방사선 요법, 화학 요법, 면역 요법 및 표적 요법을 포함한 다양한 종양 치료 방식이 종양의 면역원성뿐만 아니라 면역 체계 자체를 조절한다는 것은 잘 알려져 있습니다. 결과적으로, 종양 세포와 T 세포 간의 상호 작용은 종양 치료 중 T 세포의 복잡한 역할을 완전히 이해하기 위해 다양한 치료 맥락에서 보다 집중적인 연구를 필요로 합니다. 이러한 요구를 해결하기 위해 전처리된 종양 세포와 공동 배양에서 인간 세포독성(CD8+) T 세포의 활성과 증식 능력을 분석하기 위한 프로토콜이 개발되었습니다. 특히, 건강한 기증자의 CD8+ T 세포는 무독성 증식 마커인 카르복시플루오레세인 디아세테이트 숙시니미딜 에스테르(CFSE)로 염색하고 CD3/CD28 코팅된 플레이트를 사용하여 자극합니다. 그 후, T 세포는 전처리된 종양 세포와 공동 배양됩니다. 판독으로, T 세포 증식은 CFSE 신호 분포를 측정하고 유세포 분석을 통해 표면 활성화 마커의 발현을 평가하여 정량화됩니다. 이는 효소 결합 면역흡착 분석법(ELISA)을 사용하여 사이토카인 방출을 정량화함으로써 더욱 보완될 수 있습니다. 이 방법은 종양 세포와 T 세포 간의 상호 작용에서 치료 유도 변화의 평가를 용이하게 하여 인간 체외 환경에서 종양 치료 방식 및 면역원성에 대한 보다 상세한 분석을 위한 기반을 제공합니다. 또한 전임상 생체 내 분석을 줄이는 데 기여합니다.
서문
요즘에는 종양의 성장과 진행이 숙주의 면역 체계의 효과적인 조작과 억제에 크게 의존한다는 것이 점점 더 분명해지고 있습니다. 변형된 세포는 건강한 유기체에서도 매일 나타납니다. 그러나 거시적 종양의 형성은 신흥 형질전환세포가 높은 효율로 유기체에서 제거되기 때문에 다소 드문 경우입니다. 악성 세포를 제거하기 위해서는 세포독성 T세포, 자연살해(NK)T세포, NK세포, 대식세포와 같은 다양한 면역세포 유형이 작용합니다 1,2,3. 그럼에도 불구하고, 때때로 숙주의 면역 체계와 평형 상태에서 생존하는 형질전환된 세포 클론이 나타날 수 있으며, 이는 종양 세포 클론4의 다른 면역억제 전략을 특징으로 합니다. 결국, 일부 형질전환된 세포는 종양 세포가 면역 반응을 적극적으로 억제할 수 있도록 하는 추가 기능을 획득하게 되며, 이는 결과적으로 종양의 증식으로 이어집니다. 이러한 면역억제는 종양세포에 대한 면역억제 리간드의 발현 또는 면역조절 또는 면역억제 면역세포 집단의 적극적인 모집 또는 프라이밍을 포함하는 수많은 메커니즘에 의해 매개됩니다. 이른바 면역 편집 개념은 종양 형성 및 증식 과정에서 면역 조절의 핵심 역할을 입증합니다5.
따라서 면역 체계가 오늘날 암 치료뿐만 아니라 많은 종양 기관 및 치료 환경에서 예측 및 예후 인자로 주요 초점이 되는 것은 놀라운 일이 아닙니다. 지난 몇 년 동안 면역관문억제제(ICI)는 두경부 편평세포암(HNSCC) 또는 비소세포폐암(NSCLC)과 같은 다양한 고형암에서 유망한 치료 옵션으로 부상했으며, 종양 미세환경(TME)을 조절하여 보다 효율적인 항종양 면역 반응과 종양 세포의 면역 억제 감소를 목표로 합니다6. 면역관문억제제는 프로그래밍된 사멸 단백질 1(PD-1) 및 리간드 1(PD1/PD-L1) 축과 같은 면역 관문 분자를 표적으로 삼아 T 세포 매개 종양 세포 사멸을 촉진하는 것을 목표로 합니다. 이 사실은 항종양 면역에서 T 세포의 핵심 역할을 강조합니다. 예를 들어, HNSCC에서 ICI는 재발성 및 전이된 HNSCC7에서 1차 치료제로 성공적으로 승인되었습니다. 이에 따라 TME에 세포독성 T 세포의 존재와 그에 따른 종양 세포 및 T 세포에 대한 PD1 및 PD-L1의 발현은 HNSCC 8,9,10에서 예측 바이오마커 역할을 할 수 있습니다.
T 세포가 종양 면역학 및 종양 치료에서 중요한 역할을 하고 있지만, T 세포와 종양과의 상호 작용에 대한 많은 미해결 질문은 여전히 해결되어야 합니다. 요즘에는 종양 면역 반응이 역동적인 과정이며 종양의 면역원성이 질병과 치료 과정 전반에 걸쳐 변할 수 있다는 것은 잘 알려져 있습니다. 화학요법(CT), 방사선 요법(RT) 또는 표적 요법(TT)과 같은 다양한 치료 방식은 특히 종양 세포의 면역학적 표현형을 조절하는 것으로 널리 알려져 있습니다. RT는 종양 조직에서 면역 관문 분자의 상향 조절을 유도하고 종양 침투 세포의 빈도를 변경할 수 있습니다11,12. 반면에, TT는 적응 면역 반응의 직접 조절에 의해 종양과 TME 내에서 유리한 변화를 지지할 수도 있습니다 13,14,15,16. 그러나 이러한 조절은 치료 과정에서 종양 조직에 대한 반복적인 검사가 필요하기 때문에 환자를 대상으로 연구하기 어렵습니다. 따라서 종양 세포와 T 세포의 동적 면역학적 표현형, 그리고 더 중요하게는 이들의 상호 작용을 연구하기 위해 결정적인 실험 모델 시스템이 필요합니다.
따라서 T 세포 활성과 종양 세포 및 T 세포의 상호 작용을 분석하기 위해서는 간단한 세포 배양 작업과 일반적으로 사용되는 유세포 분석을 기반으로 모든 실험실에서 쉽게 구현할 수 있는 포괄적인 생체 외 공동 배양 분석이 필요합니다. 현존하는 및 이용 가능한 문헌에 근거하여, T 세포와 종양 세포의 공동 배양과 관련하여 사용하기 쉽고 일반적으로 사용되는 프로토콜은 지금까지 발표되지 않았습니다. 최근 T 세포 및 종양 오가노이드에 대한 여러 공동 배양 분석법이 발표되었지만, 3D 세포 배양 기술은 여전히 모든 실험실에서 표준 기술로 구현되지 않았습니다. 따라서 당사는 2D 세포 배양에 사용하기 위한 프로토콜을 제공하며, 이는 향후 3D 세포 배양을 위해 확립될 수 있습니다. 다른 2D 공동 배양 프로토콜은 예를 들어 종양 세포와 루시페라제17 의 형질도입이 필요하거나 혈액학적 악성 종양(일치하지 않는 T 세포와 백혈병 세포의 공동 배양)에만 적합하기 때문에 더 복잡한 경우가 많습니다18. 여기에 설명된 분석법에서 정상적인 건강한 기증자의 T 세포는 말초 혈액에서 분리되고 항-CD3 및 항-CD28 항체로 자극됩니다. 그 후, T 세포는 유세포 분석을 통해 T 세포의 증식 능력과 활성을 분석하기 위해 (전)처리된 종양 세포와 공동 배양됩니다. 이를 통해 T세포 활성과 증식에 영향을 미치는 RT, CT 또는 TT와 같은 종양 세포 면역 표현형에 대한 다양한 치료 방식의 효과를 쉽게 스크리닝하고 보다 심층적인 기계론적 분석 및 연속적으로 선택된 전임상 in vivo 분석의 기초로 사용할 수 있습니다. 여기에 설명된 분석은 틀에 얽매이지 않는 장치, 기술 또는 재료가 필요하지 않기 때문에 사용하기 쉬운 설정을 제공합니다. 또한 이 분석은 다른 종양 세포주 또는 특정 T 세포 하위 집합(예: CD4+ T 세포)에 쉽게 적용할 수 있습니다. 이 기술을 사용하면 높은 표준화와 재현성을 얻을 수 있습니다.
프로토콜
이 분석법은 혈액 채취 및 인간 일차 세포 배양을 포함합니다. 따라서 이러한 분석에는 윤리적 투표가 필수입니다. 이 원고에 제시된 모든 결과는 IMMO-NHD 임상시험의 윤리적 승인에 의해 다루어지며, 모든 기증자로부터 서면 동의서를 받았습니다. 2022년 11월 9일 Friedrich-Alexander-Universität Erlangen-Nürnberg의 기관 검토 위원회에서 승인을 받았습니다(신청 번호 21-415-B). 이 연구에 사용된 HSC4 종양 세포는 상업적으로 이용 가능한 세포주에서 가져온 것입니다.
이 분석은 방사선 요법(RT) 및 두 가지 특이적 키나아제 억제제를 포함하는 치료 환경에서 인간 두경부 편평 세포 암종(HNSCC) 세포주 HSC4를 사용하여 T 세포 및 종양 세포 공동 배양 분석의 모든 단계를 보여줍니다. 결과적으로, 세포 수, 트립신화 시간 및 치료 계획과 같은 매개변수는 이 공동 배양 환경에 특이적이며 다른 종양 세포주에 맞게 조정되어야 합니다(논의 섹션 참조). 모든 원심분리 단계는 실온에서 수행하였다. 본 연구에서는 키나아제 억제제 AZD0156와 VE-822를 사용하여 HSC4 세포의 DNA 손상 복구(DDR) 시스템을 표적으로 삼았습니다. AZD0156(Selleckchem)은 운동실조증 모세혈관확장증 돌연변이(ATM) 단백질을 억제하는 반면, VE-822(Selleckchem)는 운동실조증 모세혈관확장증 및 Rad3 관련(ATR) 단백질을 표적으로 합니다. 두 억제제 모두 종양 세포의 방사선 민감도를 증가시키는 잠재적인 물질로 논의되어 왔습니다. 이들은 디메틸 설폭사이드(DMSO)에 용해되어 -20°C에서 보관됩니다. 그림 1 은 전처리된 종양 세포와 CD3/CD28 자극 인간 CD8+ T 세포의 공동 배양을 자세히 설명하는 생체 외 분석의 흐름도를 제공합니다. 사용된 시약 및 장비는 재료 표에 나열되어 있습니다.
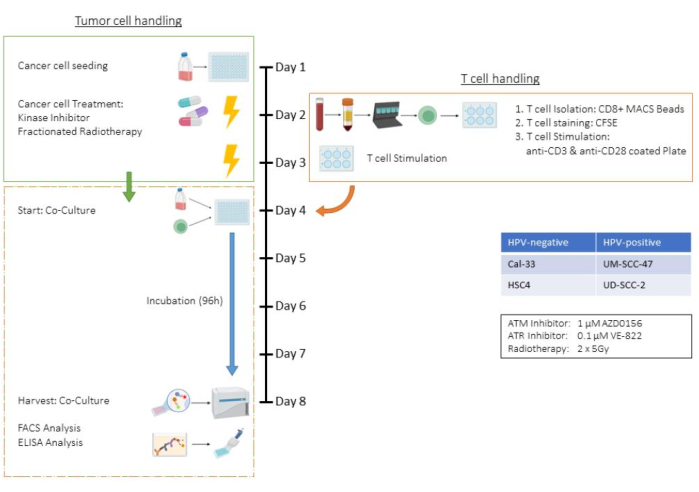
그림 1: (CD3/CD28)을 자극한 인간 CD8+ T 세포와의 공동 배양에서 전처리된 종양 세포의 생체 외 분석 흐름도. 1일차: HSC4 종양 세포의 파종. 2일차: 종양 세포 처리 및 분리, CFSE 염색 및 인간 CD8+ T 세포의 CD3/CD28 코팅 플레이트에 파종. 3일차: 종양 세포 치료. 4일차: 종양 세포의 대표적인 웰 계수. 모든 T 세포의 수확 및 계수. T 세포와 HSC4 종양 세포를 1:1 비율로 공동 배양. 5일차-8일차: 공동 배양 배양. 8일차: 공동 배양 수확, 상층액 동결, 항체 기반 염색 및 유세포 분석을 통한 세포 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 종양세포 파종(1일차)
참고: 타이밍: 1시간. 인간 HSC4 종양 세포는 T75 세포 배양 병에서 96웰 플레이트로 파종됩니다.
- 세포 배양 병의 상등액(D10 Medium)을 폐기합니다.
- 37°C 온열 PBS 5mL로 종양 세포를 세척합니다. PBS를 폐기합니다.
- HSC4 종양 세포는 세포 배양 플라스크에 단단히 부착되는 경향이 있기 때문에 모든 세포를 분리하기 위해 2단계 트립신화가 권장됩니다. 이를 위해 3mL 트립신을 첨가하고 37°C의 가열판에 3분 동안 병을 올려 놓은 다음 피펫으로 트립신을 버립니다.
- 3mL 트립신을 더 첨가하고 병을 가열판에 놓고 단일 세포 현탁액에 도달할 때까지 기다립니다. 단일 세포 현탁액을 현미경으로 검사합니다.
- D10 Medium(10% 소 태아 혈청과 1% 페니실린-스트렙토마이신이 보충된 DMEM)을 두 배로 첨가하여 트립신을 중단하고, 철저히 재현탁한 다음 세포를 50mL 원심분리 튜브로 옮깁니다.
- single-cell suspension의 세포 수를 결정한 다음 총 부피에 따라 종양 세포의 총량을 계산합니다. Neubauer cell chamber는 세포 수를 측정하기 위해 권장됩니다.
- 종양 세포가 들어 있는 50mL 원심분리 튜브를 실온에서 300 x g 에서 5분 동안 원심분리합니다. 상등액을 버리십시오.
- HSC4 종양 세포를 적절한 부피의 D10 배지에 재현탁시켜 200μL 배지에서 15,000개 세포의 농도에 도달합니다.
- 종양 세포의 계획된 처리에 따라 각 조건에 대한 시드는 2개의 96웰 플레이트(1x 샘플, 1x 종양 세포만 대조군, 공동 배양일 동안 1x 세포 계수 웰)에서 200μL 배지에 15,000개의 HSC4 종양 세포를 포함하는 최소 3개의 웰을 포함합니다.
참고: 세포 수는 세포주와 배가 시간에 따라 다릅니다. 배양 중 100% 합류를 피하기 위해 사전 실험에서 다양한 처리를 위한 세포의 수를 검사해야 합니다. - 37°C 및 5% CO2 및 포화 습도에서 24시간 동안 세포를 배양합니다.
2. 종양세포의 치료 (Day 2)
참고: 타이밍: 3-5시간 24시간의 배양 시간 후, 이전에 파종된 HSC4 세포는 원하는 처리 계획에 따라 처리될 수 있습니다. 이러한 예시적인 사례에서, 종양 세포는 ATM- 또는 ATR 억제제로 치료된다. 또한, 본 명세서에서, 2개의 96-웰 플레이트 중 하나는, 또한 2x 5 Gy로 조사된다.
- 종양 세포를 치료하기 위해 1 μM AZD0156(ATM 억제제) 및 0.1 μM VE-822(ATR 억제제)의 농도를 얻기 위해 키나아제 억제제를 준비합니다.
- 예를 들어, 한 줄의 샘플을 3.1μL의 ATM 억제제로 처리하고 두 번째 줄의 샘플을 각 플레이트에 3.1μL의 ATR 억제제로 처리하는 등 종양 세포를 적절하게 처리합니다.
- 37 °C에서 3-5 시간의 배양 후 1 개의 플레이트에 5 Gy를 조사합니다.
- 24시간 더 배양한 후 동일한 플레이트에 5Gy를 다시 조사합니다.
3. T 세포 격리 (2일차)
참고: 타이밍: 4시간. CD8+ T 세포는 건강한 성인 기증자에서 유래한 말초 혈액(PB)의 밀도 구배 원심분리 후 PBMC의 anti-CD8 MicroBeads로 자기적으로 분리됩니다. 그런 다음 분리된 T 세포를 CFSE로 염색하고 자극을 위해 CD3/CD28로 코팅된 웰 플레이트에서 배양합니다. 이후 단계에서 자원과 재료 친화적으로 작업할 수 있으려면 공동 배양 실험에 필요한 T 세포의 양을 추정하는 것이 중요합니다. 기증자에 따라 약 45ml의 EDTA 혈액에서 50,000,000개에서 최대 100,000,000개의 PBMC를 분리할 수 있습니다. 전체 PBMC의 약 10%는 CD8+ T 세포입니다.
- 밀도 구배 원심분리
- 건강한 기증자로부터 유래한 9mL의 EDTA 혈액관 3-5개를 50mL 원심분리 튜브 2개로 이식합니다.
- 두 원심분리 튜브를 PBS + 2% FBS로 50mL까지 채웁니다.
- 6개의 원심분리 튜브(PBMC 분리를 위한 플라스틱 인레이 포함)를 준비하고 각 튜브에 15mL의 + 4°C 저온 밀도 구배 배지를 채웁니다.
- 3.1.2단계에서 희석된 혈액 12-15mL로 밀도 구배 매체를 조심스럽게 오버레이합니다.
- 1200 x g 에서 10분 동안 원심분리기(감속 필요 없음).
- T 세포 자극을 위한 6-well plate의 준비
- 항체 준비: PBS를 사용하여 1mg/mL의 항-CD3(클론 OKT3) 용액을 준비합니다. PBS를 사용하여 0.1mg/mL의 항-CD28(클론 28.2) 용액을 준비합니다.
- 권장 사항: 코팅 용액을 준비하고 T 세포를 자극하기 위해 웰 자체를 코팅하기 위해 원심분리(단계 3.1.5) 중 시간을 사용하십시오.
- 5 μL의 CD3 항체 용액과 4.995 μL의 PBS 및 50 μL의 CD28 항체 용액을 4.950 μL의 PBS와 혼합합니다(최종 농도: 1 μg/μL).
- 1.000 μL의 두 항체 용액을 6-well 플레이트의 각 well에 추가합니다.
- 예상되는 T 세포 양에 따라 6-well 플레이트의 2 또는 3 well를 코팅하고 37 ° C에서 최소 2 시간 동안 배양합니다.
- T 세포 배지의 제조
참고: 100x L-라이신의 제조: 50mL 원심분리기 튜브에 200mg의 L-라이신 염산염을 50mL의 증류수에 용해시킵니다. 0.2μm 주사기 필터를 사용하여 용액을 멸균하고 50mL 관류 주사기를 사용하여 새 50mL 튜브로 옮깁니다. 용액을 4-8 °C에서 보관하고 3 개월 이내에 사용하십시오. 15mM L-아르기닌 제제: L-아르기닌 26mg을 DPBS 10mL에 용해시킵니다. 0.2μm 주사기 필터를 사용하여 용액을 멸균하고 10mL 주사기를 사용하여 새 튜브로 옮깁니다. 용액을 4-8 °C에서 보관하고 3 개월 이내에 사용하십시오.- 1.5단계에서 언급한 원심분리 시간을 사용하여 T 세포 배지를 준비합니다.
- 예상되는 T 세포 양에 따라 약 10-30mL의 T 세포 배지를 준비합니다.
- L-아르기닌 및 L-라이신이 없는 RPMI 배지를 10% 열 비활성화 FBS, 1% 페니실린-스트렙토마이신, 1% L-아르기닌, 1% L-리신 및 1% L-글루타민과 혼합합니다. 예: RPMI 배지 25.8mL + FBS 3mL + 펜/연쇄상구균 0.3mL + L-아르기닌 0.3mL + L-라이신 0.3mL + L-글루타민 0.3mL.
- 나머지 배지를 다음 2일 동안 4°C에서 보관하여 4일차 - 공동 배양 시작에 사용합니다. 전체 실험을 새로 실행할 때마다 새로운 배양 배지를 준비하는 것이 좋습니다.
- PBMC 절연
- 원심분리 후(단계 3.1.5) 상등액을 4개의 새로운 50mL 원심분리 튜브로 옮기고 사용한 튜브를 폐기합니다.
- 원심분리 튜브에 PBS + 2% FBS를 최대 50mL까지 채웁니다.
- 실온에서 300 x g 으로 8분 동안 원심분리기.
- 상등액을 버리고 세포 펠릿을 PBS 1mL + 2% FBS에 재현탁시킨 후 두 개의 원심분리 튜브로 결합합니다.
- PBS + 2% FCS로 튜브를 50mL로 다시 채웁니다.
- 실온에서 120 x g 의 원심분리기를 10분 동안 사용합니다.
- 상등액을 버리고 PBS +2% FBS 1mL에 세포 펠릿을 조심스럽게 재현탁시킨 다음 두 펠릿을 하나의 매에 결합합니다.
- 원심분리 튜브를 PBS + 2% FBS로 50mL까지 채웁니다.
- Neubauer 계수 챔버를 사용하여 PBMC의 총 수를 계산합니다. 권장 사항: 계수를 위해 세포 현탁액을 트리판 블루로 1:10으로 희석합니다.
- CD8+ T 세포 분리
참고: CD8 MicroBeads human을 자기 분리(MS) 컬럼 및 자기 활성화 세포 분류 플러스(MACS+) 버퍼와 함께 사용하여 제조업체의 프로토콜에 따라 CD8+ T 세포를 자기적으로 분리합니다( 재료 표 참조).- PBMC(세포 계수 후)를 300 x g 에서 10분 동안 원심분리합니다.
- 상층액을 버리고 세포 펠릿을 107 세포당 80 μL의 MACS+ 완충액(10 mM EDTA 및 0.5% BSA가 보충된 500 mL PBS)에 재현탁합니다(예: 60,000,000 PBMC는 6 x 80 μL = 480 μL 완충액에 재현탁).
참고: 예: 465mL PBS + 10mL(0.5M) EDTA 및 25mL BSA-스톡 용액. - 107 cells당 20 μL의 CD8 MicroBeads를 추가하고 위아래로 피펫팅하여 조심스럽게 혼합합니다. 4 °C에서 15분 동안 배양합니다.
- 배양 후 107 세포 당 2mL의 MACS+ 완충액을 추가하여 세포를 세척합니다.
- 실온에서 300 x g 에서 10분 동안 원심분리기. 상층액을 버리고 1,000μL의 MACS+ 완충액에 세포를 재현탁합니다.
- 자석에 두 개의 MS 컬럼을 놓고 그 아래에 두 개의 15mL 원심분리 튜브를 놓습니다.
- 500μL MACS+ 완충액으로 컬럼을 준비합니다. 버퍼는 컬럼을 통과하여 아래의 원심분리 튜브에 수집할 수 있습니다. 이 단계는 3.5.6단계와 병행하여 수행할 수도 있습니다.
- 그런 다음 세포 현탁액을 준비된 MS 컬럼에 동일하게 피펫팅합니다. 플로우 스루는 동일한 원심분리 튜브에 수집할 수 있습니다. 이제 레이블이 지정되지 않은 모든 CD8 음성 세포가 포함됩니다.
- 3x 500μL의 MACS+ 버퍼를 추가하여 컬럼을 플러시합니다. 열이 마르거나 떨어지는 것을 멈춘 직후에만 열 위에 새 버퍼를 추가하십시오.
- 최종적으로 수집된 세포를 "Flow-through" 또는 "CD8 negative"로 표시하고 하나의 단일 원심분리 튜브에 결합합니다. 이는 나중에 유세포 분석을 통해 분리의 순도를 측정하는 데 사용할 수 있습니다.
- "CD8+ T cells"라고 표시된 새 15mL 원심분리 튜브를 사용합니다. 컬럼은 자석에서 제거되어 원심분리 튜브에 놓입니다.
- 자기적으로 표지된 CD8 양성 T 세포를 포함하는 두 컬럼을 각각 1,000μL의 MACS+ 완충액으로 플러시합니다. 따라서 버퍼를 컬럼에 피펫으로 삽입하고 즉시 제조업체에서 제공한 플런저를 사용하여 용액을 컬럼 밖으로 조심스럽게 밀어내기 시작하십시오.
참고: 두 컬럼에 대해 이 작업을 수행하여 원심분리에서 2mL의 T 세포 총 현탁액을 수집합니다. - Neubauer 계수 챔버를 사용하여 T 세포의 총 수를 계산합니다. 권장 사항: 트리판 블루와 함께 1:4 희석액을 사용하십시오.
- CFSE를 이용한 T 세포 염색
- 분리된 T 세포를 300 x g 에서 5분 동안 원심분리합니다.
- 원심분리 중에 PBS 10mL에 CFSE 용액 1.1μL를 혼합하여 CFSE 염색 용액을 준비합니다. 최종 농도는 1μM이어야 합니다.
- 상층액을 버리고 세포 펠릿을 1,000μL의 PBS에 재현탁합니다. 300 x g 에서 5분 동안 원심분리기
- 상층액을 버리고 세포 펠렛을 2000μL CFSE 염색 용액(1μM)에 재현탁합니다. 37 °C에서 20분 동안 배양합니다.
- 염색된 세포를 300 x g 에서 5분 동안 원심분리합니다. 상층액을 버리고 세포 펠릿을 1,000μL의 PBS에 재현탁합니다.
- 300 x g 에서 5분 동안 원심분리기 상등액을 버리고 세포 펠릿을 적절한 양의 T 세포 배지에 재현탁시켜 약 3-4mL의 T 세포 배지에서 1.5-2 x 106 T 세포의 농도에 도달합니다.
- T 세포를 6-well 플레이트에 파종(seeding)
- 6웰 플레이트에서 코팅 용액을 폐기합니다.
- 웰당 3-4mL T 세포 배지에 15-200만 개의 분리 및 염색된 T 세포를 파종합니다.
- 다음 48시간 동안 37°C 및 5% CO2 에서 T 세포를 배양합니다.
참고: 시딩 밀도를 항상 1.5 Mio cells / 3 mL로 조정합니다. T 세포를 더 낮은 밀도로 파종하지 마십시오. 더 높은 밀도가 가능하지만 테스트가 필요합니다.
4. 공동문화 시작 (4일차)
참고: 타이밍: 2시간. HSC4 종양 세포의 세포 수를 측정한 후 T 세포를 96웰 플레이트에 1:1 비율로 첨가합니다.
- 대표 세포 수를 결정하기 위해 조건당 하나의 웰을 수확합니다.
- 세포 수 측정을 위해 모범적으로 파종된 웰의 상등액을 폐기합니다.
- 먼저 100μL PBS로 세포를 세척한 다음 PBS를 폐기합니다.
- 100μL 트립신을 추가하고 가열판에서 5분 동안 배양합니다. 그런 다음 현미경으로 단일 세포 현탁액을 다시 현탁하고 확인하십시오. 세포가 분리되지 않으면 트립신 50μL를 더 첨가합니다.
- 모든 세포가 분리되는 즉시 D10 배지 100μL(또는 이전에 50μL의 트립신을 추가로 첨가한 경우 150μL)를 첨가하여 트립신 반응을 중지하고 재현탁합니다.
- 웰에서 200μL의 전체 부피를 1.5mL 샘플 튜브로 옮기고 100μL를 사용하여 세포 수를 측정합니다. 측정된 세포 수를 샘플 부피에 맞게 조정하는 것을 잊지 마십시오.
- 무독성 형광 세포 추적 염료를 사용한 HSC4 종양 세포 염색
- 20mL PBS(제조업체에 따라 최종 농도 0.1μM)에 2μL를 용해하여 세포 추적기( 재료 표 참조)를 준비합니다.
- 종양 세포가 포함된 모든 웰에서 D10 배지를 파이펫으로 분리하고 폐기합니다.
- 200μL의 세포 추적기 용액을 종양 세포 웰에 추가합니다. 37 °C에서 20분 동안 배양합니다.
- 배양 후 염색액을 버리고 PBS 100μL를 첨가하여 세척합니다. 그런 다음 PBS도 폐기하십시오.
- 200μL의 신선한 D10 배지를 추가합니다.
- T 세포 채취(6-well plate)
- T 세포를 배지에 조심스럽게 재현탁시킵니다. 대부분의 T 세포는 현탁 상태이며 웰에서 피펫을 꺼내는 것만으로 수확할 수 있습니다.
- 우물이 비어 있는지 현미경으로 확인하십시오. 그렇지 않은 경우 1,000μL의 트립신을 사용하여 수확하고 T 세포가 분리될 때까지 37°C의 가열판에 플레이트를 올려 놓은 다음 1,000μL의 PBS 또는 T 세포 배지(선택 사항)를 추가하여 반응을 중지합니다.
- Neubauer 계수 챔버를 사용하여 T 세포를 계수합니다. 그런 다음 T 세포를 300 x g 에서 5분 동안 원심분리합니다.
- T 세포 배지의 T 세포를 20μL당 10,000 T 세포의 최종 농도로 재현탁합니다(T 세포 분리 2일차에 준비된 것과 동일한 배지 사용).
- HSC4 종양 세포에 T 세포 추가(96웰 플레이트)
- 이전에 결정된 종양 세포 수에 따라 원하는 양의 T 세포를 1:1의 비율로 종양 세포 웰에 추가합니다.
- "종양 세포만" 대조군으로 T 세포가 없는 조건별 하나의 종양 세포를 잘 유지합니다. 이 "종양 세포만" 제어를 통해 유동 데이터의 정확한 게이팅을 수행할 수 있습니다.
- 200μL의 T 세포 현탁액을 "T 세포만" 대조군(200,000 T 세포)으로 빈 웰에 추가합니다. 이 "Only T cell" 제어를 통해 흐름 데이터의 정확한 게이팅을 수행할 수 있습니다.
- 96 시간 (37 ° C, 5 % CO2) 동안 공동 배양 배양
5. 유세포 분석을 통한 T 세포 증식 정량화(7일차)
참고: 타이밍: 3시간. 공동 배양을 96시간 더 배양한 후, 연구 가설에 따라 다른 항체(예: 항-CD3, CD8, HLA-DR 및 CD25-항체)를 포함하는 항체 혼합물로 웰을 수확하고 염색합니다. 그런 다음 세포를 다색 유세포 분석법으로 분석합니다.
- 수확할 각 웰에 대해 FACS 튜브와 마이크로 원심분리기 튜브 배치를 준비하고 새깁니다.
- 세포 채취
- 세포를 배지에 재현탁시키고 FACS 튜브로 옮깁니다.
- 100μL의 PBS를 사용하여 세포를 세척한 다음 이를 FACS 튜브로 옮깁니다.
- 웰에 트립신 100μL를 추가하고 가열판(37°C)에서 5분 동안 배양합니다.
- 세포를 재현탁시킨 다음 모든 세포가 분리되면 현미경으로 제어합니다. 그렇다면 트립신화된 세포 현탁액을 FACS 튜브로 옮깁니다.
- 모든 웰이 비어 있는지 현미경으로 확인하십시오. 그렇지 않은 경우 5.2.3-5.2.4단계를 반복합니다.
- 추가 실험을 위해 공동 배양의 상층액을 수집
- 세포로 채워진 튜브를 300 x g 에서 5분 동안 원심분리합니다.
- 튜브에서 약 300μL의 상층액을 조심스럽게 피펫으로 주입하고 -20°C에서 동결할 다른 마이크로 원심분리기 튜브에 넣습니다. 상등액은 나중에 분비된 사이토카인을 정량화하기 위해 ELISA 분석 등을 수행하는 데 사용할 수 있습니다.
- 유세포 분석을 수행하기 위해 항체로 세포를 염색
- 항체 혼합물 준비: 91μL의 PBS/FACS 완충액에 anti-CD3-Krome Orange 5μL, anti-CD8-PerCE-Cyp5.5 0.5μL, anti-HLA-DR-APCVio770 1μL, anti-CD25-PE-Dazzle 2.5μL를 추가합니다.
- 각 튜브에 200μL의 FACS 완충액(2% FBS 및 2% EDTA가 보충된 PBS)을 추가하고 재현탁합니다.
- 300 x g 에서 5분 동안 다시 원심분리기를 합니다. 상층액을 버리고 이전에 준비된 항체 혼합물 100μL에 세포를 재현탁합니다(단계 5.4.1). 빛으로부터 보호된 냉장고에서 4°C에서 30-45분 동안 배양합니다.
- 배양 후 300 x g 에서 5분 동안 원심분리합니다. 상층액을 버리고 100μL의 FACS 완충액에 세포를 재현탁합니다.
- 앞서 언급한 모든 형광 항체와 CSFE 신호를 구별할 수 있는 세포분석기에서 유세포 분석을 수행합니다.
6. 게이팅 전략 및 데이터 분석
- 이중항을 제외하고 올바른 T 세포 집단을 식별합니다(그림 2A).
- forward vs. 측면 산란 영역(FSC-A 대 SSC-A) (싱글렛).
- 순방향 vs. 측면 산란 영역(FSC-A 대 SSC-A) (T 세포).
참고: 최상의 크기 제외를 위해 "T 세포만" 및 "종양 세포만" 샘플을 병렬로 측정합니다(그림 2B). - SSC-A에 대한 CD3 발현을 플로팅하여 T 세포를 구별합니다. 또한, CD8 양성 T 세포는 SSC-A에 대해 CD8 신호를 플로팅하여 확인할 수 있습니다. 모든 T 세포는 CD3+/CD8+(CD8+ T 세포)입니다(그림 2A).
- 모든 "CD8+ T 세포"의 CFSE 신호를 히스토그램으로 플로팅합니다.
참고: 비증식성 하위 집단(가장 높은 CFSE 신호), 증식성 하위 집단(CFSE 신호가 감소한 모든 T 세포) 및 고도로 증식하는 하위 집단(4번째 이하의 집중적 CFSE 피크의 모든 T 세포)의 게이팅.
- T 세포 집단에 대한 활성 관련 표면 마커 분석
- 게이팅 단계(6.1단계)를 따릅니다(그림 3A).
- 옵션 A: "CD8+ T cells"를 입력으로 선택하고 SSC-A 특성에 대한 각 표면 마커 형광을 플로팅하여 CD25 또는 HLA-DR 발현을 분석합니다.
참고: 뚜렷한 CD25-high 하위 모집단이 검출될 수 있는 경우, CD25-high 모집단에 대한 게이팅이 권장됩니다. T 세포에 대한 HLA-DR의 게이팅/분석에도 동일하게 적용됩니다(그림 3B). - 옵션 B: "CD8+ T cells"를 입력으로 선택하고 SSC-A 특성에 대한 각 표면 마커 형광을 플로팅하여 CD25 또는 HLA-DR 발현을 분석합니다.
참고: 뚜렷한 하위 집단을 검출할 수 없는 경우(분석된 표면 마커에 따라 다름) 전체 T 세포 집단의 평균 형광 강도(MFI)의 이동 분석을 수행하는 것이 좋습니다(그림 3C).
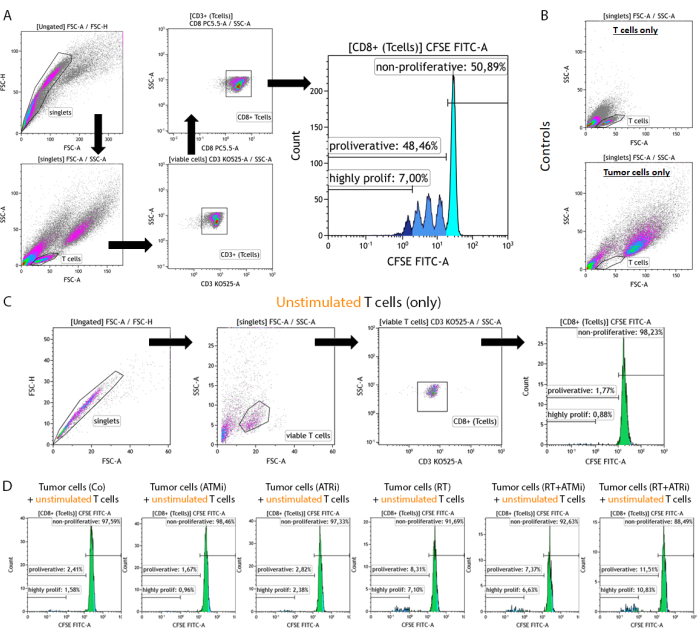
그림 2: 전처리된 HNSCC 종양 세포와 96시간 동안 공동 배양한 후 증식 분석을 위한 CFSE 염색 전 자극 T 세포의 게이팅 전략. T 세포와 종양 세포는 96-well 플레이트에서 공동 배양 후 96시간 후에 수확하고, T 세포 특이적 표면 마커를 사용하여 염색하고, 유세포 분석 장치를 사용하여 측정합니다. (A) 이중선은 FSC-A/FSC-H에 따라 배제하고, T 세포는 크기(FSC-A/SSC-A)에 따라 먼저 게이트를 실시하였다. T 세포는 CD3(anti-CD3 Krome Orange) 및 CD8(anti-CD8 PerCP-Cy5.5) 발현에 대해 추가로 분석했습니다. CD3+/CD8+ T 세포를 히스토그램에 표시하고, CFSE 신호 강도를 분석하였다. CFSE 신호는 다양한 증식 행동을 보이는 T 세포 하위 그룹을 나타냅니다. CFSE 신호가 가장 높은 T 세포는 "비증식성"으로 정의되었습니다. 세포분열로 인해 신호가 절반으로 줄어듦으로써 발생하는 CFSE 신호의 손실을 보이는 모든 하위 집단은 뚜렷한 피크에서 "증식성"으로 요약되었습니다. 3회 이상(CSFE 신호 피크 3회 이상) 분열한 T 세포는 "고증식성"으로 정의되었습니다. (B) 대조군으로, 사전 자극된 T 세포와 사전 처리된 종양 세포로만 구성된 샘플을 추가로 측정합니다. T 세포와 HSC4 종양 세포는 FSC-A와 FSC-A를 사용하여 크기별로 구별할 수 있습니다. SCC-A 신호. 또한, 자극되지 않은 CD8+ T 세포를 분석하여 동종 종양 세포와의 공동 배양을 기반으로 T 세포 활성화를 확인했습니다. (C) 대조군으로서, 공동 배양과 병행하여 자극되지 않은 CFSE-염색된 T 세포의 96시간 동안 배양이 포함되었습니다. (D) 자극되지 않은 CFSE로 염색된 T 세포를 전처리된 종양 세포와 함께 배양하였다. 96시간 후, 세포를 수확하고, 표준 절차를 사용하여 CFSE 신호를 측정했습니다. 자극되지 않은 T 세포는 단독으로 또는 전처리된 종양 세포와 공동 배양 후 증식을 보이지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
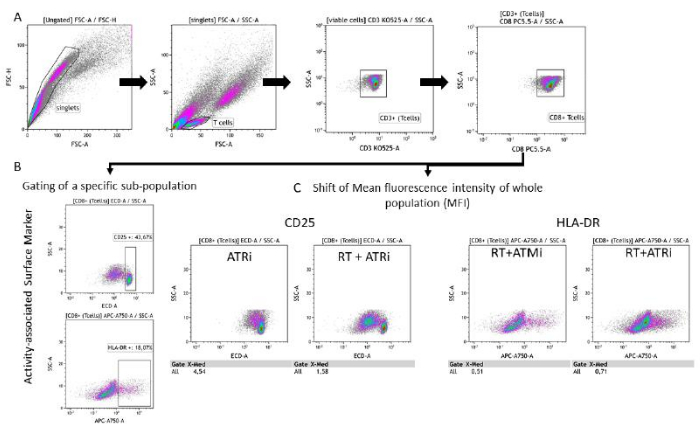
그림 3: 전처리된 HNSCC 세포와 96시간 동안 공동 배양한 후 T 세포 활성과 관련된 표면 마커 발현(CD25 및 HLA-DR)의 게이팅 전략. (A) 이중항은 FSC-A/FSC-H 특성에 따라 제외하고, T 세포는 크기(FSC-A/SSC-A)에 따라 먼저 게이트를 실시했습니다. T 세포는 CD3(anti-CD3 Krome Orange) 및 CD8(anti-CD8 PerCP-Cy5.5) 발현에 대해 추가로 분석했습니다. T 세포 표면의 활성 마커 CD25(anti-CD25, PEDazzle594) 및 HLA-DR(anti-HLA-DR, APC-Vio770)의 게이팅은 두 가지 다른 설정에서 수행할 수 있습니다. (B) 밀도 플롯을 기반으로 한 특정 CD25높음 또는 HLA-DR높음 하위 집단의 백분율에 대한 모든 CD8+ T 세포의 게이팅. (C) 대안적으로, 전체 CD8+ T 세포 집단의 MFI-shift의 측정이 두 활성 마커에 대해 수행됩니다. HSC4 종양 세포와 공동 배양 후 T 세포 표면 마커 발현 분석의 대표적인 이미지가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
HNSCC에서 유래한 HSC4 종양 세포를 파종하고 하룻밤 동안 배양했습니다. 24시간 후, 세포를 키나아제 억제제로 처리했습니다. 3 시간 후, 분획 당 5 Gy의 처음 2 회 용량이 적용되었습니다. 24시간 후, 두 번째 용량을 적용하고 세포를 밤새 다시 배양했습니다. 이와 동시에, 공동 배양이 시작되기 48시간 전에 건강한 기증자의 혈액에서 T 세포를 분리했습니다. 먼저, PBMC는 밀도 구배 원심분리 튜브와 멸균 분리 매체를 사용하여 분리되었습니다. PBMC는 세포 계수 챔버를 사용하여 계수하고, CD8+ T 세포는 CD8+ T 세포 분리 키트를 사용하여 분리했습니다. 그런 다음 분리된 CD8+ T 세포를 CFSE(1μM)로 염색한 후 계수했습니다. T 세포는 1.5 x 106 cells/3 mL의 밀도로 CD3/CD28 사전 코팅된 웰 플레이트에 파종되었습니다. 48시간의 자극 후, T 세포를 10,000 cells/10 μL의 밀도로 수확, 계수 및 재현탁시켰다. 또한, 시딩된 종양 세포의 대표적인 well을 수확하고 계수하고, 배지를 모든 잔여 well로 교환하였다. T 세포를 종양 세포에 1:1 비율로 첨가하였다. 공동 배양은 96시간 후에 수확하고, 상등액은 -20°C에서 보관하고, 세포를 염색하고 유세포 분석으로 측정했습니다(그림 1).
T 세포는 크기 배제 및 CD3/CD8 양성으로 확인되었습니다. CD3+/CD8+ 양성 세포의 CFSE 신호는 비증식성 T 세포의 분포(높은 CFSE 신호)와 증식하는 T 세포의 뚜렷한 하위 집단(CFSE 신호 강도 손실)을 보여주었습니다. 증식하는 T 세포의 비율은 HSC4 HNSCC 세포주에 대해 예시적으로 측정되었습니다(그림 4A). 적어도 하나의 분열을 보이는 모든 T 세포는 "증식성"으로 정의되었습니다. 3개 이상의 분열을 보인 T 세포는 "고증식성"으로 정의되었습니다(그림 4B). HPV 음성 세포주 HSC4의 경우, T 세포를 방사선 조사된 종양 세포와 함께 배양했을 때 증식 속도의 약간의 증가가 감지되었습니다. RT 및 RT 플러스 ATR 억제는 RT 플러스 ATM 억제 처리된 HSC4 세포와 T 세포의 공동 배양과 비교할 때 연속 T 세포 증식을 크게 증가시켰습니다. T 세포의 "고증식성" 분획과 관련하여, RT와 ATR의 억제로 HSC4 세포를 전처리하는 것이 T 세포 증식을 자극하는 데 가장 효과적이었습니다(그림 4B).
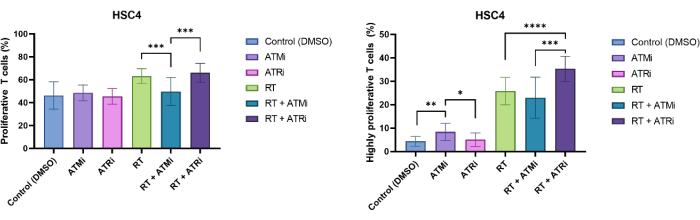
그림 4: T 세포 증식에서 HSC4 처리 의존적 변화 분석을 위한 CFSE 염색 T 세포의 증식. (A) 전처리된 HPV 음성 HSC4 종양 세포와 96시간 공동 배양 후 증식하는 T 세포의 비율. RT+ATMi 처리된 HSC4 종양 세포와의 공동 배양 후 RT 또는 RT와 ATRi 치료와 비교했을 때 T 세포 증식이 유의하게 낮았습니다. (B) HSC4 종양 세포의 RT는 고도로 증식하는 T 세포의 더 높은 분획을 유도했습니다(3개 이상의 세포 분열). RT+ATRi 전처리된 HSC4 종양 세포와 T 세포를 공동 배양한 후 증식성이 높은 T 세포의 비율이 가장 높았습니다. 막대는 4명의 독립적이고 건강한 기증자(n = 4; 평균 ± SD). (*p≤ 0.05, **p≤ 0.01, ***p≤ 0.001, ****p≤ 0.0001; 정규 분포가 없는 데이터에 대해 양측 Mann-Whitney-U를 사용하여 모든 실험 조건을 각각에 대해 비교하여 테스트한 통계적 유의성). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Proliferation-based CFSE-loss는 T 세포 증식 속도를 정량화하는 데 사용할 수 있습니다. 또한, 여러 세포 표면 마커는 CD25 및 HLADR과 같은 T 세포 활성과 관련된 것으로 설명됩니다. 따라서 유세포 분석을 통해 모든 CD3+ 및 CD8+ T 세포 표면의 CD25 및 HLA-DR을 분석했습니다(그림 5). 뚜렷한 CD25high 또는 HLA-DRhigh sub-population을 검출할 수 있는 경우 발현을 정량화할 수 있으며 이러한 highly positive cell을 게이팅하여 구별할 수 있습니다(그림 3B). 뚜렷한 하위 집단을 검출할 수 없는 경우 전체 집단의 평균 형광 강도(MFI)를 측정하고 MFI의 조건 기반 이동을 정량화할 수 있습니다(그림 3C).
예시적으로, CD25 및 HLA-DR의 MFI에 의해 확인된 발현은 전처리된 HSC4 종양 세포와 96시간 동안 공동 배양한 후 분석되었습니다(그림 5). RT 처리된 HSC4 종양 세포와 T 세포를 공동 배양한 후, T 세포에서 CD25의 발현을 강력하게 하향 조절했습니다. 특히, ATMi만 사용한 종양 세포의 전처리는 ATRi 전처리와 비교할 때 CD25의 발현을 현저히 감소시켰습니다. RT와 병용한 환경에서, RT가 T 세포에서 CD25의 발현을 감소시켰음에도 불구하고, RT와 ATMi의 병용은 RT와 ATRi를 병용했을 때 CD25의 발현을 증가시켰다(그림 5A). T 세포에서 HLA-DR의 발현과 관련하여, RT는 일반적으로 HLA-DR의 상향 조절을 유도했지만, 다시 ATMi 또는 ATRi와 함께 사용하면 다른 행동이 관찰되었습니다(그림 5B). RT+ATRi의 조합으로 전처리된 HSC4 세포와 공동 배양된 T 세포는 RT 단독 또는 RT+ATMi에 비해 HLA-DR의 발현을 증가시켰습니다.
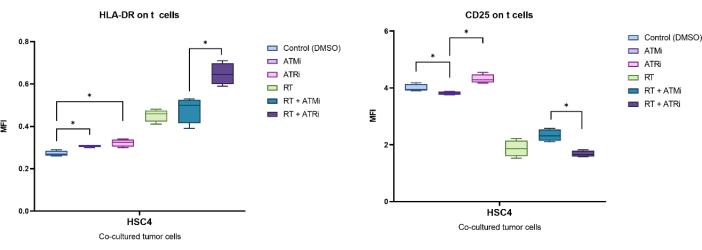
그림 5: 전처리된 HSC4 종양 세포와 96시간 동안 공동 배양한 후 T 세포 표면에서 활성화 마커 CD25 및 HLA-DR의 발현. CD25 및 HLA-DR의 발현은 전체 T 세포 집단의 MFI 이동을 기반으로 분석되었습니다. HSC4의 RT는 T 세포에서 CD25의 발현을 감소시키고 HLA-DR의 발현을 증가시켰습니다. RT와 ATMi의 조합은 RT와 ATRi를 비교했을 때 현저히 다른 발현 패턴을 나타냈습니다. 상자 그림은 4명의 독립적이고 건강한 공여자(n = 4; 평균 ± SD). 데이터는 정규 분포가 없는 데이터(*p≤ 0.050)에 대해 양측 Mann-Whitney-U 검정을 사용하여 모든 실험 조건을 서로 비교하여 분석했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이러한 데이터는 종양 세포(이 경우 HSC4 HNSCC 세포)의 치료가 종양 세포의 면역원성에 영향을 미친다는 것을 예시적으로 나타냅니다. 이는 종양 세포와 사전 자극된 T 세포의 공동 배양을 통해 모니터링할 수 있으며, 이는 적용된 종양 세포 치료 요법에 따라 인간 T 세포에서 다양한 증식 거동 및 활성화 마커의 발현으로 이어집니다.
토론
여기에 제시된 프로토콜은 전처리된 종양 세포와의 공동 배양 환경에서 T 세포의 활성화 상태와 함께 T 세포의 증식 능력을 빠르고 쉽게 분석할 수 있는 방법을 제공합니다. 이를 통해 RT, CT 또는 TT와 같은 다양한 치료 방식이 T 세포 활성 및 증식에 미치는 영향을 쉽게 스크리닝할 수 있으며, 이는 유망한 접근 방식에 대한 후속 심층 면역학적 분석을 위한 기반을 구축할 수 있습니다. 본 원고에 제시된 대표적인 결과는 이 동종 T세포 공동배양 분석법이 잘 수행되고 있음을 증명합니다. 차등적으로 전처리된 인간 HSC4(HNSCC) 세포와의 공동 배양에서 T 세포 증식과 T 세포 활성에서 상당한 차이가 관찰되었습니다(그림 4 및 그림 5). HSC4를 RT 단독 또는 TT와 병용하여 처리하면 특히 T 세포의 증식률이 높은 분획과 관련하여 T 세포의 증식이 증가하는 것으로 나타났습니다(그림 4). 증식 속도의 정량화에 따라, T 세포의 활성화 상태도 다른 치료 요법에 의해 다르게 영향을 받았습니다. 요약하면, RT의 적용은 T 세포에서 CD25의 발현을 강력하게 하향 조절하는 결과를 낳은 반면, HLA-DR의 발현은 상향 조절되었습니다. RT는 방사선 조사된 종양 세포에서 DNA 손상을 유도하며, 이는 다시 스트레스 및 손상 관련 분자 및 사이토카인의 방출뿐만 아니라 면역 조절 세포 표면 리간드의 발현을 포함하는 세포 스트레스 반응을 유발합니다19.
DNA 복구 억제제의 형태로 RT와 TT의 조합은 종양 세포가 RT로 인한 DNA 손상을 효율적으로 복구할 수 없기 때문에 이러한 효과를 더욱 강화하고 유지합니다. 이는 면역원성 인자의 분비와 면역원성 세포 표면 리간드의 발현을 더욱 촉진하고 유지할 수 있다20. 이에 따라, 우리는 RT 및 DNA 손상 억제제로 종양 세포(HNSCC)를 처리하면 종양 세포 표면의 면역 표현형이 변경된다는 것을 이전에 입증했습니다. 면역 표현형의 조절에는 면역 자극 분자 ICOS-L과 면역 억제 분자 PD-L1의 조절이 포함되었습니다11. 종양 세포 면역 표현형의 이러한 조절에 대한 반응으로 T 세포는 세포 표면의 활성화 마커 발현도 조절할 수 있습니다. 또한, RT는 IFNγ 또는 IL-6와 같은 전염증성 사이토카인의 방출을 자극하는 것으로 잘 알려져 있으며, 이는 차례로 T 세포 증식 및 활성에 영향을 미칩니다21. T 세포에서 활성화 마커의 발현은 매우 역동적인 과정입니다. Zimmerman et al.22 의 데이터에 따르면 CD25는 자극 후 24시간 후에 높게 발현되지만 자극 후 96시간 후에 다시 하향 조절됩니다. 이것은 우리의 연구 결과와 일치합니다. 대조적으로, HLA-DR은 후기 단계 활성화 마커이며 일반적으로 CD25 및 CD69의 증가가 선행됩니다23. 주목할 만한 것은 RT + ATRi의 조합이 RT + ATMi에 비해 T 세포에서 HLA-DR의 상당한 상향 조절로 이어진다는 것입니다. 이 발견은 염증성 TME를 유도하는 데 있어 ATRi + RT의 시너지 효과를 입증한 Dillion 등의 연구와 일치합니다24. T 세포 활성과 증식의 덜 뚜렷한 조절은 kinase 억제제만을 사용한 종양 세포 치료에 의해 달성되었습니다(그림 5). 이는 DNA 복구 억제제인 ATMi와 ATRi가 RT에 의한 DNA 손상을 강화하는 역할을 하기 때문에 단독요법으로 적용할 때 면역원성이 높지 않기 때문일 수 있습니다. 우리는 이미 ATMi 또는 ATRi 단독의 최소 독성을 입증했습니다11. 요약하면, 이번 연구 결과는 RT(및 DNA 손상 억제제를 동반한 TT)의 면역원성 가능성을 확인했으며, 이 실험 시스템이 인간 두경부암 세포에서 뚜렷한 치료 방식의 면역 자극 능력을 스크리닝하는 데 적합하다는 것을 나타냅니다.
여기에 제시된 방법은 쉽고 강력하지만 프로토콜에는 사전에 고려해야 할 몇 가지 중요한 단계가 있습니다. 분리 과정과 T 세포의 유세포 분석 중에 높은 EDTA 농도가 존재해야 합니다. 따라서 기증자 혈액을 EDTA 코팅된 수집 튜브에 수집하고 10mM EDTA가 보충된 MACS 완충액을 사용하여 효율적인 T 세포 분리와 유세포 분석을 위한 균일한 단일 세포 현탁액 생성을 보장하는 것이 좋습니다. 또한, T 세포 배지의 구성은 T 세포의 증식 능력에 매우 중요합니다. 다양한 배양 배지 조성을 테스트한 후, L-아르기닌 및 L-라이신의 농도가 낮은 배지는 L-아르기닌이 T 세포 대사 및 생존에 중요하고 적절한 농도로 공급되어야 하기 때문에 최상의 T 세포 증식 신호를 나타냅니다25,26. 그럼에도 불구하고 L-아르기닌 및 L-라이신 용액은 장기적으로 안정적이지 않으므로 3개월 이내에 사용해야 한다는 점을 명심해야 합니다. 최적의 자극을 위해 아미노산이 보충된 T 세포 배지는 모든 T 세포 배양 실험을 위해 새롭게 준비되어야 합니다. 더욱이, 종양 세포의 세포 수뿐만 아니라 T 세포의 세포 수는 실험의 판독에 영향을 미치기 때문에 고려해야 할 중요한 요소입니다.
종양 세포의 경우, 한편으로는 공동 배양 실험이 끝날 때 70%에서 80%의 세포 밀도가 바람직합니다. 종양 세포의 과다 증식은 세포 성장을 억제하는 인자의 분비를 초래할 수 있으며, 결과적으로 T 세포 증식 속도에도 영향을 미칠 수 있습니다. 종양 세포 성장은 개별 세포주에 크게 의존하기 때문에 서로 다른 웰 플레이트와 다양한 치료 요법에 대해 각 종양 세포주의 성장 거동을 철저히 테스트하는 것이 좋습니다. 또한, 종양 세포와 T 세포는 1:1의 비율로 공동 배양되어야 합니다. 따라서 각 치료 조건에 대해 종양 세포를 추가로 파종하는 것이 필수이며, 이는 공동 배양 시작 당일 세포 수를 결정하는 데 사용할 수 있습니다. 이에 의해, 다양한 치료 조건에 대해 적절한 수의 T 세포가 파종되는 것을 보장할 수 있습니다. T 세포의 세포 수와 관련하여, 건강한 기증자로부터 분리할 수 있는 T 세포의 양은 매우 개별적이라는 점을 고려할 필요가 있습니다. T 세포는 건강한 기증자의 PBMC의 약 45%에서 70%를 차지한다27. 따라서 필요한 T 세포의 양은 혈액 채취 시점에 이미 광범위하게 추정되어야 합니다. 더욱이, T세포 밀도는 T세포 활성화의 효율성과 생존에 중요합니다. 결과적으로, T 세포는 공동 배양 시작 전에 초기 자극을 위해 3mL의 T 세포 배지에 있는 6-well 플레이트의 웰당 최소 150만 개의 세포 농도로 파종되어야 합니다. 더 높은 T 세포 밀도는 가능하지만 더 낮은 밀도는 피해야 합니다. T 세포의 활성화는 활성화된 T 세포가 세포 클러스터를 형성하는 경향이 있기 때문에 현미경으로 형태학적으로 평가할 수도 있습니다.
이 방법은 다양한 종양 세포주 및 치료 방식의 면역 자극 능력을 연구하기 위한 단순화된 실험 시스템이기 때문에 고려해야 할 몇 가지 제한 사항이 있습니다. 첫째, 이 분석은 동종 시스템을 기반으로 하며, 이는 공여자 T 세포가 해당 종양 세포주와 HLA 일치가 없음을 의미합니다. 따라서, 이러한 HLA-불일치는 이미 T세포 자극을 유도할 수 있고, 이어서 종양세포 치료제로부터 추가적인 자극 없이 T세포 증식을 유도할 수 있다28. 이러한 원치 않는 효과를 정량화하기 위해, 분리된 T 세포를 CD28 및 CD3 항체로 사전 자극 없이 HSC4 세포주와 공동 배양했습니다. 이 환경에서 증식이 거의 유도되지 않는 것으로 밝혀졌으며, 이는 HLA 불일치가 이 특정 실험 환경에서 T 세포 활성화에 미미한 영향만 미친다는 것을 나타냅니다. 또한, 동종 환경에도 불구하고 종양 세포 치료에 따른 T 세포 증식 및 활성화에 유의한 차이가 발견되었습니다. 그럼에도 불구하고, 이 분석법의 확립을 위해서는 T 세포의 잠재적인 동종 유도 증식을 실험 시작 시 한 번 테스트하고 정량화해야 합니다. 권장되는 "T 세포만" 및 "종양 세포만" 대조군은 충분한 게이팅을 위해 필요하며 모든 실험 복제에서 필수입니다. 그럼에도 불구하고, 동종 공동 배양 시스템은 종양 특이적 항원 인식이 부족하다는 점을 명심해야 합니다. 따라서, 이 시스템은 환자에서 생체 내에서 발생하는 것처럼 특정 항종양 반응을 정확하게 반영하지 못할 수 있습니다29,30. 더 나은 개선을 위해 보다 정교한 설정은 자율적인 공동 문화 접근 방식입니다. 이러한 환경에서는 환자 유래 종양 생검을 배양하고 동일한 환자의 말초 혈액에서 분리한 T 세포를 배양하여 배양해야 합니다28. 그러나 이러한 실험적 접근 방식은 원발성 종양 세포를 배양하는 측면뿐만 아니라 환자 유래 생체 물질의 가용성 측면에서도 도전적일 수 있습니다. 고려해야 할 또 다른 한계는 공동 배양에서 종양 세포와 T 세포의 비율입니다. 세포의 권장 비율이 1:1이기 때문에 이 비율은 환자31에서 TME의 생리학적 상황을 반영하지 않습니다. 그러나 T 세포 수가 적을수록 증식 속도 및 활성화 상태의 변화를 정량화할 수 없기 때문에 이러한 제한을 받아들여야 합니다.
종양 면역학 분야에서 이 분석은 쉽고 빠른 실험적인 체외 환경에서 다양한 치료 방식의 면역원성을 스크리닝할 수 있는 기회를 제공합니다. 따라서 면역원성 측면에서 가장 유망한 접근 방식을 사전 스크리닝함으로써 시간을 절약할 수 있을 뿐만 아니라 생체 내 실험도 절약할 수 있습니다. 동물 모델은 면역 체계 전체를 유기체에 반영하기 위해 동물 모델에서 더 추구될 수 있기 때문에 동물 모델을 줄일 수 있습니다. 또한, 이 분석은 인간 일차 세포와 인간 암 세포주를 기반으로 하기 때문에 다른 모델 시스템 및 종을 기반으로 하는 분석보다 결과를 임상으로 더 잘 번역할 수 있습니다.
앞으로 이 분석은 보다 구체적인 연구 질문에 답하기 위해 조정되고 조정될 수 있습니다. 예를 들어, 환자의 상황에 더 가까운 치료 시나리오를 반영하기 위해 T 세포의 치료를 포함할 수 있습니다. 종양반응성 T세포는 대부분 TME에서 발견되기 때문에 RT와 같은 국소 요법에 의해 동등하게 영향을 받으며 CT 또는 TT32와 같은 전신 요법에 의해서도 영향을 받을 가능성이 있습니다. 이 분석법의 또 다른 개선은 종양 세포주에서 종양 스페로이드와 T 세포를 공동 배양하거나 환자 유래 종양 오가노이드와 공동 배양하는 것입니다. 이러한 3차원 배양은 환자28의 종양 구조와 더 유사합니다. 마지막으로, 유세포 분석을 통한 실험 판독은 T 세포 표면의 추가 분자를 조사하거나 종양 세포에서 면역 관문 분자의 발현을 분석하기 위해 쉽게 조정할 수 있습니다. T 세포의 면역 표현형을 측정하는 것 외에도 공동 배양 실험에서 얻은 세포 배양 상등액을 사용하여 분비된 사이토카인 또는 케모카인의 정량화를 통해 T 세포 활성에 대한 더 많은 통찰력을 얻을 수 있습니다. 요약하면, 이 프로토콜은 다양한 암 치료 방식의 면역원성을 스크리닝할 수 있는 포괄적이고 강력하며 쉬운 T 세포 및 종양 세포 공동 배양 분석을 제공합니다. 이 분석은 특정 연구 질문에 적용할 수 있기 때문에 광범위한 종양 면역학 분야에 적용하기에 매우 적합합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 Erlangen 임상 연구를 위한 학제 간 센터(IZKF Erlangen)와 Bayerisches Zentrum für Krebsforschung (BZKF)의 일부 자금 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
참고문헌
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378 (2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150 (2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151 (2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114 (2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610 (2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899 (2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661 (2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076 (2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., Verhoeckx, K. . The impact of food bioactives on health: In vitro and ex vivo models. , 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716 (2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082 (2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222 (2022).
- Wang, W., Green, M., Rebecca Liu, J., Lawrence, T. S., Zou, W., Zitvogel, L., Kroemer, G. . Oncoimmunology: A practical guide for cancer immunotherapy. , 23-39 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유