Method Article
Анализ активности Т-клеток человека в условиях аллогенного ко-культивирования предварительно обработанных опухолевых клеток
В этой статье
Резюме
Настоящий протокол описывает экспериментальный рабочий процесс, который позволяет проводить ex vivo анализ стимуляции Т-клеток человека в аллогенной системе совместного культивирования с предварительно обработанными опухолевыми клетками.
Аннотация
Цитотоксические Т-клетки играют ключевую роль в элиминации опухолевых клеток и поэтому интенсивно изучаются в иммунологии рака. Частота и активность цитотоксических Т-клеток в опухолях и их опухолевом микроокружении (ТМЭ) в настоящее время являются хорошо известными прогностическими и прогностическими биомаркерами для различных типов опухолей. Тем не менее, хорошо известно, что различные методы лечения опухолей, включая лучевую терапию, химиотерапию, иммунотерапию и таргетную терапию, модулируют не только иммуногенность опухоли, но и саму иммунную систему. Следовательно, взаимодействие между опухолевыми клетками и Т-клетками требует более интенсивного изучения в различных терапевтических контекстах, чтобы полностью понять сложную роль Т-клеток во время терапии опухолей. Для удовлетворения этой потребности был разработан протокол анализа активности и пролиферативной способности цитотоксических (CD8+) Т-клеток человека в кокультуре с предварительно обработанными опухолевыми клетками. В частности, CD8+ Т-клетки здоровых доноров окрашивают нетоксичным маркером пролиферации карбоксифлуоресцеином диацетатом сукцинимидиловым эфиром (CFSE) и стимулируют с помощью пластин, покрытых CD3/CD28. Впоследствии Т-клетки культивируют совместно с предварительно обработанными опухолевыми клетками. В качестве считывания пролиферация Т-клеток количественно определяется путем измерения распределения сигнала CFSE и оценки экспрессии маркеров поверхностной активации с помощью проточной цитометрии. Это может быть дополнительно дополнено количественным определением высвобождения цитокинов с помощью иммуноферментного анализа (ИФА). Этот метод облегчает оценку индуцированных лечением изменений во взаимодействии между опухолевыми клетками и Т-клетками, обеспечивая основу для более детального анализа методов лечения опухолей и их иммуногенности в условиях ex vivo человека. Кроме того, это способствует сокращению доклинических анализов in vivo .
Введение
В настоящее время становится все более очевидным, что рост и развитие опухолей в значительной степени зависят от эффективного манипулирования иммунной системой хозяина и подавления ее. Трансформированные клетки появляются каждый день, даже в здоровом организме. Однако образование макроскопических опухолей является довольно редким явлением, так как возникающие трансформированные клетки удаляются из организма с высокой эффективностью. Для удаления злокачественных клеток в действие вступают различные типы иммунных клеток, такие как цитотоксические Т-клетки, естественные киллеры (NK)T-клетки, NK-клетки или макрофаги 1,2,3. Тем не менее, иногда могут возникать трансформированные клеточные клоны, которые выживают в равновесном состоянии с иммунной системой хозяина, которая характеризуется различными иммуносупрессивными стратегиями клона опухолевых клеток4. В конце концов, некоторые трансформированные клетки приобретают дополнительные функции, которые позволяют опухолевым клеткам активно подавлять иммунный ответ, что в свою очередь приводит к росту опухоли. Эта иммуносупрессия опосредована многочисленными механизмами, которые включают экспрессию иммуносупрессивных лигандов на опухолевых клетках или активный набор или прайминг иммунорегуляторных или иммуносупрессивных иммунных клеточных популяций. Эта так называемая концепция иммунного редактирования демонстрирует ключевую роль иммунной модуляции во время формирования и роста опухоли5.
Таким образом, неудивительно, что иммунная система в настоящее время находится в центре внимания не только в терапии рака, но и в качестве прогностического и прогностического фактора во многих опухолевых образованиях и терапевтических условиях. В последние годы ингибиторы контрольных точек иммунного ответа (ИПЦ) стали многообещающими терапевтическими вариантами при различных солидных раковых заболеваниях, таких как плоскоклеточный рак головы и шеи (HNSCC) или немелкоклеточный рак легкого (НМРЛ), с целью модуляции опухолевого микроокружения (ТМЭ) в сторону более эффективного противоопухолевого иммунного ответа и снижения иммуносупрессии опухолевых клеток6. Ингибиторы контрольных точек иммунного ответа нацелены на ускорение уничтожения опухолевых клеток, опосредованное Т-клетками, нацеливаясь на молекулы иммунных контрольных точек, такие как молекулы запрограммированного белка смерти 1 (PD-1) и его лиганда 1 (PD1/PD-L1). Этот факт подчеркивает ключевую роль Т-клеток в формировании противоопухолевого иммунитета. В HNSCC, например, ICIs были успешно одобрены в качестве терапии первой линии при рецидивирующем и метастазированном HNSCC7. В связи с этим, присутствие цитотоксических Т-клеток в ТМЭ, а также экспрессия PD1 и PD-L1 на опухолевых клетках и Т-клетках соответственно могут служить прогностическими биомаркерами в HNSCC 8,9,10.
Несмотря на то, что Т-клетки играют решающую роль в иммунологии опухолей и терапии опухолей, многие открытые вопросы об их взаимодействии с опухолью все еще нуждаются в решении. В настоящее время хорошо известно, что иммунный ответ опухоли является динамическим процессом и что иммуногенность опухолей может меняться на протяжении заболевания и лечения. Различные методы лечения, такие как химиотерапия (КТ), лучевая терапия (ЛТ) или таргетная терапия (ТТ), особенно широко известны для модуляции иммунологического фенотипа опухолевых клеток. ЛТ может стимулировать активацию молекул иммунных контрольных точек в опухолевой ткани и изменять частоту инфильтрации клеток в опухоль11,12. ТТ, с другой стороны, может также способствовать благоприятным изменениям внутри опухоли и ТМЭ путем прямой модуляции адаптивного иммунного ответа 13,14,15,16. Тем не менее, эти модуляции сложно изучить у пациентов, так как это потребовало бы повторного обследования опухолевой ткани во время курса лечения. Таким образом, необходимы убедительные экспериментальные модельные системы для изучения динамического иммунологического фенотипа опухолевых клеток и Т-клеток и, что более важно, их взаимодействий.
Следовательно, с целью анализа активности Т-клеток и взаимодействия опухолевых клеток и Т-клеток необходим комплексный анализ сокультуры ex vivo , который легко реализовать в любой лаборатории на основе простой работы с клеточными культурами и широко используемого анализа проточной цитометрии. На основании существующей и доступной литературы до сих пор не было опубликовано простого в использовании и широко используемого протокола в отношении совместного культивирования Т-клеток и опухолевых клеток. Несмотря на то, что в последнее время было опубликовано несколько анализов для Т-клеток и опухолевых органоидов, метод 3D-культивирования клеток в настоящее время все еще не используется в качестве стандартного метода во всех лабораториях. Таким образом, мы предоставляем протокол для использования в 2D клеточной культуре, который также может быть разработан для 3D клеточной культуры в будущем. Другие протоколы 2D ко-культивирования часто являются более сложными, поскольку они требуют, например, трансдукции опухолевых клеток люциферазой17 или подходят только для гематологических злокачественных новообразований (совместное культивирование несовпадающих Т-клеток с лейкозными клетками)18. В описанном здесь анализе Т-клетки нормальных здоровых доноров выделяют из периферической крови и стимулируют антителами против CD3 и CD28. Впоследствии Т-клетки культивируют совместно с (предварительно) обработанными опухолевыми клетками с целью анализа пролиферативной способности Т-клеток, а также их активности с помощью проточной цитометрии. Таким образом, влияние различных методов лечения на иммунный фенотип опухолевых клеток, таких как ОТ, КТ или ТТ, которые, в свою очередь, влияют на активность и пролиферацию Т-клеток, может быть легко проверено и использовано в качестве основы для более глубокого механистического анализа и последующего выбора доклинических анализов in vivo . Описанный здесь анализ предлагает простую в использовании конфигурацию, так как не требует нетрадиционных устройств, методов или материалов. Кроме того, анализ может быть легко адаптирован к различным линиям опухолевых клеток или конкретным субпопуляциям Т-клеток (например, CD4+ Т-клеткам). С помощью этой методики достигается высокая стандартизация и воспроизводимость.
протокол
Этот анализ включает в себя забор крови и культивирование первичных клеток человека. Таким образом, этическое голосование является обязательным для этих анализов. Все результаты, представленные в данной рукописи, подпадают под этическое одобрение исследования IMMO-NHD, и письменное информированное согласие было получено от всех доноров. Одобрение было выдано институциональным наблюдательным советом Университета Фридриха-Александра Эрлангена-Нюрнберга 9 ноября 2022 года (заявка No 21-415-B). Опухолевые клетки HSC4, используемые в этом исследовании, происходят из коммерчески доступной клеточной линии.
Этот анализ иллюстрирует все этапы совместного культивирования Т-клеток и опухолевых клеток с использованием клеточной линии плоскоклеточного рака головы и шеи человека (HNSCC) HSC4 в условиях лечения с использованием лучевой терапии (ЛТ) и двух специфических ингибиторов киназы. Следовательно, такие параметры, как количество клеток, время трипсинизации и схемы лечения, специфичны для этой совместной культуры и должны быть адаптированы для других линий опухолевых клеток (см. также раздел «Обсуждение»). Все этапы центрифугирования выполняли при комнатной температуре. В этом исследовании ингибиторы киназы AZD0156 и VE-822 были использованы для нацеливания на систему репарации повреждений ДНК (DDR) клеток HSC4. AZD0156 (Selleckchem) ингибирует мутировавший белок (ATM) телеангиэктазии атаксии, в то время как VE-822 (Selleckchem) нацелен на телеангиэктазию атаксии и белок, связанный с Rad3 (ATR). Оба ингибитора обсуждались как потенциальные агенты для повышения радиочувствительности в опухолевых клетках. Они растворяются в диметилсульфоксиде (ДМСО) и хранятся при температуре -20 °C. На рисунке 1 представлена блок-схема анализа ex vivo , в которой подробно описывается совместное культивирование предварительно обработанных опухолевых клеток с CD3/CD28-стимулированными человеческими CD8+ Т-клетками. Используемые реагенты и оборудование перечислены в Таблице материалов.
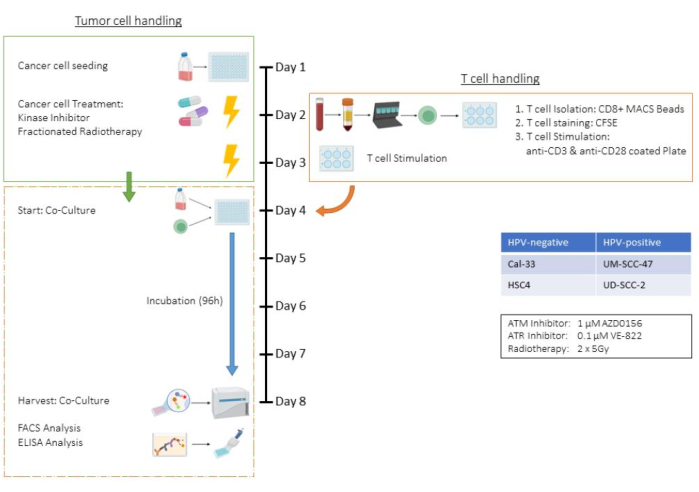
Рисунок 1: Блок-схема анализа ex vivo предварительно обработанных опухолевых клеток в кокультуре со (CD3/CD28) стимулированными человеческими CD8+ Т-клетками. День 1: Посев опухолевых клеток HSC4. День 2: Лечение опухолевых клеток и выделение, CFSE-окрашивание и посев в CD3/CD28-покрытые пластины CD8+ Т-клеток человека. День 3: Лечение опухолевых клеток. День 4: Подсчет репрезентативных лунок опухолевых клеток. Сбор и подсчет всех Т-клеток. Совместное культивирование Т-клеток и опухолевых клеток HSC4 в соотношении 1:1. День 5-День 8: Инкубация сокультур. День 8: Сбор ко-культуры, замораживание надосадочной жидкости, окрашивание на основе антител и анализ клеток с помощью проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Посев опухолевых клеток (день 1)
ПРИМЕЧАНИЕ: Хронометраж: 1 час. Опухолевые клетки HSC4 человека высеваются из бутылок с клеточными культурами T75 в 96-луночные планшеты.
- Выбросьте надосадочную жидкость (D10 Medium) из флакона для клеточной культуры.
- Промойте опухолевые клетки 5 мл теплой температуры 37 °C PBS. Откажитесь от PBS.
- Поскольку опухолевые клетки HSC4 имеют тенденцию плотно прилегать к колбам с клеточными культурами, рекомендуется двухэтапная трипсинизация, чтобы обеспечить отделение всех клеток. Для этого добавьте 3 мл трипсина и поместите флакон на нагревательную пластину при температуре 37 °C на 3 минуты, затем выбросьте трипсин с помощью пипетки.
- Добавьте еще 3 мл трипсина, установите флакон на нагревательную пластину и подождите, пока не будет достигнута суспензия одиночных клеток. Проверьте под микроскопом наличие суспензии одиночных клеток.
- Остановите прием трипсина, добавив двойной объем D10 Medium (DMEM с добавлением 10% фетальной бычьей сыворотки и 1% пенициллин-стрептомицина), тщательно ресуспендируйте и перенесите клетки в центрифужную пробирку объемом 50 мл.
- Определите количество клеток одноклеточной суспензии, затем рассчитайте общее количество опухолевых клеток в соответствии с общим объемом. Для определения количества клеток рекомендуется использовать камеру Нейбауэра.
- Центрифугируйте центрифужную пробирку объемом 50 мл, содержащую опухолевые клетки, при давлении 300 x g в течение 5 минут при комнатной температуре. Выбросьте надосадочную жидкость.
- Ресуспендируйте опухолевые клетки HSC4 в подходящем объеме среды D10 для достижения концентрации 15 000 клеток в среде объемом 200 мкл.
- В соответствии с плановыми методами лечения опухолевых клеток, для каждого состояния затравливают не менее 3 лунок, содержащих 15 000 опухолевых клеток HSC4 в среде объемом 200 мкл в двух 96-луночных планшетах (1 образец, 1 контрольная опухолевая клетка, 1 лунка для подсчета клеток в день совместного культивирования).
ПРИМЕЧАНИЕ: Номер ячейки зависит от клеточной линии и времени удвоения. Количество клеток для различных методов лечения необходимо исследовать в ходе предварительных экспериментов, чтобы избежать 100% слияния во время инкубации. - Инкубируйте клетки в течение 24 ч при 37 °C и 5%CO2 и насыщенной влажности.
2. Лечение опухолевых клеток (День 2)
ПРИМЕЧАНИЕ: Хронометраж: 3-5 ч. После инкубации в течение 24 часов ранее посеянные клетки HSC4 могут быть обработаны в соответствии с желаемой схемой обработки. В этом примерном случае опухолевые клетки обрабатываются ингибитором ATM или ATR. Кроме того, при этом один из двух 96-луночных планшетов также облучают 2x 5 Гр впоследствии.
- Готовят ингибиторы киназы для получения концентрации 1 мкМ AZD0156 (ингибитор ATM) и 0,1 мкМ VE-822 (ингибитор ATR) для лечения опухолевых клеток.
- Обрабатывайте опухолевые клетки соответствующим образом, например, обрабатывая один ряд образцов 3,1 мкл ингибитора ATM, а второй — 3,1 мкл ингибитора ATR в каждой пластине.
- После 3-5 ч инкубации при 37 °C облучите одну пластину 5 Гр.
- После инкубации в течение еще 24 ч снова облучите ту же тарелку 5 Гр.
3. Выделение Т-клеток (день 2)
Примечание: Время: Через 4 ч. CD8+ Т-клетки изолируют магнитом с помощью анти-CD8 микрогранул из PBMC после центрифугирования градиента плотности периферической крови (PB), полученной от здоровых взрослых доноров. Затем выделенные Т-клетки окрашивают CFSE и инкубируют в луночной пластине, покрытой CD3/CD28, для стимуляции. Чтобы иметь возможность работать с ресурсами и материалами на последующих этапах, важно оценить количество Т-клеток, необходимых для экспериментов по совместному культивированию. В зависимости от донора, от 50 000 000 до 100 000 000 PBMC могут быть выделены из примерно 45 мл крови ЭДТА. Около 10% от общего числа PBMC составляют CD8+ Т-клетки.
- Центрифугирование с градиентом плотности
- Переложите 3-5 пробирок с кровью ЭДТА объемом 9 мл, полученных от здорового донора, в две центрифугирующие пробирки по 50 мл.
- Заполните обе центрифужные пробирки до 50 мл PBS + 2% FBS.
- Подготовьте шесть центрифугирующих пробирок (с пластиковой вкладышем для разделения PBMC) и заполните каждую 15 мл градиентной среды +4 °C.
- Осторожно насыпьте градиент плотности среды с 12-15 мл разведенной крови из шага 3.1.2.
- Центрифугируйте при давлении 1200 x g в течение 10 минут (замедление не требуется).
- Подготовка 6-луночного планшета для стимуляции Т-клеток
- Приготовление антител: Приготовьте раствор анти-CD3 (клон OKT3) в концентрации 1 мг/мл с PBS. Приготовьте раствор анти-CD28 (клон 28.2) в дозе 0,1 мг/мл с PBS.
- Рекомендация: использовать время во время центрифугирования (шаг 3.1.5) для приготовления растворов покрытий, а покрытие самих лунок для стимуляции Т-клеток.
- Смешайте 5 мкл раствора CD3-антитела с 4,995 мкл PBS и 50 мкл раствора CD28-антитела с 4,950 мкл PBS (конечная концентрация: 1 мкг/мкл).
- Добавьте по 1.000 мкл обоих растворов антител в каждую лунку 6-луночного планшета.
- Покройте 2 или 3 лунки, в зависимости от ожидаемого количества Т-клеток, 6-луночным планшетом и инкубируйте не менее 2 ч при 37 °С.
- Приготовление Т-клеточной среды
ПРИМЕЧАНИЕ: Приготовление 100x L-лизина: Растворите 200 мг L-лизина гидрохлорида в 50 мл дистиллированной воды в центрифужной пробирке объемом 50 мл. Стерилизуйте раствор с помощью шприцевого фильтра 0,2 мкм и перенесите его в новую пробирку объемом 50 мл с помощью перфузионного шприца объемом 50 мл. Храните раствор при температуре 4-8 °C и используйте в течение 3 месяцев. Приготовление 15 мМ L-аргинина: Растворите 26 мг L-аргинина в 10 мл DPBS. Стерилизуйте раствор с помощью шприцевого фильтра 0,2 мкм и переложите его в новую пробирку с помощью шприца объемом 10 мл. Храните раствор при температуре 4-8 °C и используйте в течение 3 месяцев.- Используйте время центрифугирования, как указано в шаге 1.5, для приготовления среды для Т-клеток.
- Приготовьте около 10-30 мл Т-клеточной среды, в зависимости от ожидаемого количества Т-клеток.
- Смешайте среду RPMI без L-аргинина и L-лизина с 10% термоинактивированным FBS, 1% пенициллин-стрептомицина, 1% L-аргинина, 1% L-лизина и 1% L-глутамина. Пример: 25,8 мл среды RPMI + 3 мл FBS + 0,3 мл Pen/Strepping + 0,3 мл L-аргинина + 0,3 мл L-лизина + 0,3 мл L-глутамина.
- Оставшуюся среду хранить при температуре 4 °C в течение следующих двух дней, чтобы использовать на 4-й день - начало совместного культивирования. Для каждого нового прогона всего эксперимента рекомендуется готовить свежую питательную среду.
- Изоляция PBMC
- После центрифугирования (шаг 3.1.5) переложите надосадочную жидкость в четыре новые центрифужные пробирки объемом 50 мл и выбросьте использованные пробирки.
- Заполните центрифужные пробирки объемом до 50 мл PBS + 2% FBS.
- Центрифуга при 300 х г в течение 8 минут при комнатной температуре.
- Выбросьте надосадочную жидкость, повторно суспендируйте клеточные гранулы в 1 мл PBS + 2% FBS каждая, и объедините их в две центрифугирующие пробирки.
- Наполните пробирки до 50 мл PBS + 2% FCS.
- Центрифуга при 120 х г в течение 10 минут при комнатной температуре.
- Выбросьте надосадочную жидкость, осторожно ресуспендируйте клеточную гранулу в 1 мл PBS +2% FBS, и соедините две гранулы в одну сокол.
- Заполните центрифужную пробирку до 50 мл PBS + 2% FBS.
- Подсчитайте общее количество PBMC с помощью счетной камеры Нейбауэра. Рекомендация: для подсчета развести клеточную суспензию в соотношении 1:10 с трипановым синим.
- Разделение CD8+ Т-клеток
ПРИМЕЧАНИЕ: Используйте CD8 MicroBeads в человеческом сочетании с колонками магнитной сепарации (MS) и буфером для сортировки магнитных активированных клеток плюс (MACS+) для магнитного разделения CD8+ Т-клеток в соответствии с протоколом производителя (см. Таблицу материалов).- Центрифугируйте PBMC (после подсчета клеток) при давлении 300 x g в течение 10 минут.
- Выбросьте надосадочную жидкость и ресуспендируйте клеточную гранулу в 80 мкл буфера MACS+ (500 мл PBS с добавлением 10 мМ ЭДТА и 0,5% БСА) на 107 клеток (например, 60 000 000 PBMC ресуспендируют в буфере 6 x 80 μL = 480 μL).
ПРИМЕЧАНИЕ: Пример: 465 мл PBS + 10 мл (0,5 М) раствора ЭДТА и 25 мл раствора BSA-Stock. - Добавьте 20 мкл CD8 микрогранул на10-7 клеток и тщательно перемешайте, пипетируя вверх и вниз. Выдерживать в течение 15 минут при температуре 4 °C.
- После инкубации промойте клетки, добавив 2 мл буфера MACS+ на 10–7 клеток.
- Центрифуга при 300 х г в течение 10 минут при комнатной температуре. Выбросьте надосадочную жидкость и повторно суспендируйте клетки в 1 000 мкл буфера MACS+.
- Установите две колонки MS в магнит и поместите под них две центрифужные пробирки объемом 15 мл.
- Подготовьте колонки с буфером MACS+ объемом 500 μL. Буфер проходит через колонны и может быть собран в центрифужных трубках под ними. Этот шаг также может быть выполнен параллельно с шагом 3.5.6.
- Затем равномерно пипетируйте клеточную суспензию в подготовленные колонки МС. Проточный поток может быть собран в тех же центрифугаторных трубках. Теперь он содержит все немеченые, CD8-отрицательные клетки.
- Очистите столбцы, добавив 3x 500 μL буфера MACS+. Добавляйте новый буфер поверх столбцов только тогда, когда они иссякнут или перестанут капать.
- Пометьте окончательные собранные клетки как «Проточные» или «CD8 отрицательные» и объедините их в одну центрифужную пробирку. В дальнейшем это может быть использовано для измерения чистоты выделения с помощью проточной цитометрии.
- Возьмем новую центрифужную пробирку объемом 15 мл с маркировкой «CD8+ Т-клетки». Колонки снимаются с магнита и помещаются на центрифужную трубку.
- Промойте обе колонки, содержащие меченые магнитом CD8-положительные Т-клетки, 1000 мкл буфера MACS+ каждая. Поэтому нанесите пипетку в колонки и сразу же начните осторожно выталкивать раствор из колонок с помощью поршня, предоставленного производителем.
ПРИМЕЧАНИЕ: Проделайте это для обеих колонок, собрав 2 мл суспензии Т-клеток в центрифугировании. - Подсчитайте общее количество Т-клеток с помощью счетной камеры Нейбауэра. Рекомендация: Используйте разбавление 1:4 с трипановым синим.
- Окрашивание Т-клеток с помощью CFSE
- Центрифугируйте выделенные Т-клетки при давлении 300 x g в течение 5 минут.
- Во время центрифугирования приготовьте окрашивающий раствор CFSE, смешав 1,1 мкл раствора CFSE с 10 мл PBS. Конечная концентрация должна составлять 1 мкМ.
- Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в 1000 мкл PBS. Центрифугируйте при 300 х г в течение 5 мин.
- Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в 2000 мкл окрашивающего раствора CFSE (1 мкМ). Инкубировать в течение 20 минут при 37 °C.
- Центрифугируйте окрашенные клетки при 300 х г в течение 5 минут. Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в 1000 мкл PBS.
- Центрифугируйте при 300 х г в течение 5 мин. Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в соответствующем количестве Т-клеточной среды до достижения концентрации 1,5-2 x 106 Т-клеток примерно в 3-4 мл Т-клеточной среды.
- Посев Т-клеток в 6-луночный планшет
- Сбросить раствор покрытия с 6-луночного планшета.
- Засейте 1,5-2 млн выделенных и окрашенных Т-клеток в среду 3-4 мл Т-клеток в лунке.
- Инкубируйте Т-клетки при 37 °C и 5%CO2 в течение следующих 48 часов
ПРИМЕЧАНИЕ: Всегда регулируйте плотность посева на 1,5 млн клеток / 3 мл. Избегайте посева Т-клеток с более низкой плотностью. Более высокая плотность возможна, но ее необходимо проверить.
4. Начало кокультуры (День 4)
ПРИМЕЧАНИЕ: Хронометраж: 2 ч. После определения количества клеток опухолевых клеток HSC4 Т-клетки добавляются к 96-луночным планшетам в соотношении 1:1.
- Сбор урожая из одной лунки для каждого условия для определения репрезентативного количества клеток
- Выбросьте надосадочную жидкость из лунки, которая была образцово засеяна для определения количества клеток.
- Сначала промойте ячейки 100 μл PBS, затем выбросьте PBS.
- Добавьте 100 μл трипсина и инкубируйте 5 минут на нагревательной пластине. Затем повторно суспензировать и проверить одноклеточную суспензию под микроскопом; Если клетки не отделяются, добавьте еще 50 мкл трипсина.
- Как только все клетки отсоединились, остановите реакцию трипсина, добавив 100 мкл (или 150 мкл, если до этого было добавлено еще 50 мкл трипсина) среды D10 и повторите.
- Перелейте весь объем 200 мкл из лунки в пробирку для образца объемом 1,5 мл и используйте 100 мкл для измерения количества клеток. Не забудьте отрегулировать измеренное количество ячеек в соответствии с объемом образца.
- Окрашивание опухолевых клеток HSC4 нетоксичным флуоресцентным красителем для слежения за клетками
- Подготовьте клеточный трекер (см. Таблицу материалов), растворив 2 мкл в 20 мл PBS (конечная концентрация 0,1 мкМ в зависимости от производителя).
- Пипетируйте среду D10 из всех лунок, содержащих опухолевые клетки, и выбросьте ее.
- Добавьте 200 мкл раствора клеточного трекера в лунки опухолевых клеток. Инкубировать в течение 20 минут при 37 °C.
- После инкубации выбросьте раствор для окрашивания и промойте, добавив 100 мкл PBS. Впоследствии также откажитесь от PBS.
- Добавьте 200 μL свежей среды D10.
- Забор Т-клеток (6-луночный планшет)
- Осторожно ресуспендировать Т-клетки в их среде; Большинство Т-клеток находятся во взвешенном состоянии и могут быть собраны путем простого дозирования из лунки.
- Микроскопически проверить, пусты ли лунки; если нет, соберите с помощью 1000 мкл трипсина, поместите планшет на нагревательную пластину при температуре 37 °С до тех пор, пока Т-клетки не отделятся, затем остановите реакцию, добавив 1000 мкл PBS или Т-клеточной среды (необязательно).
- Подсчитайте количество Т-клеток с помощью счетной камеры Нейбауэра. Затем центрифугируйте Т-клетки при давлении 300 x g в течение 5 минут.
- Ресуспендируйте Т-клетки в Т-клеточной среде (используйте ту же среду, которая была приготовлена на 2-й день изоляции Т-клеток) до конечной концентрации 10 000 Т-клеток на 20 мкл.
- Добавление Т-клеток к опухолевым клеткам HSC4 (96-луночный планшет)
- Добавьте желаемое количество Т-клеток в лунки опухолевых клеток в соответствии с ранее определенным количеством опухолевых клеток в соотношении 1:1.
- Держите одну опухолевую клетку здоровой в каждом состоянии свободной от Т-клеток в качестве контроля «только опухолевых клеток». Этот контроль «только опухолевых клеток» обеспечивает точное стробирование данных потока.
- Добавьте 200 мл суспензии Т-клеток в пустую лунку в качестве контрольной группы «только для Т-клеток» (200 000 Т-клеток). Это управление «только Т-клеткой» обеспечивает точное стробирование данных потока.
- Инкубация сокультуры в течение 96 ч (37 °C, 5%CO2)
5. Количественная оценка пролиферации Т-клеток методом проточной цитометрии (день 7)
ПРИМЕЧАНИЕ: Время: 3 часа. После инкубации ко-культуры в течение еще 96 ч лунки собирают и окрашивают смесью антител, содержащей различные антитела в зависимости от исследовательской гипотезы (например, анти-CD3, CD8, HLA-DR и CD25-антитела). Затем клетки анализируют с помощью многоцветной проточной цитометрии.
- Подготовьте и запишите партию пробирок FACS и микроцентрифужных пробирок для каждой скважины, которую необходимо собрать.
- Забор клеток
- Ресуспендируйте клетки в их среде и перенесите их в трубки FACS.
- Промойте ячейки 100 μл PBS, затем перенесите его в пробирки FACS.
- Добавьте в лунки 100 мкл трипсина и выдерживайте на нагревательной пластине (37 °C) в течение 5 минут.
- Восстановите суспензию клеток, затем контролируйте под микроскопом, если все клетки отделены. Если это так, перенесите суспензию трипсинированных клеток в пробирки FACS.
- Проверьте под микроскопом, все ли лунки пусты; Если нет, повторите шаги 5.2.3-5.2.4.
- Сбор надосадочной жидкости сокультуры для дальнейших экспериментов
- Центрифугируйте пробирки, заполненные ячейками, при давлении 300 х г в течение 5 минут.
- Осторожно отпижьте около 300 мкл надосадочной жидкости из пробирок в другую партию микроцентрифужных пробирок для замораживания при температуре -20°С. Надосадочная жидкость может быть впоследствии использована для выполнения, например, анализов ИФА с целью количественного определения секретируемых цитокинов.
- Окрашивание клеток антителами для выполнения проточной цитометрии
- Приготовьте смесь антител: добавьте 5 мкл анти-CD3-Krome Orange, 0,5 мкл анти-CD8-PerCE-Cyp5.5, 1 мкл анти-HLA-DR-APCVio770, 2,5 мкл анти-CD25-PE-Dazzle к 91 мкл буфера PBS/FACS.
- Добавьте 200 μL буфера FACS (PBS с добавлением 2% FBS и 2% EDTA) в каждую пробирку и повторите.
- Снова центрифугируйте при 300 x g в течение 5 минут. Отбраковать надосадочную жидкость и ресуспендировать клетки в 100 мкл ранее приготовленной смеси антител (шаг 5.4.1). Выдерживать 30-45 минут при температуре 4 °C в холодильнике, защищенном от света.
- После инкубации центрифугируйте при 300 х г в течение 5 минут. Выбросьте надосадочную жидкость и ресуспендируйте клетки в 100 мкл буфера FACS.
- Проведите проточную цитометрию на цитометре, способном различать все вышеупомянутые флуоресцентные антитела и сигнал CSFE.
6. Стратегия стробирования и анализ данных
- Исключение дублетов и определение правильной популяции Т-клеток (рис. 2A).
- Исключение популяции дублетов на основе прямого и . боковая зона рассеяния (FSC-A в сравнении с SSC-A) (синглеты).
- График "Синглеты" для идентификации Т-клеток на основе прямого и обратного анализа. боковая зона рассеяния (FSC-A в сравнении с SSC-A) (Т-клетки).
ПРИМЕЧАНИЕ: Для исключения наилучшего размера измеряйте образцы «Только Т-клетки» и «Только опухолевые клетки» параллельно (Рисунок 2B). - Нанесите график экспрессии CD3 против SSC-A для различения Т-клеток. Кроме того, CD8-положительные Т-клетки могут быть идентифицированы путем построения графика сигнала CD8 против SSC-A. Все Т-клетки являются CD3+/CD8+ (CD8+ Т-клетками) (Рисунок 2A).
- Отобразите сигнал CFSE всех «CD8+ Т-клеток» в виде гистограммы.
ПРИМЕЧАНИЕ: Гейтирование непролиферативной субпопуляции (самый высокий сигнал CFSE), пролиферативной субпопуляции (все Т-клетки со сниженным сигналом CFSE) и высокопролиферативной субпопуляции (все Т-клетки4-го или менее интенсивного пика CFSE).
- Анализ активно-ассоциированных поверхностных маркеров в популяции Т-клеток
- Следуйте инструкциям по стробированию (шаг 6.1) (рисунок 3A).
- Вариант А: Выберите «CD8+ Т-клетки» в качестве входных данных и проанализируйте их экспрессию CD25 или HLA-DR путем сопоставления флуоресценции соответствующего поверхностного маркера с характеристиками SSC-A.
ПРИМЕЧАНИЕ: Если обнаруживается отчетливая субпопуляция с высоким уровнем CD25, рекомендуется стробирование для популяции с высоким уровнем CD25. То же самое относится и к гейтингу/анализу HLA-DR на Т-клетках (рис. 3B). - Вариант Б: Выберите «CD8+ Т-клетки» в качестве входных данных и проанализируйте их экспрессию CD25 или HLA-DR путем построения графика флуоресценции соответствующего поверхностного маркера в зависимости от характеристик SSC-A.
Примечание: Если не обнаруживается ни одной отдельной субпопуляции (в зависимости от анализируемого поверхностного маркера), то рекомендуется провести анализ сдвига средней интенсивности флуоресценции (MFI) всей популяции Т-клеток (рис. 3C).
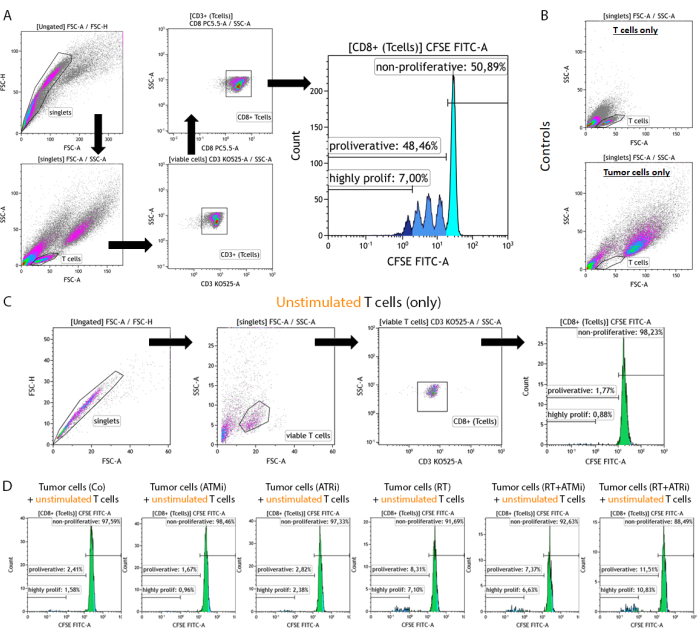
Рисунок 2: Стратегия гейтирования окрашенных CFSE, предварительно стимулированных Т-клеток для анализа пролиферации после 96 ч совместного культивирования с предварительно обработанными опухолевыми клетками HNSCC. Т-клетки и опухолевые клетки собирают через 96 ч после совместного культивирования из 96-луночного планшета, окрашивают с помощью Т-клеточного поверхностного маркера и измеряют с помощью устройства проточной цитометрии. (A) Дублеты были исключены на основе FSC-A/FSC-H, а Т-клетки были сначала закрыты по размеру (FSC-A/SSC-A). Т-клетки были дополнительно проанализированы на экспрессию CD3 (анти-CD3 Krome Orange) и CD8 (анти-CD8 PerCP-Cy5.5). CD3+/CD8+ Т-клетки были нанесены на гистограмму, а интенсивность сигнала CFSE была проанализирована. Сигнал CFSE представляет подгруппы Т-клеток с различным пролиферативным поведением. Т-клетки с самым высоким сигналом CFSE были определены как «непролиферативные». Все субпопуляции, демонстрирующие потерю сигнала CFSE, вызванную делением клеток, приводящим к уменьшению сигнала вдвое, в отчетливых пиках были обобщены как «пролиферативные». Т-клетки, которые делились более трех раз (более трех пиков сигнала CSFE), были определены как «высокопролиферативные». (В) В качестве контроля дополнительно измеряют образцы, состоящие только из предварительно стимулированных Т-клеток и только предварительно обработанных опухолевых клеток. Т-клетки и опухолевые клетки HSC4 можно различать по размеру с помощью FSC-A в сравнении с FSC-A. Сигнал SCC-A. Кроме того, нестимулированные CD8+ Т-клетки были проанализированы для проверки активации Т-клеток на основе совместного культивирования только с аллогенными опухолевыми клетками. (C) В качестве контроля включали инкубацию нестимулированных CFSE-окрашенных Т-клеток в течение 96 ч параллельно с совместным культивированием. (D) Нестимулированные, окрашенные CFSE Т-клетки культивировали совместно с предварительно обработанными опухолевыми клетками. Через 96 ч клетки собирали и измеряли сигнал CFSE с помощью стандартной процедуры. Нестимулированные Т-клетки не показали пролиферации ни отдельно, ни после совместного культивирования с предварительно обработанными опухолевыми клетками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
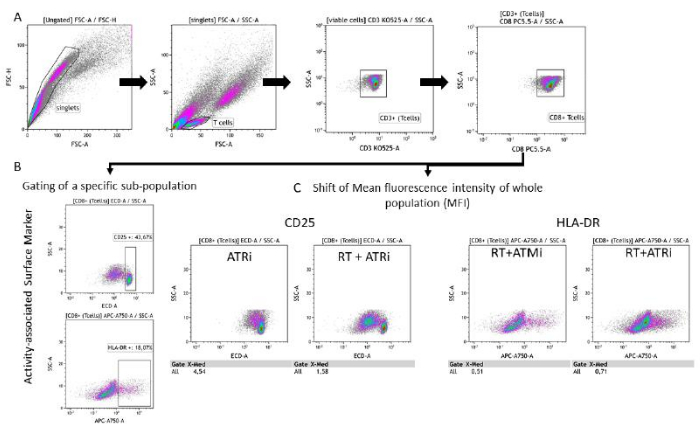
Рисунок 3: Стратегия гейтирования экспрессии поверхностных маркеров (CD25 и HLA-DR), связанной с активностью Т-клеток, после 96 ч совместного культивирования с предварительно обработанными клетками HNSCC. (А) Дублеты были исключены на основе их характеристик FSC-A/FSC-H, а Т-клетки были сначала закрыты по размеру (FSC-A/SSC-A). Т-клетки были дополнительно проанализированы на экспрессию CD3 (анти-CD3 Krome Orange) и CD8 (анти-CD8 PerCP-Cy5.5). Гейтинг маркеров активности CD25 (anti-CD25 PEDazzle594) и HLA-DR (anti-HLA-DR APC-Vio770) на поверхности Т-клеток может быть выполнен в двух различных режимах. (B) Гейтирование всех CD8+ Т-клеток на процентное содержание специфической субпопуляциис высоким уровнем CD25 или HLA-DRна основе графиков плотности. (C) В качестве альтернативы, измерение MFI-сдвига всей популяции CD8+ Т-клеток проводится для обоих маркеров активности. Приведены репрезентативные изображения из анализа экспрессии маркеров поверхности Т-клеток после совместного культивирования с опухолевыми клетками HSC4. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Опухолевые клетки HSC4, полученные из HNSCC, высевали и инкубировали в течение ночи. Через 24 ч клетки обрабатывали ингибитором киназы. Через 3 ч применяли первые две дозы по 5 Гр на фракцию. Через 24 ч применяли вторую дозу, и клетки снова инкубировали в течение ночи. Параллельно, за 48 ч до начала совместного культивирования, Т-клетки были выделены из крови здорового донора. Во-первых, PBMC были выделены с помощью центрифугирующих пробирок с градиентом плотности и стерильной разделительной среды. PBMC подсчитывали с помощью камеры для подсчета клеток, а CD8+ Т-клетки выделяли с помощью набора для выделения CD8+ Т-клеток. Затем выделенные CD8+ Т-клетки окрашивали CFSE (1 мкМ) и впоследствии подсчитывали. Т-клетки засеивали в предварительно покрытые CD3/CD28 луночные планшеты плотностью 1,5 x 106 клеток/3 мл. После 48 ч стимуляции Т-клетки собирали, подсчитывали и ресуспендировали в плотности 10 000 клеток/10 мкл. Кроме того, собирали и подсчитывали репрезентативные лунки засеянных опухолевых клеток, а также заменяли среду на все оставшиеся лунки. Т-клетки добавляли к опухолевым клеткам в соотношении 1:1. Кокультуру собирали через 96 ч, надосадочную жидкость хранили при -20 °C, а клетки окрашивали и измеряли с помощью проточной цитометрии (рис. 1).
Т-клетки были идентифицированы по исключению размера и CD3/CD8-положительности. CFSE-сигнал CD3+/CD8+ положительных клеток показал распределение непролиферативных Т-клеток (высокий CFSE-сигнал) и отдельных субпопуляций пролиферирующих Т-клеток (потеря интенсивности CFSE-сигнала). Доля пролиферирующих Т-клеток была показательно измерена для клеточной линии HSC4 HNSCC (рис. 4A). Все Т-клетки, которые показали хотя бы одно деление, были определены как «пролиферативные». Т-клетки, которые показали более 3 делений, были определены как «высокопролиферативные» (рис. 4B). Для ВПЧ-негативной клеточной линии HSC4 было обнаружено небольшое увеличение скорости пролиферации при совместном культивировании Т-клеток с облученными опухолевыми клетками. ОТ и ОТ плюс ингибирование ATR приводило к значительному увеличению последовательной пролиферации Т-клеток по сравнению с кокультурами ОТ плюс ингибирование ATM клеток HSC4 с Т-клетками. Что касается «высокопролиферативной» фракции Т-клеток, то предварительная обработка клеток HSC4 методом ОТ плюс ингибирование ПТР была наиболее эффективной в стимулировании пролиферации Т-клеток (рис. 4B).
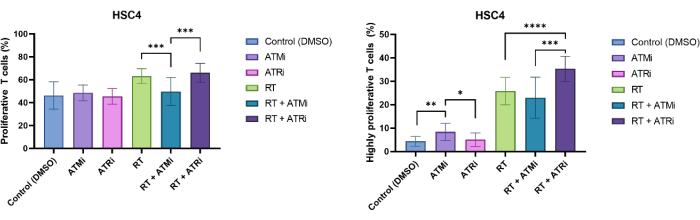
Рисунок 4: Пролиферация Т-клеток, окрашенных CFSE, для анализа изменений в пролиферации Т-клеток, зависящих от лечения HSC4. (A) Доля пролиферирующих Т-клеток после 96 часов совместной культивирования с предварительно обработанными ВПЧ-отрицательными опухолевыми клетками HSC4. Пролиферация Т-клеток была значительно ниже после кокультуры опухолевых клеток HSC4, обработанных RT+ATMi, по сравнению с терапией RT или RT плюс ATRi. (B) ОТ опухолевых клеток HSC4 индуцировала более высокую фракцию высокопролиферирующих Т-клеток (более трех делений клеток). После кокультивирования предварительно обработанных опухолевых клеток HSC4 опухолевыми клетками RT+ATRi процент высокопролиферативных Т-клеток был самым высоким. Столбцы показывают данные четырех независимых экспериментов с Т-клетками от четырех независимых, здоровых доноров (n = 4; Среднее значение ± SD). (*p≤ 0,05, **p≤ 0,01, ***p≤ 0,001, ****p≤ 0,0001; статистическая значимость проверена путем сравнения всех экспериментальных условий с каждым из них с использованием двустороннего теста Манна-Уитни-U для ненормально распределенных данных). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Потеря CFSE на основе пролиферации может быть использована для количественной оценки скорости пролиферации Т-клеток. Кроме того, некоторые маркеры клеточной поверхности описываются как связанные с активностью Т-клеток, такие как CD25 и HLADR. Поэтому был проведен анализ CD25 и HLA-DR на поверхности всех CD3+ и CD8+ Т-клеток методом проточной цитометрии (рис. 5). Экспрессия может быть количественно определена, еслиотдельные субпопуляции с высоким уровнем CD25 или HLA-DR обнаруживаются и могут быть дискриминированы путем гейтирования этих высокопозитивных клеток (рис. 3B). Если отдельные субпопуляции не обнаруживаются, можно измерить среднюю интенсивность флуоресценции (MFI) всей популяции, а также количественно оценить сдвиги MFI на основе условий (рисунок 3C).
Например, экспрессия, идентифицированная MFI CD25 и HLA-DR, была проанализирована после 96 ч совместного культивирования с предварительно обработанными опухолевыми клетками HSC4 (рис. 5). После кокультивирования Т-клеток с опухолевыми клетками HSC4, обработанными методом ОТ, экспрессия CD25 на Т-клетках была сильно подавлена. Примечательно, что предварительная обработка опухолевых клеток только ATMi привела к значительному снижению экспрессии CD25 по сравнению с предварительной обработкой ATRi. В комбинированном сочетании с ЛТ, несмотря на то, что ЛТ приводила к снижению экспрессии CD25 на Т-клетках, комбинация ОТ с ATMi приводила к увеличению экспрессии CD25 по сравнению с ОТ плюс ATRi (рис. 5A). Что касается экспрессии HLA-DR на Т-клетках, то ОТ в целом приводила к повышению регуляции HLA-DR, но опять же, в сочетании с ATMi или ATRi наблюдалось иное поведение (рис. 5B). Т-клетки, культивируемые совместно с клетками HSC4, которые были предварительно обработаны комбинацией RT+ATRi, увеличивали экспрессию HLA-DR по сравнению с монотерапией RT или RT+ATMi.
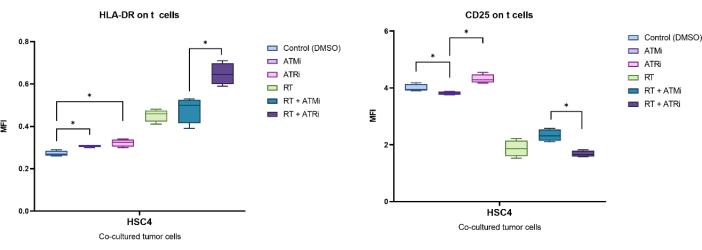
Рисунок 5: Экспрессия маркеров активации CD25 и HLA-DR на поверхности Т-клеток после 96 ч совместного культивирования с предварительно обработанными опухолевыми клетками HSC4. Экспрессия CD25 и HLA-DR анализировалась на основе сдвига MFI всей популяции Т-клеток. ОТ HSC4 приводила к снижению экспрессии CD25 на Т-клетках и увеличению экспрессии HLA-DR. Комбинация ОТ с ATMi привела к значительному различию паттернов экспрессии по сравнению с ОТ плюс ATRi. На диаграммах представлены данные четырех независимых экспериментов с Т-клетками от четырех независимых, здоровых доноров (n = 4; Среднее значение ± SD). Данные были проанализированы путем сравнения всех экспериментальных условий друг с другом с помощью двустороннего критерия Манна-Уитни-U для ненормально распределенных данных (*p≤ 0,050). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Эти данные убедительно свидетельствуют о том, что лечение опухолевых клеток, в данном случае клеток HSC4 HNSCC, влияет на иммуногенность опухолевых клеток. Это можно контролировать путем совместного культивирования опухолевых клеток с предварительно стимулированными Т-клетками, что приводит к разнообразному пролиферативному поведению и экспрессии маркеров активации на Т-клетках человека в зависимости от применяемого режима лечения опухолевыми клетками.
Обсуждение
Представленный здесь протокол предлагает быстрый и простой метод анализа пролиферативной способности Т-клеток, а также статуса их активации в условиях совместного культивирования с предварительно обработанными опухолевыми клетками. Таким образом, влияние различных методов лечения, таких как ОТ, КТ или ТТ, на активность и пролиферацию Т-клеток может быть легко проверено, что создает основу для последующего более глубокого иммунологического анализа перспективных подходов. Репрезентативные результаты, представленные в этой рукописи, доказывают, что этот аллогенный анализ кокультур Т-клеток работает хорошо. Значимые различия в пролиферации Т-клеток, а также в активности Т-клеток наблюдались при совместном культивировании с дифференциально предварительно обработанными человеческими клетками HSC4 (HNSCC) (рис. 4 и рис. 5). Было обнаружено, что лечение ГСК4 ЛОТ в отдельности или в комбинации с ТТ приводило к увеличению пролиферации Т-клеток, в частности, в отношении высокопролиферативной фракции Т-клеток (рис. 4). В соответствии с количественной оценкой скорости пролиферации, состояние активации Т-клеток также по-разному влияло на различные режимы лечения. Таким образом, применение ОТ привело к сильному подавлению экспрессии CD25 на Т-клетках, в то время как экспрессия HLA-DR была повышена. ЛТ вызывает повреждение ДНК в облученных опухолевых клетках, что, в свою очередь, приводит к клеточным реакциям на стресс, включающим высвобождение молекул и цитокинов, связанных со стрессом и повреждением, а также экспрессию иммуномодулирующих лигандов клеточной поверхности19.
Комбинация ОТ с ТТ в виде ингибиторов репарации ДНК еще больше усиливает и поддерживает эти эффекты, поскольку опухолевые клетки не могут эффективно восстанавливать поврежденную ДНК, вызванную ОТ. Это может способствовать дальнейшему стимулированию и поддержанию секреции иммуногенных факторов и экспрессии иммуногенных лигандов клеточной поверхности20. В соответствии с этим мы ранее продемонстрировали, что лечение опухолевых клеток (HNSCC) ингибиторами ОТ и повреждения ДНК изменяет иммунный фенотип на поверхности опухолевых клеток. Модуляция иммунного фенотипа включала регуляцию иммуностимулирующей молекулы ICOS-L, а также иммуносупрессивной молекулы PD-L111. В ответ на эту модуляцию иммунного фенотипа опухолевых клеток Т-клетки также могут регулировать экспрессию маркеров активации на своей клеточной поверхности. Кроме того, хорошо известно, что ЛТ стимулирует высвобождение провоспалительных цитокинов, таких как IFNγ или IL-6, которые, в свою очередь, влияют на пролиферацию и активность Т-клеток21. Экспрессия маркеров активации на Т-клетках является высокодинамичным процессом. Данные Zimmerman et al.22 показали, что CD25 сильно экспрессируется через 24 ч после стимуляции, но снова снижается через 96 ч после стимуляции. Это согласуется с нашими выводами. Напротив, HLA-DR является маркером активации на поздней фазе, и обычно ему предшествует увеличение CD25 и CD6923. Примечательно, что комбинация RT + ATRi приводит к значительному повышению регуляции HLA-DR на Т-клетках по сравнению с RT + ATMi. Этот вывод согласуется с работой Dillion et al., которые продемонстрировали синергетические эффекты ATRi + RT в индуцировании воспалительного TME24. Менее выраженная модуляция активности и пролиферации Т-клеток была достигнута при лечении опухолевых клеток только ингибиторами киназы (рис. 5). Это может быть связано с тем, что ингибиторы репарации ДНК ATMi и ATRi функционируют как усилитель повреждения ДНК, вызванного ОТ, и, следовательно, не очень иммуногенны при применении в качестве монотерапии. Мы уже продемонстрировали минимальную токсичность ATMi или только ATRi11. Таким образом, полученные результаты подтверждают иммуногенный потенциал ОТ (и ТТ с ингибиторами повреждения ДНК) и указывают на то, что эта экспериментальная система подходит для скрининга иммуностимулирующих способностей различных методов лечения в клетках рака головы и шеи человека.
Несмотря на то, что представленный здесь метод прост и надежен, в протоколе есть некоторые важные шаги, которые необходимо учесть заранее. Необходимо наличие высоких концентраций ЭДТА в процессе выделения, а также при проточном цитометрическом анализе Т-клеток. Таким образом, рекомендуется собирать донорскую кровь в пробирки с покрытием ЭДТА и использовать буфер MACS с добавлением 10 мМ ЭДТА для обеспечения эффективной изоляции Т-клеток и получения однородной суспензии одиночных клеток для проточной цитометрической оценки. Кроме того, состав среды Т-клеток имеет большое значение для пролиферативной способности Т-клеток. После тестирования различных композиций питательных сред среда с низкими концентрациями L-аргинина и L-лизина дает наилучший сигнал пролиферации Т-клеток, поскольку L-аргинин имеет решающее значение для метаболизма и выживания Т-клеток и должен подаваться в подходящей концентрации25,26. Тем не менее, следует иметь в виду, что растворы L-аргинина и L-лизина не являются стабильными в течение длительного времени и поэтому должны быть использованы в течение 3 месяцев. Для оптимальной стимуляции среда для Т-клеток, обогащенная аминокислотами, должна быть свежей для каждого эксперимента по культивированию Т-клеток. Кроме того, количество Т-клеток, а также опухолевых клеток является критическим фактором, который необходимо учитывать, поскольку он влияет на результаты эксперимента.
Для опухолевых клеток, с одной стороны, желательно слияние клеток от 70% до 80% в конце эксперимента по совместному культивированию. Чрезмерный рост опухолевых клеток может привести к секреции факторов, которые ингибируют рост клеток и впоследствии также влияют на скорость пролиферации Т-клеток. Поскольку рост опухолевых клеток в значительной степени зависит от конкретной клеточной линии, мы рекомендуем тщательно протестировать поведение роста соответствующей опухолевой клеточной линии в различных луночных планшетах и для различных режимов лечения. Кроме того, опухолевые клетки и Т-клетки должны быть совместно культивированы в соотношении 1:1. Таким образом, для каждого условия лечения обязательно необходимо засеять дополнительную лунку опухолевых клеток, которая может быть использована для определения количества клеток в день начала совместного культивирования. Таким образом, можно гарантировать, что будет засеяно подходящее количество Т-клеток для различных условий лечения. Что касается количества Т-клеток, то необходимо учитывать, что количество Т-клеток, которое может быть выделено от здорового донора, очень индивидуально. Т-клетки составляют от 45% до 70% PBMC здорового донора27. Таким образом, необходимое количество Т-клеток должно быть в общих чертах оценено уже на момент забора крови. Кроме того, плотность Т-клеток важна для эффективности активации Т-клеток и их выживания. Следовательно, Т-клетки следует засеивать в концентрации не менее 1,5 млн клеток на лунку 6-луночного планшета в 3 мл Т-клеточной среды для начальной стимуляции до начала совместного культивирования. Возможна более высокая плотность Т-клеток, но следует избегать более низкой плотности. Активация Т-клеток также может быть оценена морфологически под микроскопом, поскольку активированные Т-клетки имеют тенденцию образовывать клеточные кластеры.
Поскольку этот метод представляет собой упрощенную экспериментальную систему для изучения иммуностимулирующих способностей различных линий опухолевых клеток и методов лечения, он имеет некоторые ограничения, которые необходимо учитывать. Во-первых, этот анализ основан на аллогенной системе, что означает, что донорские Т-клетки не совместимы с HLA-совместимостью с соответствующей линией опухолевых клеток. Таким образом, это HLA-несоответствие уже может индуцировать стимуляцию Т-клеток и, следовательно, пролиферацию Т-клеток без дальнейшей стимуляции состороны лечения опухолевыми клетками. Чтобы количественно оценить этот нежелательный эффект, изолированные Т-клетки культивировали совместно с клеточной линией HSC4 без предварительной стимуляции антителами к CD28 и CD3. Было обнаружено, что в этих условиях пролиферация практически не индуцировалась, что указывает на то, что HLA-несоответствие оказывает лишь незначительное влияние на активацию Т-клеток в этих конкретных экспериментальных условиях. Кроме того, были обнаружены достоверные различия в пролиферации и активации Т-клеток на основе лечения опухолевыми клетками, несмотря на аллогенную обстановку. Тем не менее, для проведения данного анализа потенциальная аллогенная индуцированная пролиферация Т-клеток должна быть проверена и количественно определена один раз в начале экспериментов. Рекомендуемый контроль «только Т-клетки» и «только опухолевые клетки» необходим для достаточного гейтинга и является обязательным при каждом повторении экспериментов. Тем не менее, следует иметь в виду, что в аллогенной системе ко-культивирования отсутствует распознавание опухолеспецифических антигенов. Таким образом, эта система может неточно отражать специфический противоопухолевый ответ, как это было бы происходить in vivo у пациентов29,30. Для дальнейшего совершенствования более сложной обстановкой будет подход к аутологичной совместной культуре. В этих условиях биопсия опухоли, полученная от пациента, должна быть культивирована и введена в культуру с Т-клетками, выделенными из периферической крови того же пациента28. Этот экспериментальный подход, однако, может быть сложным не только с точки зрения культивирования первичных опухолевых клеток, но и с точки зрения доступности биоматериала, полученного от пациента. Еще одним ограничением, которое необходимо учитывать, является соотношение опухолевых клеток и Т-клеток в кокультуре. Поскольку рекомендуемое соотношение клеток составляет 1:1, оно не отражает физиологическое состояние ТМЭ у пациентов31. Тем не менее, это ограничение должно быть принято, так как при более низком количестве Т-клеток изменения скорости пролиферации и статуса активации не поддаются количественной оценке.
В области иммунологии опухолей этот анализ дает возможность проводить скрининг иммуногенности различных методов лечения в простых и быстрых экспериментальных условиях in vitro . Таким образом, можно сэкономить время не только за счет предварительного скрининга наиболее перспективных с точки зрения иммуногенности подходов, но и проведения экспериментов in vivo . Животные модели могут быть сокращены, так как на животных моделях могут быть разработаны только многообещающие схемы лечения, отражающие иммунную систему организма в целом. Кроме того, поскольку этот анализ основан на первичных клетках человека и линиях раковых клеток человека, результаты могут быть более применимы в клинике, чем анализы, основанные на других модельных системах и видах.
В будущем этот анализ может быть модулирован и адаптирован для ответа на более конкретные исследовательские вопросы. Например, можно включить лечение Т-клеток, чтобы отразить сценарий лечения, который ближе к ситуации у пациентов. Поскольку опухолеактивные Т-клетки в основном находятся в ТМЭ, они в равной степени подвержены влиянию местной терапии, такой как ЛТ, и, вероятно, также подвержены влиянию системной терапии, такой как КТ или ТТ32. Дальнейшим усовершенствованием анализа является совместное культивирование Т-клеток с опухолевыми сфероидами из опухолевых клеточных линий или даже совместное культивирование с опухолевыми органоидами, полученными от пациента. Эти трехмерные культуры более сопоставимы со структурой опухоли у пациента28. Наконец, считывание результатов эксперимента с помощью проточной цитометрии также может быть легко адаптировано для исследования дальнейших молекул на поверхности Т-клеток или путем анализа экспрессии молекул иммунных контрольных точек на опухолевых клетках. В дополнение к определению иммунного фенотипа Т-клеток, можно использовать надосадочную линию клеточных культур из экспериментов по совместному культивированию для количественного определения секретируемых цитокинов или хемокинов, чтобы получить более полное представление об активности Т-клеток. Таким образом, этот протокол обеспечивает комплексный, надежный и простой в использовании кокультуральный анализ Т-клеток и опухолевых клеток, который позволяет проводить скрининг иммуногенности различных методов лечения рака. Поскольку этот анализ может быть адаптирован к конкретным исследовательским вопросам, он хорошо подходит для применения в широкой области иммунологии опухолей.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было частично профинансировано Междисциплинарным центром клинических исследований Эрлангена (IZKF Erlangen) и Баварским центром кребсфоршунг (BZKF).
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL Cellstar tubes | Greiner Bio-One GmbH | 188271 | |
| 50 mL Cellstar tubes | Greiner Bio-One GmbH | 227261 | |
| 6 well cell culture plate sterile, with lid | Greiner Bio-One GmbH | 657160 | |
| 96 well cell culture plate sterile, F-bottom, with lid | Greiner Bio-One GmbH | 655180 | |
| AZD0156 | Selleck Chemicals GmbH | S8375 | |
| Berzosertib (VE-822) | Selleck Chemicals GmbH | S7102 | |
| CASYcups | OMNI Life Science GmbH & Co KG | 5651794 | |
| CASYton | OMNI Life Science GmbH & Co KG | 5651808 | |
| CD25a, PE-Dazzle594, Mouse IgG1 | Biolegend | 356126 | |
| CD28-UNLB | Beckmann Coulter, Inc. | IM1376 | |
| CD3a,Krome Orange, Mouse IgG1 | Beckmann Coulter, Inc. | B00068 | |
| CD3e Monoclonal Antibody | Thermo-Fisher Scientific, Inc. | MA1-10176 | |
| CD4, APC, Mouse Anti-Human Mouse IgG1 | BD Pharmingen | 555349 | |
| CD8 MicroBeads, human | Miltenyi Biotec, Inc. | 130-045-201 | |
| CD8a, PerCP-Cy5.5, Mouse IgG1 | Biolegend | 300924 | |
| CellTracker Deep Red Dye | Thermo Fisher Scientific, Inc. | C34565 | |
| CFSE | Merck KGaA (Sigma-Aldrich) | 21888 | |
| DMEM (Dulbecco´s Modified Eagle´s Medium) | PAN-Biotech GmbH | P04-02500 | |
| DxFlex Flow Cytometer (with Auto Loader) | Beckmann Coulter, Inc. | C44326, C02846 | |
| EDTA disodium salt dihydrate | Carl Roth GmbH + Co. KG | 8043.2 | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-500ML | |
| FBS superior | Merck KGaA (Sigma-Aldrich) | S0615-100ML | For production of heat-inactivated FBS. Heat up for 30 min at 56 °C with mixing to inactivate complement proteins. |
| Graph Pad Prism (version number 9) | GraphPad Software | - | |
| HLA-DR, DP, DQ Antibody, anti-human, APC-Vio770 | Miltenyi Biotec, Inc. | 130-123-550 | |
| Kaluza (version number 2.1) | Beckmann Coulter, Inc. | - | |
| L-Arginin | Merck KGaA (Sigma-Aldrich) | A8094-25G | |
| L-Lysin-monohydrochloride | Merck KGaA (Sigma-Aldrich) | L5626-100G | |
| MACS BSA Stock Solution | Miltenyi Biotec, Inc. | 130-091-376 | |
| MS Columns | Miltenyi Biotec, Inc. | 130-042-201 | |
| Neubauer-improved counting chamber | Paul Marienfeld GmbH & Co. KG | 640010 | |
| PBS | Merck KGaA (Sigma-Aldrich) | D8537-500mL | |
| Penicillin-Streptomycin | Thermo-Fisher Scientific, Inc. | 1514-122 | |
| ROTISep 1077 | Carl Roth GmbH + Co. KG | 0642.2 | |
| RPMI-1640 Medium | Merck KGaA (Sigma-Aldrich) | R1790 | |
| SepMate 50mL tubes | Stemcell Technologies | 85450 | |
| Trypan blue | Merck KGaA (Sigma-Aldrich) | T6146-25G | |
| Trypsin | Thermo-Fisher Scientific, Inc. | 15400054 |
Ссылки
- Hiam-Galvez, K. J., Allen, B. M., Spitzer, M. H. Systemic immunity in cancer. Nat Rev Cancer. 21 (6), 345-359 (2021).
- Mantovani, A., Allavena, P., Marchesi, F., Garlanda, C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 21 (11), 799-820 (2022).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From t cell basic science to clinical practice. Nat Rev Immunol. 20 (11), 651-668 (2020).
- Dunn, G. P., Old, L. J., Schreiber, R. D. The immunobiology of cancer immunosurveillance and immunoediting. Immunity. 21 (2), 137-148 (2004).
- Mittal, D., Gubin, M. M., Schreiber, R. D., Smyth, M. J. New insights into cancer immunoediting and its three component phases--elimination, equilibrium and escape. Curr Opin Immunol. 27, 6-25 (2014).
- Irianto, T., Gaipl, U. S., Ruckert, M. Immune modulation during anti-cancer radio(immuno)therapy. Int Rev Cell Mol Biol. 382, 239-277 (2024).
- Burtness, B., et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (keynote-048): A randomized, open-label, phase 3 study. Lancet. 394 (10212), 1915-1928 (2019).
- Hecht, M., et al. Safety and efficacy of single cycle induction treatment with cisplatin/docetaxel/ durvalumab/tremelimumab in locally advanced HNSCC: First results of checkered-CD8. J Immunother Cancer. 8 (2), e001378(2020).
- Chen, J. A., Ma, W., Yuan, J., Li, T. Translational biomarkers and rationale strategies to overcome resistance to immune checkpoint inhibitors in solid tumors. Cancer Treat Res. 180, 251-279 (2020).
- Solomon, B., Young, R. J., Rischin, D. Head and neck squamous cell carcinoma: Genomics and emerging biomarkers for immunomodulatory cancer treatments. Semin Cancer Biol. 52 (Pt 2), 228-240 (2018).
- Meidenbauer, J., et al. Inhibition of atm or atr in combination with hypo-fractionated radiotherapy leads to a different immunophenotype on transcript and protein level in HNSCC. Front Oncol. 14, 1460150(2024).
- Kumari, S., et al. Immunomodulatory effects of radiotherapy. Int J Mol Sci. 21 (21), 8151(2020).
- Wimmer, S., et al. Hypofractionated radiotherapy upregulates several immune checkpoint molecules in head and neck squamous cell carcinoma cells independently of the HPV status while icos-l is upregulated only on HPV-positive cells. Int J Mol Sci. 22 (17), 9114(2021).
- Derer, A., et al. Chemoradiation increases pd-l1 expression in certain melanoma and glioblastoma cells. Front Immunol. 7, 610(2016).
- Schatz, J., et al. Normofractionated irradiation and not temozolomide modulates the immunogenic and oncogenic phenotype of human glioblastoma cell lines. Strahlenther Onkol. 199 (12), 1140-1151 (2023).
- Xu, M. M., Pu, Y., Zhang, Y., Fu, Y. X. The role of adaptive immunity in the efficacy of targeted cancer therapies. Trends Immunol. 37 (2), 141-153 (2016).
- Olivo Pimentel, V., Yaromina, A., Marcus, D., Dubois, L. J., Lambin, P. A novel co-culture assay to assess anti-tumor cd8(+) t cell cytotoxicity via luminescence and multicolor flow cytometry. J Immunol Methods. 487, 112899(2020).
- Kulp, M., Diehl, L., Bonig, H., Marschalek, R. Co-culture of primary human t cells with leukemia cells to measure regulatory t cell expansion. STAR Protoc. 3 (3), 101661(2022).
- Ruckert, M., et al. Immune modulatory effects of radiotherapy as basis for well-reasoned radioimmunotherapies. Strahlenther Onkol. 194 (6), 509-519 (2018).
- Samstein, R. M., Riaz, N. The DNA damage response in immunotherapy and radiation. Adv Radiat Oncol. 3 (4), 527-533 (2018).
- Meeren, A. V., Bertho, J. M., Vandamme, M., Gaugler, M. H. Ionizing radiation enhances il-6 and il-8 production by human endothelial cells. Mediators Inflamm. 6 (3), 185-193 (1997).
- Zimmerman, M., et al. Ifn-gamma upregulates survivin and ifi202 expression to induce survival and proliferation of tumor-specific T cells. PLoS One. 5 (11), e14076(2010).
- Saraiva, D. P., et al. Expression of HLA-dr in cytotoxic t lymphocytes: A validated predictive biomarker and a potential therapeutic strategy in breast cancer. Cancers (Basel). 13 (15), (2021).
- Dillon, M. T., et al. Atr inhibition potentiates the radiation-induced inflammatory tumor microenvironment. Clin Cancer Res. 25 (11), 3392-3403 (2019).
- Geiger, R., et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity. Cell. 167 (3), 829-842.e13 (2016).
- Rodriguez, P. C., Quiceno, D. G., Ochoa, A. C. L-Arginine availability regulates t-lymphocyte cell-cycle progression. Blood. 109 (4), 1568-1573 (2007).
- Lozano-Ojalvo, D., López-Fandiño, R., López-Expósito, I., et al. The impact of food bioactives on health: In vitro and ex vivo models. Verhoeckx, K., et al. , Springer International Publishing. Cham. 169-180 (2015).
- Gronholm, M., et al. Patient-derived organoids for precision cancer immunotherapy. Cancer Res. 81 (12), 3149-3155 (2021).
- Perez, C., Gruber, I., Arber, C. Off-the-shelf allogeneic t cell therapies for cancer: Opportunities and challenges using naturally occurring "universal" donor t cells. Front Immunol. 11, 583716(2020).
- Martinez Bedoya, D., Dutoit, D., Migliorini, D. Allogeneic car t cells: An alternative to overcome challenges of car t cell therapy in glioblastoma. Front Immunol. 12, 640082(2021).
- Schnellhardt, S., et al. The prognostic value of FOXP3+ tumor-infiltrating lymphocytes in rectal cancer depends on immune phenotypes defined by CD8+ cytotoxic T cell density. Front Immunol. 13, 781222(2022).
- Zitvogel, L., Kroemer, G. Oncoimmunology: A practical guide for cancer immunotherapy. , Springer International Publishing. Cham. 23-39 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены