Method Article
التعديل الأنزيمي وتقييم قياس التدفق الخلوي للبروتينات المعروضة على سطح الخميرة
* These authors contributed equally
In This Article
Summary
هنا ، نقدم بروتوكولا لاستخدام ركائز الخميرة المعروضة على سطح الخميرة لمقايسات التعديل الأنزيمي. تم عرض المنصة باستخدام تحليل نشاط إزالة الفسفرة من التيروزين فوسفاتيز SHP-2 ضد إحدى ركائزها كمقايسة تعديل إنزيمي تمثيلي.
Abstract
عرض سطح الخميرة هو استراتيجية ربط النمط الجيني والنمط الظاهري التي تمكن الفحص عالي الإنتاجية لوظيفة البروتين. تقليديا ، تم تطبيق عرض سطح الخميرة على تطور بروتينات ربط جديدة ، مع استخدام قياس التدفق الخلوي لتقييم وفرز مستويات قوة الارتباط. في الآونة الأخيرة ، كان هناك اهتمام متزايد بتطبيق عرض سطح الخميرة لفحص التعديل الأنزيمي لمتغيرات الركيزة ، مع تعديلات مضافة (على سبيل المثال ، الفسفرة) أو طرحها (على سبيل المثال ، تحلل البروتين) توفر نمطا ظاهريا يمكن قراءته عن طريق قياس التدفق الخلوي. يتم تطبيق هذه التعديلات بانتظام باستخدام التوطين المشترك داخل الخلايا ، ولكن القدرة على تحقيق تعديل إنزيمي خارج الخلية للركائز المعروضة يمكن أن تفتح العديد من ردود الفعل على التحقيق. هنا ، نصف تقنيات تصميم وتطبيق فحوصات الفحص للتعديل الأنزيمي خارج الخلية على الركائز المرشحة المعروضة على سطح الخميرة والتقييم اللاحق باستخدام تحليل قياس التدفق الخلوي. نحن نقدم هذه البروتوكولات في سياق الخميرة التي تزيل الفسفرة الفوسفاتيز التي تحتوي على بقايا التيروزين الفسفرة ونعلق على كيفية تكييف هذا الإطار المطبق لتطوير فحوصات الفحص لأزواج الركيزة الإنزيمية الأخرى.
Introduction
أصبح فهم التفاعلات بين الإنزيمات وأهدافها مجالا بحثيا مثيرا للاهتمام بشكل متزايد نظرا لضرورته في التوصيف البيولوجي للمسارات التي تتحكم في التوازن الخلوي وتطور المرض1،2. الإنزيمات مسؤولة عن تحفيز العديد من التفاعلات التي تحافظ على الحياة البيولوجية ، والتحكم في المسارات الضرورية مثل التمثيل الغذائي الخلوي3،4 ، والإشارات5 ، وحتى العمليات الأساسية مثل إصلاح الجينوم6،7. نظرا لدورها في هذه العمليات ، تلعب تفاعلاتها أيضا دورا في تطور العديد من الأمراض ، حيث يمكن أن تسبب الانحرافات في نشاطها خللا شديدا في نشاط الخلية ، مما يتسبب في موت الخلايا المبرمج أو تكاثر الخلايا السرطانية الضارة2. كان لدراسة النشاط الأنزيمي تطبيقات مهمة في تطوير علاجات جديدة8،9 ، مما يتطلب فحوصات مصممة خصيصا لكل تفاعل إنزيم وركيزةمحددة 10. تم إنشاء فحوصات إنزيمية متعددة كبروتوكولات قياسية لتقييم وتوصيف هذه التفاعلات. تصنف المقايسات التي تم تطويرها لتحليل التفاعلات الأنزيمية إلى فحوصات الكشف التي تراقب الارتباط للتنشيط / التثبيط11 أو المقايسات التي تراقب تعديل الركيزة بواسطة الإنزيمات12.
أحد الأدوار الرئيسية للإنزيمات هو تنظيم سلوك الخلية. نقل الإشارة ، الاستجابة داخل الخلايا للخلية إلى مشغل خارج الخلية13 ، هو المسؤول عن بقاء الخلية ووظائفها. يتضمن تكاثر الخلايا والتمايز والعديد من العمليات الوظيفية الأخرى مسارات إشارات مع تفاعلات إنزيمية تحكمها14،15. تحفز الإنزيمات تعديلات ما بعد الترجمة ، والتي غالبا ما تعدل شبكات الإشارات الضخمة المسؤولة عن النقل الصحيح للرسائل خارجالخلية 16. فسفرة البروتين هي التعديل الأكثر شيوعا بعد الترجمة ، وهي موجودة في كل مكان في إشارات الخلية والعديد من المسارات الخلوية الأخرى. وبالتالي ، ظهرت كينازات البروتين كنسبة كبيرة من الأهداف العلاجية المحتملة نظرا لدورها التنظيمي الحاسم17. الفوسفاتيز هي الجزيئات المعدلة الطبيعية لمجمعات إشارات الخلية القائمة على الفوسفات18،19 ، ولديها القدرة على إزالة بقايا الفوسفات من البروتينات المستهدفة20. في العقد الماضي ، أصبحت الفوسفاتيز هدفا علاجيا رئيسيا لعلاج السرطان21 والأمراض الالتهابية22 بناء على مشاركتها في تنظيم مسارات الإشارات النهائية في أنواع متعددة من الخلايا. توفر كينازات البروتين والفوسفاتيز معا اتساعا من التفاعلات ، والتي يمكن دراستها من خلال تطوير بروتوكولات فحص إنزيمية محددة.
تم استخدام عرض سطح الخميرة كأداة لتوصيف وتقييم النشاط الأنزيمي23،24. يوفر منصة عالية الإنتاجية لفحص عمليات التعديل اللاحق للترجمة عند دمجها مع استراتيجيات عزل الشبكة الإندوبلازمية25،26. يسمح ذلك بتحديد موقع أزواج ركيزة كيناز والاحتفاظ بها في الشبكة الإندوبلازمية من خلال الارتباط بمستقبلات KDEL27 ، حيث يمكن أن تحدث فسفرة الركيزة بمعدلات متزايدة بسبب القرب بين الكينازات وأهدافها. يتم التوسط في ارتباط مستقبلات KDEL بواسطة تسلسل الاحتفاظ بالشبكة الإندوبلازمية FEHDEL الطرفية C الذي ثبت أنه يتمتع بقدرة احتفاظ أقوى من تسلسلات HDEL الأخرى25،28. ثم يتم تثبيت الركيزة الفسفرة على سطح الخميرة لتقييمها اللاحق من خلال قياس التدفقالخلوي 29. حاليا ، لا توجد بروتوكولات قابلة للتعميم تم إنشاؤها للتعديل الأنزيمي للركائز المعروضة على سطح الخميرة. نقوم بالتوسع في قدرات عرض سطح الخميرة من خلال الاستفادة من متغيرات الركيزة الفسفرية المعبر عنها خارج الخلية وتعديلها من خلال إزالة الفسفرة بواسطة الفوسفاتيز المعروف. يوفر تحليل قياس التدفق الخلوي بعد ذلك منصة لتقييم النمط الظاهري للركائز المذكورة أعلاه من خلال قياس التغيرات في وسيط الفسفرة نتيجة للحضانة مع الفوسفاتيز المعروف. يوفر هذا طريقة قابلة للتكيف للتعديل اللاحق للترجمة للبروتينات المعروضة على السطح مع توفير طريقة لتحليل التعديل الأنزيمي للتفاعلات عند استخدام منصة عرض سطح الخميرة.
نقدم تقنيات لتطوير وتطبيق مقايسة التعديل الأنزيمي التي تصف إدخال تفاعل ركيزة كيناز في منصة عرض سطح الخميرة ، والحضانة المشتركة للركيزة الفسفرية المعبر عنها مع الفوسفاتيز المؤتلف ، والتحليل اللاحق لنشاط إزالة الفسفرة من خلال قياس التدفق الخلوي. في هذا التقرير ، يتم تحقيق ذلك من خلال المشاركة في تحديد المجال السيتوبلازمي ل CD28 مع كيناز الخلايا الليمفاوية (LCK) في الشبكة الإندوبلازمية للخميرة ، متبوعا بعرض CD28 الفسفوري على سطح الخميرة وإزالة الفسفرة اللاحقة بواسطة منطقة تماثل Src 2 المحتوية على مجال الفوسفاتيز -2 (SHP-2). يستخدم الجسم المضاد للفوسفوتيروزين (في هذه الدراسة ، 4G10) ، والذي يكتشف بقايا التيروزين الفسفرية في مجموعة متنوعة من تسلسلات الببتيد ، لتحديد مستوى الفسفرة كدالة لمعالجة الفوسفاتيز. توفر العملية التفصيلية نهجا قابلا للتعميم للتحقيق في تفاعلات الإنزيم والركيزة. طريقة مستقبلية لدراسة الإنزيمات والركائز بطريقة نقية.
Protocol
1. نمو خلايا الخميرة التي تحتوي على البلازميد وتحريض تعبير البروتين
- باتباع الوصفة الموضحة في الجدول 1 ، قم بإعداد الوسائط المطلوبة لنمو الخميرة غير المحتوية على البلازميد (YPD) ونمو خلايا الخميرة المحتوية على البلازميد (SD-CAA) وتحريض تعبير البروتين (SRG-CAA) بالإضافة إلى لوحات SD-CAA.
- قم بتحويل الحمض النووي البلازميد لعرض الخميرة الذي يحتوي على زوج ركيزة كيناز إلى خلايا خميرة EBY-100 من خلال الطريقة القائمة على كاتيونالليثيوم 30،31 ، والتي يتم اعتمادها بشكل شائع للاستخدام في مجموعات تحويل الخميرة من مجموعة متنوعة من الشركات المصنعة.
ملاحظة: يمكن استخدام التثقيب الكهربائي32 أو غيرها من تقنيات تحويل بلازميد الخميرة المفضلة اعتمادا على بنية البلازميد التي يتم تحويلها. - قم بإعداد أنبوب استزراع سعة 14 مل مع 10 مل من وسائط YPD. تلقيح خلايا EBY-100 وتنمو في حاضنة اهتزاز عند 30 درجة مئوية ، 300 دورة في الدقيقة حتى تصل المزرعة إلى كثافة بصرية (OD600nm) من 0.8-1.0 (8 × 106- 1 × 107 خلايا / مل).
ملاحظة: يتم قياس OD600nm عن طريق تحضير 3 مل من الكوفيتات التي تحتوي على 1:10 تخفيفات من مزارع الخميرة في الوسائط الخاصة بها و 3 مل من الكوفيتات الفارغة التي تحتوي على الوسائط المستخدمة في تخفيف العينات. يتم استخدام برنامج OD600nm على مقياس الطيف الضوئي لقياس الكوفيت الفارغ أولا ، ثم كل كوفيت عينة عن طريق ضبط التخفيف المقابل المحضر لكل عينة. 1 OD600nm يتوافق مع 1 × 107 خميرة / مل. - احصد الخلايا عن طريق الطرد المركزي للثقافة عند 1,000 × جم لمدة 3 دقائق ، واغسلها بمحلولالغسيل الأول الموجود في مجموعة تحويل الخميرة ، أو TE (10 ملي مولار Tris-HCl و 1.0 ملي EDTA)31.
- قم بتكبيل الخلايا مرة أخرى عند 1,000 × جم لمدة 3 دقائق وأعد تعليقها في 1 مل من المخزن المؤقت للتحويل الموجود في مجموعة تحويل الخميرة ، أو الماء المعقم. يجب تقسيم الخلايا إلى 50 ميكرولتر ويمكن تخزينها عند -80 درجة مئوية لمدة تصل إلى 6 أشهر.
- لتحويل البلازميد ، يتم تحضير حصة واحدة لكل بلازميد وإذابتها على الجليد ، ثم تتم إضافة 0.5-1.5 ميكروغرام من الحمض النووي البلازميد الذي يحتوي على بنية عرض الخميرة مباشرة إلى الخلايا. تمت إضافة 0.5 مل من محلول التحويل المقدم في مجموعة تحويل الخميرة ، أو 0.5 مل من محلول بولي إيثيلين جلايكول معقم بنسبة 50٪ ومحلول LiOAc0.1 M 31. امزج خليط الخلايا والحمض النووي البلازميد ومحلول التحويل جيدا عن طريق سحب العينات.
- احتضان خليط التحويل بشكل ثابت لمدة 30-60 دقيقة عند 30 درجة مئوية ، خليط الدوامة على فترات 15 دقيقة. حصاد الخلايا عن طريق الطرد المركزي عند 1,000 × جم لمدة 3 دقائق.
- قم بإعداد أنبوب استزراع سعة 14 مل مع 4.5 مل من وسائط SD-CAA. أعد تعليق الخلايا التي تحتوي على البلازميد المطلوب في 500 ميكرولتر من SD-CAA وتلقيح 4.5 مل المحضر.
- مع الحرص على عدم اختراق الأجار ، قم بتوزيع 50 ميكرولتر من 5 مل من الثقافة الملقحة على لوحة SD-CAA واحتضانها بشكل ثابت عند 30 درجة مئوية لمدة 48 ساعة لتحديد كفاءة التحول.
- احتضان 5 مل من ثقافة خلايا SD-CAA في حاضنة اهتزاز عند 30 درجة مئوية ، 300 دورة في الدقيقة لمدة 18 ساعة على الأقل. مراقبة الكثافة البصرية (OD600nm) بعد 16 ساعة و 20 ساعة. بمجرد أن تنمو العينة إلى كثافة بصرية كافية لا تتجاوز 6 ، قم بالطرد المركزي للثقافة لمدة 3 دقائق عند 2,500 × جم. تخلص من المادة الطافية دون إزعاج حبيبات الخميرة.
- أعد تعليق حبيبات الخميرة في SRG-CAA إلى ODنهائي 600 نانومتر أقل من 1 (<1 ×10 7 خميرة / مل).
- احتضان استزراع الخميرة في حاضنة اهتزاز عند 30 درجة مئوية ، 300 دورة في الدقيقة لمدة 8 ساعات على الأقل ولكن ليس أكثر من 24 ساعة.
ملاحظة: يمكن أن يختلف تحريض تعبير البروتين في خلايا الخميرة في أي مكان من 20-37 درجة مئوية. 30 درجة مئوية مناسبة لتخليق أزواج كيناز / الركيزة29،33 ولكن يمكن تعديلها إذا لزم الأمر للبروتينات المحددة التي تتم دراستها. - قم بقياس OD600 نانومتر لتحديد كثافة الخلية.
ملاحظة: يمكن إيقاف البروتوكول في هذه المرحلة عن طريق تخزين مزارع الخميرة عند 4 درجات مئوية.
2. البيوتينيل للجسم المضاد 4G10 المضاد للفوسفوتيروزين
- أعد تعليق قارورة 2 مجم من PEG4-NHS-Biotin إلى تركيز نهائي يبلغ 5 ملي مولار عن طريق إضافة 680 ميكرولتر من PBS المعقم.
ملاحظة: يجب أن يتم إعادة تعليق PEG4-NHS-Biotin طازجا مباشرة قبل إجراء تفاعل البيوتينيل. تحلل NHS في محلول مائي. يعد استخدام PBS والقوارير المعقمة أمرا مهما لإعداد الكواشف للتخزين طويل الأجل ولاستخدامها في المقايسات القائمة على الخلايا للتخفيف من أي آثار محتملة للملوثات على صلاحية الكاشف أو المقايسات الحساسة التي يتم إجراؤها. - بناء على تركيز الجسم المضاد 4G10 ، أضف 100 ميكروغرام من الجسم المضاد إلى قارورة معقمة سعة 1.7 مل.
- أضف 1 ميكرولتر من 5 ملي مولار PEG4-NHS-Biotin المحضر من الخطوة 2.1 إلى القارورة التي تحتوي على 100 ميكروغرام من الجسم المضاد 4G10 لتحقيق نسبة مولية من البيوتين إلى الجسم المضاد 7.5: 1. ماصة الخليط برفق لتجانس التفاعل.
- احتضان التفاعل في درجة حرارة الغرفة مع دوران مستمر لمدة 2 ساعة على الأقل.
- اتبع بروتوكول الشركة المصنعة لأعمدة تحلية الدوران 0.5 مل لتبادل المخزن المؤقت من 4G10 البيوتينيل (B-4G10) إلى PBS.
ملاحظة: تستخدم أعمدة تحلية المياه ذات الحد الأقصى للوزن الجزيئي (MWCO) البالغ 7 كيلو دالتون بشكل شائع لبيوتينيل الأجسام المضادة للسماح بإزالة البيوتين غير المتفاعل والجزيئات الصغيرة الأخرى مع الاحتفاظ بالجسم المضاد الأكبر. - تمييع الجسم المضاد B-4G10 إلى تركيز نهائي قدره 1 ميكرومتر في PBSA (PBS مع 1 جم / لتر من زلال مصل الأبقار). قم بتقسيم الجسم المضاد B-4G10 إلى أحجام أصغر لمنع دورات التجميد / الذوبان المتكررة.
ملاحظة: يمكن تخزين الأجسام المضادة البيوتينيل عند 4 درجات مئوية للاستخدام اليومي لمدة تصل إلى 3 أشهر دون فقدان الكفاءة الكبيرة. قم بتخزين باقي الكميات غير المستخدمة عند -20 درجة مئوية لمدة أقصاها 2 سنوات.
3. إزالة الفسفرة من الركائز المعبر عنها على سطح خلية الخميرة
- قم بإعداد حل المخزن المؤقت للعمل 2x كما هو موضح سابقا في الأدبيات34.
ملاحظة: يوصى ب 2x لتسهيل قياس المكونات المطلوبة. - قم بإعداد مخزن العمل المؤقت للعينات في قارورة سعة 1.7 مل عن طريق تخفيف محلول العازلة 2x المحضر في الخطوة 3.1 1: 2 في الماء منزوع الأيونات.
ملاحظة: سيكون إجمالي حجم التفاعل لكل عينة 20 ميكرولتر ، وستتطلب كل عينة ما بين 10 ميكرولتر و 18 ميكرولتر من المخزن المؤقت للعمل. قم بإعداد مخزن مؤقت كاف لجميع العينات أو الضوابط. - بعد تحضير العينة الموصى به الموضح في الجدول 2 ، قم بتسمية قوارير سعة 1.7 مل مع اسم التحكم أو العينة المقابلة.
- استنادا إلى OD600nm المقاس في الخطوة 1.9 ، احسب حجم الثقافة اللازمة لاستعادة مليوني (2 × 106) خلية خميرة من ثقافة الخميرة المقابلة لكل عينة.
- أضف حجم زراعة الخميرة المحسوبة في الخطوة السابقة في قارورة 1.7 مل لكل عينة.
- جهاز الطرد المركزي القارورة لمدة 1 دقيقة عند 4,500 × جم. قم بإزالة المادة الطافية بعناية باستخدام ماصة دقيقة وتخلص منها كنفايات خطرة بيولوجيا.
- أعد تعليق الخلايا المحببة في 1 مل من PBSA وكرر الخطوة 3.6.
ملاحظة: من المهم إزالة أكبر قدر ممكن من المواد الطافية دون إزعاج الخلايا المحببة. - بناء على تركيز مخزونه ، احسب حجم SHP-2 البشري المؤتلف المطلوب للحصول على تركيز نهائي يبلغ 1,000 نانومتر في حجم تفاعل إجمالي يبلغ 20 ميكرولتر.
ملاحظة: يجب أن يتم اقتباس SHP-2 المؤتلف بكميات صغيرة بحيث لا يمر أي بروتين مستخدم في كل اختبار بأكثر من دورتين من دورات التجميد والذوبان. يجب التخلص من أي بقايا SHP-2 من الاقتباس بعد إعداد جميع العينات للفحص.
يمكن أن تختلف تركيزات مخزون الإنزيمات المؤتلفة اعتمادا على رقم الدفعة. عادة ما يتم صياغة SHP-2 المؤتلف بتركيز مخزون 0.2-0.4 مجم / مل. بالنسبة لتركيز المخزون 0.324 مجم / مل SHP-2 ، فإن هذا يتوافق مع تركيز مخزون يبلغ 4.696 ميكرومتر (SHP-2 له وزن جزيئي يبلغ 69 كيلو دالتون). ينتج عن 4.26 ميكرولتر من مخزون SHP-2 في تفاعل 20 ميكرولتر تركيز تفاعل نهائي يبلغ 1,000 نانومتر SHP-2. - أضف 7.7 مجم من DTT إلى 10 مل من الماء منزوع الأيونات المحضر في شكل مخروطي سعة 15 مل لإنشاء محلول DTT سعة 5 ملم. إذا كانت قيود المعدات تجعل من الصعب وزن المليغرام ، أضف 0.77 جم من DTT إلى 10 مل من الماء منزوع الأيونات ، ثم قم بإجراء تخفيف 100x لإنشاء محلول DTT 5 ملي متر المستخدم في الفحص.
ملاحظة: يمكن تحضير محلول DTT في محاليل مخزون عالي التركيز لتخفيفها إلى 5 ملي مولار إذا لم يكن من الممكن قياس كميات مقياس مليغرام باستخدام المعدات المتاحة. يحتاج محلول DTT إلى التحضير لإعادة تعليق الخلية السابقة الطازجة في عازلة العمل نظرا لميله إلى التحلل المائي ، مما يجعله غير مستقر على مدى فترات طويلة عند تخفيفه في الماء. - أعد تعليق الخلايا المحببة في مخزن العمل المعد في الخطوة 3.2 بحيث يكون حجم التفاعل النهائي في كل عينة أو عنصر تحكم 20 ميكرولتر.
ملاحظة: يجب حساب كمية المخزن المؤقت للعمل المضاف بناء على كمية DTT (2 ميكرولتر) و SHP-2 (المحسوبة في الخطوة 3.8) التي ستكون في كل عينة. - أضف 2 ميكرولتر من محلول DTT 5 ملي المحضر في الخطوة 3.9 إلى كل عينة أو عنصر تحكم للحصول على تركيز تفاعل نهائي يبلغ 0.5 ملي مولار DTT.
- أضف حجم SHP-2 المحسوب في الخطوة 3.8 إلى كل عينة للحصول على حجم نهائي قدره 20 ميكرولتر واخلطه برفق باستخدام ماصة دقيقة.
- لف أغطية قارورة العينة في بارافيلم لمنع التسرب أو التلوث المتبادل.
- احتضان العينات عند 37 درجة مئوية لمدة ساعتين على دوار بسرعة ثابتة.
- قم بإزالة العينات من الدوار وأوقف التفاعل بإضافة 1 مل من PBSA إلى كل عينة.
- كرر الخطوة 3.6.
4. وضع العلامات على الخلايا وتحليل قياس التدفق الخلوي للركائز منزوعة الفسفرة
- أعد تعليق العينات من الخطوة 3.16 في مزيج 20 ميكرولتر من الكواشف الأولية المقابلة لها كما هو موضح في الجدول 2. احتضان العينات لمدة 20 دقيقة في درجة حرارة الغرفة.
ملاحظة: تم حساب جميع تركيزات الكاشف المستخدمة على أنها زائدة فيما يتعلق بعدد البروتينات المعبر عنها على سطح خلايا الخميرة. يفترض الحساب التعبير عن 10,000 بروتين / خلية من جميع الخميرة 2 × 106 في عينة35 ، عندما يكون ذلك بشكل روتيني ~ 50٪ فقط. يوضح الجدول 3 نسبة كاشف الملصقات الزائدة لكل من الكواشف المعبر عنها في الجدول 2 ، محسوبة على النحو التالي:
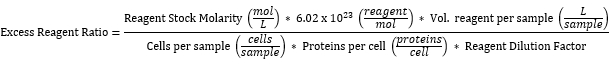
- عينات أجهزة الطرد المركزي عند 4,500 × جم لمدة دقيقة واحدة والتخلص من المادة الطافية كنفايات خطرة بيولوجيا.
- اغسل الخلايا مرة واحدة عن طريق إعادة تعليقها في 1 مل من PBSA. كرر الخطوة 4.2.
- أعد تعليق العينات في مزيج 20 ميكرولتر من الكواشف الثانوية المقابلة لها كما هو موضح في الجدول 2. احتضان العينات لمدة 15 دقيقة في حالة عدم وجود ضوء.
- كرر الخطوة 4.2.
- كرر الخطوة 4.3.
- أعد تعليق العينات المغسولة في 300-500 ميكرولتر من PBSA وانقلها إلى أنابيب البوليسترين سعة 5 مل لتحليلها على الفور باستخدام مقياس التدفق الخلوي المناسب.
ملاحظة: إذا كانت هناك حاجة إلى نقل العينات ، فاحتفظ بها على الثلج الرطب. لا ينصح بذلك, ولكن يمكن تخزين العينات عند 4 درجات مئوية لمدة أقصاها 2 ساعة ككريات رطبة. - بعد إجراء بدء التشغيل اللازم وإعداد مقياس الخلوي لتجربة جديدة ، انقر فوق الزر " تجربة جديدة " داخل قائمة "ملف" ، وقم بتسمية التجربة ، وانقر فوق "حفظ " لضمان حفظ البيانات التي تم الحصول عليها في مسار الملف المطلوب.
- حدد أيقونة المخطط النقطي داخل شريط الأدوات العلوي لإنشاء مخططين نقطيين أو أكثر لكل نموذج يتم تشغيله. بالنسبة لأحد المخططات النقطية، حدد اسم المحور X لعرض قناة FSC-A واسم المحور Y لعرض قناة SSC-A. يوضح هذا المخطط منطقة التشتت الجانبي مقابل التشتت الأمامي - المنطقة ويستخدم لبوابة خلايا الخميرة لمزيد من التحليل.
- في مخطط نقطي آخر ، حدد اسم المحور X لعرض القناة التي يتألق فيها الكاشف الثانوي الذي يستهدف الجسم المضاد لعلامة اللوحة الأولية المضادة للحاتمة. حدد اسم المحور Y لعرض القناة التي يتألق فيها الكاشف الثانوي للستربتافيدين. ستظهر هذه المخطط فقط الأحداث المسورة من الجانب مقابل مخطط التشتت الأمامي كخلايا خميرة وتستخدم لعرض فسفرة التيروزين على المحور Y وتعبير سطح الركيزة على المحور X.
ملاحظة: الكاشف الثانوي الذي يستهدف الأجسام المضادة لعلامة الحافة الأولية في قناة FITC (AF-488) وكاشف الستربتافيدين الثانوي يتألق في قناة AF-647 في هذا المثال. قد تختلف القنوات المستخدمة اعتمادا على الكواشف الأولية والثانوية المستخدمة أثناء وضع العلامات. - ضع كل أنبوب عينة في حامل أنبوب مقياس الخلوي وحدد تشغيل لمقياس الخلوي لبدء تحميل العينة والحصول على البيانات. اضبط الأحداث المراد عرضها والأحداث المراد تسجيلها ووقت التسجيل وعينة معدل التدفق حسب الضرورة.
- حدد بوابة تحيط بخلايا الخميرة السليمة في مخطط SSC-A مقابل FSC-A الذي تم إنشاؤه في الخطوة 4.9. يوضح الشكل 1 تمثيلا وصفيا لاستراتيجية البوابات المراد تطبيقها.
ملاحظة: في مخطط SSC-A مقابل FSC-A ، يعد 100,000 حدث لعرضه ، و 50,000 حدث لتسجيله داخل بوابة الخميرة المحددة دليلا جيدا لتصور وجمع البيانات الكافية لمزيد من التحليل. يمكن تطبيق استراتيجيات بوابات أكثر صرامة لاختيار الخميرة المفردة بناء على مخطط ارتفاع التشتت الأمامي مقابل منطقة التشتت الأمامية كما تم الإبلاغ عنهمؤخرا 36. تتوافق استراتيجية البوابات الموضحة في الشكل 1 مع نهج أقل صرامة ، بما في ذلك الخميرة المفردة وبعض الخميرة المزدوجة من خلال بوابات مبعثرة. - سجل مضان جميع عينات التحكم باستخدام محلل قياس التدفق الخلوي. يتم جمع عينات التحكم بشكل روتيني أولا للمساعدة في تحديد استراتيجية البوابات ، كما هو موضح أدناه في الخطوة 4.14.
- حدد استراتيجية بوابات لقطعة الأرض الخاصة بك التي تم إنشاؤها في الخطوة 4.10 قبل تحليل العينات المعالجة. يوضح الشكل 1 تمثيلا وصفيا لاستراتيجية البوابات المراد تطبيقها.
- سجل مضان العينات منزوعة الفسفرة باستخدام مقياس التدفق الخلوي واستراتيجية البوابات المحددة في الخطوتين 4.12 و 4.14.
- تحليل بيانات قياس التدفق الخلوي التي تم الحصول عليها باستخدام برنامج تحليل قياس التدفق الخلوي.
- قم بتقييم إزالة الفسفرة عن طريق قياس ومقارنة متوسط المحور Y للخلايا التي تعبر عن البروتين على سطحها والفسفرة الأساسية التي توفرها الخلايا غير المعروضة بين العينات والضوابط. احسب النسبة المئوية لفرق الفسفرة المتوسطة على النحو التالي:

النتائج
يكشف تحليل قياس التدفق الخلوي من نسخة مكررة فردية لنظامنا النموذجي المحتضن لمدة ساعتين بدون (الشكل 1 أ) ومع (الشكل 1 ب) 1,000 نانومتر SHP-2 عن فرق متوسط الفسفرة بنسبة 63.6٪ ، والذي يتم تعريفه على أنه نسبة متوسط المحور Y (الفسفرة) من جميع الأحداث المعروضة على السطح مطروحا منه إشارة الفسفرة الأساسية المحددة على أنها وسيط المحور Y للأحداث غير المعروضة بين العينة المعالجة والتحكم غير المعالج كما هو موضح في المعادلة المعرفة في خطوة البروتوكول 4.12. قبل تحليل المتوسطات ، تم ربط العينات بوابات بناء على حجمها (التشتت الأمامي) وتعقيدها (التشتت الجانبي) لتشمل مجموعة صحية من الخلايا. في ظل الظروف المحددة ، يجب تمييز إزالة الفسفرة من العينة على مرأى من الجميع (الشكل 1 ج).
يتم تعريف الاختبار من خلال إجراء مباشر يتكون من أربع طرق رئيسية (الشكل 2 أ). يعتمد نظام عرض سطح الخميرة الذي نستخدمه ونشرناه سابقا على بلازميد يحتوي على محفز ثنائي الاتجاه مع القدرة على التعبير المحفز المتزامن لزوج ركيزة كيناز يتكون من الذيل السيتوبلازمي ل CD28 والتيروزين كيناز LCK (الشكل 2 ب) 29. يتم توجيه التوطين المشترك للبروتينات المترجمة بواسطة شبكة إندوبلازمية تستهدف ببتيد الإشارة والتعديل اللاحق للترجمة الذي يفرضه زيادة وقت الإقامة الناتج عن تسلسل الاحتفاظ بالتقارير الإلكترونية الطرفية C. يؤدي إفراز الركيزة الفسفرية المدمجة في Aga2p إلى التعبير السطحي (الشكل 2 ج). تم تصميم الركيزة لتكون محاطة بعلامتين حاتمة ، مما يسمح بتأكيد الترجمة الناجحة خارج الخلية والتعبير السطحي اللاحق. يسمح حضانة الركيزة التي تعرض خلايا الخميرة مع الفوسفاتيز محل الاهتمام (في هذه الحالة ، فوسفاتيز التيروزين SHP-2) بتحليل تعديل الإنزيم من خلال انخفاض الفوسفات المرتبط بالركيزة (الشكل 2 د).
على الرغم من تحديد الظروف المثلى لنظام النموذج المقدم ، إلا أن قابلية تعميم الفحص تسمح بتنويع البروتينات المراد تحليلها. تم تحديد الظروف المثلى للمقايسة من خلال سلسلة من المعايرة بالتحليل الحجمي حيث تم تقييم مجموعات مختلفة من الوقت وتركيز الفوسفاتيز في أربع مرات (الشكل 3). أظهرت البيانات التي تم تحليلها دلالة إحصائية من خلال ANOVA ثنائي الاتجاه مع النسخ المتماثل (ص < 0.05). قدمت الظروف المختارة من 2 ساعة و 1,000 نانومتر (48.8٪ ± 10٪) فرقا متوسطا تقريبيا للفسفرة مع الحفاظ على الدلالة الإحصائية عند مقارنتها بنظيرتها البالغة 750 نانومتر عند ساعتين (ص < 0.05) بناء على تحليل اختبار t مع تباين غير متساو. كشف اختبار t أيضا عن عدم وجود فرق كبير عن نتيجة 2 ساعة و 1,000 نانومتر عن طريق زيادة الوقت بمقدار 1 ساعة تحت أي من التركيزات التي وفرت نسبة فرق الفسفرة المتوسطة التقريبية (ص > 0.05 ل 500 نانومتر و 750 نانومتر و 1,000 نانومتر عند 3 ساعات).
يكشف تحليل Tukey HSD اللاحق أن جميع المقارنات المتوسطة بين فترات الحضانة عبر جميع التركيزات تختلف اختلافا كبيرا بصرف النظر عن 1 ساعة إلى 2 ساعة. عند مقارنة التركيزات المتعددة التي تم اختبارها ، نلاحظ فقط اختلافات متوسطة ذات دلالة إحصائية عند مقارنة 250 نانومتر بجميع التركيزات الأخرى ، مما يشير إلى أنه من المتوقع حدوث مستويات مماثلة من نشاط الفوسفاتيز داخل المجموعات ، باستثناء 250 نانومتر. على الرغم من ملاحظة فرق بنسبة 20٪ عندما تمت معالجة العينات في 4 ساعات و 1,000 نانومتر SHP-2 (22.1٪ ± 5.5٪) ، مقارنة بالظروف المثلى (t-test ، ص < 0.05) ، قررنا عدم متابعة هذا المزيج بسبب انخفاض التعبير السطحي وانخفاض صحة الخميرة من الحضانة الطويلة مع DTT. نفترض أن هذا ناتج عن ظروف التقليل من عازلة العمل ، وهو أمر ضروري لوظيفة الفوسفاتيز SHP-2 المناسبة.

الشكل 1: تحليل قياس التدفق الخلوي لنظام النموذج. مخططات الكثافة التي تعرض التشتت الأمامي (المحور X) مقابل بوابة التشتت الجانبي (المحور Y) (اليسار) والمخططات النقطية التي تعرض التعبير السطحي من خلال وضع العلامات على علامة الحاتمة الطرفية C للركيزة (المحور X) مقابل فسفرة الركيزة (المحور Y) (المركز) للمجال السيتوبلازم CD28 المحتضن لمدة ساعتين (A) بدون SHP-2 و (B) مع التركيز الأمثل ل SHP-2 المحدد على أنه 1,000 نانومتر. تم قياس Y-Median داخل البوابات المحددة التي تشمل الخلايا المعبر عنها على السطح (الأخضر) فقط كقياس نسبي للفسفرة. تم تحديد أحداث الإشارة غير المعروضة لتحديد قياس Y-Median للخلفية (رمادي). (ج) تراكب مخطط النقاط للعينات الذي يظهر اختلاف الرؤية الواضحة في Y-median. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التعديل الأنزيمي للبروتينات المعروضة على سطح الخميرة. (أ) تخطيطي الفحص يعرض الخطوات الحاسمة ضمن الطرق الأربع الموصوفة: تحضير العينات باستخدام الفوسفاتيز (tan) للفحص الأنزيمي ، والحضانة للنشاط الأنزيمي المطلوب ، وغسل الخلايا ووضع العلامات للكشف عن النشاط ، وتحليل قياس التدفق الخلوي وجمع البيانات. (ب) الرسم التخطيطي الجيني الذي يمثل الهيكل العام للكاسيت المستخدم لعزل الشبكة الإندوبلازمية لزوج ركيزة الإنزيم والتعبير السطحي عن الركيزة. (ج) التمثيل الرسومي للتوطين المشترك للشبكة الإندوبلازمية لزوج ركيزة كيناز (يسار) متبوعا بإفراز الركيزة المعدلة بعد الترجمة المعروضة على سطح الخميرة ومصنفة بجسم مضاد مضاد للفوسفوتيروزين (أزرق) وجسم مضاد للعلامة المضادة للحاتمة (وردي) لتأكيد التعبير السطحي (يمين). (د) حضانة خلايا الخميرة بالفوسفاتيز (تان) يزيل مجموعة الفوسفات من الركيزة المعروضة ، مما يعطل وضع العلامات على الأجسام المضادة للفوسفوتيروزين ، مما يسهل تحليل التعديل الأنزيمي من خلال قياس التدفق الخلوي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: نشاط الفوسفاتيز والمعايرة بالتحليل الحجمي. تعرضت خلايا الخميرة لمجموعات متعددة من الوقت وتركيز الفوسفاتيز متبوعا بتحليل قياس التدفق الخلوي. تمت مقارنة جميع العينات المعالجة بعنصر تحكم محتضن لنفس المدة الزمنية وظروف العازلة بدون SHP-2. تم تعريف النسبة المئوية لفرق الفسفرة الوسيط على أنه نسبة وسيط Y من الأحداث المعروضة على السطح مطروحا منه إشارة الضوضاء الأساسية التي يوفرها وسيط Y في الأحداث غير المعروضة في SHP-2 المحتوية على عينات ، مقسومة على نفس العلاقة في التحكم الخاص بها. يتم رفض الفرضية الصفرية عند ملاحظة اختلافات ذات دلالة إحصائية في مقارنة التغيرات بين مجموعات الوقت والتركيز باستخدام ANOVA ثنائي الاتجاه (ص < 0.05). تأثير المتغيرات الموصوفة على النسبة المئوية لفرق الفسفرة المتوسط مستقل عن بعضها البعض (التفاعل ص > 0.05). تم إجراء اختبار Tukey's HSD للتحليل اللاحق للحصول على مزيد من المعلومات حول أهمية الاختلاف عبر وقت الحضانة الإجمالي ومجموعات التركيز ، وتم استخدام سلسلة من اختبارات t بافتراض تباين غير متساو لتحديد الدلالة الإحصائية للمجموعات الفردية في وقت وتركيز محددين. يتم تقديم البيانات كمتوسط ± انحراف معياري لأربعة مكررات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: نمو الخميرة وإرشادات تحضير وسائط تحريض البروتين. وصف جدولي للكتلة المطلوبة من كل مكون كيميائي لصياغة 1 لتر من وسائط نمو الخميرة الانتقائية ، ووسائط تحريض بروتين الخميرة الانتقائية ووسائط سكر العنب بتون الخميرة. بمجرد خلط الوسط الموصوف بشكل صحيح ، قم بتعقيمه قبل استخدامه. يتم تضمين تعليمات إضافية لصنع لوحات وسائط نمو الخميرة الانتقائية. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: تحضير العينة الموصى بها لإزالة الفسفرة من الركيزة واستراتيجية وضع العلامات على الأجسام المضادة. وصف جدولي للعينات المطلوبة لقياس التعديلات الأنزيمية للركائز الفسفرية المعروضة على سطح الخميرة. يتم تحديد إعداد العينة واستراتيجية وضع العلامات على الأجسام المضادة التالية لكل من الضوابط المطلوبة وكل عينة ليتم تحليلها ، بما في ذلك التخفيفات المقابلة لكواشف وضع العلامات. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 3: حسابات نسبة الأجسام المضادة إلى البروتين الزائدة. وصف جدولي للعدد النظري للأجسام المضادة المتاحة لكل بروتين معبرا عنه على سطح خلية الخميرة أثناء تصنيفها لقياس التدفق الخلوي. يفترض الرقم النظري المعبر عنه أن 100٪ من خلايا الخميرة تعبر عن 10,000 بروتين على سطحها لضمان زيادة الجسم المضاد وتستند حسابات النسبة الزائدة إلى تركيز مخزون الكاشف المعروض في الجدول والمكتسب من المزود. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول التكميلي S1: تسلسل الأحماض الأمينية لأشرطة البناء. تمثيل جدولي لتسلسل الأحماض الأمينية لأشرطة البناء الموجودة على جانبي مروج Gal 1-10. تتوافق التسلسلات المميزة مع أوصافها المرمزة بالألوان. يتم تمثيل جانب Gal-10 من البلازميد على أنه ترجمة تسلسل عكسي للأحماض الأمينية لتسهيل فهمه. تتوافق جميع الأحرف المتبقية باللون الأسود مع ترجمة الأحماض الأمينية لمواقع هضم إنزيم التقييد المستخدمة لتوفير نمطية للبناء. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يسمح البروتوكول المقدم بتحليل التفاعلات الأنزيمية باستخدام العرض خارج الخلية للبروتينات على سطح الخميرة. يؤدي دمج عزل الشبكة الإندوبلازمية في البلازميد السطحي المستخدم إلى تقديم القدرة على تحليل تفاعلات محددة بين الإنزيمات والركائز المعدلة بعد الترجمة خارج الخلية بسبب التفاعلات داخل الخلايا التي يمكن تصميمها لتحدث27،29. تتضمن فحوصات التفاعل الأنزيمي التي تم إنشاؤها مسبقا باستخدام عرض سطح الخميرة التعبير عن البروتينات ذات الأهمية داخل الخلايا ، مع كون العرض السطحي أداة فقط للكشف عن التفاعلات داخل الخلايا التي تحدث بين البروتينات المستهدفة23،25،29.
يعتمد هذا البروتوكول على هذا النظام الأساسي عن طريق نقل التفاعلات الأنزيمية المستهدفة إلى البيئة خارج الخلية ، مما يوفر مرونة إضافية في كل من الإنزيمات التي يمكن دراستها ، والبيئة التي يتم مراقبة نشاطها فيها. تمنح التفاعلات المدروسة التي تحدث خارج الخلية الباحثين الفرصة لتكييف بيئة الحضانة لتكون أكثر مثالية للنشاط الأنزيمي ، وتوسيع الإنزيمات التي يمكن دراستها والتي يتم إعاقة أنشطتها في الشبكة الإندوبلازمية الخميرة ، وهي بيئة مؤكسدة بشدة37. علاوة على ذلك ، فإن القدرة على معايرة تركيز الإنزيمات فيما يتعلق بركيزة معينة تسمح بمقايسات نشاط إنزيمي محددة لا يمكن إجراؤها داخل الخلايا بسبب تشبع معدل التفاعل المفترض أثناء العزل.
وضمن البروتوكول، هناك العديد من الخطوات الحاسمة التي يجب ملاحظتها لضمان مراعاة النتيجة المرجوة. يعد التحويل الناجح للتركيبات المدروسة إلى خميرة أمرا ضروريا للحصول على أفضل النتائج من الخطوات التالية. يجب إجراء مراقبة دقيقة للكثافة الضوئية لتتبع النمو الصحي للثقافات والتأكد من عدم نموها قبل تحريض البروتين أو تحضير العينة. تشمل المرحلة اللوغاريتمية لنمو خلايا الخميرة الفترة التي يكون فيها إنتاج البروتين هو الأعلى ، بينما في المرحلة الثابتة ، يتم إيقاف الآليات المسؤولة عن إنتاج البروتين38. مع وضع ذلك في الاعتبار ، توفر قياسات الكثافة الضوئية قياسا دقيقا لمراحل النمو التي توجد فيها مزارع الخميرة ، ويجب أن تتم خطوات مثل تحريض البروتين والتحضير للمقايسات خارج المرحلة الثابتة أو عندما تصبح الثقافات متضخمة (OD600nm < 6).
بالنسبة لمقايسة التعديل الأنزيمي ، كانت بيئة الحضانة الموصوفة خاصة بالإنزيم المدروس ، SHP-2 والنشاط الأنزيمي الذي تم إجراؤه ، إزالة الفسفرة. تم استخدام DTT لبيئة الاختزال التي يوفرها أثناء الحضانة مع SHP-234. لذلك ، من المهم قياس التركيزات الدقيقة للمواد الكيميائية المستخدمة لتعديل بيئة الحضانة في المقايسات الأنزيمية لضمان نشاط إنزيمي متسق بين العينات والتجارب. تم استخدام SHP-2 كبروتين مؤتلف ، ومن الأهمية بمكان تنظيم درجة الحرارة خلال الخطوات المختلفة للتعامل مع الإنزيم. لإجراء فحص ناجح ، يجب ألا يكون الإنزيم قد مر بأكثر من دورتين من التجميد والذوبان ويجب أن يكون على الجليد أثناء تحضير كل عينة. من الضروري بعد ذلك نقل الإنزيم المؤتلف إلى حجم كاف لتلبية متطلبات الفحص. أثناء الحضانة الفعلية ، يجب التحكم في درجة الحرارة بدقة عند درجة الحرارة المثلى للإنزيم ، 37 درجة مئوية في هذه الحالة ، مع حركة مستمرة من الدوار لضمان تجانس خليط الحضانة.
تطلبت الطريقة العامة للتحليل باستخدام الإنزيمات المؤتلفة تعديلات خاصة بالتفاعل بين SHP-2 والركيزة الفسفرية المعروضة على السطح. يتضمن تكييف البروتوكول مع تفاعلات الركيزة الإنزيمية خارج الخلية الأخرى تعديل التسلسلات المستخدمة ، وبيئة المخزن المؤقت للنشاط ، والكاشف المستخدم للكشف. لفحص تفاعلات الكيناز والركيزة والفوسفاتيز الأخرى ، يتضمن التكيف استبدال تسلسلات البروتين لزوج ركيزة كيناز في مواقعها الخاصة في كاسيت البناء الموصوف في الجدول التكميلي S1. يجب تضمين تسلسل البروتين للركيزة جنبا إلى جنب مع مجال كيناز الكيناز محل الاهتمام على الأقل في البلازميد ، ويجب أن يكون الفوسفاتيز الذي يستهدف الركيزة الفسفرية المنتجة في شكل بروتين مؤتلف. يقدم التفاعل التمثيلي بين LCK و CD28 و SHP-2 مثالا على استخدام عزل الشبكة الإندوبلازمية المصممة في كاسيت البناء كأداة لإنتاج بروتينات معدلة بعد الترجمة ليتم فحصها خارج الخلية باستخدام إنزيم الاستهداف الخاص بها. يمكن التعبير عن الركائز ذات الأهمية التي لا تحتاج إلى إجراء تعديلات ما بعد الترجمة (على سبيل المثال ، الركائز التي يمكن فسفرتها خارج الخلية باستخدام كيناز مضاف) على سطح الخميرة بدون إنزيم مقترن داخل كاسيت البناء. في هذه الحالة ، ستتم إزالة تسلسل البروتين للكيناز الموصوف في الجدول التكميلي S1 مع تضمين تسلسل الركيزة فقط في كاسيت البناء. نلاحظ من تجربتنا السابقة أن التوطين المشترك لسيرين ثريونين كيناز مع ركيزة معروفة أدى إلى عرض الركيزة التي لم تكن فسفرة (Ezagui و Stern ، بيانات غير منشورة) ، لذلك يجب إجراء اختبار صارم للتعديل الأنزيمي الناجح قبل تطبيق الفوسفاتيز خارج الخلية. لقد نشرنا سابقا بروتوكولا للتوطين المشترك لركيزة كيناز قد يكون مفيدا لهذه الخطوةالمؤهلة 39.
غالبا ما تحتوي الكينازات والفوسفاتيز على بقايا سيستين غير متزاوجة والتي ، عند تأكسدها ، تشكل روابط ثاني كبريتيد داخل البروتين أو عبر البروتينات ، والتي يمكن أن تعطل النشاط التحفيزي للبروتين بسبب التغيير التوافقي40،41. يعد فهم هذه الكيمياء الحيوية للبروتين أمرا ضروريا لتحديد بيئة التفاعل المناسبة للتعديل الأنزيمي. نتيجة لذلك ، يجب استكمال عامل الاختزال في بيئة الحضانة لضمان بقاء البروتين المؤتلف المستخدم نشطا. DTT هو عامل اختزال شائع يستخدم لهذه الأغراض ، ولكن يجب تحسين التركيز في الفحص. يؤدي استخدام تركيز DTT المرتفع جدا إلى إعاقة عرض الركيزة على سطح الخميرة ، حيث يتم تثبيت مثبتات Aga1p و Aga2p مع بعضها البعض من خلال روابط ثاني كبريتيد ، والتي يتم تقليلها في وجود DTT42. تم تعديل تركيز DTT إلى الحد الأدنى من التركيز الذي من شأنه أن يسمح بأقصى نشاط نسبي للفوسفاتيز دون أن يكون له آثار ضارة على العرض السطحي للركائز42. يجب تحسين بيئة الحضانة لأي إنزيم يتم فحصه لضمان الاحتفاظ بالنشاط الأنزيمي عند استخدامه في هذا الفحص. إذا كان الإنزيم يتطلب بيئة مختزلة أقوى بكثير من 0.5 ملي مولار DTT المستخدم في هذا الاختبار ، فإن المنصة محدودة بانخفاض عرض السطح وقد لا تكون مثالية للمقايسة الأنزيمية المحددة المطلوبة. وبالمثل ، تم تضمين المخزن المؤقت 2x المستخدم أثناء خطوة الحضانة في هذا البروتوكول من البحث السابق في المخازن المؤقتة المقبولة التي تعزز نشاط SHP-2 ، ويجب إجراء بحث مماثل لصياغة مخزن مؤقت للحضانة لأي إنزيم آخر يتم استخدامه لهذا الاختبار34. يمكن أن تشمل نقاط البداية لصياغة هذه المخازن المؤقتة البحث في الأدبيات عن التطبيقات الناجحة في المختبر للإنزيم محل الاهتمام أو توصية الشركة المصنعة للإنزيم لمخزن مؤقت للنشاط. يجب معايرة الإنزيم المؤتلف المستخدم خصيصا لهذا الاختبار لتحديد التركيز المقبول ووقت الحضانة ، مما يسمح بحدوث النشاط الأنزيمي المستهدف قبل جمع البيانات.
لتكييف هذا البروتوكول مع أنواع أخرى من تفاعل الإنزيم والركيزة ، يجب اختيار كواشف الكشف عن الفلورسنت الجديدة ومعايرتها من أجل الحساسية. أظهرت دراسات أخرى أمثلة على ذلك ، بما في ذلك استخدام الأجسام المضادة التي تستهدف علامة الحاتمة للكشف عن وجود أو عدم وجود ركائز الببتيد بعد العلاج بالبروتياز23،25 والأجسام المضادة الحساسة للأكتيلات للكشف عن التعديلات على بروتينات الهيستون43. لتأهيل هذه الكواشف ، يجب إنشاء تحكم إيجابي (تحكم يوضح تعديل الفائدة بشكل يمكن التحقق منه) وتحكم سلبي (يثبت بشكل يمكن التحقق منه عدم تعديل الفائدة). يمكن القيام بذلك من خلال عرض سطح الخميرة لبناء أظهر سابقا تعديل الاهتمام ، أو في بعض الحالات يمكن إنشاؤه من خلال تثبيت البروتينات أو الببتيدات المؤتلفة. على سبيل المثال ، في حالة الفسفرة (والعديد من التعديلات الأخرى ذات الأهمية بعد الترجمة) ، يمكن تصنيع الببتيدات ذات التسلسل المعروف إما مع الفوسفوتيروزين (التحكم الإيجابي) أو التيروزين غير المعدل (التحكم السلبي) والبيوتين الطرفي C الذي من شأنه أن يمكن من تثبيت الببتيدات على الخرز المطلي بالستربتافيدين. يمكن تصنيف الخرزات المغلفة بالببتيد بالجسم المضاد الخاص بالتعديل وتقييمها من حيث خصوصية وحساسية الكشف باستخدام قياس التدفق الخلوي بطرق مشابهة لتلك الموضحة في القسم 4. يجب استخدام تخفيفات مختلفة من الجسم المضاد لإيجاد تركيز يوفر أقصى إشارة للتحكم الإيجابي ، والحد الأدنى من الإشارة للتحكم السلبي ، ويوازن بين زيادة كافية من الجسم المضاد لكل بروتين معدل (باستخدام المعادلة الموجودة في الملاحظة من الخطوة 4.1) مع الاعتبارات الاقتصادية لعدد التجارب التي سيتم إجراؤها لكل حصة من الجسم المضاد الذي تم الحصول عليه.
نصف بروتوكولا لتكييف سهولة منصة عرض سطح الخميرة لمقايسات النشاط الأنزيمي خارج الخلية. يتم توضيح الطريقة باستخدام CD28 الفسفوري المعروض على سطح الخميرة ليتم نزع الفسفرة بواسطة SHP-2 المؤتلف أثناء الحضانة ولكنه قابل للتعميم للعديد من أنواع التعديل الأنزيمي من خلال تعديل عازلة العمل وزوج الإنزيم والركيزة المستخدمة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح فيما يتعلق بهذا العمل للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من خلال جائزة NSF CAREER ل L.A.S. (CBET - 2339172) وصناديق بدء التشغيل من جامعة جنوب فلوريدا.
في الشكل 2 أ ، تم ترخيص أيقونة الأنبوب الدقيق المفتوحة والشفافة بواسطة Servier https://smart.servier.com/ بموجب CC-BY 3.0 Unported https://creativecommons.org/licenses/by/3.0/. تشمل التعديلات إضافة عازلة وخلية خميرة (يسار) وإضافة جسم مضاد (وسط يمين).
تم توفير أنبوب الاختبار والحاضنة ومقياس التدفق الخلوي في الشكل 2 أ من خلال www.bioicons.com تحت الوصول المفتوح.
Materials
| Name | Company | Catalog Number | Comments |
| 1 L Media Bottles | Corning | 06-414-1D | |
| 1.7/2.0 mL Microtubes | Axygen | MCT-175-C | |
| 10 µL SureOne Pipet Tips | Fisher Scientific | 02-707-438 | |
| 1000 µL SureOne Pipet Tips | Fisher Scientific | 02-707-408 | |
| 12 mL Polystyrene Round-Bottom Tubes | Greiner | 07-000-212 | |
| 3 mL platic Cuvettes | BRAND | 759076D | |
| 300 µL SureOne Pipet Tips | Fisher Scientific | 02-707-411 | |
| 5 mL Serological Pipettes | Fisher Scientific | 13-678-11D | |
| Acid Casein (Casamino Acids) | Fisher Scientific | BP-1424-500 | |
| Analytical Balance | Mettler Toledo | 30243397 | |
| Bacteriological Petri Dish | Corning | Falcon 351008 | |
| Biosafety Cabinets | Labconco | Logic Class II, Type A2 302310102 | |
| Biospectrometer | Eppendorf | Kinetic 6136000010 | |
| Bovine Serum Albumin | Fisher bioreagents | BP1600-100 | |
| Citric Acid | Fisher Scientific | A940-500 | |
| CytoFLEX Flow Cytometry Analyzer | Beckam Coulter | Cytoflex C09745 | CytExpert software |
| Dextrose | Fisher Scientific | D16-1 | |
| Dithiothreitol | Fisher bioreagents | BP172-5 | |
| Donkey anti-goat FITC | Invitrogen | A16000 | |
| EDTA | Alfa Aesar | H56165.30 | |
| Ez-Link PEG4-NHS-Biotin | Thermo Scientific | A39259 | |
| Frozen-EZ Yeast Transformation II Kit | Zymo Research | T2001 | |
| Galactose | Fisher Scientific | BP656-500 | |
| General Purpose Refrigerator | Marvel Scientific | MS24RAS4RW | |
| Goat anti-myc tag antibody | Bethyl | A190-104A | |
| Mictrotube Centrifuge | Eppendorf | 5425 R 5406000313 | |
| Mini Low Temperature Refrigerated Incubator | Fisher Scientific | 15-015-2632 | |
| Mouse anti-phosphotyrosine antibody 4G10 | BioXcell | BE0194 | |
| Parafilm M | Bemis | M PM999 | |
| Phosphate Buffered Saline | Fisher bioreagents | BP399-500 | |
| Pipette Controller | Eppendorf | easypet 3 4430000018 | |
| Raffinose | Thermo Scientific | J21060-36 | |
| Recombinant human Active SHP-2 Protein | R&D Systems | 1894-SH | |
| Refrigerated Centrifuge | Eppendorf | 5910 R | |
| Saccharomyces cerevisiae yeast surface display strain EBY 100 | ATCC | MYA-4941 | |
| Shaker Incubator | Eppendorf | M1335-0002 New Brunswick Innova 42 | |
| Single Channel Pipette Set | Eppendorf | 05-403-151 | |
| Sodium Chloride | Fisher Scientific | S671-500 | |
| Sodium Citrate Dihydrate | Fisher Scientific | S279-500 | |
| Sodium Phosphate Dibasic Heptahydrate | Fisher Scientific | S373-500 | |
| Sodium Phosphate Monobasic Monohydrate | Fisher Scientific | S468-500 | |
| Streptavidin Alexa Fluor 647 | Invitrogen | S32357 | |
| Top Loading Balance | Mettler Toledo | ||
| Tris hydrochloride | EMD Millipore | 648317-100GM | |
| Tube revolver rotator | Fisher Scientific | 11-676-341 | |
| Weighing Paper | Fisher Scientific | 09-898-12B | |
| Yeast Nitrogen Base | BD Difco | 291940 | |
| Zeba Spin Desalting Columns | Thermo Scientific | 89883 |
References
- Lea, M. A., Weber, G. Role of enzymes in homeostasis: VIII. Inhibition of the activity of glycolytic enzymes by free fatty acids. J Biol Chem. 243 (6), 1096-1102 (1968).
- Mahé, M., Rios-Fuller, T. J., Karolin, A., Schneider, R. J. Genetics of enzymatic dysfunctions in metabolic disorders and cancer. Front Oncol. 13, 1230934(2023).
- Fernandez-de-Cossio-Diaz, J., Vazquez, A. A physical model of cell metabolism. Sci Rep. 8 (1), 8349(2018).
- Metallo, C. M., Vander Heiden, M. G. Understanding metabolic regulation and its influence on cell physiology. Mol Cell. 49 (3), 388-398 (2013).
- Mildvan, A. S. Mechanisms of signaling and related enzymes. Proteins. 29 (4), 401-416 (1997).
- Frosina, G. Overexpression of enzymes that repair endogenous damage to DNA. Eur J Biochem. 267 (8), 2135-2149 (2000).
- Schärer, O. D. Chemistry and biology of DNA repair. Angew Chem Int Ed. 42 (26), 2946-2974 (2003).
- de la Fuente, M., et al. Enzyme therapy: Current challenges and future perspectives. Int J Mol Sci. 22 (17), 9181(2021).
- Robertson, J. G. Enzymes as a special class of therapeutic target: clinical drugs and modes of action. Curr Opin Struct Biol. 17 (6), 674-679 (2007).
- Goddard, J. -P., Reymond, J. -L. Enzyme assays for high-throughput screening. Curr Opin Biotechnol. 15 (4), 314-322 (2004).
- Helm, J. S., Hu, Y., Chen, L., Gross, B., Walker, S. Identification of active-site inhibitors of MurG using a generalizable, high-throughput glycosyltransferase screen. J Am Chem Soc. 125 (37), 11168-11169 (2003).
- Veldhuyzen, W. F., Nguyen, Q., McMaster, G., Lawrence, D. S. A light-activated probe of intracellular protein kinase activity. J Am Chem Soc. 125 (44), 13358-13359 (2003).
- Torres, M., Forman, H. J. Encyclopedia of Respiratory. Laurent, G. J., Shapiro, S. D. , Academic Press. 10-18 (2006).
- Blume-Jensen, P., Hunter, T. Oncogenic kinase signalling. Nature. 411 (6835), 355-365 (2001).
- Martin, G. S. Cell signaling and cancer. Cancer Cell. 4 (3), 167-174 (2003).
- Lothrop, A. P., Torres, M. P., Fuchs, S. M. Deciphering post-translational modification codes. FEBS Lett. 587 (8), 1247-1257 (2013).
- Graves, J. D., Krebs, E. G. Protein phosphorylation and signal transduction. Pharmacol Ther. 82 (2), 111-121 (1999).
- Hafen, E. Kinases and phosphatases--A marriage is consummated. Science. 280 (5367), 1212-1213 (1998).
- Westphal, R. S., Anderson, K. A., Means, A. R., Wadzinski, B. E. A signaling complex of Ca2+-calmodulin-dependent protein kinase IV and protein phosphatase 2A. Science. 280 (5367), 1258-1261 (1998).
- Barford, D., Das, A. K., Egloff, M. -P. The structure and mechanism of protein phosphatases: Insights into catalysis and regulation. Annu Rev Biophys Biomol Struct. 27, 133-164 (1998).
- Liu, Q., Qu, J., Zhao, M., Xu, Q., Sun, Y. Targeting SHP2 as a promising strategy for cancer immunotherapy. Pharmacol Res. 152, 104595(2020).
- Pan, J., Zhou, L., Zhang, C., Xu, Q., Sun, Y. Targeting protein phosphatases for the treatment of inflammation-related diseases: From signaling to therapy. Signal Transduct Targeted Ther. 7 (1), 177(2022).
- Denard, C. A., et al. YESS 2.0, a tunable platform for enzyme evolution, yields highly active TEV protease variants. ACS Synth Biol. 10 (1), 63-71 (2021).
- Lim, S., Glasgow, J. E., Filsinger Interrante, M., Storm, E. M., Cochran, J. R. Dual display of proteins on the yeast cell surface simplifies quantification of binding interactions and enzymatic bioconjugation reactions. Biotechnol J. 12 (5), (2017).
- Yi, L., et al. Engineering of TEV protease variants by yeast ER sequestration screening (YESS) of combinatorial libraries. Proc Natl Acad Sci USA. 110 (18), 7229-7234 (2013).
- Yi, L., et al. Yeast endoplasmic reticulum sequestration screening for the engineering of proteases from libraries expressed in yeast. Methods Mol Biol. 1319, 81-93 (2015).
- Semenza, J. C., Hardwick, K. G., Dean, N., Pelham, H. R. ERD2, a yeast gene required for the receptor-mediated retrieval of luminal ER proteins from the secretory pathway. Cell. 61 (7), 1349-1357 (1990).
- Mei, M., et al. Characterization of aromatic residue-controlled protein retention in the endoplasmic reticulum of Saccharomyces cerevisiae. J Biol Chem. 292 (50), 20707-20719 (2017).
- Ezagui, J., Russell, B., Mairena, Y., Stern, L. A. Endoplasmic reticulum sequestration empowers phosphorylation profiling on the yeast surface. AIChE J. 68 (12), e17931(2022).
- Kawai, S., Murata, K. Genetic Transformation Systems in Fungi. van den Berg, M. A., Maruthachalam, K. 1, Springer International Publishing. 187-192 (2015).
- Kawai, S., Hashimoto, W., Murata, K. Transformation of Saccharomyces cerevisiae and other fungi: methods and possible underlying mechanism. Bioeng Bugs. 1 (6), 395-403 (2010).
- Loock, M., et al. High-efficiency transformation and expression of genomic libraries in yeast. Methods Protoc. 6 (5), 89(2023).
- Huang, D., Gore, P. R., Shusta, E. V. Increasing yeast secretion of heterologous proteins by regulating expression rates and post-secretory loss. Biotechnol Bioeng. 101 (6), 1264-1275 (2008).
- Yu, B., et al. Targeting protein tyrosine phosphatase SHP2 for the treatment of PTPN11-associated malignancies. Mol Cancer Ther. 12 (9), 1738-1748 (2013).
- Stern, L. A., et al. Geometry and expression enhance enrichment of functional yeast-displayed ligands via cell panning. Biotechnol Bioeng. 113 (11), 2328-2341 (2016).
- Pan, X., et al. Optimized single-cell gates for yeast display screening. Protein Eng Design Sel. 38, gzae018(2025).
- Margittai, É, et al. Production of H2O2 in the endoplasmic reticulum promotes in vivo disulfide bond formation. Antioxid Redox Signal. 16 (10), 1088-1099 (2012).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiol Rev. 57 (2), 383-401 (1993).
- Ezagui, J., Stern, L. A. Tyrosine phosphorylation screening on the yeast surface by magnetic bead selection and FACS. Methods Mol Biol. 2681, 275-290 (2023).
- Yarnall, M. T. N., Kim, S. H., Korntner, S., Bishop, A. C. Destabilization of the SHP2 and SHP1 protein tyrosine phosphatase domains by a non-conserved “backdoor” cysteine. Biochem Biophys Rep. 32, 101370(2022).
- Dustin, C. M., Heppner, D. E., Lin, M. J., van der Vliet, A. Redox regulation of tyrosine kinase signalling: more than meets the eye. J Biochem. 167 (2), 151-163 (2020).
- Stern, L. A., Csizmar, C. M., Woldring, D. R., Wagner, C. R., Hackel, B. J. Titratable avidity reduction enhances affinity discrimination in mammalian cellular selections of yeast-displayed ligands. ACS Comb Sci. 19 (5), 315-323 (2017).
- Waldman, A. C., Rao, B. M., Keung, A. J. Mapping the residue specificities of epigenome enzymes by yeast surface display. Cell Chem Biol. 28 (12), 1772-1779.e4 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved