Method Article
Maya Yüzeyinde Görüntülenen Proteinlerin Enzimatik Modifikasyonu ve Akış Sitometrisi Değerlendirmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, enzimatik modifikasyon deneyleri için maya yüzeyinde görüntülenen substratların kullanılması için bir protokol sunuyoruz. Platform, temsili bir enzimatik modifikasyon deneyi olarak tirozin fosfataz SHP-2'nin substratlarından birine karşı defosforilasyon aktivitesinin analizi kullanılarak gösterildi.
Özet
Maya yüzey gösterimi, protein fonksiyonunun yüksek verimli taramasını güçlendiren bir genotip-fenotip bağlantı stratejisidir. Geleneksel olarak, maya yüzeyi gösterimi, bağlanma kuvveti seviyelerini değerlendirmek ve bunlara göre sıralamak için kullanılan akış sitometrisi ile yeni bağlayıcı proteinlerin evrimine uygulanmıştır. Son zamanlarda, akış sitometrisi ile okunabilen bir fenotip sağlayan katkı maddesi (örneğin, fosforilasyon) veya eksiltici (örneğin, proteoliz) modifikasyonları ile substrat varyantlarının enzimatik modifikasyonunu taramak için maya yüzey ekranının uygulanmasına artan bir ilgi olmuştur. Bu tür modifikasyonlar, hücre içi ko-lokalizasyon kullanılarak düzenli olarak uygulanır, ancak görüntülenen substratların hücre dışı enzimatik modifikasyonunu elde etme yeteneği, araştırmaya çok daha fazla reaksiyon açabilir. Burada, maya yüzeyinde görüntülenen aday substratlara hücre dışı enzimatik modifikasyon için tarama deneyleri tasarlama ve uygulama tekniklerini ve ardından akış sitometrisi analizi kullanarak değerlendirmeyi açıklıyoruz. Bu protokolleri, fosforile edilmiş tirozin kalıntıları içeren fosfatazların fosforillenmeye maruz kalan maya ile görüntülenmesi bağlamında sağlıyoruz ve bu uygulanan çerçevenin diğer enzim-substrat çiftleri için tarama deneylerinin geliştirilmesine nasıl uyarlanabileceği hakkında yorum yapıyoruz.
Giriş
Enzimler ve hedefleri arasındaki etkileşimlerin anlaşılması, hücresel homeostazı ve hastalık gelişimini kontrol eden yolların biyolojik karakterizasyonundaki gerekliliği nedeniyle giderek daha ilginç bir araştırma alanı haline gelmiştir 1,2. Enzimler, biyolojik yaşamı sürdüren reaksiyonların çoğunun katalizinden, hücresel metabolizma 3,4, sinyalleşme5 gibi gerekli yolları ve hatta genom onarımı 6,7 gibi temel süreçleri kontrol etmekten sorumludur. Bu süreçlerdeki rolleri nedeniyle, etkileşimleri birçok hastalığın gelişiminde de rol oynar, çünkü aktivitelerindeki sapmalar hücre aktivitesinde ciddi düzensizliğe neden olarak apoptoza veya zararlı kanser hücrelerinin çoğalmasına neden olabilir2. Enzimatik aktivite çalışması, her bir spesifik enzim-substrat etkileşimine10 göre uyarlanmış tahliller gerektiren yeni terapötiklerin 8,9 geliştirilmesinde önemli uygulamalara sahip olmuştur. Bu etkileşimlerin değerlendirilmesi ve karakterizasyonu için standart protokoller olarak çoklu enzimatik testler oluşturulmuştur. Enzimatik etkileşimleri analiz etmek için geliştirilen tahliller, aktivasyon/inhibisyon11 için bağlanmayı izleyen tespit tahlilleri veya enzimler12 tarafından substrat modifikasyonunu izleyen tahliller olarak sınıflandırılır.
Enzimlerin önemli bir rolü hücre davranışını düzenlemektir. Bir hücrenin hücre dışı bir tetikleyiciye13 hücre içi tepkisi olan sinyal iletimi, hücrenin hayatta kalmasından ve işlevselliğinden sorumludur. Hücre çoğalması, farklılaşması ve diğer birçok fonksiyonel sürecin tümü, onları yöneten enzimatik etkileşimlere sahip sinyal yollarını içerir14,15. Enzimler, genellikle hücre dışı mesajların doğru iletilmesinden sorumlu olan büyük sinyal ağlarını modüle eden translasyon sonrası modifikasyonları katalize eder16. Protein fosforilasyonu, hücre sinyallemesinde ve diğer birçok hücresel yolda her yerde bulunan en yaygın translasyon sonrası modifikasyondur. Sonuç olarak, protein kinazlar, kritik düzenleyici rolleri nedeniyle potansiyel terapötik hedeflerin önemli bir kısmı olarak ortaya çıkmıştır17. Fosfatazlar, fosfat bazlı hücre sinyal kompleksleri 18,19 için doğal modülatör moleküllerdirve hedef proteinlerinden20 fosfat kalıntılarını uzaklaştırma kapasitesine sahiptir. Son on yılda, fosfatazlar, çoklu hücre tiplerinde aşağı akış sinyal yollarının düzenlenmesindeki rollerine bağlı olarak kanser tedavisi21 ve enflamatuar hastalıklar22 için önemli bir terapötik hedef haline gelmiştir. Birlikte, protein kinazlar ve fosfatazlar, spesifik enzimatik tahlil protokollerinin geliştirilmesi yoluyla incelenebilecek geniş bir etkileşim genişliği sağlar.
Maya yüzey gösterimi, enzimatik aktivitenin karakterizasyonu ve değerlendirilmesi için bir araç olarak kullanılmıştır23,24. Endoplazmik retikulum sekestrasyon stratejileri25,26 ile birleştirildiğinde translasyon sonrası modifikasyon süreçlerinin taranması için yüksek verimli bir platform sağlar. Bu, kinaz-substrat çiftlerinin, kinazlar ve hedefleri arasındaki yakınlık nedeniyle substratın fosforilasyonunun artan oranlarda meydana gelebileceği KDEL reseptörlerine27 bağlanarak endoplazmik retikulumda birlikte lokalize edilmesine ve tutulmasına izin verir. KDEL reseptör bağlanmasına, diğer HDEL sekanslarından daha güçlü bir retansiyon kabiliyetine sahip olduğu gösterilen bir C-terminali FEHDEL endoplazmik retikulum retansiyon sekansı aracılık eder25,28. Fosforile substrat daha sonra akış sitometrisi29 aracılığıyla müteakip değerlendirmesi için maya yüzeyine sabitlenir. Şu anda, maya yüzeyinde görüntülenen substratların enzimatik modifikasyonu için oluşturulmuş genelleştirilebilir protokoller yoktur. Hücre dışı olarak eksprese edilen fosforile substrat varyantlarından yararlanarak ve bunları bilinen fosfatazları ile defosforilasyon yoluyla modifiye ederek maya yüzeyi gösteriminin kapasitelerini genişletiyoruz. Akış sitometrisi analizi daha sonra, bilinen fosfataz ile inkübasyonun bir sonucu olarak fosforilasyon medyanındaki değişikliklerin ölçümü yoluyla yukarıda belirtilen substratların fenotipik değerlendirmesi için bir platform sağlar. Bu, yüzeyde görüntülenen proteinlerin translasyon sonrası modifikasyonu için uyarlanabilir bir yöntem sağlarken, aynı zamanda maya yüzey görüntüleme platformunu kullanırken etkileşimlerin enzimatik modifikasyon analizi için bir yöntem sağlar.
Maya yüzeyi görüntüleme platformuna bir kinaz-substrat etkileşiminin sokulmasını, eksprese edilen fosforile substratın bir rekombinant fosfataz ile birlikte inkübasyonunu ve ardından akış sitometrisi yoluyla defosforilasyon aktivitesinin analizini tanımlayan bir enzimatik modifikasyon testinin geliştirilmesi ve uygulanması için teknikler sunuyoruz. Bu raporda, bu, CD28'in sitoplazmik alanının maya endoplazmik retikulumunda lenfosit kinaz (LCK) ile birlikte lokalize edilmesi, ardından fosforile CD28'in maya yüzeyinde gösterilmesi ve ardından Src homoloji bölgesi 2 alanı içeren fosfataz-2 (SHP-2) ile defosforilasyon ile gerçekleştirilir. Fosfataz tedavisinin bir fonksiyonu olarak fosforilasyon seviyesinin miktar tayini için çok çeşitli peptit dizilerinde fosforile tirozin kalıntılarını tespit eden bir pan anti-fosfotirozin antikoru (bu çalışmada, 4G10) kullanılır. Ayrıntılı süreç, enzim-substrat etkileşimlerini araştırmak için genelleştirilebilir bir yaklaşım sağlar; Enzimleri ve substratları saflaştırılmış bir şekilde incelemenin olası bir yolu.
Protokol
1. Plazmid barındıran mayanın hücre büyümesi ve protein ekspresyonunun indüksiyonu
- Tablo 1'de açıklanan tarifi takiben, plazmid içermeyen maya (YPD), plazmit içeren maya hücresi büyümesi (SD-CAA) ve protein ekspresyonunun indüksiyonu (SRG-CAA) ve ayrıca SD-CAA plakalarının büyümesi için gerekli ortamı hazırlayın.
- Kinaz-substrat çiftini içeren maya teşhir plazmid DNA'sını, çeşitli üreticilerin maya dönüşüm kitlerinde kullanım için yaygın olarak benimsenen lityum katyon bazlı yöntem30,31 aracılığıyla EBY-100 maya hücrelerine dönüştürün.
NOT: Dönüştürülen plazmit yapısına bağlı olarak elektroporasyon32 veya diğer tercih edilen maya plazmit dönüşüm teknikleri kullanılabilir. - 10 mL YPD ortamı içeren 14 mL'lik bir kültür tüpü hazırlayın. EBY-100 hücrelerini aşılayın ve kültür 0.8-1.0 (8 x 106-1 x 107 hücre / mL) optik yoğunluğa (OD600nm) ulaşana kadar 30 ° C, 300 rpm'de çalkalanan bir inkübatörde büyütün.
NOT: OD600nm , ilgili ortamlarında 1:10 maya kültürü seyreltmesi içeren 3 mL numune küveti ve numune seyreltmeleri için kullanılan ortamı içeren 3 mL boş küvet hazırlanarak ölçülür. Spektrofotometre üzerindeki OD600nm programı, önce boş küveti, ardından her numune küvetini, her numune için hazırlanan ilgili seyreltmeyi ayarlayarak ölçmek için kullanılır. 1 OD600nm, 1 × 107 maya/mL'ye karşılık gelir. - Kültürü 3 dakika boyunca 1.000 x g'da santrifüjleyerek hücreleri hasat edin ve maya dönüşüm kitinde verilen 1. yıkama solüsyonu veya TE (10 mM Tris-HCl ve 1.0 mM EDTA) 31 ile yıkayın.
- Hücreleri 3 dakika boyunca 1.000 x g'da tekrar pelet haline getirin ve maya dönüşüm kitinde veya steril suda sağlanan 1 mL dönüşüm tamponunda yeniden süspanse edin. Hücreler 50 μL'lik alikotlara ayrılmalıdır ve -80 ° C'de 6 aya kadar saklanabilir.
- Plazmit transformasyonu için, plazmit başına bir alikot hazırlanır ve buz üzerinde çözülür, daha sonra maya görüntüleme yapısını içeren 0.5-1.5 μg plazmit DNA'sı doğrudan hücrelere eklenir. Maya dönüşüm kitinde sağlanan dönüşüm solüsyonunun 0,5 mL'si veya 0,5 mL steril %50 polietilen glikol ve 0,1 M LiOAc solüsyonu31 eklenir. Hücrelerin, plazmid DNA'nın ve transformasyon solüsyonunun karışımını pipetleyerek iyice birleştirin.
- Dönüşüm karışımını 30 ° C'de 30-60 dakika statik olarak inkübe edin, girdap karışımını 15 dakika aralıklarla inkübe edin. 1.000 × g'da 3 dakika santrifüjleyerek hücreleri hasat edin.
- 4.5 mL SD-CAA ortamı ile 14 mL'lik bir kültür tüpü hazırlayın. İstenilen plazmidi içeren hücreleri 500 μL SD-CAA'da yeniden süspanse edin ve hazırlanan 4.5 mL'yi aşılayın.
- Agarı delmemeye dikkat ederek, 5 mL aşılanmış kültürün 50 μL'sini bir SD-CAA plakasına dağıtın ve dönüşüm verimliliğini belirlemek için 30 °C'de 48 saat statik olarak inkübe edin.
- 5 mL SD-CAA hücre kültürünü 30 ° C, 300 rpm'de en az 18 saat boyunca çalkalayan bir inkübatörde inkübe edin. Optik yoğunluğu (OD600nm) 16 saat ve 20 saat sonra izleyin. Numune 6'yı aşmayan yeterli bir optik yoğunluğa ulaştığında, kültürü 2.500 × g'da 3 dakika santrifüjleyin. Maya peletini bozmadan süpernatanı atın.
- SRG-CAA'daki maya peletini 1'den daha düşük (107 maya / mL'× <1 son OD600nm'ye yeniden süspanse edin).
- Maya kültürünü 30 ° C, 300 rpm'de çalkalanan bir inkübatörde en az 8 saat, ancak 24 saatten daha uzun olmamak üzere inkübe edin.
NOT: Maya hücrelerinde protein ekspresyonunun indüksiyonu 20-37 °C arasında herhangi bir yerde değiştirilebilir. 30 °C, kinaz/substrat çiftlerinin sentezi için uygundur29,33, ancak incelenen spesifik proteinler için gerekli görüldüğü takdirde ayarlanabilir. - Hücre yoğunluğunu belirlemek için OD600nm'yi ölçün.
NOT: Protokol bu noktada maya kültürlerini 4 °C'de saklayarak durdurulabilir.
2. 4G10 anti-fosfotirozin antikorunun biyotinilasyonu
- 2 mg'lık bir PEG4-NHS-Biotin şişesini, 680 μL steril PBS ekleyerek 5 mM'lik bir nihai konsantrasyona yeniden süspanse edin.
NOT: PEG4-NHS-Biotin'in yeniden süspansiyonu, biyotinilasyon reaksiyonu gerçekleştirilmeden hemen önce taze olarak yapılmalıdır. NHS sulu çözelti içinde hidrolize olur. Steril PBS ve şişelerin kullanımı, uzun süreli depolama için reaktiflerin hazırlanması ve kirleticilerin reaktif canlılığı veya gerçekleştirilen hassas tahliller üzerindeki olası etkilerini azaltmak için hücre bazlı tahlillerde kullanım için önemlidir. - 4G10 antikor konsantrasyonuna dayanarak, steril 1.7 mL'lik bir şişeye 100 μg antikor ekleyin.
- 7.5: 1'lik bir molar biyotin / antikor oranı elde etmek için 100 μg 4G10 antikorunu tutan şişeye adım 2.1'den hazırlanan 5 mM PEG4-NHS-Biotin'den 1 μL ekleyin. Reaksiyonu homojen hale getirmek için karışımı nazikçe pipetleyin.
- Reaksiyonu oda sıcaklığında en az 2 saat sabit dönüşle inkübe edin.
- Tamponu biyotinile edilmiş 4G10'dan (B-4G10) PBS'ye değiştirmek için 0,5 mL spin tuzdan arındırma kolonları için üreticinin protokolünü izleyin.
NOT: 7 kDa'lık bir moleküler ağırlık kesme (MWCO) ile tuzdan arındırma kolonları, daha büyük antikoru korurken reaksiyona girmemiş biyotin ve diğer küçük moleküllerin uzaklaştırılmasına izin vermek için antikorların biyotinilasyonu için yaygın olarak kullanılır. - B-4G10 antikorunu PBSA'da (1 g / L sığır serum albümini ile PBS) 1 μM'lik bir nihai konsantrasyona seyreltin. Tekrarlanan donma/çözülme döngülerini önlemek için B-4G10 antikorunu daha küçük hacimlere ayırın.
NOT: Biyotinillenmiş antikorlar, önemli bir verimlilik kaybı olmadan 3 aya kadar günlük kullanım için 4 ° C'de saklanabilir. Kullanılmayan alikotların geri kalanını -20 °C'de en fazla 2 yıl saklayın.
3. Maya hücresi yüzeyinde eksprese edilen substratların defosforilasyonu
- 2x çalışma tamponu çözeltisini daha önce literatürdeaçıklandığı gibi hazırlayın 34.
NOT: İhtiyaç duyulan bileşenlerin ölçümünü kolaylaştırmak için 2x önerilir. - Adım 3.1 1:2'de hazırlanan 2x tampon çözeltisini deiyonize suda seyrelterek 1.7 mL'lik bir şişedeki numuneler için çalışma tamponunu hazırlayın.
NOT: Her numune için toplam reaksiyon hacmi 20 μL olacaktır ve her numune 10 μL ile 18 μL arasında herhangi bir çalışma tamponu gerektirecektir. Tüm numuneler veya kontroller için yeterli çalışma tamponu hazırlayın. - Tablo 2'de açıklanan önerilen numune hazırlamanın ardından, 1.7 mL'lik şişeleri ilgili kontrol veya numune adıyla etiketleyin.
- Adım 1.9'da ölçülen OD600nm'ye dayanarak, her numune için karşılık gelen maya kültüründen iki milyon (2 × 106) maya hücresini geri kazanmak için gerekli kültür hacmini hesaplayın.
- Önceki adımda hesaplanan maya kültürü hacmini her numune için 1,7 mL'lik şişeye ekleyin.
- Şişeyi 4.500 × g'da 1 dakika santrifüjleyin. Süpernatanı bir mikropipet kullanarak dikkatlice çıkarın ve biyolojik olarak tehlikeli atık olarak atın.
- Peletlenmiş hücreleri 1 mL PBSA içinde yeniden süspanse edin ve adım 3.6'yı tekrarlayın.
NOT: Peletlenmiş hücreleri rahatsız etmeden mümkün olduğunca fazla süpernatanın çıkarılması önemlidir. - Stok konsantrasyonuna bağlı olarak, 20 μL'lik bir toplam reaksiyon hacminde 1.000 nM'lik bir nihai konsantrasyona sahip olması gereken rekombinant insan SHP-2 hacmini hesaplayın.
NOT: Rekombinant SHP-2, her tahlilde kullanılan herhangi bir proteinin ikiden fazla donma-çözülme döngüsünden geçmemesi için küçük hacimlerde aliquote edilmelidir. Tüm numuneler bir tahlil için hazırlandıktan sonra bir alikottan kalan herhangi bir SHP-2 atılmalıdır.
Rekombinant enzimlerin stok konsantrasyonları lot numarasına bağlı olarak değişebilir. Rekombinant SHP-2 yaygın olarak 0.2-0.4 mg / mL'lik bir stok konsantrasyonunda formüle edilir. 0.324 mg / mL SHP-2'lik bir stok konsantrasyonu için bu, 4.696 μM'lik bir stok konsantrasyonuna karşılık gelir (SHP-2'nin moleküler ağırlığı 69 kDa'dır). 20 μL'lik bir reaksiyonda 4.26 μL'lik SHP-2 stoğu, 1.000 nM SHP-2'lik bir nihai reaksiyon konsantrasyonu ile sonuçlanır. - 5 mM'lik bir DTT çözeltisi oluşturmak için 15 mL'lik bir konik içinde hazırlanan 10 mL deiyonize suya 7.7 mg DTT ekleyin. Ekipman sınırlamaları miligram tartmayı zorlaştırıyorsa, 10 mL deiyonize suya 0,77 g DTT ekleyin, ardından tahlil için kullanılan 5 mM DTT çözeltisini oluşturmak için 100x seyreltme gerçekleştirin.
NOT: DTT çözeltisi, mevcut ekipman kullanılarak miligram ölçekli miktarların ölçülmesi mümkün değilse, 5 mM'ye seyreltilmek üzere daha yüksek konsantrasyonlu stok çözeltilerinde hazırlanabilir. DTT çözeltisinin, hidrolize olma eğilimi nedeniyle çalışma tamponunda taze önceki hücre yeniden süspansiyonu hazırlanması gerekir, bu da su içinde seyreltildiğinde uzun süreler boyunca kararsız hale gelir. - Peletlenmiş hücreleri, her numune veya kontroldeki nihai reaksiyon hacmi 20 μL olacak şekilde adım 3.2'de hazırlanan çalışma tamponunda yeniden süspanse edin.
NOT: Eklenen çalışma tamponu miktarı, her numunede bulunacak olan DTT (2 μL) ve SHP-2 (adım 3.8'de hesaplanan) miktarına göre hesaplanmalıdır. - Her numuneye adım 3.9'da hazırlanan 5 mM DTT çözeltisinden 2 μL ekleyin veya 0.5 mM DTT'lik bir son reaksiyon konsantrasyonunu kontrol edin.
- Adım 3.8'de hesaplanan SHP-2 hacmini, 20 μL'lik bir son hacim için her numuneye ekleyin ve bir mikropipet kullanarak hafifçe karıştırın.
- Sızıntıyı veya çapraz kontaminasyonu önlemek için numune şişesi kapaklarını parafilm ile sarın.
- Numuneleri 37 °C'de 2 saat boyunca bir rotor üzerinde sabit bir hızda inkübe edin.
- Numuneleri rotordan çıkarın ve her numuneye 1 mL PBSA ekleyerek reaksiyonu durdurun.
- Adım 3.6'yı tekrarlayın.
4. Defosforile substratların hücre etiketleme ve akış sitometrisi analizi
- Numune 3.16. adımdan numuneleri, Tablo 2'de açıklandığı gibi karşılık gelen birincil reaktiflerinin 20 μL'lik bir karışımında yeniden süspanse edin. Numuneleri oda sıcaklığında 20 dakika inkübe edin.
NOT: Kullanılan tüm reaktif konsantrasyonlarının, maya hücrelerinin yüzeyinde eksprese edilen protein sayısına göre fazla olduğu hesaplanmıştır. Hesaplama, rutin olarak sadece ~%50'si bunu yaptığında, bir numune35'teki 2 x 106 mayanın tümünden 10.000 protein/hücrenin ekspresyonunu varsayar. Tablo 3, Tablo 2'de ifade edilen reaktiflerin her biri için aşağıdaki gibi hesaplanan fazla etiketleme reaktif oranını göstermektedir:
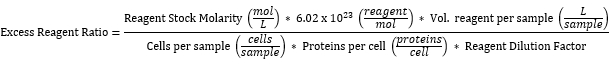
- Numuneleri 1 dakika boyunca 4.500 × g'da santrifüjleyin ve süpernatanı biyolojik olarak tehlikeli atık olarak atın.
- 1 mL PBSA'da yeniden süspanse ederek hücreleri bir kez yıkayın. Adım 4.2'yi tekrarlayın.
- Numuneleri, Tablo 20'de açıklandığı gibi karşılık gelen ikincil reaktiflerinin 2 μL'lik bir karışımında yeniden süspanse edin. Numuneleri ışık yokluğunda 15 dakika inkübe edin.
- Adım 4.2'yi tekrarlayın.
- Adım 4.3'ü tekrarlayın.
- Yıkanmış numuneleri 300-500 μL PBSA içinde yeniden süspanse edin ve uygun bir akış sitometresi kullanarak hemen analiz etmek için 5 mL polistiren tüplere aktarın.
NOT: Numunelerin taşınması gerekiyorsa, ıslak buz üzerinde tutun. Tavsiye edilmez, ancak numuneler 4 °C'de ıslak peletler halinde en fazla 2 saat saklanabilir. - Yeni bir deney için sitometrenin gerekli başlatılmasını ve hazırlanmasını gerçekleştirdikten sonra, Dosya menüsündeki Yeni Deney düğmesine tıklayın, deneyi adlandırın ve elde edilen verilerin istenen dosya yoluna kaydedildiğinden emin olmak için Kaydet'e tıklayın.
- Çalıştırılacak her örnek için iki veya daha fazla nokta çizimi oluşturmak için üst araç çubuğundaki nokta grafiği simgesini seçin. Nokta grafiklerinden biri için, FSC-A kanalını görüntülemek için X ekseni adını ve SSC-A kanalını görüntülemek için Y ekseni adını seçin. Bu çizim, Yan Saçılma - Alana karşı İleri Dağılım - Alanını gösterir ve daha fazla analiz için maya hücrelerini geçit etmek için kullanılır.
- Başka bir nokta grafiğinde, birincil anti-epitop etiketi antikorunu hedefleyen ikincil reaktifin floresan olduğu kanalı görüntülemek için X ekseni adını seçin. Streptavidin ikincil reaktifinin floresan yayıldığı kanalı görüntülemek için Y ekseni adını seçin. Bu çizim, maya hücreleri olarak yalnızca yandan ve ileri saçılma grafiğinden geçitli olayları gösterecektir ve Y ekseninde tirozin fosforilasyonunu ve X ekseninde substrat yüzey ifadesini görüntülemek için kullanılır.
NOT: Birincil anti-epitop etiketi antikorunu hedefleyen ikincil reaktif, bu örnekte FITC (AF-488) kanalında floresan ve streptavidin ikincil reaktifi AF-647 kanalında floresan olur. Kullanılan kanallar, etiketleme sırasında kullanılan birincil ve ikincil reaktiflere bağlı olarak değişebilir. - Her bir numune tüpünü sitometrenin tüp tutucusuna yerleştirin ve sitometrenin numuneyi yüklemeye ve veri almaya başlaması için Çalıştır'ı seçin. Görüntülenecek olayları, kaydedilecek olayları, kaydedilecek zamanı ve örnek akış hızını gerektiği gibi ayarlayın.
- Adım 4.9'da oluşturulan SSC-A ve FSC-A grafiğinde sağlıklı maya hücrelerini çevreleyen bir kapı tanımlayın. Şekil 1 , uygulanacak geçit stratejisinin açıklayıcı bir temsilini göstermektedir.
NOT: SSC-A ve FSC-A grafiğinde, görüntülenecek 100.000 olay ve tanımlanan maya kapısı içinde kaydedilecek 50.000 olay, daha fazla analiz için yeterli veriyi görselleştirmek ve toplamak için iyi bir kılavuzdur. Tekil maya için seçilecek daha katı geçit stratejileri, yakın zamanda bildirildiği gibi İleri Saçılma Yüksekliği ve İleri Saçılma Alanı grafiğine dayalı olarak uygulanabilir36. Şekil 1'de gösterilen geçit stratejisi, saçılma kapısı yoluyla singlet ve bir miktar çift maya dahil olmak üzere daha az katı bir yaklaşıma karşılık gelir. - Bir akış sitometrisi analizörü kullanarak tüm kontrol numunelerinin floresansını kaydedin. Aşağıda adım 4.14'te açıklandığı gibi, bir geçit stratejisinin tanımlanmasına yardımcı olmak için önce kontrol örnekleri rutin olarak toplanır.
- İşlem görmüş numuneleri analiz etmeden önce adım 4.10'da oluşturulan grafiğiniz için bir geçit stratejisi tanımlayın. Şekil 1 , uygulanacak geçit stratejisinin açıklayıcı bir temsilini göstermektedir.
- Akış sitometresini ve adım 4.12 ve 4.14'te tanımlanan geçit stratejisini kullanarak fosforile edilmiş numunelerin floresansını kaydedin.
- Bir akış sitometrisi analiz yazılımı kullanılarak elde edilen akış sitometrisi verilerini analiz edin.
- Yüzeylerinde protein eksprese eden hücrelerin Y ekseni medyanını ve numuneler ve kontroller arasında görüntülenmeyen hücreler tarafından sağlanan temel fosforilasyonu ölçerek ve karşılaştırarak defosforilasyonu değerlendirin. Medyan fosforilasyon yüzdesi farkını aşağıdaki gibi hesaplayın:

Sonuçlar
(Şekil 1A) ve (Şekil 1B) 1.000 nM SHP-2 olmadan 2 saat inkübe edilen model sistemimizin bireysel bir kopyasından alınan akış sitometrisi analizi, %63.6'lık bir medyan fosforilasyon farkı ortaya çıkarır, bu da Y ekseni medyanının oranı olarak tanımlanır (fosforilasyon) tüm yüzey görüntülenen olaylardan eksi denklemde açıklandığı gibi muamele edilen numune ile tedavi edilmeyen kontrol arasındaki görüntülenmeyen olayların Y ekseni medyanı olarak tanımlanan temel fosforilasyon sinyali Protokol adımı 4.12'de tanımlanmıştır. Medyanların analizinden önce, numuneler, sağlıklı bir hücre grubunu kapsayacak şekilde boyutlarına (İleri Dağılım) ve karmaşıklıklarına (Yan Saçılma) göre kapılandı. Tanımlanan koşullar altında, numune defosforilasyonu düz görüşte ayırt edilebilir olmalıdır (Şekil 1C).
Tahlil, dört ana yöntemden oluşan basit bir prosedürle tanımlanır (Şekil 2A). Kullandığımız ve daha önce yayınladığımız maya yüzeyi görüntüleme sistemi, CD28'in sitoplazmik kuyruğu ve tirozin kinaz LCK'dan oluşan bir kinaz-substrat çiftinin eşzamanlı indüklenebilir ekspresyonu kapasitesine sahip çift yönlü bir promotör içeren bir plazmide dayanmaktadır (Şekil 2B)29. Translasyona tabi proteinlerin birlikte lokalizasyonu, bir endoplazmik retikulum hedefleme sinyal peptidi ve bir C-terminal ER tutma sekansından kaynaklanan artan kalma süresi tarafından zorlanan translasyon sonrası modifikasyon tarafından yönlendirilir. Aga2p'ye kaynaşmış fosforile substratın salgılanması, yüzey ifadesine yol açar (Şekil 2C). Substrat, başarılı translasyonun ve müteakip yüzey ekspresyonunun hücre dışı onayına izin veren iki epitop etiketi ile çevrelenecek şekilde tasarlanmıştır. İlgilenilen fosfataz (bu durumda, tirozin fosfataz SHP-2) ile maya hücrelerini gösteren substratın inkübasyonu, substrata bağlı fosfatın azaltılması yoluyla enzim modifikasyonunun analizine izin verir (Şekil 2D).
Sunulan model sistem için en uygun koşullar tanımlanmış olsa da, testin genelleştirilebilirliği, proteinlerin çeşitlendirilmesinin analiz edilmesine izin verir. Test için en uygun koşullar, farklı zaman ve fosfataz konsantrasyonu kombinasyonlarının dörtlü olarak değerlendirildiği bir dizi titrasyon yoluyla tanımlanmıştır (Şekil 3). Analiz edilen veriler, replikasyonlu iki yönlü ANOVA ile istatistiksel anlamlılık göstermiştir (p < 0.05). Seçilen 2 saat ve 1.000 nM koşulları (%48.8 ± %10), yaklaşık %50'lik bir medyan fosforilasyon farkı sunarken, 2 saatteki 750 nM'lik muadili ile karşılaştırıldığında istatistiksel anlamlılığı korurken (p < 0.05) eşit olmayan varyanslı bir t-testi analizine dayanmaktadır. T-testi ayrıca, yaklaşık bir medyan fosforilasyon farkı yüzdesi sağlayan konsantrasyonların herhangi biri altında süreyi 1 saat artırarak 2 saat ve 1.000 nM sonucundan anlamlı bir fark göstermedi (p 500 nM, 750 nM için 0.05'e > ve 3 saatte 1.000 nM).
Tukey HSD post hoc analizi, tüm konsantrasyonlardaki inkübasyon süreleri arasındaki tüm ortalama karşılaştırmaların 1 saat ila 2 saat arasında önemli ölçüde farklı olduğunu ortaya koymaktadır. Test edilen çoklu konsantrasyonları karşılaştırırken, 250 nM'yi diğer tüm konsantrasyonlarla karşılaştırırken yalnızca istatistiksel olarak anlamlı ortalama farklılıklar gözlemliyoruz, bu da 250 nM dışında gruplar içinde karşılaştırılabilir fosfataz aktivitesi seviyelerinin beklendiğini gösteriyor. Numuneler 4 saat ve 1.000 nM SHP-2'de (% 22.1 ±% 5.5) muamele edildiğinde% 20'lik bir fark gözlemlememize rağmen, optimal koşullara kıyasla (t-testi, p < 0.05), DTT ile uzun inkübasyondan kaynaklanan yüzey ekspresyonunun azalması ve maya sağlığının azalması nedeniyle bu kombinasyonu sürdürmemeye karar verdik. Bunun, uygun SHP-2 fosfataz fonksiyonu için gerekli olan çalışma tamponunun indirgeme koşullarından kaynaklandığını varsayıyoruz.

Şekil 1: Model sistemin akış sitometrisi analizi. İleri Saçılma (X ekseni) ve Yan Saçılma geçitli (Y ekseni) (solda) ve substrat C-terminali epitop etiketi etiketlemesi (X ekseni) ile substrat fosforilasyonu (Y ekseni) (ortada) aracılığıyla yüzey ifadesini gösteren nokta grafikleri, CD28 sitoplazmik alanının 2 saat boyunca inkübe edilmesi, (A) SHP-2 olmadan ve (B) 1.000 nm olarak tanımlanan optimal SHP-2 konsantrasyonu ile. Y-Medyan, yüzey eksprese edilen hücreleri (yeşil) kapsayan tanımlanmış kapılar içinde sadece nispi bir fosforilasyon ölçümü olarak ölçüldü. Görüntülenmeyen sinyal olayları, arka plan Y-Medyan ölçümünü (gri) tanımlamak için kapılandı. (C) Y medyanında düz görüş farkını gösteren örneklerin nokta grafiği kaplaması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Maya yüzeyi görüntülenen proteinlerin enzimatik modifikasyonu. (A) Açıklanan dört yöntem içindeki kritik adımları gösteren tahlil şeması: enzimatik tahlil için fosfataz (tan) ile numunelerin hazırlanması, istenen enzimatik aktivite için inkübasyon, aktivitenin tespiti için hücre yıkama ve etiketleme ve akış sitometrisi analizi ve veri toplama. (B) Bir enzim-substrat çiftinin endoplazmik retikulum sekestrasyonu ve substratın yüzey ekspresyonu için kullanılan kasetin genel bir yapısını temsil eden gen şeması. (C) Bir kinaz-substrat çiftinin endoplazmik retikulum ko-lokalizasyonunun grafiksel gösterimi (Solda), ardından maya yüzeyinde görüntülenen ve bir anti-fosfotirozin antikoru ile etiketlenen translasyon sonrası modifiye edilmiş substratın salgılanması (mavi) ve yüzey ekspresyonunu doğrulamak için bir anti-epitop etiket antikoru (pembe) (Sağ). (D) Maya hücrelerinin fosfataz (tan) ile inkübe edilmesi, fosfat grubunu görüntülenen substrattan uzaklaştırır, anti-fosfotirozin antikor etiketlemesini bozar ve akış sitometrisi yoluyla enzimatik modifikasyon analizini kolaylaştırır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Fosfataz aktivitesi ve zaman titrasyonu. Maya hücreleri, zaman ve fosfataz konsantrasyonunun çoklu kombinasyonlarına maruz bırakıldı ve ardından akış sitometrisi analizi yapıldı. Tedavi edilen tüm numuneler, SHP-2 olmadan aynı süre ve tampon koşulları için inkübe edilen bir kontrol ile karşılaştırıldı. Yüzde medyan fosforilasyon farkı, yüzeyde görüntülenen olaylardan Y-medyanın eksi SHP-2 içeren numunelerde gösterilmeyen olaylarda Y-medyan tarafından sağlanan temel gürültü sinyalinin oranının, ilgili kontrollerinde aynı ilişkiye bölünmesi olarak tanımlandı. İki yönlü ANOVA kullanılarak zaman ve konsantrasyon grupları arasındaki değişikliklerin karşılaştırılmasında anlamlı farklılıklar gözlendiğinde sıfır hipotezi reddedilir (p < 0.05). Açıklanan değişkenlerin medyan fosforilasyon farkı yüzdesi üzerindeki etkisi birbirinden bağımsızdır (Etkileşim p > 0.05). Tukey'in HSD testi, genel inkübasyon süresi ve konsantrasyon grupları arasındaki farkın önemi hakkında daha fazla bilgi için post hoc analiz için gerçekleştirildi ve belirli bir zaman ve konsantrasyonda bireysel grupların istatistiksel anlamlılığını tanımlamak için eşit olmayan varyans varsayan bir dizi t-testi kullanıldı. Veriler, dört kopyanın ortalama ± standart sapması olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Maya büyümesi ve protein indüksiyon ortamı hazırlama kılavuzları. 1 L Seçici Maya Büyüme Ortamı, Seçici Maya Proteini İndüksiyon Ortamı ve Maya Özütü Pepton Dekstroz Ortamını formüle etmek için her bir kimyasal bileşenden gereken kütlenin tablo şeklinde açıklaması. Açıklanan ortam uygun şekilde karıştırıldıktan sonra, kullanımdan önce filtre ile sterilize edin. Seçici Maya Büyüme Ortamı Plakaları yapmak için ek talimatlar dahildir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Substrat defosforilasyonu ve antikor etiketleme stratejisi için önerilen numune hazırlama. Maya yüzeyinde görüntülenen fosforile substratların enzimatik modifikasyonlarının ölçümü için gerekli olan numunelerin tablo halinde açıklaması. Numune hazırlama ve takip eden antikor etiketleme stratejisi, etiketleme reaktiflerinin karşılık gelen seyreltmeleri de dahil olmak üzere hem gerekli kontroller hem de analiz edilecek her numune için belirtilmiştir. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 3: Antikor-protein fazlalık oranı hesaplamaları. Akış sitometrisi için etiketlenirken bir maya hücresinin yüzeyinde eksprese edilen protein başına mevcut olan teorik antikor sayısının tablo şeklinde açıklaması. İfade edilen teorik sayı, maya hücrelerinin %100'ünün, antikor fazlalığını sağlamak için yüzeylerinde 10.000 protein eksprese ettiğini varsayar ve fazlalık oranı hesaplamaları, tabloda görüntülenen ve sağlayıcıdan elde edilen reaktif stok konsantrasyonuna dayanır. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Ek Tablo S1: Yapı kasetlerinin amino asit dizisi. Gal 1-10 promotörün her iki tarafında bulunan yapı kasetleri için amino asit dizisinin tablo şeklinde gösterimi. Vurgulanan diziler, renk kodlu açıklamalarına karşılık gelir. Plazmidin Gal-10 tarafı, anlaşılmasını kolaylaştırmak için bir ters amino asit dizisi translasyonu olarak temsil edilir. Siyah olarak bırakılan tüm karakterler, yapıya modülerlik sağlamak için kullanılan kısıtlama enzimi sindirim bölgelerinin amino asit translasyonuna karşılık gelir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Sunulan protokol, maya yüzeyindeki proteinlerin hücre dışı görüntüsünü kullanarak enzimatik etkileşimlerin analizine izin verir. Endoplazmik retikulum sekestrasyonunun kullanılan yüzey görüntüleme plazmidine dahil edilmesi, meydana gelmek üzere tasarlanabilen hücre içi etkileşimler nedeniyle enzimler ve translasyon sonrası modifiye edilmiş substratlar arasındaki spesifik etkileşimleri hücre dışı olarak analiz etme kapasitesini sunar27,29. Maya yüzey gösterimi kullanılarak daha önce kurulan enzimatik etkileşim deneyleri, ilgilenilen proteinlerin hücre içi ekspresyonunu içerir ve yüzey gösterimi yalnızca hedef proteinler arasında meydana gelen hücre içi etkileşimlerin tespiti için bir araçtır 23,25,29.
Bu protokol, hedeflenen enzimatik etkileşimleri hücre dışı ortama taşıyarak bu platform üzerine inşa edilir, bu da hem çalışılabilen enzimlerde hem de aktivitelerinin izlendiği ortamda ek esneklik sağlar. Hücre dışı olarak meydana gelen incelenen etkileşimler, araştırmacılara inkübasyon ortamını enzimatik aktivite için daha optimal olacak şekilde uyarlama fırsatı verir ve aktiviteleri ağır oksitleyici bir ortam olan maya endoplazmik retikulumunda engellenen incelenebilecek enzimleri genişletir37. Ayrıca, enzimlerin konsantrasyonunu belirli bir substrata göre titre etme yeteneği, sekestrasyon sırasında varsayımsal reaksiyon hızı doygunluğu nedeniyle hücre içi olarak gerçekleştirilemeyen spesifik enzimatik aktivite testlerine izin verir.
Protokol içinde, istenen sonucun gözlemlenmesini sağlamak için dikkat edilmesi gereken birkaç kritik adım vardır. İncelenen yapıların mayaya başarılı bir şekilde dönüştürülmesi, aşağıdaki adımlardan en iyi sonuçları almak için çok önemlidir. Kültürlerin sağlıklı büyümesini izlemek ve protein indüksiyonu veya numune hazırlamadan önce aşırı büyümediklerinden emin olmak için optik yoğunluğun doğru bir şekilde izlenmesi yapılmalıdır. Maya hücresi büyümesinin log fazı, protein üretiminin en yüksek olduğu dönemi kapsarken, durağan fazda protein üretiminden sorumlu mekanizmalar durur38. Bunu akılda tutarak, optik yoğunluk ölçümleri, maya kültürlerinin içinde bulunduğu büyüme aşamalarının doğru bir ölçümünü sağlar ve protein indüksiyonu ve tahliller için hazırlık gibi adımlar, durağan fazın dışında veya kültürler aşırı büyüdüğünde yapılmalıdır (OD600nm < 6).
Enzimatik modifikasyon tahlili için, tarif edilen inkübasyon ortamı, incelenen enzime, SHP-2'ye ve gerçekleştirilen enzimatik aktiviteye, defosforilasyona özgüydü. DTT, SHP-234 ile inkübasyon sırasında sağladığı indirgeyici ortam için kullanıldı. Bu nedenle, numuneler ve deneyler arasında tutarlı enzimatik aktivite sağlamak için enzimatik tahlillerde inkübasyon ortamını değiştirmek için kullanılan kimyasalların doğru konsantrasyonlarını ölçmek önemlidir. SHP-2, rekombinant bir protein olarak kullanılmıştır ve enzimin işlenmesinin farklı adımları sırasında sıcaklığın düzenlenmesi kritik öneme sahiptir. Başarılı bir test için, enzimin ikiden fazla donma-çözülme döngüsünden geçmemiş olması ve her numunenin hazırlanması sırasında buz üzerinde olması gerekir. Daha sonra, tahlil gereksinimlerini karşılamak için rekombinant enzimi yeterli bir hacme alikot etmek zorunludur. Gerçek inkübasyon sırasında, inkübasyon karışımının homojenliğini sağlamak için sıcaklığın enzim için en uygun sıcaklıkta, bu durumda 37 °C'de ve bir rotordan sürekli hareket ile sıkı bir şekilde kontrol edilmesi gerekir.
Rekombinant enzimlerle yapılan analiz için genel yöntem, SHP-2 ile yüzeyde görüntülenen fosforile substrat arasındaki etkileşime özgü modifikasyonlar gerektirdi. Protokolün diğer hücre dışı enzim-substrat etkileşimlerine uyarlanması, kullanılan dizilerin, aktivite tampon ortamının ve tespit için kullanılan reaktifin modifikasyonunu içerir. Diğer kinaz-substrat-fosfataz etkileşimlerini test etmek için adaptasyon, bir kinaz-substrat çifti için protein dizilerinin, Ek Tablo S1'de açıklanan yapı kasetindeki ilgili konumlarına değiştirilmesini içerir. Substratın protein dizisi, en azından ilgilenilen kinazın kinaz alanı ile birlikte plazmide dahil edilmeli ve üretilen fosforile substratı hedef alan fosfataz, rekombinant bir protein formunda olmalıdır. LCK, CD28 ve SHP-2 arasındaki temsili etkileşim, tasarlanan endoplazmik retikulum sekestrasyonunun, hedefleme enzimleri ile hücre dışı olarak araştırılacak translasyon sonrası modifiye edilmiş proteinlerin üretilmesi için bir araç olarak yapı kasetinde kullanılmasına bir örnek sağlar. Translasyon sonrası modifikasyonlardan geçmesi gerekmeyen ilgilenilen substratlar (örneğin, ilave kinaz kullanılarak hücre dışı olarak fosforile edilebilen substratlar), yapı kaseti içinde eşleştirilmiş bir enzim olmadan maya yüzeyinde eksprese edilebilir. Bu durumda, Ek Tablo S1'de tarif edilen kinaz için protein dizisi, sadece substrat dizisi yapı kasetine dahil edilerek çıkarılacaktır. Önceki deneyimlerimizden, bir serin-treonin kinazın bilinen bir substrat ile birlikte lokalizasyonunun, fosforile edilmemiş substratın görüntülenmesine neden olduğunu not ediyoruz (Ezagui ve Stern, yayınlanmamış veriler), bu nedenle hücre dışı fosfataz uygulanmadan önce başarılı enzimatik modifikasyonun titiz bir şekilde test edilmesi gerekir. Daha önce, bu eleme adımı39 için yardımcı olabilecek kinaz-substrat ko-lokalizasyonu için bir protokol yayınlamıştık.
Kinazlar ve fosfatazlar genellikle, oksitlendiğinde protein içinde veya proteinler arasında disülfür bağları oluşturan eşleşmemiş sistein kalıntıları içerir, bu da konformasyonel değişiklik nedeniyle proteinin katalitik aktivitesini bozabilir40,41. Bu protein biyokimyasının anlaşılması, enzimatik modifikasyon için uygun reaksiyon ortamının belirlenmesi için gereklidir. Sonuç olarak, kullanılan rekombinant proteinin aktif kalmasını sağlamak için inkübasyon ortamına bir indirgeyici ajanın takviye edilmesi gerekir. DTT, bu amaçlar için kullanılan yaygın bir indirgeyici ajandır, ancak tahlildeki konsantrasyon optimize edilmelidir. Çok yüksek bir DTT konsantrasyonunun kullanılması, Aga1p ve Aga2p ankrajları, DTT42 varlığında indirgenen disülfür bağları yoluyla birbirine tutulduğundan, substratın maya yüzeyinde görüntülenmesini engeller. DTT konsantrasyonu, substratların42 yüzey gösterimi üzerinde zararlı etkilere sahip olmadan nispi bir maksimum fosfataz aktivitesine izin verecek minimum konsantrasyona ayarlandı. Hangi enzim test edilirse edilsin inkübasyon ortamı, bu testte kullanıldığında enzimatik aktivitenin korunmasını sağlamak için optimize edilmelidir. Bir enzim, bu tahlilde kullanılan 0.5 mM DTT'den önemli ölçüde daha güçlü bir indirgeme ortamı gerektiriyorsa, platform yüzey gösterimindeki azalma ile sınırlıdır ve istenen spesifik enzimatik tahlil için optimal olmayabilir. Benzer şekilde, bu protokoldeki inkübasyon adımı sırasında kullanılan 2x tampon, SHP-2 aktivitesini teşvik eden kabul edilebilir tamponlara yapılan önceki araştırmalardan dahil edilmiştir ve bu test için kullanılan diğer herhangi bir enzim için bir inkübasyon tamponu formüle etmek için benzer araştırmalar yapılmalıdır34. Bu tamponların hazırlanması için başlangıç noktaları, ilgilenilen enzimin başarılı in vitro uygulamaları için literatür taramasını veya enzim üreticisinin bir aktivite tamponu önerisini içerebilir. Kullanılan rekombinant enzim, veri toplamadan önce hedeflenen enzimatik aktivitenin gerçekleşmesine izin veren kabul edilebilir bir konsantrasyon ve inkübasyon süresini belirlemek için bu test için özel olarak titre edilmelidir.
Bu protokolün diğer enzim-substrat etkileşimi türlerine uyarlanması için, yeni floresan tespit reaktiflerinin seçilmesi ve duyarlılık için titre edilmesi gerekecektir. Proteaz tedavisinden 23,25 sonra peptit substratlarının varlığını veya yokluğunu tespit etmek için epitop etiket hedefli antikorların kullanımı ve histon proteinlerindeki43 modifikasyonları tespit etmek için asetilasyona duyarlı antikorların kullanılması da dahil olmak üzere diğer çalışmalar bunun örneklerini göstermiştir. Bu reaktifleri nitelendirmek için, pozitif bir kontrol (ilginin modifikasyonunu doğrulanabilir bir şekilde gösteren) ve negatif bir kontrol (ilginin modifikasyonunun eksikliğini doğrulanabilir bir şekilde gösteren kontrol) oluşturulmalıdır. Bu, daha önce ilginin modifikasyonunu göstermiş olan bir yapının maya yüzeyi gösterimi yoluyla yapılabilir veya bazı durumlarda rekombinant proteinlerin veya peptitlerin immobilizasyonu yoluyla kurulabilir. Örneğin, fosforilasyon (ve ilgilenilen diğer birçok translasyon sonrası modifikasyon) durumunda, bilinen dizilimin peptitleri, fosfotirozin (pozitif kontrol) veya modifiye edilmemiş tirozin (negatif kontrol) ve peptitlerin streptavidin kaplı boncuklar üzerinde hareketsiz hale getirilmesini sağlayacak bir C-terminal biyotin ile sentezlenebilir. Peptit kaplı boncuklar, modifikasyona özgü antikor ile etiketlenebilir ve Bölüm 4'te tarif edilenlere benzer yöntemlerle akış sitometrisi kullanılarak tespitin özgüllüğü ve duyarlılığı açısından değerlendirilebilir. Pozitif kontrolün maksimum sinyalini, negatif kontrolün minimum sinyalini sağlayan ve modifiye protein başına yeterli antikor kat fazlalığını dengeleyen bir konsantrasyon bulmak için farklı antikor dilüsyonları kullanılmalıdır (Adım 4.1'deki nottaki denklemi kullanarak) elde edilen antikor alikotu başına yapılacak deney sayısı için ekonomik hususlarla.
Hücre dışı enzimatik aktivite deneyleri için maya yüzeyi görüntüleme platformunun kolaylığını uyarlamak için bir protokol açıklıyoruz. Yöntem, inkübasyon sırasında rekombinant SHP-2 ile fosforillenmek üzere maya yüzeyinde görüntülenen fosforile CD28 kullanılarak gösterilmiştir, ancak kullanılan çalışma tamponu ve enzim-substrat çiftinin modifikasyonu yoluyla birçok enzimatik modifikasyon türü için genelleştirilebilir.
Açıklamalar
Yazarların bu çalışmayla ilgili ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, L.A.S.'ye (CBET - 2339172) verilen bir NSF KARİYER ödülü ve Güney Florida Üniversitesi'nden başlangıç fonları ile desteklenmiştir.
Şekil 2A'da, Servier https://smart.servier.com/'in mikrotüp açık-yarı saydam simgesi CC-BY 3.0 Unported https://creativecommons.org/licenses/by/3.0/ altında lisanslanmıştır. Modifikasyonlar, tampon ve bir maya hücresinin eklenmesini (solda) ve antikor eklenmesini (orta-sağ) içerir.
Şekil 2A'daki test tüpü, inkübatör ve akış sitometresi, açık erişim altında www.bioicons.com aracılığıyla sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 L Media Bottles | Corning | 06-414-1D | |
| 1.7/2.0 mL Microtubes | Axygen | MCT-175-C | |
| 10 µL SureOne Pipet Tips | Fisher Scientific | 02-707-438 | |
| 1000 µL SureOne Pipet Tips | Fisher Scientific | 02-707-408 | |
| 12 mL Polystyrene Round-Bottom Tubes | Greiner | 07-000-212 | |
| 3 mL platic Cuvettes | BRAND | 759076D | |
| 300 µL SureOne Pipet Tips | Fisher Scientific | 02-707-411 | |
| 5 mL Serological Pipettes | Fisher Scientific | 13-678-11D | |
| Acid Casein (Casamino Acids) | Fisher Scientific | BP-1424-500 | |
| Analytical Balance | Mettler Toledo | 30243397 | |
| Bacteriological Petri Dish | Corning | Falcon 351008 | |
| Biosafety Cabinets | Labconco | Logic Class II, Type A2 302310102 | |
| Biospectrometer | Eppendorf | Kinetic 6136000010 | |
| Bovine Serum Albumin | Fisher bioreagents | BP1600-100 | |
| Citric Acid | Fisher Scientific | A940-500 | |
| CytoFLEX Flow Cytometry Analyzer | Beckam Coulter | Cytoflex C09745 | CytExpert software |
| Dextrose | Fisher Scientific | D16-1 | |
| Dithiothreitol | Fisher bioreagents | BP172-5 | |
| Donkey anti-goat FITC | Invitrogen | A16000 | |
| EDTA | Alfa Aesar | H56165.30 | |
| Ez-Link PEG4-NHS-Biotin | Thermo Scientific | A39259 | |
| Frozen-EZ Yeast Transformation II Kit | Zymo Research | T2001 | |
| Galactose | Fisher Scientific | BP656-500 | |
| General Purpose Refrigerator | Marvel Scientific | MS24RAS4RW | |
| Goat anti-myc tag antibody | Bethyl | A190-104A | |
| Mictrotube Centrifuge | Eppendorf | 5425 R 5406000313 | |
| Mini Low Temperature Refrigerated Incubator | Fisher Scientific | 15-015-2632 | |
| Mouse anti-phosphotyrosine antibody 4G10 | BioXcell | BE0194 | |
| Parafilm M | Bemis | M PM999 | |
| Phosphate Buffered Saline | Fisher bioreagents | BP399-500 | |
| Pipette Controller | Eppendorf | easypet 3 4430000018 | |
| Raffinose | Thermo Scientific | J21060-36 | |
| Recombinant human Active SHP-2 Protein | R&D Systems | 1894-SH | |
| Refrigerated Centrifuge | Eppendorf | 5910 R | |
| Saccharomyces cerevisiae yeast surface display strain EBY 100 | ATCC | MYA-4941 | |
| Shaker Incubator | Eppendorf | M1335-0002 New Brunswick Innova 42 | |
| Single Channel Pipette Set | Eppendorf | 05-403-151 | |
| Sodium Chloride | Fisher Scientific | S671-500 | |
| Sodium Citrate Dihydrate | Fisher Scientific | S279-500 | |
| Sodium Phosphate Dibasic Heptahydrate | Fisher Scientific | S373-500 | |
| Sodium Phosphate Monobasic Monohydrate | Fisher Scientific | S468-500 | |
| Streptavidin Alexa Fluor 647 | Invitrogen | S32357 | |
| Top Loading Balance | Mettler Toledo | ||
| Tris hydrochloride | EMD Millipore | 648317-100GM | |
| Tube revolver rotator | Fisher Scientific | 11-676-341 | |
| Weighing Paper | Fisher Scientific | 09-898-12B | |
| Yeast Nitrogen Base | BD Difco | 291940 | |
| Zeba Spin Desalting Columns | Thermo Scientific | 89883 |
Referanslar
- Lea, M. A., Weber, G. Role of enzymes in homeostasis: VIII. Inhibition of the activity of glycolytic enzymes by free fatty acids. J Biol Chem. 243 (6), 1096-1102 (1968).
- Mahé, M., Rios-Fuller, T. J., Karolin, A., Schneider, R. J. Genetics of enzymatic dysfunctions in metabolic disorders and cancer. Front Oncol. 13, 1230934(2023).
- Fernandez-de-Cossio-Diaz, J., Vazquez, A. A physical model of cell metabolism. Sci Rep. 8 (1), 8349(2018).
- Metallo, C. M., Vander Heiden, M. G. Understanding metabolic regulation and its influence on cell physiology. Mol Cell. 49 (3), 388-398 (2013).
- Mildvan, A. S. Mechanisms of signaling and related enzymes. Proteins. 29 (4), 401-416 (1997).
- Frosina, G. Overexpression of enzymes that repair endogenous damage to DNA. Eur J Biochem. 267 (8), 2135-2149 (2000).
- Schärer, O. D. Chemistry and biology of DNA repair. Angew Chem Int Ed. 42 (26), 2946-2974 (2003).
- de la Fuente, M., et al. Enzyme therapy: Current challenges and future perspectives. Int J Mol Sci. 22 (17), 9181(2021).
- Robertson, J. G. Enzymes as a special class of therapeutic target: clinical drugs and modes of action. Curr Opin Struct Biol. 17 (6), 674-679 (2007).
- Goddard, J. -P., Reymond, J. -L. Enzyme assays for high-throughput screening. Curr Opin Biotechnol. 15 (4), 314-322 (2004).
- Helm, J. S., Hu, Y., Chen, L., Gross, B., Walker, S. Identification of active-site inhibitors of MurG using a generalizable, high-throughput glycosyltransferase screen. J Am Chem Soc. 125 (37), 11168-11169 (2003).
- Veldhuyzen, W. F., Nguyen, Q., McMaster, G., Lawrence, D. S. A light-activated probe of intracellular protein kinase activity. J Am Chem Soc. 125 (44), 13358-13359 (2003).
- Torres, M., Forman, H. J. Encyclopedia of Respiratory. Laurent, G. J., Shapiro, S. D. , Academic Press. 10-18 (2006).
- Blume-Jensen, P., Hunter, T. Oncogenic kinase signalling. Nature. 411 (6835), 355-365 (2001).
- Martin, G. S. Cell signaling and cancer. Cancer Cell. 4 (3), 167-174 (2003).
- Lothrop, A. P., Torres, M. P., Fuchs, S. M. Deciphering post-translational modification codes. FEBS Lett. 587 (8), 1247-1257 (2013).
- Graves, J. D., Krebs, E. G. Protein phosphorylation and signal transduction. Pharmacol Ther. 82 (2), 111-121 (1999).
- Hafen, E. Kinases and phosphatases--A marriage is consummated. Science. 280 (5367), 1212-1213 (1998).
- Westphal, R. S., Anderson, K. A., Means, A. R., Wadzinski, B. E. A signaling complex of Ca2+-calmodulin-dependent protein kinase IV and protein phosphatase 2A. Science. 280 (5367), 1258-1261 (1998).
- Barford, D., Das, A. K., Egloff, M. -P. The structure and mechanism of protein phosphatases: Insights into catalysis and regulation. Annu Rev Biophys Biomol Struct. 27, 133-164 (1998).
- Liu, Q., Qu, J., Zhao, M., Xu, Q., Sun, Y. Targeting SHP2 as a promising strategy for cancer immunotherapy. Pharmacol Res. 152, 104595(2020).
- Pan, J., Zhou, L., Zhang, C., Xu, Q., Sun, Y. Targeting protein phosphatases for the treatment of inflammation-related diseases: From signaling to therapy. Signal Transduct Targeted Ther. 7 (1), 177(2022).
- Denard, C. A., et al. YESS 2.0, a tunable platform for enzyme evolution, yields highly active TEV protease variants. ACS Synth Biol. 10 (1), 63-71 (2021).
- Lim, S., Glasgow, J. E., Filsinger Interrante, M., Storm, E. M., Cochran, J. R. Dual display of proteins on the yeast cell surface simplifies quantification of binding interactions and enzymatic bioconjugation reactions. Biotechnol J. 12 (5), (2017).
- Yi, L., et al. Engineering of TEV protease variants by yeast ER sequestration screening (YESS) of combinatorial libraries. Proc Natl Acad Sci USA. 110 (18), 7229-7234 (2013).
- Yi, L., et al. Yeast endoplasmic reticulum sequestration screening for the engineering of proteases from libraries expressed in yeast. Methods Mol Biol. 1319, 81-93 (2015).
- Semenza, J. C., Hardwick, K. G., Dean, N., Pelham, H. R. ERD2, a yeast gene required for the receptor-mediated retrieval of luminal ER proteins from the secretory pathway. Cell. 61 (7), 1349-1357 (1990).
- Mei, M., et al. Characterization of aromatic residue-controlled protein retention in the endoplasmic reticulum of Saccharomyces cerevisiae. J Biol Chem. 292 (50), 20707-20719 (2017).
- Ezagui, J., Russell, B., Mairena, Y., Stern, L. A. Endoplasmic reticulum sequestration empowers phosphorylation profiling on the yeast surface. AIChE J. 68 (12), e17931(2022).
- Kawai, S., Murata, K. Genetic Transformation Systems in Fungi. van den Berg, M. A., Maruthachalam, K. 1, Springer International Publishing. 187-192 (2015).
- Kawai, S., Hashimoto, W., Murata, K. Transformation of Saccharomyces cerevisiae and other fungi: methods and possible underlying mechanism. Bioeng Bugs. 1 (6), 395-403 (2010).
- Loock, M., et al. High-efficiency transformation and expression of genomic libraries in yeast. Methods Protoc. 6 (5), 89(2023).
- Huang, D., Gore, P. R., Shusta, E. V. Increasing yeast secretion of heterologous proteins by regulating expression rates and post-secretory loss. Biotechnol Bioeng. 101 (6), 1264-1275 (2008).
- Yu, B., et al. Targeting protein tyrosine phosphatase SHP2 for the treatment of PTPN11-associated malignancies. Mol Cancer Ther. 12 (9), 1738-1748 (2013).
- Stern, L. A., et al. Geometry and expression enhance enrichment of functional yeast-displayed ligands via cell panning. Biotechnol Bioeng. 113 (11), 2328-2341 (2016).
- Pan, X., et al. Optimized single-cell gates for yeast display screening. Protein Eng Design Sel. 38, gzae018(2025).
- Margittai, É, et al. Production of H2O2 in the endoplasmic reticulum promotes in vivo disulfide bond formation. Antioxid Redox Signal. 16 (10), 1088-1099 (2012).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiol Rev. 57 (2), 383-401 (1993).
- Ezagui, J., Stern, L. A. Tyrosine phosphorylation screening on the yeast surface by magnetic bead selection and FACS. Methods Mol Biol. 2681, 275-290 (2023).
- Yarnall, M. T. N., Kim, S. H., Korntner, S., Bishop, A. C. Destabilization of the SHP2 and SHP1 protein tyrosine phosphatase domains by a non-conserved “backdoor” cysteine. Biochem Biophys Rep. 32, 101370(2022).
- Dustin, C. M., Heppner, D. E., Lin, M. J., van der Vliet, A. Redox regulation of tyrosine kinase signalling: more than meets the eye. J Biochem. 167 (2), 151-163 (2020).
- Stern, L. A., Csizmar, C. M., Woldring, D. R., Wagner, C. R., Hackel, B. J. Titratable avidity reduction enhances affinity discrimination in mammalian cellular selections of yeast-displayed ligands. ACS Comb Sci. 19 (5), 315-323 (2017).
- Waldman, A. C., Rao, B. M., Keung, A. J. Mapping the residue specificities of epigenome enzymes by yeast surface display. Cell Chem Biol. 28 (12), 1772-1779.e4 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır