A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحضير الآلي ل [68Ga] Ga-3BP-3940 على وحدة توليف لتصوير التصوير المقطعي بالإصدار البوزيتروني للبيئة المكروية للورم
In This Article
Summary
يصف هذا البحث العملية الآلية لإنتاج [68Ga] Ga-3BP-3940 باستخدام مركب GAIA V2 ، لتصوير التصوير المقطعي بالإصدار البوزيتروني لبروتين تنشيط الخلايا الليفية. كما يتم عرض نتائج اختبارات مراقبة الجودة التي أجريت على ثلاث دفعات اختبار.
Abstract
تم تطوير طريقة سريعة وفعالة على وحدة تخليق GAIA للوسم الإشعاعي الآلي للغاليوم -68 ل 3BP-3940 ، وهو مسبار تصوير جزيئي يستهدف بروتين تنشيط الخلايا الليفية لتصوير التصوير المقطعي بالإصدار البوزيتروني للبيئة المكروية للورم. تضمنت ظروف التفاعل عازلة الأسيتات (التركيز النهائي: 0.1 م) ، والميثيونين كعامل مضاد للتحلل الإشعاعي (التركيز النهائي: 5.4 مجم / مل) ، و 30 ميكروغرام من 3BP-3940 ، مع تسخين لمدة 8 دقائق عند 98 درجة مئوية. كانت خطوة التنقية النهائية على خرطوشة C18 ضرورية للحصول على منتج ذو علامات إشعاعية عالية النقاء. في المقابل ، تم استخدام 68Ga المنتج من المولد مباشرة دون خطوة تركيز على خرطوشة التبادل الكاتيوني. أكد إنتاج ثلاث دفعات للتحقق من موثوقية الطريقة ، مما سمح بتخليق [68Ga] Ga-3BP-3940 في 22.3 ± 0.6 دقيقة بنقاوة كيميائية إشعاعية عالية (RCP) ، على النحو الذي حددته كل من radio-HPLC (99.1٪ ± 0.1٪) و radio-TLC (99.2٪ ± 0.1٪). كان متوسط العائد الكيميائي الإشعاعي ، بناء على قيم RCP المقاسة بواسطة HPLC الراديوي ، 74.4٪ ± 3.3٪. تم إثبات ثبات المنتج الملصق بالإشعاع لمدة تصل إلى 4 ساعات بعد التحضير. يوفر هذا البروتوكول منهجية موثوقة وسريعة وفعالة لإعداد [68Ga] Ga-3BP-3940 ، والتي يمكن نقلها بسهولة إلى بيئة سريرية.
Introduction
في السنوات الأخيرة ، اجتذب استهداف البيئة المكروية للورم (TME) اهتماما كبيرا بالتطبيقات التشخيصيةوالعلاجية 1. توفر وفرة أنواع الخلايا وجزيئات الإشارات والجزيئات الكبيرة خارج الخلية (ECM) داخل TME مجموعة واسعة من الأهداف الجزيئيةالمحتملة 2. من بين الخلايا المضيفة المقيمة والمتسللة ، تشكل الخلايا الليفية المرتبطة بالسرطان (CAFs) مجموعة فرعية مميزة من الخلايا الليفية داخل TME ، والتي تختلف ظاهريا عن الخلايا الليفية الطبيعية. تلعب CAFs أدوارا حاسمة في تطور الورم ، والورم الخبيث ، والتهرب المناعي ، ومقاومة العلاج من خلال الخصائص الخلوية والجزيئيةالفريدة 3. تظهر هذه الخلايا الوسيطة نمطا ظاهريا نشطا يتميز بالتعبير عن بروتين تنشيط الخلايا الليفية (FAP). جزيئيا ، تفرز CAFs مجموعة معقدة من السيتوكينات ، والكيموكينات ، وعوامل النمو (على سبيل المثال ، TGF-β و IL-6 و CXCL12) ، وبروتينات ECM (على سبيل المثال ، الكولاجين ، الفيبرونكتين) ، والتي تعيد تشكيل ECM وتعزز بيئة مؤيدة للأورام4.
باعتباره بروتين محددا للغاية يتم التعبير عنه بشكل مفرط وتوطينه على السطح خارج الخلية لغشاء CAF ، يعرض FAP جميع خصائص الهدف الجزيئي الموثوق به ، خاصة بالنسبة للطب النووي وتطبيقات المستحضرات الصيدلانية المشعة5. في هذا السياق ، تم تطوير مثبطات الجزيئات الصغيرة القائمة على الكينولين ل FAP (FAPI) ، والتي تعمل مع مجموعة DOTA ، وإدخالها بسرعة في الاستخدام السريري6،7،8. على وجه التحديد ، أظهر FAPI-04 و FAPI-46 المصنفان بالإشعاع بالغاليوم -68 (β+ باعث ، ر1/2 = 68 دقيقة) لتصوير التصوير المقطعي بالإصدار البوزيتروني (PET) قيمة كبيرة في الأمراض الليفية وأمراض القلب والأورام8،9 ، خاصة بالنسبة للسرطانات التي يكون فيها [18فهرنهايت] فلوروديوكسي جلوكوز ([18فهرنهايت] FDG) ذات فائدةمحدودة 10. ومع ذلك ، في حين أن مساهماتها في تصوير الأورام والأمراض غير الخبيثة لا يمكن إنكارها ، فإن FAPIs الجزيئية الصغيرة تظهر قيودا معينة على تطبيقات العلاج بالنويدات المشعة المستهدفة (TRT) ، لا سيما بسبب وقت إقامتها دون المستوى الأمثل داخل الورم ، والذي يمكن أن يؤدي إلى تشعيع غير مقصود للأنسجةالسليمة 11. لمعالجة هذه المشكلة ، تم استكشاف العديد من الاستراتيجيات ، مثل تصميم الروابط متعددة التكافؤ11،12 أو استخدام النويدات المشعة العلاجية ذات عمر النصفالقصير 13،14،15. كما تم تطوير سقالات جزيئية جديدة ذات تقارب عال ل FAP وتؤدي إلى نسبة عالية من استيعاب الخلايا.
واحد من هؤلاء هو مشتق الببتيد الكاذب FAP-2286. يحتوي على تسلسل من 7 أحماض أمينية ، يتم تدويره ومرتبطه بمخلب DOTA بواسطة جزء 1،3،5-benzenetrimethanethiol16. أظهرت دراسة أولية أجريت على البشر أن [68Ga] Ga-FAP-2286 يظهر ملف توزيع بيولوجي مشابه ل [68Ga] Ga-FAPI-46 ، مع امتصاص فسيولوجي أعلى قليلا في الكبد والكلى والقلب17. في هذه الدراسة ، خضع 64 مريضا ، يعانون بشكل أساسي من سرطانات الرقبة والكبد والمعدة والبنكرياس والمبيض والمريء ، لتصوير التصوير المقطعي بالإصدار البوزيتروني باستخدام [68Ga] Ga-FAP-2286 لتحديد مراحل السرطان أو الكشف عن تكراره: كان امتصاص [68Ga] Ga-FAP-2286 أعلى بشكل ملحوظ من [18فهرنهايت] FDG في الأورام الأولية ، ونقائل العقدة الليمفاوية ، والنقائل البعيدة ، مما يعزز تباين الصورة وإمكانية اكتشاف الآفة. كانت جميع الأورام الأولية مرئية مع [68Ga] Ga-FAP-2286 PET / CT ، في حين أن [18فهرنهايت] FDG PET / CT غاب عن ما يقرب من 20٪ من الآفات. بالنسبة للغدد الليمفاوية المصابة ، كانت معدلات الكشف أعلى مع [68Ga] Ga-FAP-2286 ، وكذلك بالنسبة للنقائل العظمية والحشوية. أظهرت دراسة أخرى أجريت على مجموعة أصغر من 21 مريضا يعانون من مجموعة متنوعة من أمراض السرطان أيضا الحساسية الممتازة لعامل التصوير هذا ، مما يعكس الكفاءة التشخيصية ل [68Ga] Ga-FAP-228618. ركزت دراسات أكثر تحديدا على نوع واحد من السرطان ، مثل سرطان الظهارة البولية أو سرطان الرئة ، مما يسلط الضوء مرة أخرى على الإمكانات العالية ل [68Ga] Ga-FAP-2286 للتصوير الجزيئي السريري4،5. فيما يتعلق بالعلاج ، بحثت دراسة أولية في استخدام FAP-2286 الملصق بالإشعاع مع اللوتيوم -177 (β- باعث ، ر1/2 = 6.7 د) في 11 مريضا يعانون من سرطانات تقدمية ونقيليةمتنوعة 19. تلقى معظم المرضى دورتين علاجيتين متباعدة بفارق 8 أسابيع ، وكان متوسط الجرعة المعطاة لكل دورة 5.8 ± 2.0 جيجابايت في [177لو] Lu-FAP-2286. أظهر الدواء احتفاظا طويل الأمد داخل الورم ، مع عمر نصف فعال يبلغ حوالي 44 ساعة في نقائل العظام. بالنظر إلى الآثار الجانبية المقبولة ، مهدت هذه النتائج الطريق لتجارب سريرية واسعة النطاق: يتم حاليا تقييم سلامة وفعالية [177Lu] Lu-FAP-2286 في المرحلة 1/2 تجربة LuMIERE السريرية ، برعاية Novartis (NCT04939610) 7،8. يتم توثيق بروتوكولات البحث الأصغر حجما في الأدبيات 9,20, وقد نشرت تقارير حالة متعددة 21,22,23,24,25,26, مما يدل على فعالية وتحمل ممتازة من حزب تاي راك تاي هذا.
أدت تعديلات الهيكل البسيطة التي تم إجراؤها على FAP-2286 إلى التناظرية المحسنة 3BP-3940 (الشكل 1) 27. على الرغم من أن الأدبيات العلمية حول جزيء الناقل هذا لا تزال محدودة ، فقد أجريت دراسات مبكرة لكل من تطبيقات التصوير والعلاج. يصف تقرير أولي استخدام [68Ga] Ga-3BP-3940 في 18 مريضا يعانون من سرطان نقيلي مختلف في المرحلة النهائية ويخلص إلى أن هذه المستحضرات الصيدلانية المشعة هي عامل تصوير PET مناسب ، مع التركيز على نسبة الورم إلى الخلفية الممتازة وامتصاص الكلى المنخفضجدا 28. في عمل آخر ، تلقى مريض واحد بسرطان البنكرياس مصاب بنقائل الكبد 150 ميجابايت في الدقيقة من [68Ga] Ga-3BP-3940 لتصوير التصوير المقطعي بالإصدار البوزيتروني ، مما أظهر امتصاصا مكثفا في الورم الأولي والآفات النقيلية29. تلقى نفس المريض لاحقا جرعة واحدة من 9.7 جيجابايت من [177لو] Lu-3BP-3940 لحزب تاي راك تاي. تم تحمل العلاج بشكل جيد ، مع عدم وجود تغييرات كبيرة في العلامات الحيوية أو المعايير البيولوجية. قدمت دراسة مختلفة النتائج البشرية الأولية لنهج العلاج العلاجي باستخدام 3BP-3940: تم اختيار المرضى باستخدام [68Ga] Ga-3BP-3940 التصوير المقطعي بالإصدار البوزيتروني ثم تلقوا 3BP-3940 المصنفة بنظائر مختلفة (177Lu أو 90Y أو 225Ac) ، تم إعطاؤها بمفردها أو في مجموعات جنبا إلى جنب (على سبيل المثال ، 177Lu + 225Ac) في 1-5 دورات علاج30. تضمنت النتائج مغفرة كاملة واحدة ، وأربع مغفرات جزئية ، وثلاثة أمراض مستقرة ، و 12 تطورا للمرض. كان متوسط البقاء على قيد الحياة الإجمالي للمجموعة (ن = 28) 9 أشهر من بداية حزب تاي راك تاي.

الشكل 1: التركيب الكيميائي ل [68Ga] Ga-3BP-3940. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تتضمن عملية وضع العلامات الإشعاعية 68Ga للمستحضرات الصيدلانية المشعة التجريبية مثل FAP-2286 و 3BP-3940 بشكل عام وحدة توليف لأتمتة خطوة التحضير. والجدير بالذكر أن أتمتة الطريقة تضمن متانة العملية والامتثال لممارسات التصنيع الجيدة وتقلل من تعرض المشغل للإشعاع مقارنة بطرق التحضيراليدوي 31،32،33. في كثير من الحالات ، تتوقع السلطات التنظيمية مثل هذا البروتوكول كجزء من ملف المنتجات الطبية التجريبية (IMPD) قبل تفويض مركز بتصنيع المستحضرات الصيدلانية المشعة التجريبيةالمقابلة 34. حتى الآن ، يتوفر القليل جدا من المعلومات التفصيلية حول الملصقات الراديوية الآلية 68Ga للببتيدات الكاذبة المضادة ل FAP في الأدبيات29،35،36،37،38. علاوة على ذلك ، فإن البيانات المبلغ عنها تنطبق بشكل عام فقط على نموذج معين من المركب. يمكن أن يجلب نوع مولد 68Ga المستخدم أيضا خصائص معينة ، حيث تتميز الحلول المختلفة المتاحة تجاريا بأحجام محددة من 68Ga3+ eluate في HCl (عادة 0.1 M) ، والتي يمكن أن يكون لها تأثير مباشر على ظروف وضع العلامات الراديوية الآلية.
في هذا السياق ، نقدم بروتوكولا مفصلا للوسم الإشعاعي الآلي السريع والفعال للببتيد الكاذب 3BP-3940 مع 68Ga ، باستخدام وحدة التوليف GAIA V2. يعتمد هذا المركب على استخدام مجموعة أنابيب تتكون من ثلاثة منحدرات من خمسة مشعبات لكل منها ، متصلة بمضخة تمعجية للتحكم في تدفق السوائل. كما أنه يتميز بفرن قارورة لتسخين وسط التفاعل ، والعديد من مجسات النشاط الإشعاعي ، ومستشعر ضغط لمراقبة هذه المعلمات داخل النظام. على الرغم من أنه ليس منتشرا مثل بعض الطرز الأخرى ، إلا أن هذا الآلي يستخدم بشكل روتيني في مركزنا ويتم تثبيته في عدد متزايد من المرافق31،39،40،41،42،43،44. تم استخدام مولد GALLIAD 68Ge / 68Ga في هذا العمل دون تنقية مسبقة للتصريف 68Ga. تم تصميم هذه الطريقة لتقديم حل قوي وسريع ومريح لإنتاج [68Ga] Ga-3BP-3940 ، كما تحسين الحماية من الإشعاع للمشغلين أثناء وضع العلامات الراديوية. هذا أيضا هو أول بروتوكول تحضير لهذه المستحضرات الصيدلانية المشعة يتم الإبلاغ عنه في نموذج المركب المحدد هذا ، وبهذه التفاصيل.
Protocol
ملاحظة: يتضمن هذا البروتوكول العمل مع النظائر المشعة. يجب أن يكون أي شخص يقوم بهذا الإجراء مدربا بشكل صحيح على التعامل مع المواد المشعة غير المختومة ويجب أن يحصل على موافقة من مسؤول السلامة الإشعاعية في مؤسسته. يجب وضع المركب الآلي في خلية ساخنة محمية مخصصة. يجب أيضا تنفيذ أي إجراءات يدوية تنطوي على مواد مشعة في خلية ساخنة محمية أو خلف الحماية الإشعاعية المناسبة.
1. تحضير الكواشف
ملاحظة: تم تحضير الكواشف المطلوبة للإنتاج الآلي ل [68Ga] Ga-3BP-3940 (انظر جدول المواد) في وحدة تحضير المستحضرات الصيدلانية المشعة (غرفة نظيفة GMP من الدرجة C). يمكن تحضير الكواشف بأي ترتيب وحتى 2 ساعة قبل التوليف.
- تحضير محلول عازل (أسيتات الصوديوم 0.8 م)
- الحصول على المواد الخام التالية: أسيتات الصوديوم ثلاثي هيدرات EMPROVE API Ph Eur و BP و JP و USP ، FCC ، E262.
- في حاوية معقمة (على سبيل المثال ، أنبوب الطرد المركزي الدقيق ، 5 مل) تم تحديده بشكل صحيح ، قم بوزن كتلة دقيقة من ثلاثي هيدرات أسيتات الصوديوم قريبة من 544.32 مجم باستخدام ميزان دقيق.
- باستخدام ماصة دقيقة معايرة ومخاريط معقمة، قم بإذابة أسيتات الصوديوم في حجم من الماء للحقن (WFI) قريبا من 5 مل بحيث يكون WFI كما هو موضح أدناه.
حجم WFI = (الكتلة العازلة الموزونة × 5) / 544.32 - قم بتدوير المحلول وتشغيله من خلال حمام بالموجات فوق الصوتية (40 كيلو هرتز ، ~ 1 دقيقة) لتسهيل الذوبان.
- باستخدام حقنة سعة 10 مل مزودة بإبرة 21G ، اسحب محلول العازلة. قم بتركيب مرشح 0.22 ميكرومتر بين المحقنة وإبرة جديدة ، ثم قم بتصفية المحلول العازل مباشرة في قارورة معقمة محكمة الغلق محددة بشكل صحيح (على سبيل المثال ، TC-ELU 5) بعد تطهير الحاجز.
- تحضير محلول مركب مضاد للتحلل الإشعاعي (ميثيونين 10 مجم / مل)
- الحصول على المواد الخام التالية: لام-ميثيونين (دكتوراه. اليورو., جامعة جنوب المحيط الهادئ) نقية, فارما الصف.
- في حاوية معقمة (على سبيل المثال ، أنبوب الطرد المركزي الدقيق 5 مل) تم تحديده بشكل صحيح ، قم بوزن كتلة دقيقة من L-methionine قريبة من 50 مجم باستخدام ميزان دقيق.
- باستخدام ماصة دقيقة معايرة ومخاريط معقمة ، قم بإذابة L-methionine بحجم WFI قريب من 5 مل بحيث يكون WFI كما هو موضح أدناه.
حجم WFI = (الكتلة العازلة الموزونة × 5) / 50 - قم بتدوير المحلول وتشغيله من خلال حمام بالموجات فوق الصوتية (40 كيلو هرتز ، ~ 1 دقيقة) لتسهيل الذوبان.
- باستخدام حقنة سعة 10 مل مزودة بإبرة 21G ، اسحب محلول الميثيونين. قم بتركيب مرشح 0.22 ميكرومتر بين المحقنة والإبرة الجديدة ، ثم قم بتصفية المحلول مباشرة في قارورة معقمة محكمة الغلق محددة بشكل صحيح (على سبيل المثال ، TC-ELU 5 ، Curium) بعد تطهير الحاجز.
2. إعداد المعدات لمراقبة الجودة
- التحكم في الأس الهيدروجيني للمنتج النهائي
- خلف درع واقي مناسب ، ضع شريطا من ورق الأس الهيدروجيني للفحص اللاحق للمنتج النهائي.
- التحكم في النقاء الكيميائي الإشعاعي عن طريق الراديو TLC
- إعداد خزانين للترحيل TLC يحتويان على مراحل متحركة مناسبة. المرحلة المتنقلة أ: المخزن المؤقت للسترات 0.1 M pH 4 في الماء ، مع Rf المتوقع = 0-0.2 ل [68Ga] Ga-3BP-3940 و Rf = 0.8-1 مجانا 68Ga3+. المرحلة المتنقلة ب: عازلة أسيتات الأمونيوم 1 م في خليط 1: 1 من الماء والميثانول (v / v) ، مع Rf = 0-0.2 متوقع ل [68Ga] غرويات الغاليوم و Rf = 0.8-1 ل [68Ga] Ga-3BP-3940.
- خلف درع واقي مناسب ، ضع خزاني ترحيل TLC بجوار لوحين iTLC-SG للتحكم اللاحق في RCP للمنتج النهائي.
- قم بتشغيل الكروماتوغراف الإشعاعي وافتح برنامج الاقتناء المرتبط على الكمبيوتر الذي يعمل بتشغيله. أدخل مسبقا معلومات التعريف للتحليل الأول الذي سيتم إجراؤه.
- التحكم في النقاء الكيميائي الإشعاعي بواسطة راديو HPLC
- تحقق من تثبيت نموذج العمود المطلوب للتحليل (معادلة C18 ACE) على النظام.
- قم بإعداد مرحلة متنقلة جديدة ل HPLC ، أي الماء ل HPLC + 0.1٪ TFA (المذيب A) والأسيتونيتريل + 0.1٪ TFA (المذيب B). قم بتوصيل زجاجات المذيبات A والمذيبات B بالخطوط المقابلة على الراديو HPLC.
- قم بتشغيل الكمبيوتر قيد التشغيل والاتصال ببرنامج التحكم.
- إذا لزم الأمر ، افتح صمام التطهير على وحدة المضخة وقم بتطهير الخطوط التي سيتم استخدامها للتحليل (أي الخط A والخط B). أغلق صمام التطهير بعد هذه العملية.
- اسمح للنظام بالتوازن مع نسبة من المذيبات تساوي بداية التدرج (أي 95٪ A / 5٪ B) بتدفق 0.6 مل / دقيقة لمدة 20 دقيقة على الأقل. بالنسبة لتسلسل تحليل [68Ga] Ga-3BP-3940 HPLC ، استخدم معدل التدفق المحفوظ عند 0.6 مل / دقيقة ، وقم ببرمجة تدرج الطور المتحرك من 0.1٪ TFA في الماء (A) إلى 0.1٪ TFA في الأسيتونيتريل (B) على النحو التالي: 0 - 1 دقيقة 95/5 A / B ؛ 1 - 8 دقائق تدرج خطي من 95/5 A / B إلى 60/40 A / B ؛ 8 - 9 دقائق 60/40 أ / ب ؛ 9 - 10 دقائق تدرج خطي من 60/40 A / B إلى 95/5 A / B ؛ 10 - 12 دقيقة 95/5 أ / ب.
- حدد الطريقة التحليلية مع تدرج الطور المتحرك الموضح في الخطوة 2.3.5، ثم أدخل مسبقا معلومات التعريف للتحليل الأول الذي سيتم إجراؤه.
- في حاوية محمية ، قم بإعداد قارورة HPLC مع ملحق زجاجي لتلقي العينة المراد تحليلها ووضعها خلف درع واقي مناسب.
3. إعداد وحدة التوليف
- قم بتشغيل قوة وضوء الخلية المحمية. قم بتشغيل الكمبيوتر المحمول الذي يتحكم في جهاز المزج وقم بتسجيل الدخول إلى برنامج الوحدة.
- إذا لزم الأمر ، قم بإزالة المجموعة القديمة من المركب وتخلص من النفايات في الحاويات المناسبة.
- قم بتنظيف الجزء الداخلي من الخزانة المحمية التي تحتوي على وحدة التوليف وجهاز التوليف نفسه وفقا لمعايير النظافة المعمول بها.
- في برنامج المركب، اضغط على المستخدم، ثم حدد اسم مستخدم وأدخل كلمة المرور المقترنة في النافذة المنبثقة. اضغط على الطريقة وحدد البروتوكول التلقائي الذي تم تكوينه مسبقا لتوليف [68Ga]Ga-3BP-3940.
- اضغط على التحضير وأدخل عنوان التوليف ورقم دفعة المتجه ورقم دفعة مجموعة الكاشف وأي تعليقات في مربع النص المناسب. يمكن أيضا إعداد قائمة مرجعية بخطوات إعداد المجموعة المختلفة ومتابعتها في هذه المرحلة (الشكل التكميلي 1).
4. إعداد تركيب كاسيت التوليف والكاسيت
- نظف منضدة عمل مختبر الصيدلة المشعة بمنديل ومطهر المنظفات المناسب وضع ستارة معقمة فوق طاولة العمل.
- احصل على كاسيت وضع العلامات المعقم [68Ga] Ga (المرجع RT-01-H) ومجموعة الكواشف (الشكل التكميلي 2). يتم تحديد 3 منحدرات لمجموعة الأنابيب على أنها A و B و C من اليسار إلى اليمين على الوحدة. يتم ترقيم مشعبات كل منحدر من 1 إلى 5 من أعلى إلى أسفل (المنحدرات A و C) أو من اليسار إلى اليمين (المنحدر B).
- قم بتجميع الكاسيت باتباع الخطوات أدناه.
- قم بفك غلاف كاسيت [68Ga]Ga ، وتحقق من وجود أي تلف ، وشد كل وصلة Luer على الدرج. قم بإزالة جميع أغطية السنبل.
- باستخدام حقنة Luer Lock سعة 5 مل وإبرة 21G ، ارسم 5 مل من الإيثانول المطلق من مجموعة الكاشف وقم بتمريرها ببطء شديد فوق خرطوشة C18 ، ثم ارسم 5 مل من WFI (غير متوفرة في المجموعة) وقم بتمريرها ببطء شديد فوق نفس خرطوشة C18 لتكييفها مسبقا.
- ضع منحدر الموضع A من الأنبوب الذي تم ضبطه على وحدة التوليف وأدر المزلاجين لتثبيت المنحدر في مكانه. قم بتوصيل الطرف الحر للأنبوب الرأسي A1 بإبرة 19G وأدخلها في قارورة النفايات.
- أضف إبرة تنفيس إلى قارورة النفايات وضعها للخلف ، على النحو الأمثل خلف الحاوية المحمية التي ستتلقى قارورة الإخلاء. ضع مرشح 0.22 ميكرومتر في الموضع A4.
- قم بتوصيل الأنبوب الأفقي A1 بمستشعر الضغط في الجزء السفلي الأيسر من اللوحة الأمامية للوحدة.
- باستخدام محول ذكر / ذكر ، قم بتوصيل امتداد 30 سم في وضع A5 أفقي ينتهي بمرشح طرفي 0.22 μ وإبرة 80 مم 20 جم.
- أدخل إبرة 20G المذكورة أعلاه في قارورة إخلاء محكمة الغلق ومعقمة (على سبيل المثال ، TC-ELU 5) ، وأضف إبرة تهوية وضع قارورة الإخلاء في حاويتها المحمية.
- ضع خط الأنبوب الذي يربط الرأسي A1 ب C1 الرأسي خلف خطافات التثبيت فوق المنحدر B.
- قم بتوصيل المشعبات الأفقية A2 و B1 بخط تمديد قصير (إما غير مدرج في المجموعة ، أو الخط المتصل في البداية في الموضع C5 أفقيا) ، باستخدام المحول المثبت بالفعل في الموضع A2.
- ضع المنحدر B على وحدة التوليف وأدر المزلاجين لتثبيت المنحدر في مكانه.
- قم بتوصيل خرطوشة C18 المكيفة مسبقا بالوضع الأفقي C2 ، مع الحفاظ على المحول الذي يربط الصمام B5 الأفقي ب C2 على يساره.
- ضع المنحدر C على وحدة التوليف وأدر المزلاجين لتثبيت المنحدر في مكانه.
- باستخدام محول ذكر / ذكر ، قم بتوصيل خط تمديد 50 سم من C5 الأفقي بمولد GALLIAD 68Ga.
- ضع قارورة تفاعل الزجاج الملون لمجموعة الأنابيب في فرن الوحدة. ضع الأنبوب بعناية من A5 الرأسي إلى C5 الرأسي في المضخة التمعجية ، وأغلق المضخة ، وتحقق من وضع الأنبوب بشكل صحيح ، وقم بتمرير الأنبوب عبر مستشعر النشاط على الجانب الأيسر من المضخة.
- قم بإجراء فحص وسيط للتأكد من تجميع الكاسيت والأنبوب على جهاز المزج الإشعاعي كما هو موضح في الشكل 2 ، بدون كواشف حتى الآن.
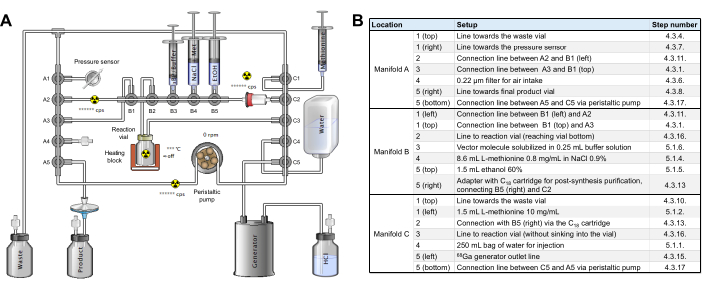
الشكل 2: تكوين وحدة التوليف. (أ) إعداد التوليف الآلي ل [68Ga] Ga-3BP-3940 على وحدة التوليف. (ب) تفاصيل عن مواضع الكاشف للإنتاج الآلي ل [68Ga] Ga-3BP-3940 باستخدام وحدة توليف GAIA. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تركيب الكواشف
- بمجرد تثبيت المنحدرات على الوحدة النمطية ، قم بتثبيت الكواشف كما هو موضح أدناه.
- قم بتوصيل كيس WFI سعة 250 مل من مجموعة الكاشف بأنبوب C4 باستخدام محول Spike ، وقم بتعليق الكيس على الخطاف المخصص على الجانب الأيمن من الوحدة.
- باستخدام حقنة Luer Lock ثلاثية القطع سعة 3 مل ومجهزة بإبرة 20G ، اسحب 1.5 مل من محلول L-methionine 10 mg / ml المعد مسبقا ، وقم بتوصيل المحقنة بأنبوب C1 الأفقي وقم بتعليق المحقنة في الفتحة المخصصة على الجانب الأيمن من الوحدة. اترك ما يقرب من 2 مل من الهواء بين سطح السائل وختم مكبس المحقنة لضمان نقل السائل بالكامل.
- باستخدام حقنة 1 مل بإبرة 20G ، اسحب 750 ميكرولتر من محلول L-methionine المحضر مسبقا 10 مجم / مل وحقنها في قارورة كلوريد الصوديوم 0.9٪ (تجعيد أزرق) من مجموعة الكاشف ، بعد تطهير الحاجز.
- باستخدام حقنة Luer Lock ثلاثية القطع سعة 10 مل بإبرة 20G ، اسحب محتويات قارورة NaCl + L-methionine 0.9٪ (تجعيد أزرق) ، واضبط على 8.6 مل ، وقم بإزالة Spike في الموضع B4 ، ثم قم بتوصيل المحقنة في B4 بدلا من ذلك. اترك ما يقرب من 2 مل من الهواء بين سطح السائل وختم مكبس المحقنة لضمان نقل السائل بالكامل.
- باستخدام حقنة Luer Lock ثلاثية القطع سعة 3 مل بإبرة 20G ، اسحب محتويات قارورة الإيثانول 60٪ (تجعيد برتقالي) بعد تطهير الحاجز. تأكد من أن مستوى الصوت يساوي 1.5 مل على الأقل ، قم بإزالة Spike في الموضع B5 ، ثم قم بتوصيل المحقنة ب B5 بدلا من ذلك. اترك ما يقرب من 2 مل من الهواء بين سطح السائل وختم مكبس المحقنة لضمان نقل السائل بالكامل.
- باستخدام حقنة منخفضة الحجم 1 مل بإبرة 20G ، اسحب 0.25 مل من محلول أسيتات الصوديوم 0.8 M المعد مسبقا وحقنها في القارورة التي تحتوي على 30 ميكروغرام من 3BP-3940 لإذابتها عن طريق دورات الحقن / إعادة الشفط المتتالية. اسحب محلول 0.25 مل في نفس المحقنة ، وافصل الإبرة ، وضع المخزن المؤقت + حقنة المتجه في B3. اترك ما يقرب من 0.25 مل من الهواء بين سطح السائل ومكبس المحقنة لضمان نقل السائل بالكامل.
- قم بإجراء فحص نهائي قبل بدء التوليف كما هو موضح أدناه.
- تحقق من أن جميع الكواشف متصلة بالكاسيت أو الأنبوب ، كما هو موضح في الشكل 3.
- تأكد من أن كل توصيلات المجموعة ضيقة بما فيه الكفاية. تأكد من عدم وجود أنبوب مضغوط أو بزاوية.
- النظام جاهز. أغلق اللوحة الأمامية وقم بتشغيل تهوية الخلية المحمية.

الشكل 3: إعداد المجموعة. التثبيت النهائي لمجموعة الأنابيب والكواشف على المركب للوسم الإشعاعي ل 3BP-3940 مع 68Ga. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
6. تسلسل الملصقات الراديوية الآلي لإنتاج [68Ga] Ga-3BP-3940
- انقر فوق تشغيل التوليف عند وضع جميع الكواشف على المنحدرات ويتم تسجيل جميع المعلومات بشكل صحيح في البرنامج.
- يظهر المظهر الجانبي النموذجي لتوزيع النشاط الإشعاعي في مجموعة الأنابيب في جميع أنحاء تسلسل التوليف في الشكل 4. اتبع الخطوات المتتالية في الطريقة التلقائية لإعداد [68Ga]Ga-3BP-3940 كما هو موضح أدناه.
- اختبارات سلامة المجموعة: بعد تطهير قصير للأنبوب باتجاه قارورة النفايات (بشكل أساسي لإزالة أي سائل متبقي في خرطوشة C18 ) ، يزيد النظام من ضغطه الداخلي عن طريق فتح A4 وضخ الهواء المصفى عبر المضخة التمعجية. بمجرد أن يكتشف مستشعر الضغط المتصل ب A1 ضغط أنبوب > 1500 ملي بار ، يغلق النظام وتتوقف المضخة التمعجية. إذا كان انخفاض الضغط لا يتجاوز 400 ملي بار على مدى 15 ثانية، فقم بتقييم اختبار سلامة المجموعة على أنه ناجح وابدأ التوليف. إذا فشل الاختبار ، اشتبه في تسرب النظام وإجهاض تسلسل التوليف.
- إضافة ناقل إلى قارورة التفاعل: تأكد من أن 3BP-3940 القابل للذوبان في محلول المخزن المؤقت يتم سحبه إلى قارورة التفاعل في حوالي 30 ثانية ، من خلال المشعب B2.
- إضافة L-methionine إلى قارورة التفاعل: تأكد من أن محلول الميثيونين الموجود في المحقنة في C1 يتم نقله إلى قارورة التفاعل عبر المشعب B2 ، المنحدر السفلي C ثم المنحدر العلوي A للتفرع عند المنحدر B بواسطة المشعب A2.
- تنشيط خرطوشة C18 باستخدام WFI: تأكد من تمرير WFI الموجود في الكيس في C4 فوق خرطوشة C18 ، وكذلك شطف المنحدرات A و B و C على المسارات المتبوعة بالمحاليل المتجهة والميثيونين. ثم يتم شطف نفس الطرق بالهواء المفلتر لضمان عدم وجود ماء في الأنبوب للخطوات اللاحقة.
- شطف المولد في قارورة التفاعل (التدخل اليدوي): لتصفية مولد GALLIAD ، قم بتدوير المقبض الأخضر أعلى المولد إلى 90 درجة إلى وضع التحميل قبل الانتظار لمدة 10-20 ثانية: هذه المرة تسمح للمولد بإعداد حجم شطف ثابت يبلغ 1.1 مل. أعد المقبض الأخضر إلى موضعه الأولي ، وانقر فوق الموجه في برنامج التحكم. ثم تقوم المضخة التمعجية بسحب 68Ga إلى قارورة التفاعل على مدى 3 دقائق. خلال هذه الفترة الزمنية ، يتم رفع درجة حرارة قارورة التفاعل تدريجيا إلى 60 درجة مئوية خلال دقيقة واحدة ، ثم إلى 90 درجة مئوية خلال دقيقتين ، للوصول إلى درجة الحرارة المحددة لخطوة الوسم الإشعاعي بسرعة أكبر.
- وضع العلامات الراديوية: تأكد من أنه في بداية خطوة وضع العلامات الراديوية ، يتم تطبيق درجة حرارة نقطة ضبط تبلغ 120 درجة مئوية لمدة 30 ثانية لتمكين التسخين السريع والفعال. تأكد من ضبط درجة حرارة نقطة الضبط بعد ذلك إلى 98 درجة مئوية لمدة دقيقتين. بسبب ارتفاع التسخين والضغط في قارورة التفاعل ، يميل بعض وسط التفاعل إلى التدفق مرة أخرى إلى الأنبوب المتصل ب B2. للحد من ذلك ، يتم ضبط تطهير الخط لمدة 10 ثوان بعد تسخين دقيقتين ؛ ثم يستمر وضع العلامات الراديوية لمدة 5.5 دقيقة تقريبا.
- الاصطياد على خرطوشة C18 : تأكد من ضخ الهواء المفلتر في وعاء التفاعل بواسطة C3. يسمح الضغط الممارس على سطح السائل لوسط التفاعل بالتدفق لأعلى عبر الأنبوب المتصل في B2 ثم إلى خرطوشة SPE. ثم يتم شطف قارورة التفاعل باستخدام WFI من الكيس في C4 ، ويتم نقل سائل الشطف هذا إلى خرطوشة SPE بنفس الطريقة. يتم شطف الخرطوشة في النهاية باستخدام WFI الطازج وشطفها بالهواء المصفى.
- شطف خرطوشة C18 والتركيبة (إضافة كلوريد الصوديوم 0.9٪ + L-ميثيونين): تحتفظ خرطوشة SPE في البداية بالمنتج الملصق بالإشعاع وأي غرويات الغاليوم وتسمح بمرور 68Ga3+ مجانا. لتصفية الخرطوشة واستعادة [68Ga] Ga-3BP-3940 في القارورة الطرفية ، تأكد من سحب الكسور المتتالية من الإيثانول 60٪ والميثيونين ~ 0.9 مجم / مل في كلوريد الصوديوم 0.9٪ (3 × 0.5 مل لكل منهما) فوق الخرطوشة للشطف. ثم يتم تمرير محتويات المحقنة بالكامل في B4 عبر خرطوشة C18 في خطوة صياغة لتحقيق تركيز نهائي للإيثانول بنسبة <10٪ في القارورة الطرفية.
- اختبار سلامة الفلتر (التدخل اليدوي): بعد توليف وإزالة القارورة الطرفية ، اتبع المطالبة التي تطلب توصيل المرشح الطرفي بقارورة النفايات وإزالة مرشح التهوية من قارورة النفايات للتحقق من سلامة المرشح الطرفي باستخدام اختبار نقطة الفقاعة. أثناء اختبار نقطة الفقاعة ، يتم ترطيب المرشح في البداية بواسطة WFI لمدة 30 ثانية. بعد تطهير الخطوط ، يزداد الضغط في النظام ببطء حتى >2500 ملي بار على مدى <2 دقيقة ، حيث يتحقق المركب من عدم وجود زيادة في الضغط على مخرج المرشح. بعد ذلك ، يزيد النظام الضغط ببطء للتحقق من نقطة الفقاعة. سيقوم المركب أخيرا بتسجيل الضغط عندما يزداد الضغط على مخرج المرشح لتحديد ضغط نقطة الفقاعة.
- في نهاية التوليف ، يقوم برنامج الآلي بإنشاء تقرير توليفي يصف مسار وضع العلامات الإشعاعية وتتبع درجات الحرارة في قارورة التفاعل ، والضغوط في النظام ، وكميات النشاط الإشعاعي المعنية (الشكل 4). كمكمل ، احسب يدويا العائد الكيميائي الإشعاعي المصحح للاضمحلال (RCY) وفقا للصيغة:
RCY =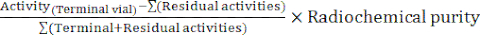
مع الأنشطة المتبقية التي تصف الأنشطة المتبقية في قارورة التفاعل ، على خرطوشة C18 ، وفي قارورة النفايات في نهاية التوليف.
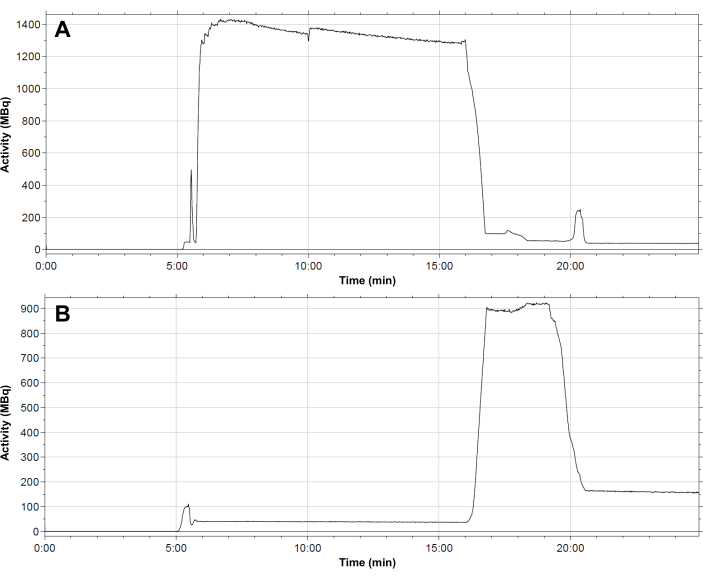
الشكل 4: ملف تعريف التوزيع النموذجي للنشاط الإشعاعي داخل الوحدة. (أ) قارورة التفاعل؛ (ب) خرطوشة C18 أثناء تخليق [68Ga] Ga-3BP-3940. يحدث تدفق 68Ga في قارورة التفاعل في 6 دقائق. يبقى النشاط في قارورة التفاعل طوال تفاعل الملصقات الإشعاعية. بعد 16 دقيقة ، يتم نقل النشاط إلى خرطوشة SPE. يتم شطف الخرطوشة بعد 19.5 دقيقة ، وبعد ذلك يبقى النشاط المتبقي حوالي 150 ميجابايت في المرحلة الثابتة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. الاستغناء ومراقبة الجودة ل [68Ga] Ga-3BP-3940
- نقل القارورة الطرفية إلى خلية محمية مناسبة لقياس النشاط الإشعاعي وإعداد جرعة المريض.
- قم بقياس نشاط القارورة الطرفية باستخدام معاير الجرعة الذي تمت معايرته بشكل صحيح وسجل المستحضر على الكمبيوتر.
- حدد القارورة بشكل صحيح وضعها في حاوية محمية مناسبة. باستخدام تقنيات التعقيم المناسبة وتقنيات الحماية من الإشعاع ، اسحب عينة ~ 0.5 مل من القارورة الطرفية لمراقبة الجودة.
- تقييم مظهر المستحضر عن طريق الفحص البصري. قم بتقييم درجة الحموضة للمستحضر عن طريق إيداع قطرة من محلول المنتج على شريط ورق الأس الهيدروجيني.
- قم بقياس النقاء الكيميائي الإشعاعي بواسطة TLC الراديوي عن طريق إيداع قطرة من محلول المنتج على كل من لوحيتي iTLC-SG المعدة مسبقا. بعد ذلك ، اسمح للألواح بالترحيل إلى المراحل المتنقلة المقابلة وقراءتها بواسطة الكروماتوغرافيا الإشعاعي. قم بدمج الكروماتوجرام الإشعاعي الناتج عن طريق قياس المنطقة الواقعة أسفل منحنى إشارة المنتج وإشارة الشوائب ، ثم احسب النقاء الكيميائي الإشعاعي وفقا للصيغة:
RCP (٪) = 100 - ٪شوائب AUC 1 - ٪شوائب AUC 2 - قم بقياس النقاء الكيميائي الإشعاعي بواسطة HPLC الراديوي عن طريق حقن ~ 50 ميكرولتر من المستحضر في قارورة HPLC المعدة مسبقا (انظر الخطوة 2.3.7). ضع القارورة في جهاز أخذ العينات التلقائي HPLC في الموضع المطلوب وابدأ تسلسل التحليل. بمجرد حقن العينة في النظام ، قم بإزالة القارورة من جهاز أخذ العينات الآلي واستبدلها في الحاوية المحمية لتقليل التشعيع. في نهاية التحليل ، قم بدمج مخطط الكروماتوماتوغرام الإشعاعي الناتج عن طريق قياس المنطقة الواقعة أسفل منحنى إشارة المنتج وإشارات الشوائب ، ثم احسب النقاء الكيميائي الإشعاعي وفقا للصيغة:
RCP (٪) = 100 - Σ (٪شوائب AUC) - تحقق من عمر النصف (عداد جاما) للنظائر المشعة الموجودة في المستحضر عن طريق إضافة ~ 5 ميكرولتر من المستحضر إلى أنبوب عداد جاما يحتوي على 1 مل من WFI. عد الأنبوب بعداد جاما 10x على التوالي (عدد 1 دقيقة لكل منهما). احسب عمر النصف بناء على الاضمحلال الإشعاعي الذي لوحظ خلال 10 قياسات.
- قم بإجراء مقايسة الهوية الراديوية المشعة على نفس العينة مثل مقايسة نصف العمر عن طريق إجراء تحليل مطياف جاما باستخدام عداد جاما ، بحثا عن قمم 511 كيلو فولت و 1077 كيلو فولت من فوتونات الإبادة.
- تقييم نقاء القلعات المشعة بعد فترة اضمحلال 48 ساعة للعينة السابقة. قم بإجراء قياس لمدة 120 دقيقة في عداد جاما ، مما يسمح بالكشف عن أي نشاط متبقي 68Ga يتكون في الموقع من اختراق 68Ge وشوائب النويدات المشعة طويلة العمر نصف العمر.
8. استقرار إعداد [68Ga] Ga-3BP-3940
- تقييم ثلاث دفعات اختبار للتأكد من ثباتها بمرور الوقت. لهذا الغرض ، اسحب ما يقرب من 200 ميكرولتر من المستحضر من القارورة الطرفية كل ساعة مباشرة بعد EoS وحتى 4 ساعات بعد التوليف.
- قم بإجراء تحليل راديو-HPLC في كل نقطة زمنية لقياس RCP بواسطة HPLC وفقا للإجراء الموضح أعلاه. إجراء تحليلات Radio-TLC في كل نقطة زمنية لقياس RCP بواسطة TLC وفقا للإجراء الموصوف سابقا.
النتائج
تسمح عملية التوليف التي تم تطويرها على وحدة GAIA بوضع العلامات الراديوية بسرعة 68Ga ل 3BP-3940 في 21-22 دقيقة. تم تصميم هذا البروتوكول للعمل مع مولد GALLIAD 68Ge / 68Ga من الدرجة الصيدلانية ، والذي ينتج 1.1 مل من 68Ga eluate في 0.1 M HCl. تم ضبط حجم وموليارتية المخزن المؤقت للتف...
Discussion
يقدم هذا العمل بروتوكول تحضير آلي متوافق مع GMP لتوليف [68Ga] Ga-3BP-3940 باستخدام وحدة GAIA ومولد GALLIAD. تم تكييف هذه الطريقة من البروتوكولات المستخدمة في مركزنا للوسم الإشعاعي بالغاليوم 68 للنواقل مثل روابط PSMA44 ومثبطات FAP الأخرى43،46
Disclosures
ليس لدى المؤلفين شراكات تجارية أو مصادر تمويل من شأنها أن تؤدي إلى تضارب حقيقي أو متصور في المصالح فيما يتعلق بهذا العمل للإفصاح عنه.
Acknowledgements
يشكر المؤلفون ياسمين سوالي وستيفان رينو وإيلودي غافن على مساعدتهم في إعداد تفاعلات الملصقات الإشعاعية المعروضة في هذه المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
References
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753 (2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68 (2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967 (2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16 (2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566 (2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821 (2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Osterkamp, F., et al. Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541 (2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452 (2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61 (2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141 (2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392 (2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4 (2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30 (2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211 (2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27 (2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824 (2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884 (2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448 (2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23 (2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034 (2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved