Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Автоматизированное получение [68Ga]Ga-3BP-3940 на модуле синтеза для ПЭТ-визуализации микроокружения опухоли
В этой статье
Резюме
В данном исследовании описывается автоматизированный процесс производства [68Ga]Ga-3BP-3940 с помощью синтезатора GAIA V2 для ПЭТ-визуализации белка активации фибробластов. Также представлены результаты контрольных испытаний, проведенных на трех тестовых партиях.
Аннотация
На модуле синтеза GAIA был разработан быстрый и эффективный метод автоматизированного радиомечения галлия-68 3BP-3940, молекулярного зонда визуализации, нацеленного на белок активации фибробластов для позитронно-эмиссионной томографической визуализации микроокружения опухоли. Условия реакции включали ацетатный буфер (конечная концентрация: 0,1 М), метионин в качестве антирадиолизного агента (конечная концентрация: 5,4 мг/мл) и 30 мкг 3BP-3940 с нагреванием в течение 8 мин при 98 °C. Заключительная стадия очистки картриджа C18 была необходима для получения продукта высокой чистоты, маркированного радиоактивными веществами. В отличие от этого, 68Ga, произведенный генератором, использовался непосредственно без ступени концентрации на катионообменном картридже. Производство трех валидационных партий подтвердило надежность метода, позволив синтезировать [68Ga]Ga-3BP-3940 за 22,3 ± 0,6 мин с высокой радиохимической чистотой (RCP), что определяется как радио-ВЭЖХ (99,1% ± 0,1%), так и радио-ТСХ (99,2% ± 0,1%). Средний радиохимический выход, основанный на значениях RCP, измеренных с помощью радио-ВЭЖХ, составил 74,4% ± 3,3%. Стабильность препарата с радиоактивной меченкой была продемонстрирована в течение 4 ч после приготовления. Этот протокол обеспечивает надежную, быструю и эффективную методологию получения [68Ga]Ga-3BP-3940, который может быть легко перенесен в клинические условия.
Введение
В последние годы воздействие на микроокружение опухоли (TME) привлекло значительный интерес в диагностических и терапевтических приложениях1. Обилие типов клеток, сигнальных молекул и макромолекул внеклеточного матрикса (ВКМ) в ТМЭ предлагает широкий спектр потенциальных молекулярных мишеней2. Среди резидентных и инфильтрирующих клеток-хозяев канцеассоциированные фибробласты (CAF) образуют отдельное подмножество фибробластов в пределах TME, фенотипически отличающееся от нормальных фибробластов. CAF играют решающую роль в прогрессировании опухоли, метастазировании, уклонении от иммунитета и резистентности к терапии благодаря уникальным клеточным и молекулярным характеристикам3. Эти мезенхимальные клетки демонстрируют активированный фенотип, характеризующийся экспрессией белка активации фибробластов (FAP). Молекулярно КАФ секретируют сложный набор цитокинов, хемокинов, факторов роста (например, TGF-β, IL-6 и CXCL12) и белков ВКМ (например, коллагена, фибронектина), которые ремоделируют ВКМ и способствуют созданию проопухолевой среды4.
Будучи высокоспецифичным белком, который сверхэкспрессируется и локализован на внеклеточной поверхности мембраны CAF, FAP обладает всеми характеристиками надежной молекулярной мишени, особенно для ядерной медицины и радиофармацевтических применений. В этом контексте были разработаны и быстро внедрены в клиническое применение низкомолекулярные ингибиторы FAP на основе хинолина (FAPI), функционализированные с группой DOTA 6,7,8. В частности, FAPI-04 и FAPI-46, меченные галлием-68 (β+ излучателем, t1/2 = 68 мин) для визуализации позитронно-эмиссионной томографии (ПЭТ), продемонстрировали значительную ценность при фиброзных заболеваниях, кардиологии и онкологии 8,9, особенно при раке, где [18F]фтордезоксиглюкоза ([18F]ФДГ) имеет ограниченную полезность10. Однако, несмотря на то, что их вклад в визуализацию онкологии и доброкачественных заболеваний неоспорим, низкомолекулярные FAPI демонстрируют определенные ограничения для применения таргетной радионуклидной терапии (TRT), в частности, из-за их неоптимального времени внутриопухолевого пребывания, что может привести к непреднамеренному облучению здоровых тканей11. Для решения этой проблемы было изучено несколько стратегий, таких как разработка поливалентных лигандов11,12 или использование терапевтических радионуклидов с коротким периодом полураспада 13,14,15. Также были разработаны новые молекулярные каркасы с высоким сродством к FAP и вызывающие высокую долю интернализации клеток.
Одним из таких является производное псевдопептида FAP-2286. Он содержит последовательность из 7 аминокислот, циклизованную и связанную с хелатором DOTA 1,3,5-бензолтриметиоловым фрагментом16. Первоначальное исследование на людях показало, что [68Ga]Ga-FAP-2286 демонстрирует профиль биораспределения, аналогичный [68Ga]Ga-FAPI-46, с несколько более высоким физиологическим поглощением в печени, почках и сердце. В этом исследовании 64 пациентам, в основном с раком шеи, печени, желудка, поджелудочной железы, яичников и пищевода, проводилась ПЭТ-визуализация с использованием [68Ga]Ga-FAP-2286 для определения стадии рака или выявления рецидива: поглощение [68Ga]Ga-FAP-2286 было заметно выше, чем [18F]FDG в первичных опухолях, метастазах в лимфатических узлах и отдаленных метастазах, что улучшало контрастность изображения и обнаруживаемость поражений. Все первичные опухоли были видны при ПЭТ/КТ с [68Ga]Ga-FAP-2286, в то время как ПЭТ/КТ с [18F]FDG пропустила почти 20% поражений. Для пораженных лимфатических узлов частота обнаружения была выше при использовании [68Ga]Ga-FAP-2286, а также для костных и висцеральных метастазов. Другое исследование в небольшой группе из 21 пациента с различными онкологическими заболеваниями также продемонстрировало превосходную чувствительность этого средства визуализации, отражая диагностическую эффективность [68Ga]Ga-FAP-228618. Более конкретные исследования были сосредоточены на одном типе рака, таком как уротелиальный рак или рак легких, что еще раз подчеркивает высокий потенциал [68Ga]Ga-FAP-2286 для клинической молекулярной визуализации 4,5. Что касается терапии, в предварительном исследовании изучалось использование FAP-2286, меченного лютецием-177 (β-эмиттер, t1/2 = 6,7 d) у11 пациентов с различными прогрессирующими метастатическими опухолями. Большинство пациентов получали два цикла лечения с интервалом в 8 недель, а средняя вводимая доза за цикл составляла 5,8 ± 2,0 ГБк [177]Lu-FAP-2286. Препарат продемонстрировал длительную внутриопухолевую ретенцию с эффективным периодом полувыведения около 44 ч в метастазах в кости. Учитывая приемлемые побочные эффекты, эти результаты проложили путь к более масштабным клиническим испытаниям: безопасность и эффективность [177Lu]Lu-FAP-2286 в настоящее время оцениваются в клиническом исследовании фазы 1/2 LuMIERE, спонсируемом компанией Novartis (NCT04939610)7,8. Дальнейшие протоколы исследований меньшего масштаба задокументированы в литературе 9,20, а также опубликованы многочисленные клинические случаи 21,22,23,24,25,26, демонстрирующие эффективность и отличную переносимость этой ЗГТ.
Минимальные конструктивные изменения, произведенные на ФАП-2286, привели к созданию оптимизированного аналога 3ВР-3940 (рис. 1)27. Хотя научная литература по этой векторной молекуле остается ограниченной, ранние исследования проводились как для визуализации, так и для терапевтических применений. В предварительном отчете описывается использование [68Ga]Ga-3BP-3940 у 18 пациентов с различными метастатическими карциномами терминальной стадии и делается вывод о том, что этот радиофармпрепарат является подходящим средством для визуализации ПЭТ, подчеркивая его отличное отношение опухоли к фону и оченьнизкое поглощение почками. В другой работе один пациент с раком поджелудочной железы с метастазами в печень получил 150 МБк [68Ga]Ga-3BP-3940 для ПЭТ-визуализации, что продемонстрировало интенсивное поглощение в первичной опухоли и метастатических поражениях29. Тот же пациент впоследствии получил однократную дозу 9,7 GBq [177Lu]Lu-3BP-3940 для TRT. Лечение хорошо переносилось, без существенных изменений в жизненных показателях и биологических параметрах. В другом исследовании были представлены первоначальные результаты тераностического подхода с использованием 3BP-3940 на людях: пациенты были отобраны с помощью ПЭТ-визуализации [68Ga]Ga-3BP-3940, а затем получили 3BP-3940, меченный различными изотопами (177Lu, 90Y или 225Ac), вводимые отдельно или в тандемных комбинациях ( например, 177Lu + 225Ac) в течение 1-5 циклов лечения30. Исходы включали одну полную ремиссию, четыре частичные ремиссии, три стабильных заболевания и 12 прогрессирующих заболеваний. Медиана общей выживаемости когорты (n = 28) составила 9 месяцев от начала ЗГТ.

Рисунок 1: Химическая структура [68Ga]Ga-3BP-3940. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Процесс радиомечения 68млрд лет для экспериментальных радиофармацевтических препаратов, таких как FAP-2286 и 3BP-3940, обычно включает в себя модуль синтеза для автоматизации стадии подготовки. Следует отметить, что автоматизация метода обеспечивает надежность технологического процесса и соответствие требованиям GMP, а также минимизирует лучевую нагрузку на оператора по сравнению с ручными методами подготовки 31,32,33. Во многих случаях регулирующие органы ожидают, что такой протокол будет включен в состав досье на исследуемый лекарственный препарат (IMPD) до выдачи разрешения центру на производство соответствующего экспериментального радиофармпрепарата34. На сегодняшний день в литературе 29,35,36,37,38 имеется очень мало подробной информации об автоматизированном радиомечении 68Ga анти-FAP псевдопептидов. Более того, приведенные данные, как правило, относятся только к данной модели синтезатора. Тип используемого генератора 68Ga также может иметь определенную специфику, поскольку различные коммерчески доступные решения характеризуются определенными объемами элюата 68Ga3+ в HCl (обычно 0,1 М), что может оказывать непосредственное влияние на условия автоматизированного радиоактивного мечения.
В этом контексте мы представляем подробный протокол для быстрого и эффективного автоматизированного радиомечения псевдопептида 3BP-3940 с 68Ga, с использованием модуля синтеза GAIA V2. Этот синтезатор основан на использовании набора трубок, состоящего из трех рамп по пять коллекторов каждая, соединенных с перистальтическим насосом для управления потоком жидкости. Он также оснащен печью для нагрева реакционной среды, несколькими зондами радиоактивности и датчиком давления для контроля этих параметров в системе. Несмотря на то, что этот автомат не так широко распространен, как некоторые другие модели, он регулярно используется в нашем центре и устанавливается во все большем числе объектов 31,39,40,41,42,43,44. В этой работе использовался генератор GALLIAD 68Ge/68Ga без предварительной очистки элюата 68Ga. Этот метод разработан для того, чтобы предложить надежное, быстрое и удобное решение для производства [68Ga]Ga-3BP-3940, а также оптимизировать радиационную защиту операторов во время радиоактивного мечения. Это также первый протокол подготовки данного радиофармпрепарата, о котором сообщается на этой конкретной модели синтезатора, причем с такой подробностью.
протокол
ПРИМЕЧАНИЕ: Этот протокол предполагает работу с радиоизотопами. Любой, кто проводит эту процедуру, должен быть должным образом обучен обращению с незапечатанными радиоактивными материалами и должен получить одобрение от сотрудника по радиационной безопасности своего учреждения. Автоматизированный синтезатор должен быть помещен в специальную экранированную горячую камеру. Любые ручные процедуры, связанные с радиоактивными материалами, также должны выполняться в экранированной горячей камере или за соответствующей радиационной защитой.
1. Приготовление реагентов
ПРИМЕЧАНИЕ: Реагенты, необходимые для автоматизированного производства [68Ga]Ga-3BP-3940 (см. Таблицу материалов), были приготовлены в установке подготовки радиофармацевтических препаратов (чистое помещение класса C по стандарту GMP). Реагенты могут быть приготовлены в любом порядке и за 2 ч до синтеза.
- Приготовление буферного раствора (натрия ацетата 0,8 М)
- Приобретите следующее сырье: тригидрат ацетата натрия EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- В стерильном контейнере (например, микроцентрифужной пробирке, 5 мл), правильно идентифицированном, взвесьте с помощью прецизионных весов точную массу тригидрата ацетата натрия, близкую к 544,32 мг.
- С помощью калиброванной микропипетки и стерильных конусов растворите ацетат натрия в объеме воды для инъекций (WFI), близком к 5 мл так, чтобы WFI был таким, как описано ниже.
Объем WFI = (взвешенная масса буфера x 5)/544,32 - Сделайте раствор вихревым и пропустите его через ультразвуковую ванну (40 кГц, ~ 1 минута) для облегчения солюбилизации.
- С помощью шприца объемом 10 мл, оснащенного иглой 21G, извлеките буферный раствор. Установите фильтр 0,22 мкм между шприцем и новой иглой, затем отфильтруйте буферный раствор непосредственно в правильно идентифицированный стерильный герметичный флакон (например, TC-ELU 5) после дезинфекции его перегородки.
- Приготовление раствора антирадиолизного соединения (метионин 10 мг/мл)
- Приобретите следующее сырье: L-метионин (Ph. Eur., USP) чистый, фармацевтического качества.
- В правильно идентифицированном стерильном контейнере (например, микроцентрифужной пробирке объемом 5 мл) взвесьте точную массу L-метионина, близкую к 50 мг, с помощью прецизионных весов.
- Используя калиброванную микропипетку и стерильные конусы, солюбилизируйте L-метионин в объеме WFI, близком к 5 мл, чтобы WFI был таким, как описано ниже.
Объем WFI = (взвешенная масса буфера x 5)/50 - Сделайте раствор вихревым и пропустите его через ультразвуковую ванну (40 кГц, ~ 1 минута) для облегчения солюбилизации.
- С помощью шприца объемом 10 мл, оснащенного иглой 21G, извлеките раствор метионина. Установите фильтр длиной 0,22 мкм между шприцем и новой иглой, затем отфильтруйте раствор непосредственно в правильно идентифицированный стерильный герметичный флакон (например, TC-ELU 5, Curium) после дезинфекции его перегородки.
2. Подготовка оборудования к контролю качества
- Контроль pH конечного продукта
- За соответствующим защитным экраном расположите полоску бумаги pH для последующей проверки конечного продукта.
- Контроль радиохимической чистоты с помощью радио-ТСХ
- Подготовьте два резервуара для миграции TLC, содержащие соответствующие мобильные фазы. Подвижная фаза А: цитратный буфер 0,1 М pH 4 в воде, с ожидаемым Rf = 0-0,2 для [68Ga]Ga-3BP-3940 и Rf = 0,8-1 для свободного 68Ga3+. Подвижная фаза В: буфер из ацетата аммония 1 М в смеси воды и метанола (v/v) в соотношении 1:1, с ожидаемым Rf = 0-0,2 для коллоидов [68Ga]галлия и Rf = 0,8-1 для [68Ga]Ga-3BP-3940.
- За соответствующим защитным экраном расположите два миграционных резервуара TLC рядом с двумя пластинами iTLC-SG для последующего контроля RCP конечного продукта.
- Включите радиохроматограф и откройте соответствующее программное обеспечение для сбора данных на рабочем компьютере. Предварительно введите идентификационную информацию для выполнения первого анализа.
- Контроль радиохимической чистоты с помощью радио-ВЭЖХ
- Убедитесь, что в системе установлена модель колонны, необходимая для анализа (эквивалентность C18 ACE).
- Приготовьте свежую подвижную фазу для ВЭЖХ, т.е. воду для ВЭЖХ + 0,1% ТФК (растворитель А) и ацетонитрил + 0,1% ТЖК (растворитель В). Подключите флаконы с растворителем А и растворителем В к соответствующим линиям на радио-ВЭЖХ.
- Включите рабочий компьютер и подключитесь к управляющему программному обеспечению.
- При необходимости откройте клапан продувки на насосном модуле и продуйте трубопроводы, которые будут использоваться для анализа (т.е. линию А и линию В). После этой операции закройте клапан продувки.
- Дайте системе уравновеситься с пропорцией растворителя, равной начальному градиенту (т.е. 95% А/5% В) с расходом 0,6 мл/мин в течение не менее 20 минут. Для последовательности анализа ВЭЖХ [68Ga]Ga-3BP-3940 используйте скорость потока, поддерживаемую на уровне 0,6 мл/мин, и запрограммируйте подвижный фазовый градиент от 0,1% TFA в воде (A) до 0,1% TFA в ацетонитриле (B) следующим образом: 0 - 1 min 95/5 A/B; 1 - 8 мин линейный градиент от 95/5 A/B до 60/40 A/B; 8 - 9 мин 60/40 А/Б; 9 - 10 мин линейный градиент от 60/40 А/Б до 95/5 А/В; 10 - 12 мин 95/5 А/Б.
- Выберите аналитический метод с подвижным фазовым градиентом, описанным в шаге 2.3.5., затем предварительно введите идентификационную информацию для первого анализа, который будет выполнен.
- В экранированном контейнере подготовьте флакон с ВЭЖХ со стеклянной вставкой для приема анализируемого образца и расположите его за соответствующим защитным экраном.
3. Подготовка модуля синтеза
- Включите питание и свет экранированной ячейки. Включите ноутбук с управлением синтезатором и войдите в программное обеспечение модуля.
- При необходимости извлеките старый комплект из синтезатора и утилизируйте отходы в соответствующие контейнеры.
- Выполните очистку внутренней части экранированного корпуса, в котором находится модуль синтеза, и самого синтезатора в соответствии с действующими гигиеническими нормами.
- В программном обеспечении синтезатора нажмите User, затем выберите имя пользователя и введите соответствующий пароль во всплывающем окне. Нажмите Method (Метод ) и выберите автоматизированный протокол, ранее настроенный для синтеза [68Ga]Ga-3BP-3940.
- Нажмите кнопку «Подготовка» и введите название синтеза, номер партии вектора, номер партии набора реагентов и любые комментарии в соответствующее текстовое поле. На этом этапе также можно составить контрольный список с различными этапами подготовки набора, которому можно следовать (дополнительный рисунок 1).
4. Подготовка кассеты синтеза и кассетной установки
- Очистите верстак лаборатории радиоаптеки салфеткой и соответствующим моющим дезинфицирующим средством и накройте его стерильной простыней.
- Приобретите стерильную кассету для мечения [68Ga]Ga (артикул RT-01-H) и набор реагентов (дополнительный рисунок 2). 3 пандуса набора трубок обозначены как A, B и C слева направо на модуле; многообразия каждой рампы нумеруются от 1 до 5 сверху вниз (рампы А и С) или слева направо (рампы В).
- Соберите кассету, выполнив следующие действия.
- Разверните конверт кассеты [68Ga]Ga, проверьте наличие повреждений и затяните каждое соединение Люэра на кассете. Снимите все колпачки с шипами.
- Используя шприц Luer Lock объемом 5 мл и иглу 21G, наберите 5 мл абсолюта этанола из набора реагентов и очень медленно пропустите его через картридж C18 , затем наберите 5 мл WFI (не входит в комплект) и очень медленно проведите его через тот же картридж C18 для предварительного кондиционирования.
- Установите рампу A из трубки, установленной на модуле синтеза, и поверните две защелки, чтобы удержать рампу на месте. Подсоедините свободный конец вертикальной трубки A1 к игле 19G и вставьте ее в пробирку для отходов.
- Добавьте вентиляционную иглу к флакону с отходами и расположите ее назад, оптимально позади экранированного контейнера, в который будет входить флакон для эвакуации. Поместите фильтр 0,22 мкм в положение A4.
- Подсоедините горизонтальную трубку A1 к датчику давления в левом нижнем углу передней панели модуля.
- С помощью адаптера типа «вилка/вилка» подсоедините в горизонтальном положении A5 удлинитель длиной 30 см, заканчивающийся фильтром μ 0,22 и иглой 20G диаметром 80 мм.
- Вставьте вышеупомянутую иглу 20G в герметичный стерильный флакон для эвакуации (например, TC-ELU 5), добавьте иглу для аэрации и поместите флакон для эвакуации в экранированный контейнер.
- Поместите трубку, соединяющую вертикаль A1 с вертикалью C1, за удерживающие крючки над рампой B.
- Подключите горизонтальные коллекторы А2 и В1 с короткой удлинительной линией (либо не входящей в комплект, либо изначально подключенной в положении С5 горизонтальной), используя уже установленный в положении А2 адаптер.
- Установите рампу B на модуле синтеза и поверните две защелки, чтобы удержать рампу на месте.
- Подсоедините предварительно подготовленный картридж C18 в горизонтальное положение C2, держа адаптер, соединяющий горизонтальный клапан B5 с C2, слева от него.
- Установите рампу C на модуль синтеза и поверните две защелки, чтобы удержать рампу на месте.
- С помощью адаптера папа/вилка подключите удлинительную линию длиной 50 см от горизонтальной C5 к генератору GALLIAD 68Ga.
- Поместите витражный флакон из набора трубок в духовку модуля. Осторожно поместите трубку от вертикального A5 к вертикальному C5 в перистальтический насос, закройте насос, убедившись, что трубка расположена правильно, и пропустите трубку через датчик активности с левой стороны насоса.
- Выполните промежуточную проверку, чтобы убедиться, что кассета и трубка собраны на радиосинтезаторе, как показано на рисунке 2, еще без реагентов.
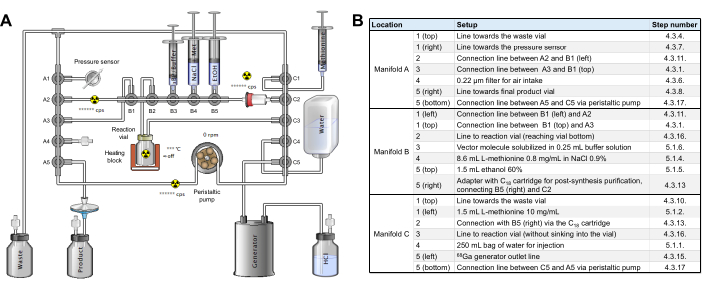
Рисунок 2: Конфигурация модуля синтеза. (A) Настройка для автоматического синтеза [68Ga]Ga-3BP-3940 в модуле синтеза. (B) Подробная информация о позициях реагентов для автоматизированного производства [68Ga]Ga-3BP-3940 с использованием модуля синтеза GAIA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Установка реагентов
- После установки пандусов на модуль установите реагенты, как описано ниже.
- Подсоедините пакет WFI объемом 250 мл из набора реагентов к трубке C4 с помощью адаптера Spike и повесьте мешок на специальный крючок с правой стороны модуля.
- С помощью трехкомпонентного шприца Luer Lock объемом 3 мл, оснащенного иглой 20G, извлеките 1,5 мл ранее приготовленного раствора L-метионина 10 мг/мл, подсоедините шприц к горизонтальной трубке С1 и подвесьте шприц в специальный слот с правой стороны модуля. Оставьте примерно 2 мл воздуха между поверхностью жидкости и уплотнением поршня шприца, чтобы обеспечить полный перенос жидкости.
- С помощью шприца объемом 1 мл с иглой 20G извлеките 750 мкл ранее приготовленного раствора L-метионина 10 мг/мл и введите в 0,9% флакон NaCl (синий обжим) из набора реагентов, после дезинфекции перегородки.
- С помощью трехкомпонентного шприца Luer Lock объемом 10 мл с иглой 20G извлеките содержимое флакона 0,9% NaCl + L-метионина (синий обжим), отрегулируйте до 8,6 мл, снимите Spike в положении B4, затем подсоедините вместо него шприц в B4. Оставьте примерно 2 мл воздуха между поверхностью жидкости и уплотнением поршня шприца, чтобы обеспечить полный перенос жидкости.
- С помощью трехкомпонентного шприца Luer Lock объемом 3 мл с иглой 20G извлеките содержимое флакона с 60% этанолом (оранжевый обжим) после дезинфекции перегородки. Убедитесь, что объем равен не менее 1,5 мл, снимите шип в положении B5, затем подсоедините шприц к B5. Оставьте примерно 2 мл воздуха между поверхностью жидкости и уплотнением поршня шприца, чтобы обеспечить полный перенос жидкости.
- С помощью шприца малого мертвого объема объемом 1 мл с иглой 20G извлеките 0,25 мл из ранее приготовленного буферного раствора 0,8 М ацетата натрия и введите во флакон, содержащий 30 мкг 3BP-3940, для его растворения путем последовательных циклов инъекций/повторных аспираций. Наберите 0,25 мл раствора в тот же шприц, отсоедините иглу и поместите буфер + векторный шприц в В3. Оставьте примерно 0,25 мл воздуха между поверхностью жидкости и поршенем шприца, чтобы обеспечить полный перенос жидкости.
- Проведите окончательную проверку перед началом синтеза, как описано ниже.
- Убедитесь, что все реагенты подключены к кассете или трубке, как показано на рисунке 3.
- Убедитесь, что каждое из соединений комплекта достаточно плотно. Убедитесь, что трубки не зажаты и не наклонены.
- Система готова. Закройте переднюю панель и включите вентиляцию экранированной камеры.

Рисунок 3: Настройка комплекта. Окончательная установка набора трубок и реагентов на синтезатор для радиоактивного мечения 3BP-3940 с 68Ga. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Автоматизированная последовательность радиоактивного мечения для производства [68Ga]Ga-3BP-3940
- Нажмите кнопку «Запустить синтез», когда все реагенты будут размещены на пандусах и вся информация будет корректно записана в программном обеспечении.
- Типичный профиль распределения радиоактивности в наборе трубок по всей последовательности синтеза показан в Рисунок 4. Следуйте последовательным шагам автоматизированного метода подготовки [68Ga]Ga-3BP-3940, как описано ниже.
- Проверка целостности комплекта: после короткой продувки трубки по направлению к пробирке с отходами (в основном для удаления остатков жидкости в картридже C18 ) система увеличивает свое внутреннее давление, открывая A4 и нагнетая отфильтрованный воздух через перистальтический насос. Как только датчик давления, подключенный к A1, обнаруживает давление в трубке > 1500 мбар, система замыкается, а перистальтический насос останавливается. Если перепад давления не превышает 400 мбар в течение 15 с, оцените испытание на целостность комплекта как успешное и начните синтез. Если тест не пройден, заподозрите утечку в системе и прервите последовательность синтеза.
- Добавление вектора в реакционный флакон: Убедитесь, что растворенный в буферном растворе 3BP-3940 втягивается в реакционный флакон примерно за 30 с через коллектор B2.
- Добавление L-метионина в реакционный флакон: Убедитесь, что раствор метионина, содержащийся в шприце в С1, переносится в реакционный флакон через коллектор В2, вниз по рампе С, а затем вверх по рампе А для ответвления на рампе В с помощью коллектора А2.
- Активация картриджа C18 с помощью WFI: Убедитесь, что WFI, содержащийся в пакете в точке C4, пропускается через картридж C18 , а также промывайте рампы A, B и C на путях, за которыми следуют растворы вектора и метионина. Затем те же маршруты промываются отфильтрованным воздухом, чтобы гарантировать, что в трубке не останется воды для последующих этапов.
- Элюирование генератора в реакционном флаконе (ручное вмешательство): Чтобы элюировать генератор GALLIAD, поверните зеленую ручку в верхней части генератора на 90° в положение загрузки, прежде чем подождать 10-20 секунд: это время позволяет генератору подготовить фиксированный объем элюата в размере 1,1 мл. Верните зеленую ручку в исходное положение и нажмите на суфлер в программном обеспечении управления. Затем перистальтический насос втягивает элюат 68Ga в реакционный флакон в течение 3 минут. В течение этого временного интервала температуру реакционного флакона постепенно повышают до 60 °C в течение 1 мин, а затем до 90 °C в течение 2 мин, чтобы быстрее достичь заданной температуры для этапа радиоактивного мечения.
- Радиоактивное мечение: Убедитесь, что в начале этапа радиоактивного мечения заданное значение температуры 120 °C применяется в течение 30 с, чтобы обеспечить быстрый и эффективный нагрев. Убедитесь, что заданное значение температуры отрегулировано до 98 °C в течение 2 минут. Из-за нагрева и повышения давления в реакционной пробирке часть реакционной среды имеет тенденцию течь обратно в трубку, соединенную с B2. Чтобы ограничить это, устанавливается 10-секундная продувка линии после 2-минутного нагрева; Затем радиоактивное мечение продолжается в течение примерно 5,5 минут.
- Захват на картридже C18 : Убедитесь, что отфильтрованный воздух закачивается в реакционный сосуд с помощью C3. Давление, оказываемое на поверхность жидкости, позволяет реакционной среде течь вверх по трубке, соединенной в точке B2, а затем к картриджу SPE. Затем реакционный флакон промывают WFI из мешка в точке C4, и эта жидкость для ополаскивания таким же образом передается в картридж SPE. В конечном итоге картридж промывается свежим WFI и промывается фильтрованным воздухом.
- Элюирование картриджа C18 и рецептуры (добавление NaCl 0,9% + L-метионина): Картридж SPE первоначально сохраняет меченый радиоактивным продуктом и любые коллоиды галлия и пропускает свободный 68Ga3+ . Чтобы элюировать картридж и извлечь [68Ga]Ga-3BP-3940 в концевом флаконе, убедитесь, что последовательные фракции этанола 60% и метионина ~0,9 мг/мл в NaCl 0,9% (3x 0,5 мл каждая) наносятся на картридж для элюирования. Затем все содержимое шприца в точке В4 пропускают через картридж С18 на стадии составления рецептуры для достижения конечной концентрации этанола в концевом флаконе в <10%.
- Проверка целостности фильтра (ручное вмешательство): После синтеза и удаления концевой пробирки следуйте подсказке с просьбой подключить клеммный фильтр к пробирке для отходов и снять вентиляционный фильтр с пробирки для отходов, чтобы проверить целостность клеммного фильтра с помощью теста на температуру пузырька. Во время испытания точки образования пузырьков фильтр первоначально смачивается WFI в течение 30 с. После продувки линий давление в системе медленно увеличивается до >2500 мбар в течение <2 мин, в течение которых синтезатор проверяет отсутствие повышения давления на выходе фильтра. Затем система медленно увеличивает давление, чтобы проверить точку пузырька. Синтезатор окончательно зарегистрирует давление при повышении давления на выходе фильтра, чтобы определить давление в точке образования пузырьков.
- В конце синтеза программное обеспечение автомата генерирует отчет о синтезе, описывающий ход радиоактивного мечения и отслеживающий температуру в реакционном флаконе, давление в системе и количество задействованной радиоактивности (рис. 4). В качестве дополнения вручную рассчитайте скорректированный на распад радиохимический выход (RCY) по формуле:
RCY =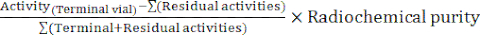
с остаточными активностями, описывающими активности, остающиеся в реакционной пробирке, на картридже C18 и в отработанной пробирке в конце синтеза.
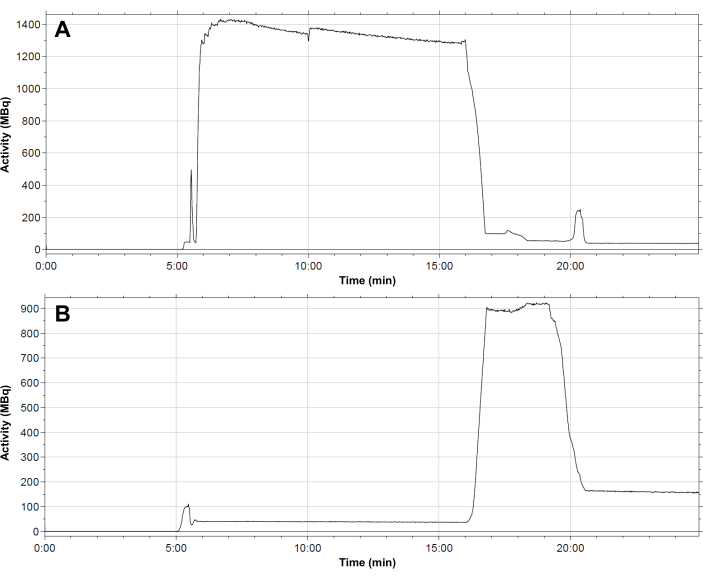
Рисунок 4: Типичный профиль распределения радиоактивности в модуле. (A) реакционный флакон; (B) Картридж C18 во время синтеза [68Ga]Ga-3BP-3940. Поступление элюата 68Ga в реакционную пробирку происходит через 6 мин. Активность сохраняется в реакционном флаконе на протяжении всей реакции радиоактивного мечения. Через 16 минут активность переносится на картридж SPE. Картридж элюируется через 19,5 мин, после чего остаточная активность в размере около 150 МБк остается на неподвижной фазе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
7. Дозирование и контроль качества [68Ga]Ga-3BP-3940
- Перенесите концевой флакон в соответствующую экранированную ячейку для измерения радиоактивности и подготовки дозы для пациента.
- Измерьте активность концевого флакона правильно откалиброванным калибратором дозы и запишите препарат на компьютер.
- Правильно определите флакон и поместите его в соответствующий экранированный контейнер. Используя соответствующие методы асептики и радиационной защиты, извлеките образец объемом ~0,5 мл из конечного флакона для контроля качества.
- Оцените внешний вид препарата при визуальном осмотре. Оцените pH препарата, нанеся каплю раствора продукта на полоску бумаги pH.
- Измерьте радиохимическую чистоту с помощью радио-TLC, нанеся каплю раствора продукта на каждую из двух предварительно подготовленных пластин iTLC-SG. Затем дайте пластинам мигрировать в соответствующие подвижные фазы и считайте с помощью радиохроматографа. Интегрируйте полученную радиохроматограмму, измерив площадь под кривой сигнала продукта и сигнала примеси, затем рассчитайте радиохимическую чистоту по формуле:
RCP (%) = 100 - %AUCпримесь 1 - %AUCпримесь 2 - Измерьте радиохимическую чистоту с помощью радио-ВЭЖХ, введя ~50 мкл препарата в заранее приготовленный флакон для ВЭЖХ (см. шаг 2.3.7). Поместите флакон в автоподатчик ВЭЖХ в нужное положение и начните последовательность анализа. После того, как образец был введен в систему, извлеките флакон из автосамплера и установите его на место в экранированном контейнере, чтобы свести к минимуму облучение. В конце анализа интегрируют полученную радиохроматограмму, измеряя площадь под кривой сигнала продукта и сигналов примесей, затем рассчитывают радиохимическую чистоту по формуле:
RCP (%) = 100 - Σ(% AUCпримесей) - Проверьте период полувыведения (гамма-счетчик) радиоизотопа, содержащегося в препарате, добавив ~5 мкл препарата в гамма-контр-пробирку, содержащую 1 мл WFI. Посчитайте трубку со счетчиком гамма-излучения 10 раз подряд (отсчет по 1 минуте каждая). Рассчитайте период полураспада на основе радиоактивного распада, наблюдаемого в течение 10 измерений.
- Проведите анализ радионуклидной идентичности на том же образце, что и анализ периода полураспада, проведя гамма-спектрометрический анализ с использованием гамма-счетчика, ища пики 511 кэВ и 1077 кэВ от фотонов аннигиляции.
- Оцените радионуклидную чистоту после 48-часового периода распада предыдущей пробы. Выполнение измерения в гамма-счетчике в течение 120 минут, позволяющее обнаружить любую остаточную активность 68Ga, образовавшуюся in situ от прорыва 68Ge и других радионуклидных примесей с длительным периодом полураспада.
8. Стабильность препарата [68Ga]Ga-3BP-3940
- Оцените три тестовые партии на стабильность с течением времени. Для этого следует извлекать примерно 200 мкл препарата из концевого флакона каждый час сразу после EoS и в течение 4 ч после синтеза.
- Выполняйте анализ радио-ВЭЖХ в каждый момент времени для измерения RCP by HPLC в соответствии с процедурой, описанной выше. Выполняйте анализ Radio-TLC в каждой временной точке для измерения RCP за TLC в соответствии с описанной ранее процедурой.
Результаты
Процесс синтеза, разработанный на модуле GAIA, позволяет быстро мечать 3BP-3940 методом 68млрд лет за 21-22 минуты. Данный протокол был разработан для работы с фармацевтическим генератором GALLIAD класса 68Ge/68Ga, который производит 1,1 мл элюата 68Ga в 0,1 М HCl. Объ?...
Обсуждение
В данной работе представлен соответствующий требованиям GMP протокол автоматизированной подготовки синтеза [68Ga]Ga-3BP-3940 с использованием модуля GAIA и генератора GALLIAD. Этот метод был адаптирован из протоколов, используемых в нашем центре радиоактивного мечения гал?...
Раскрытие информации
Авторы не имеют коммерческих партнерств или источников финансирования, которые могли бы привести к реальному или предполагаемому конфликту интересов, связанных с этой работой.
Благодарности
Авторы благодарят Ясмин Суали, Стефана Рено и Элоди Гавен за их помощь в подготовке реакций радиоактивного мечения, представленных в данной рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
Ссылки
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753 (2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68 (2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967 (2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16 (2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566 (2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821 (2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Osterkamp, F., et al. Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541 (2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452 (2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61 (2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141 (2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392 (2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4 (2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30 (2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211 (2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27 (2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824 (2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884 (2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448 (2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23 (2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034 (2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены