Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Automatisierte Präparation von [68Ga]Ga-3BP-3940 auf einem Synthesemodul für die PET-Bildgebung der Tumormikroumgebung
In diesem Artikel
Zusammenfassung
Diese Arbeit beschreibt den automatisierten Prozess zur Herstellung von [68Ga]Ga-3BP-3940 mit dem GAIA V2-Synthesizer für die PET-Bildgebung von Fibroblasten-Aktivierungsproteinen. Die Ergebnisse von Qualitätskontrolltests, die an drei Testchargen durchgeführt wurden, werden ebenfalls vorgestellt.
Zusammenfassung
Auf dem GAIA-Synthesemodul wurde eine schnelle, effiziente Methode für die automatisierte Gallium-68-Radiomarkierung von 3BP-3940 entwickelt, einer molekularen Bildgebungssonde, die auf das Fibroblasten-Aktivierungsprotein für die Positronen-Emissions-Tomographie-Bildgebung der Tumormikroumgebung abzielt. Die Reaktionsbedingungen umfassten Acetatpuffer (Endkonzentration: 0,1 M), Methionin als Antiradiolysemittel (Endkonzentration: 5,4 mg/ml) und 30 μg 3BP-3940 mit 8-minütiger Erhitzung bei 98 °C. Ein letzter Reinigungsschritt an einer C18-Kartusche war notwendig, um ein radioaktiv markiertes Produkt von hoher Reinheit zu erhalten. Im Gegensatz dazu wurde das generatorproduzierte 68Ga direkt ohne Konzentrationsschritt an einer Kationenaustauschpatrone eingesetzt. Die Herstellung von drei Validierungschargen bestätigte die Zuverlässigkeit der Methode und ermöglichte die Synthese von [68Ga]Ga-3BP-3940 in 22,3 ± 0,6 min mit hoher radiochemischer Reinheit (RCP), die sowohl durch Radio-HPLC (99,1 % ± 0,1 %) als auch durch Radio-TLC (99,2 % ± 0,1 %) bestimmt wurde. Die durchschnittliche radiochemische Ausbeute, basierend auf RCP-Werten, die mittels Radio-HPLC gemessen wurden, betrug 74,4 % ± 3,3 %. Die Stabilität des radioaktiv markierten Produkts wurde bis zu 4 h nach der Aufbereitung nachgewiesen. Dieses Protokoll bietet eine zuverlässige, schnelle und effiziente Methodik für die Herstellung von [68Ga]Ga-3BP-3940, das leicht in eine klinische Umgebung übertragen werden kann.
Einleitung
In den letzten Jahren hat die Ausrichtung auf die Tumormikroumgebung (TME) ein erhebliches Interesse an diagnostischen und therapeutischen Anwendungengeweckt 1. Die Fülle an Zelltypen, Signalmolekülen und Makromolekülen der extrazellulären Matrix (ECM) innerhalb des TME bietet ein breites Spektrum an potenziellen molekularen Zielen2. Unter den residenten und infiltrierenden Wirtszellen bilden krebsassoziierte Fibroblasten (CAFs) eine eigenständige Untergruppe von Fibroblasten innerhalb der TME, die sich phänotypisch von normalen Fibroblasten unterscheidet. CAFs spielen durch einzigartige zelluläre und molekulare Eigenschaften eine entscheidende Rolle bei der Tumorprogression, der Metastasierung, der Immunevasion und der Therapieresistenz3. Diese mesenchymalen Zellen weisen einen aktivierten Phänotyp auf, der durch die Expression des Fibroblasten-Aktivierungsproteins (FAP) gekennzeichnet ist. Molekular sezernieren CAFs ein komplexes Array von Zytokinen, Chemokinen, Wachstumsfaktoren (z. B. TGF-β, IL-6 und CXCL12) und EZM-Proteinen (z. B. Kollagen, Fibronektin), die die EZM umgestalten und ein protumorigenes Milieu fördern4.
Als hochspezifisches Protein, das überexprimiert und auf der extrazellulären Oberfläche der CAF-Membran lokalisiert ist, weist FAP alle Eigenschaften eines zuverlässigen molekularen Ziels auf, insbesondere für nuklearmedizinische und radiopharmazeutische Anwendungen5. In diesem Zusammenhang wurden chinolinbasierte niedermolekulare Inhibitoren von FAP (FAPI), funktionalisiert mit einer DOTA-Gruppe, entwickelt und schnell in den klinischen Einsatz eingeführt 6,7,8. Insbesondere FAPI-04 und FAPI-46, die mit Gallium-68 (β+ Emitter, t1/2 = 68 min) für die Positronen-Emissions-Tomographie (PET)-Bildgebung markiert wurden, haben einen signifikanten Wert bei fibrotischen Erkrankungen, in der Kardiologie und Onkologiegezeigt 8,9, insbesondere bei Krebserkrankungen, bei denen [18F]Fluordesoxyglucose ([18F]FDG) einen begrenzten Nutzen hat10. Obwohl ihre Beiträge zur Onkologie und zur Bildgebung nicht-maligner Erkrankungen unbestreitbar sind, weisen niedermolekulare FAPIs gewisse Einschränkungen für Anwendungen in der gezielten Radionuklidtherapie (TRT) auf, insbesondere aufgrund ihrer suboptimalen intratumoralen Verweilzeit, die zu einer unbeabsichtigten Bestrahlung von gesundem Gewebe führen kann11. Um dieses Problem anzugehen, wurden verschiedene Strategien untersucht, wie z. B. das Design multivalenter Liganden 11,12 oder die Verwendung therapeutischer Radionuklide mit kurzen Halbwertszeiten 13,14,15. Außerdem wurden neue molekulare Gerüste entwickelt, die eine hohe Affinität zu FAP aufweisen und einen hohen Anteil an Zellinternalisierung auslösen.
Eines davon ist das Pseudopeptid-Derivat FAP-2286. Es enthält eine 7-Aminosäuresequenz, die cyclisiert und durch eine 1,3,5-Benzoltrimethanthiol-Einheit16 mit einem DOTA-Chelator verbunden ist. Eine erste Studie am Menschen zeigte, dass [68Ga]Ga-FAP-2286 ein ähnliches Bioverteilungsprofil wie [68Ga]Ga-FAPI-46 aufweist, mit einer etwas höheren physiologischen Aufnahme in Leber, Nieren und Herz17. In dieser Studie wurden 64 Patienten, hauptsächlich mit Krebserkrankungen des Halses, der Leber, des Magens, der Bauchspeicheldrüse, der Eierstöcke und der Speiseröhre, einer PET-Bildgebung mit [68Ga]Ga-FAP-2286 zur Krebsstadie oder zum Nachweis eines Rezidivs unterzogen: Die Aufnahme von [68Ga]Ga-FAP-2286 war bei Primärtumoren, Lymphknotenmetastasen und Fernmetastasen deutlich höher als [18F]FDG, was den Bildkontrast und die Läsionserkennbarkeit verbesserte. Alle Primärtumoren waren mit [68Ga]Ga-FAP-2286 PET/CT sichtbar, während [18F]FDG PET/CT fast 20% der Läsionen übersahen. Bei befallenen Lymphknoten waren die Detektionsraten bei [68Ga]Ga-FAP-2286 höher, ebenso bei Knochen- und viszeralen Metastasen. Eine weitere Studie an einer kleineren Gruppe von 21 Patienten mit einer Vielzahl von Krebserkrankungen zeigte ebenfalls die ausgezeichnete Sensitivität dieses bildgebenden Mittels, was die diagnostische Effizienz von [68Ga]Ga-FAP-2286widerspiegelt 18. Spezifischere Studien konzentrierten sich auf eine einzelne Krebsart, wie z. B. Urothel- oder Lungenkrebs, was erneut das hohe Potenzial von [68Ga]Ga-FAP-2286 für die klinische molekulare Bildgebung unterstreicht 4,5. In einer Vorstudie wurde die Anwendung von FAP-2286, das mit Lutetium-177 (β-Strahler, t1/2 = 6,7 d) radioaktiv markiert wurde, bei 11 Patienten mit verschiedenen progredienten, metastasierten Krebserkrankungenuntersucht 19. Die meisten Patienten erhielten zwei Behandlungszyklen im Abstand von 8 Wochen, und die durchschnittlich verabreichte Dosis pro Zyklus betrug 5,8 ± 2,0 GBq [177Lu]Lu-FAP-2286. Das Medikament zeigte eine verlängerte intratumorale Retention mit einer effektiven Halbwertszeit von etwa 44 h bei Knochenmetastasen. Angesichts der akzeptablen Nebenwirkungen ebneten diese Ergebnisse den Weg für größere klinische Studien: Die Sicherheit und Wirksamkeit von [177Lu]Lu-FAP-2286 wird derzeit in der klinischen Phase-1/2-Studie LuMIERE untersucht, die von Novartis gesponsert wird (NCT04939610)7,8. Weitere kleinere Forschungsprotokolle sind in der Literatur dokumentiert 9,20, und es wurden mehrere Fallberichte veröffentlicht 21,22,23,24,25,26, die die Wirksamkeit und hervorragende Verträglichkeit dieser TRT belegen.
Minimale Strukturänderungen, die an FAP-2286 vorgenommen wurden, führten zum optimierten Analogon 3BP-3940 (Abbildung 1)27. Obwohl die wissenschaftliche Literatur zu diesem Vektormolekül nach wie vor begrenzt ist, wurden frühe Studien sowohl für bildgebende als auch für therapeutische Anwendungen durchgeführt. Ein vorläufiger Bericht beschreibt die Anwendung von [68Ga]Ga-3BP-3940 bei 18 Patienten mit verschiedenen metastasierenden Karzinomen im Endstadium und kommt zu dem Schluss, dass dieses Radiopharmakon ein geeignetes PET-Bildgebungsmittel ist, wobei sein hervorragendes Tumor-Hintergrund-Verhältnis und seine sehr geringe Nierenaufnahme hervorgehobenwerden 28. In einer anderen Arbeit erhielt ein einzelner Patient mit Lebermetastasen 150 MBq [68Ga]Ga-3BP-3940 für die PET-Bildgebung, was eine intensive Aufnahme in den Primärtumor und metastasierende Läsionen zeigte29. Derselbe Patient erhielt anschließend eine Einzeldosis von 9,7 GBq [177Lu]Lu-3BP-3940 für TRT. Die Behandlung wurde gut vertragen, es gab keine signifikanten Veränderungen der Vitalparameter oder biologischen Parameter. In einer anderen Studie wurden die ersten humanen Ergebnisse eines theranostischen Ansatzes mit 3BP-3940 vorgestellt: Die Patienten wurden mit einer [68Ga]Ga-3BP-3940 PET-Bildgebung ausgewählt und erhielten dann 3BP-3940, markiert mit verschiedenen Isotopen (177Lu, 90Y oder 225Ac), das allein oder in Tandemkombinationen (z. B. 177Lu + 225Ac) in 1-5 Behandlungszyklen verabreichtwurde 30. Zu den Ergebnissen gehörten eine vollständige Remission, vier partielle Remissionen, drei stabile Erkrankungen und 12 Krankheitsverläufe. Das mediane Gesamtüberleben der Kohorte (n = 28) betrug 9 Monate nach Beginn der TRT.

Abbildung 1: Chemische Struktur von [68Ga]Ga-3BP-3940. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der 68-Ga-Radiomarkierungsprozess für experimentelle Radiopharmazeutika wie FAP-2286 und 3BP-3940 umfasst in der Regel ein Synthesemodul, um den Vorbereitungsschritt zu automatisieren. Insbesondere gewährleistet die Methodenautomatisierung die Robustheit des Prozesses und die GMP-Konformität und minimiert die Strahlenbelastung des Bedieners im Vergleich zu manuellen Präparationsmethoden 31,32,33. In vielen Fällen wird ein solches Protokoll von den Zulassungsbehörden als Teil eines Prüfpräparatedossiers (IMPD) erwartet, bevor sie einem Zentrum die Zulassung zur Herstellung des entsprechenden experimentellen Radiopharmakons erteilen34. Bisher sind in der Literatur nur sehr wenige detaillierte Informationen über die automatisierte 68-Ga-Radiomarkierung von Anti-FAP-Pseudopeptiden verfügbar29,35,36,37,38. Darüber hinaus gelten die berichteten Daten im Allgemeinen nur für ein bestimmtes Synthesizermodell. Die Art des verwendeten 68-Ga-Generators kann auch gewisse Besonderheiten mit sich bringen, da die verschiedenen kommerziell erhältlichen Lösungen durch spezifische Volumina von 68Ga3+ Eluat in HCl (in der Regel 0,1 M) gekennzeichnet sind, was einen direkten Einfluss auf die Bedingungen der automatisierten Radiomarkierung haben kann.
In diesem Zusammenhang stellen wir ein detailliertes Protokoll für die schnelle und effiziente automatisierte Radiomarkierung des Pseudopeptids 3BP-3940 mit 68Ga unter Verwendung des GAIA V2-Synthesemoduls vor. Dieser Synthesizer basiert auf der Verwendung eines Schlauchsets, das aus drei Rampen mit jeweils fünf Verteilern besteht, die mit einer Schlauchpumpe verbunden sind, um den Flüssigkeitsfluss zu steuern. Es verfügt außerdem über einen Vial-Ofen zur Erwärmung des Reaktionsmediums, mehrere Radioaktivitätssonden und einen Drucksensor zur Überwachung dieser Parameter innerhalb des Systems. Obwohl dieser Automat nicht so weit verbreitet ist wie einige andere Modelle, wird er routinemäßig in unserem Zentrum eingesetzt und in einer wachsenden Anzahl von Einrichtungeninstalliert 31,39,40,41,42,43,44. Bei dieser Arbeit wurde ein GALLIAD 68Ge/68Ga-Generator ohne Vorreinigung des 68Ga-Eluats verwendet. Dieses Verfahren soll eine robuste, schnelle und komfortable Lösung für die Herstellung von [68Ga]Ga-3BP-3940 bieten und gleichzeitig den Strahlenschutz für Bediener während der Radiomarkierung optimieren. Dies ist auch das erste Vorbereitungsprotokoll für dieses Radiopharmazeutikum, über das über dieses spezielle Synthesizermodell berichtet wurde, und zwar in so vielen Details.
Protokoll
HINWEIS: Dieses Protokoll beinhaltet die Arbeit mit Radioisotopen. Jeder, der dieses Verfahren durchführt, muss im Umgang mit unverschlossenen radioaktiven Stoffen ordnungsgemäß geschult sein und über eine Genehmigung des Strahlenschutzbeauftragten seiner Einrichtung verfügen. Der automatisierte Synthesizer sollte in einer dafür vorgesehenen abgeschirmten heißen Zelle platziert werden. Alle manuellen Eingriffe mit radioaktiven Stoffen sollten ebenfalls in einer abgeschirmten heißen Zelle oder hinter einer geeigneten Strahlenabschirmung durchgeführt werden.
1. Vorbereitung der Reagenzien
HINWEIS: Die für die automatisierte Herstellung von [68Ga]Ga-3BP-3940 erforderlichen Reagenzien (siehe Materialtabelle) wurden in einer Aufbereitungsanlage für Radiopharmazeutika (Reinraum der GMP-Klasse C) hergestellt. Die Reagenzien können in beliebiger Reihenfolge und bis zu 2 Stunden vor der Synthese vorbereitet werden.
- Herstellung der Pufferlösung (Natriumacetat 0,8 M)
- Erwerben Sie den folgenden Rohstoff: Natriumacetat-Trihydrat EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- In einem sterilen Behälter (z. B. Mikrozentrifugenröhrchen, 5 ml) wird mit einer Präzisionswaage eine genaue Masse an Natriumacetattrihydrat in der Nähe von 544,32 mg gewogen.
- Mit einer kalibrierten Mikropipette und sterilen Kegeln lösen Sie Natriumacetat in einem Volumen von Wasser für Injektionszwecke (WFI) in der Nähe von 5 ml auf, so dass die WFI wie unten beschrieben ist.
WFI-Volumen = (gewogene Puffermasse x 5)/544,32 - Wirbeln Sie die Lösung und lassen Sie sie durch ein Ultraschallbad (40 kHz, ~1 min) laufen, um die Solubilisierung zu erleichtern.
- Entnehmen Sie die Pufferlösung mit einer 10-ml-Spritze, die mit einer 21G-Nadel ausgestattet ist. Installieren Sie einen 0,22-μm-Filter zwischen der Spritze und einer neuen Nadel und filtrieren Sie die Pufferlösung nach der Desinfektion des Septums direkt in ein ordnungsgemäß gekennzeichnetes steriles versiegeltes Fläschchen (z. B. TC-ELU 5).
- Herstellung einer Antiradiolyselösung (Methionin 10 mg/ml)
- Erwerben Sie folgenden Rohstoff: L-Methionin (Ph. Eur., USP) rein, Pharmaqualität.
- In einem sterilen Behälter (z. B. Mikrozentrifugenröhrchen 5 ml), das korrekt identifiziert wurde, wird mit einer Präzisionswaage eine genaue Masse an L-Methionin von fast 50 mg gewogen.
- Mit einer kalibrierten Mikropipette und sterilen Kegeln lösen Sie L-Methionin in einem Volumen von WFI in der Nähe von 5 ml auf, so dass WFI wie unten beschrieben ist.
WFI-Volumen = (gewogene Puffermasse x 5)/50 - Wirbeln Sie die Lösung und lassen Sie sie durch ein Ultraschallbad (40 kHz, ~1 min) laufen, um die Solubilisierung zu erleichtern.
- Entnehmen Sie die Methioninlösung mit einer 10-ml-Spritze, die mit einer 21-G-Nadel ausgestattet ist. Installieren Sie einen 0,22-μm-Filter zwischen der Spritze und der neuen Nadel und filtrieren Sie die Lösung nach der Desinfektion des Septums direkt in ein ordnungsgemäß gekennzeichnetes steriles versiegeltes Fläschchen (z. B. TC-ELU 5, Curium).
2. Vorbereitung der Ausrüstung für die Qualitätskontrolle
- pH-Kontrolle des Endprodukts
- Positionieren Sie hinter einem entsprechenden Schutzschild einen Streifen pH-Papier für die anschließende Kontrolle des Endprodukts.
- Radiochemische Reinheitskontrolle durch Radio-TLC
- Bereiten Sie zwei DC-Migrationstanks mit geeigneten mobilen Phasen vor. Mobile Phase A: Citratpuffer 0,1 M pH 4 in Wasser, mit erwartetem Rf = 0-0,2 für [68Ga]Ga-3BP-3940 und Rf = 0,8-1 für freies 68Ga3+. Mobile Phase B: Ammoniumacetat-Puffer 1 M in einem 1:1-Gemisch aus Wasser und Methanol (v/v), mit erwartetem Rf = 0-0,2 für [68Ga]Gallium-Kolloide und Rf = 0,8-1 für [68Ga]Ga-3BP-3940.
- Positionieren Sie hinter einem entsprechenden Schutzschild die beiden DC-Migrationstanks neben zwei iTLC-SG-Platten für die anschließende Kontrolle des RCP des Endprodukts.
- Schalten Sie den Radiochromatographen ein und öffnen Sie die zugehörige Erfassungssoftware auf dem Operationsrechner. Geben Sie die Identifikationsinformationen für die erste durchzuführende Analyse vorab ein.
- Radiochemische Reinheitskontrolle mittels Radio-HPLC
- Prüfen Sie, ob das für die Analyse erforderliche Säulenmodell (C18 ACE Equivalence) auf dem System installiert ist.
- Bereiten Sie eine frische mobile Phase für die HPLC vor, d. h. Wasser für die HPLC + 0,1 % TFA (Lösungsmittel A) und Acetonitril + 0,1 % TFA (Lösungsmittel B). Verbinden Sie die Solvent A und Solvent B Flaschen mit den entsprechenden Leitungen auf der Radio-HPLC.
- Schalten Sie den Operationscomputer ein und stellen Sie eine Verbindung zur Steuerungssoftware her.
- Öffnen Sie bei Bedarf das Spülventil am Pumpenmodul und spülen Sie die Leitungen, die für die Analyse verwendet werden sollen (d. h. Leitung A und Leitung B). Schließen Sie nach diesem Vorgang das Spülventil.
- Lassen Sie das System mindestens 20 Minuten lang mit einem Lösungsmittelanteil äquilibrieren, der dem Beginn des Gradienten entspricht (d. h. 95 % A/5 % B) mit einem Durchfluss von 0,6 ml/min. Für die [68Ga]Ga-3BP-3940 HPLC-Analysesequenz verwenden Sie die Flussrate bei 0,6 ml/min und programmieren Sie den mobilen Phasengradienten von 0,1 % TFA in Wasser (A) bis 0,1 % TFA in Acetonitril (B) wie folgt: 0 - 1 min 95/5 A/B; 1 - 8 min linearer Gradient von 95/5 A/B bis 60/40 A/B; 8 - 9 min 60/40 A/B; 9 - 10 min linearer Gradient von 60/40 A/B bis 95/5 A/B; 10 - 12 min 95/5 A/B.
- Wählen Sie die Analysemethode mit dem in Schritt 2.3.5 beschriebenen mobilen Phasengradienten aus und geben Sie dann die Identifikationsinformationen für die erste durchzuführende Analyse ein.
- Bereiten Sie in einem abgeschirmten Behälter ein HPLC-Fläschchen mit Glaseinsatz für die Aufnahme der zu analysierenden Probe vor und positionieren Sie es hinter einem entsprechenden Schutzschild.
3. Vorbereitung des Synthesemoduls
- Schalten Sie die Stromversorgung und das Licht der abgeschirmten Zelle ein. Schalten Sie den Laptop ein, der den Synthesizer steuert, und melden Sie sich bei der Modulsoftware an.
- Entfernen Sie bei Bedarf das alte Kit aus dem Synthesizer und entsorgen Sie den Müll in den entsprechenden Behältern.
- Führen Sie die Reinigung des Innenraums des abgeschirmten Gehäuses, in dem sich das Synthesemodul befindet, und des Synthesizers selbst gemäß den geltenden Hygienestandards durch.
- Drücken Sie in der Synthesizer-Software auf Benutzer, wählen Sie einen Benutzernamen aus und geben Sie das zugehörige Passwort in das Popup-Fenster ein. Drücken Sie Methode und wählen Sie das automatisierte Protokoll aus, das zuvor für die [68Ga]Ga-3BP-3940-Synthese konfiguriert wurde.
- Drücken Sie auf Vorbereitung und geben Sie den Synthesetitel, die Vektorchargennummer, die Chargennummer des Reagenzienkits und alle Kommentare in das entsprechende Textfeld ein. In dieser Phase kann auch eine Checkliste mit den verschiedenen Schritten der Kit-Vorbereitung eingerichtet und befolgt werden (Ergänzende Abbildung 1).
4. Vorbereitung der Synthesekassette und Kassetteneinbau
- Reinigen Sie die Laborwerkbank für Radiopharmazie mit einem Tuch und dem entsprechenden Reinigungs- und Desinfektionsmittel und legen Sie ein steriles Abdecktuch über die Werkbank.
- Besorgen Sie sich eine sterile [68Ga]Ga-Markierungskassette (Referenz RT-01-H) und ein Reagenzienkit (Ergänzende Abbildung 2). Die 3 Rampen des Schlauchsets sind als A, B und C von links nach rechts auf dem Modul gekennzeichnet; Die Verteiler jeder Rampe sind von oben nach unten (Rampen A und C) oder von links nach rechts (Rampe B) von 1 bis 5 nummeriert.
- Montieren Sie die Kassette mit den folgenden Schritten.
- Packen Sie den Umschlag der [68Ga]Ga-Kassette aus, prüfen Sie, ob sie beschädigt sind, und ziehen Sie alle Luer-Anschlüsse an der Kassette fest. Entfernen Sie alle Spike-Kappen.
- Ziehen Sie mit einer 5-ml-Luer-Lock-Spritze und einer 21-G-Nadel 5 mL Ethanol-Absolue aus dem Reagenzienkit auf und geben Sie es sehr langsam über die C18-Patrone , ziehen Sie dann 5 mL WFI (nicht im Kit enthalten) auf und leiten Sie es sehr langsam über dieselbe C18-Patrone , um es vorzukonditionieren.
- Positionieren Sie die Rampe A des Schlauchsatzes auf dem Synthesemodul und drehen Sie die beiden Riegel, um die Rampe an Ort und Stelle zu halten. Verbinden Sie das freie Ende des vertikalen A1-Schlauchs mit einer 19G-Nadel und führen Sie sie in das Abfallfläschchen ein.
- Setzen Sie eine Entlüftungsnadel in das Abfallfläschchen ein und positionieren Sie es nach hinten, optimal hinter dem abgeschirmten Behälter, der das Evakuierungsfläschchen aufnehmen soll. Setzen Sie einen 0,22-μm-Filter in Position A4 ein.
- Verbinden Sie den horizontalen A1-Schlauch mit dem Drucksensor unten links an der Frontplatte des Moduls.
- Verbinden Sie mit einem Stecker/Stecker-Adapter in horizontaler A5-Position eine 30 cm lange Verlängerung, die von einem 0,22 μ Endfilter und einer 80 mm 20G-Nadel endet.
- Führen Sie die oben erwähnte 20G-Nadel in ein verschlossenes, steriles Evakuierungsfläschchen (z. B. TC-ELU 5) ein, fügen Sie eine Belüftungsnadel hinzu und positionieren Sie das Evakuierungsfläschchen in seinem abgeschirmten Behälter.
- Verlegen Sie die Schlauchleitung, die die Vertikale A1 mit der Vertikalen C1 verbindet, hinter den Haltehaken über der Rampe B.
- Verbinden Sie die horizontalen Verteiler A2 und B1 mit einer kurzen Verlängerungsleitung (entweder nicht im Kit enthalten oder die ursprünglich in Position C5 horizontal angeschlossene) mit dem Adapter, der bereits in Position A2 montiert ist.
- Positionieren Sie die Rampe B am Synthesemodul und drehen Sie die beiden Riegel, um die Rampe an Ort und Stelle zu halten.
- Verbinden Sie die vorkonditionierte C18-Kartusche mit der horizontalen C2-Position und halten Sie den Adapter, der das horizontale B5-Ventil mit C2 verbindet, auf der linken Seite.
- Positionieren Sie die Rampe C auf dem Synthesemodul und drehen Sie die beiden Riegel, um die Rampe an Ort und Stelle zu halten.
- Verbinden Sie mit einem Stecker/Stecker-Adapter eine 50 cm lange Verlängerungsleitung von der horizontalen C5 mit dem GALLIAD 68Ga Generator.
- Stellen Sie das Buntglas-Reaktionsfläschchen des Schlauchsets in den Ofen des Moduls. Platzieren Sie den Schlauch vorsichtig von vertikal A5 nach vertikal C5 in der Schlauchpumpe, schließen Sie die Pumpe, überprüfen Sie, ob der Schlauch richtig positioniert ist, und führen Sie den Schlauch durch den Aktivitätssensor auf der linken Seite der Pumpe.
- Führen Sie eine Zwischenprüfung durch, um sicherzustellen, dass die Kassette und der Schlauch auf dem Radiosynthesizer montiert sind, wie in Abbildung 2 gezeigt, noch ohne Reagenzien.
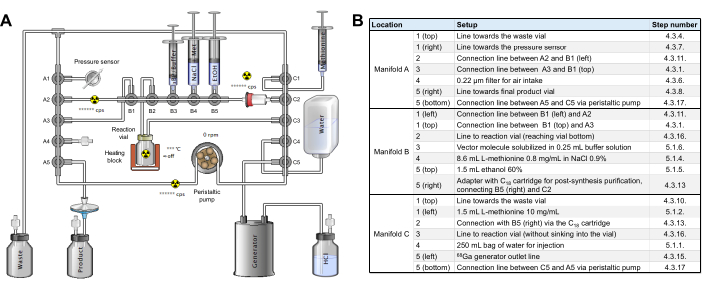
Abbildung 2: Konfiguration des Synthesemoduls. (A) Aufbau für die automatisierte Synthese von [68Ga]Ga-3BP-3940 auf dem Synthesemodul. (B) Details zu den Reagenzpositionen für die automatisierte Herstellung von [68Ga]Ga-3BP-3940 unter Verwendung eines GAIA-Synthesemoduls. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Installation der Reagenzien
- Nachdem die Rampen auf dem Modul installiert wurden, installieren Sie die Reagenzien wie unten beschrieben.
- Verbinden Sie den WFI 250-ml-Beutel aus dem Reagenzienkit mit dem Spike-Adapter mit dem C4-Schlauch und hängen Sie den Beutel an den speziellen Haken auf der rechten Seite des Moduls.
- Entnehmen Sie mit einer dreiteiligen 3-ml-Luer-Lock-Spritze, die mit einer 20-G-Nadel ausgestattet ist, 1,5 mL der zuvor vorbereiteten L-Methionin-Lösung 10 mg/ml, verbinden Sie die Spritze mit dem horizontalen C1-Schlauch und hängen Sie die Spritze in den dafür vorgesehenen Schlitz auf der rechten Seite des Moduls. Lassen Sie ca. 2 ml Luft zwischen der Flüssigkeitsoberfläche und der Dichtung des Spritzenkolbens, um einen vollständigen Flüssigkeitstransfer zu gewährleisten.
- Entnehmen Sie mit einer 1-ml-Spritze und einer 20-G-Nadel 750 μl der zuvor hergestellten 10 mg/ml-L-Methionin-Lösung und injizieren Sie sie nach Desinfektion des Septums in die 0,9%ige NaCl-Durchstechflasche (blauer Crimp) aus dem Reagenz-Kit.
- Entnehmen Sie mit einer dreiteiligen 10-ml-Luer-Lock-Spritze und einer 20-G-Nadel den Inhalt des 0,9 % NaCl + L-Methionin-Fläschchens (blauer Crimp), stellen Sie ihn auf 8,6 mL ein, entfernen Sie den Spike in Position B4 und schließen Sie die Spritze stattdessen an B4 an. Lassen Sie ca. 2 ml Luft zwischen der Flüssigkeitsoberfläche und der Dichtung des Spritzenkolbens, um einen vollständigen Flüssigkeitstransfer zu gewährleisten.
- Entnehmen Sie nach der Desinfektion des Septums mit einer dreiteiligen 3-ml-Luer-Lock-Spritze mit einer 20-G-Nadel den Inhalt des 60%igen Ethanolfläschchens (orangefarbene Bördelung). Vergewissern Sie sich, dass das Volumen mindestens 1,5 ml beträgt, entfernen Sie den Spike in Position B5 und schließen Sie die Spritze stattdessen an B5 an. Lassen Sie ca. 2 ml Luft zwischen der Flüssigkeitsoberfläche und der Dichtung des Spritzenkolbens, um einen vollständigen Flüssigkeitstransfer zu gewährleisten.
- Entnehmen Sie unter Verwendung einer 1-ml-Spritze mit geringem Totvolumen und einer 20-G-Nadel 0,25 ml der zuvor hergestellten 0,8 M Natriumacetat-Pufferlösung und injizieren Sie sie in die Durchstechflasche mit 30 μg 3BP-3940, um sie durch aufeinanderfolgende Injektions-/Re-Aspirationszyklen zu lösen. Ziehen Sie die 0,25-ml-Lösung in dieselbe Spritze auf, trennen Sie die Nadel und setzen Sie den Puffer + die Vektorspritze in B3 ein. Lassen Sie ca. 0,25 ml Luft zwischen der Flüssigkeitsoberfläche und dem Spritzenkolben, um einen vollständigen Flüssigkeitstransfer zu gewährleisten.
- Führen Sie vor Beginn der Synthese eine abschließende Prüfung durch, wie unten beschrieben.
- Stellen Sie sicher, dass alle Reagenzien mit der Kassette oder dem Schlauch verbunden sind, wie in Abbildung 3 dargestellt.
- Stellen Sie sicher, dass alle Anschlüsse des Kits ausreichend fest sind. Stellen Sie sicher, dass kein Schlauch eingeklemmt oder abgewinkelt ist.
- Das System ist bereit. Schließen Sie die Frontblende und schalten Sie die Belüftung der abgeschirmten Zelle ein.

Abbildung 3: Aufbau des Kits. Abschließende Installation des Schlauchsets und der Reagenzien auf dem Synthesizer für die Radiomarkierung von 3BP-3940 mit 68Ga. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Automatisierte Radiomarkierungssequenz für die Herstellung von [68Ga]Ga-3BP-3940
- Klicken Sie auf Synthese ausführen , wenn alle Reagenzien auf den Rampen platziert sind und alle Informationen korrekt in der Software aufgezeichnet wurden.
- Ein typisches Profil der Radioaktivitätsverteilung im Schlauchsatz während der gesamten Synthesesequenz ist in Abbildung 4. Befolgen Sie die aufeinanderfolgenden Schritte in der automatisierten Methode zur Vorbereitung von [68Ga]Ga-3BP-3940 wie unten beschrieben.
- Integritätstests des Kits: Nach einem kurzen Spülen des Schlauchs in Richtung des Abfallfläschchens (im Wesentlichen, um die verbleibende Flüssigkeit in der C 18-Kartusche zu entfernen) erhöht das System seinen Innendruck, indem es A4 öffnet und gefilterte Luft über die Peristaltikpumpe pumpt. Sobald der an A1 angeschlossene Drucksensor einen Schlauchdruck > 1500 mbar erkennt, schließt sich das System und die Schlauchpumpe stoppt. Wenn der Druckabfall über einen Zeitraum von 15 s 400 mbar nicht überschreitet, bewerten Sie den Integritätstest des Kits als erfolgreich und beginnen Sie mit der Synthese. Wenn der Test fehlschlägt, vermuten Sie ein Systemleck und brechen Sie die Synthesesequenz ab.
- Zugabe des Vektors zum Reaktionsgefäß: Es ist sicherzustellen, dass das in der Pufferlösung gelöste 3BP-3940 in etwa 30 s durch den Verteiler B2 in das Reaktionsgefäß gezogen wird.
- Zugabe von L-Methionin in das Reaktionsgefäß: Es ist sicherzustellen, dass die in der Spritze bei C1 enthaltene Methioninlösung über den Verteiler B2 in das Reaktionsgefäß überführt wird, die Rampe C hinunter und dann die Rampe A hinauf, um an der Rampe B durch den Verteiler A2 abzuzweigen.
- Aktivierung der C18-Kartusche mit WFI: Stellen Sie sicher, dass das im Beutel bei C4 enthaltene WFI über die C18-Kartusche geleitet wird, und spülen Sie auch die Rampen A, B und C auf den Wegen, denen die Vektor- und Methioninlösungen folgen. Die gleichen Wege werden dann mit gefilterter Luft gespült, um sicherzustellen, dass für die folgenden Schritte kein Wasser in den Schläuchen verbleibt.
- Generator-Elution im Reaktionsgefäß (manueller Eingriff): Um den GALLIAD-Generator zu eluieren, drehen Sie den grünen Knopf an der Oberseite des Generators um 90° in die Ladeposition, bevor Sie 10-20 s warten: Diese Zeit ermöglicht es dem Generator, ein festes Eluatvolumen von 1,1 mL herzustellen. Bringen Sie den grünen Knopf wieder in seine Ausgangsposition und klicken Sie auf die Eingabeaufforderung in der Steuerungssoftware. Die Peristaltikpumpe zieht dann das 68-Ga-Eluat über einen Zeitraum von 3 Minuten in das Reaktionsgefäß. In diesem Zeitintervall wird die Temperatur des Reaktionsgefäßes allmählich über 1 min auf 60 °C und dann über 2 min auf 90 °C angehoben, um die eingestellte Temperatur für den Radiomarkierungsschritt schneller zu erreichen.
- Radiomarkierung: Prüfen Sie, ob zu Beginn des Radiomarkierungsschritts eine Solltemperatur von 120 °C für 30 s angewendet wird, um eine schnelle und effiziente Erwärmung zu ermöglichen. Prüfen Sie, ob die Solltemperatur dann für 2 min auf 98 °C eingestellt ist. Aufgrund der Erwärmung und des Druckanstiegs im Reaktionsgefäß neigt ein Teil des Reaktionsmediums dazu, wieder in den mit B2 verbundenen Schlauch zu fließen. Um dies zu begrenzen, wird nach 2 Minuten Aufheizen eine 10-sekündige Leitungsspülung eingestellt; Dann wird die Radiomarkierung etwa 5,5 Minuten lang fortgesetzt.
- Auffangen an der C18-Kartusche : Stellen Sie sicher, dass die gefilterte Luft durch C3 in das Reaktionsgefäß gepumpt wird. Durch den auf die Oberfläche der Flüssigkeit ausgeübten Druck kann das Reaktionsmedium durch den an B2 angeschlossenen Schlauch nach oben und dann zur SPE-Kartusche strömen. Anschließend wird das Reaktionsgefäß mit WFI aus dem Beutel bei C4 gespült und diese Spülflüssigkeit auf die gleiche Weise in die SPE-Kartusche überführt. Die Kartusche wird schließlich mit frischem WFI gespült und mit gefilterter Luft gespült.
- Elution der C18-Kartusche und der Formulierung (Zugabe von NaCl 0,9 % + L-Methionin): Die SPE-Kartusche hält zunächst das radioaktiv markierte Produkt und alle Galliumkolloide zurück und lässt freies 68Ga3+ durch. Um die Kartusche zu eluieren und [68Ga]Ga-3BP-3940 im Endfläschchen zurückzugewinnen, stellen Sie sicher, dass aufeinanderfolgende Fraktionen von Ethanol 60 % und Methionin ~0,9 mg/ml in NaCl 0,9 % (jeweils 3x 0,5 mL) zur Elution über die Kartusche gezogen werden. Der gesamte Inhalt der Spritze bei B4 wird dann in einem Formulierungsschritt durch die C18-Patrone geleitet, um eine endgültige Ethanolkonzentration von <10 % im Endfläschchen zu erreichen.
- Filterintegritätstest (manueller Eingriff): Befolgen Sie nach der Synthese und Entfernung des Endfläschchens die Aufforderung, den Endfilter an das Abfallfläschchen anzuschließen, und entfernen Sie den Entlüftungsfilter aus dem Abfallfläschchen, um die Unversehrtheit des Endfilters mit einem Blasenpunkttest zu überprüfen. Während des Blasenpunkttests wird der Filter zunächst für 30 s mit WFI benetzt. Nach dem Spülen der Leitungen wird der Druck im System langsam über <2 min auf bis zu >2500 mbar erhöht, wobei der Synthesizer überprüft, ob am Ausgang des Filters kein Druckanstieg vorliegt. Dann erhöht das System langsam den Druck, um den Blasenpunkt zu überprüfen. Der Synthesizer zeichnet schließlich den Druck auf, wenn der Druck am Filterausgang ansteigt, um den Blasenpunktdruck zu bestimmen.
- Am Ende der Synthese erstellt die Automatensoftware einen Synthesebericht, der den Verlauf der Radiomarkierung beschreibt und die Temperaturen im Reaktionsgefäß, die Drücke im System und die beteiligten Radioaktivitätsmengen verfolgt (Abbildung 4). Berechnen Sie ergänzend manuell die zerfallskorrigierte radiochemische Ausbeute (RCY) nach folgender Formel:
RCY =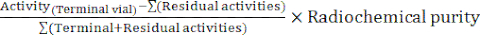
mit Restaktivitäten, die die verbleibenden Aktivitäten im Reaktionsgefäß, auf der C18-Patrone und in dem Abfallgefäß am Ende der Synthese beschreiben.
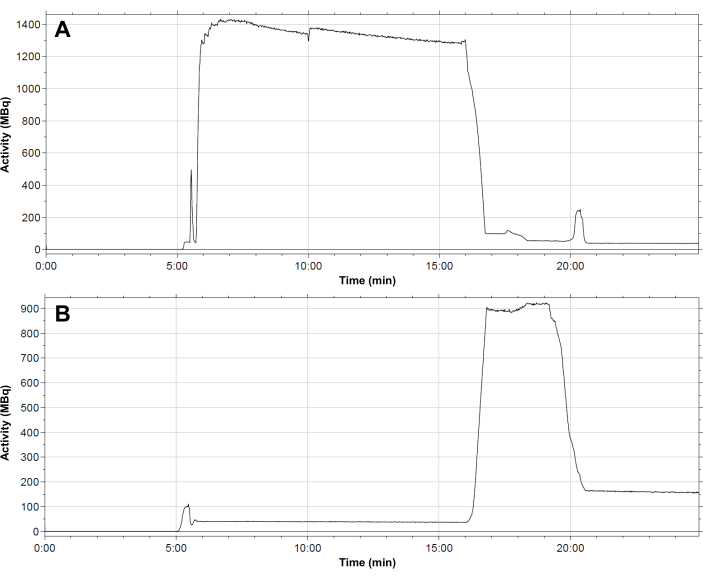
Abbildung 4: Typisches Verteilungsprofil der Radioaktivität innerhalb des Moduls. (A) Reaktionsgefäß; (B) C18-Kartusche während der Synthese von [68Ga]Ga-3BP-3940. Der Fluss von 68Ga Eluat in das Reaktionsgefäß erfolgt nach 6 min. Die Aktivität verbleibt während der gesamten Radiomarkierungsreaktion im Reaktionsgefäß. Nach 16 Minuten wird die Aktivität auf die SPE-Kartusche übertragen. Die Kartusche wird nach 19,5 min eluiert, danach verbleibt eine Restaktivität von ca. 150 MBq auf der stationären Phase. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Abgabe und Qualitätskontrolle von [68Ga]Ga-3BP-3940
- Übertragen Sie das Endfläschchen zur Radioaktivitätsmessung und zur Vorbereitung der Patientendosis in eine geeignete abgeschirmte Zelle.
- Messen Sie die Aktivität der Durchstechflasche mit einem ordnungsgemäß kalibrierten Dosiskalibrator und zeichnen Sie die Zubereitung am Computer auf.
- Identifizieren Sie die Durchstechflasche richtig und stellen Sie sie in einen geeigneten abgeschirmten Behälter. Entnehmen Sie unter Verwendung geeigneter aseptischer Techniken und Strahlenschutztechniken eine ~0,5-ml-Probe aus dem Endfläschchen zur Qualitätskontrolle.
- Beurteilen Sie das Aussehen des Präparats durch visuelle Inspektion. Beurteilen Sie den pH-Wert des Präparats, indem Sie einen Tropfen Produktlösung auf den pH-Papierstreifen geben.
- Messen Sie die radiochemische Reinheit durch Radio-DC, indem Sie jeweils einen Tropfen Produktlösung auf jede der beiden zuvor vorbereiteten iTLC-SG-Platten aufbringen. Lassen Sie dann die Platten in die entsprechenden mobilen Phasen migrieren und vom Radiochromatographen ablesen. Integrieren Sie das resultierende Radiochromatogramm, indem Sie die Fläche unter der Kurve des Produktsignals und des Verunreinigungssignals messen und dann die radiochemische Reinheit gemäß der Formel berechnen:
RCP (%) = 100 - %AUC-Verunreinigung1 - %AUC-Verunreinigung2 - Messen Sie die radiochemische Reinheit mittels Radio-HPLC, indem Sie ~50 μl des Präparats in das zuvor vorbereitete HPLC-Fläschchen injizieren (siehe Schritt 2.3.7). Positionieren Sie das Fläschchen im HPLC-Autosampler an der gewünschten Position und starten Sie den Analyseablauf. Sobald die Probe in das System injiziert wurde, nehmen Sie das Fläschchen aus dem Autosampler und setzen Sie es wieder in den abgeschirmten Behälter ein, um die Bestrahlung zu minimieren. Am Ende der Analyse integrieren Sie das resultierende Radiochromatogramm, indem Sie die Fläche unter der Kurve des Produktsignals und der Verunreinigungssignale messen und dann die radiochemische Reinheit nach der Formel berechnen:
RCP (%) = 100 - Σ(%AUC-Verunreinigungen) - Überprüfen Sie die Halbwertszeit (Gamma-Zähler) des in der Zubereitung enthaltenen Radioisotops, indem Sie ~5 μl des Präparats in ein Gamma-Zählgefäß mit 1 ml WFI geben. Zählen Sie das Röhrchen mit dem Gamma-Zähler 10x hintereinander (Zählungen von je 1 Minute). Berechnen Sie die Halbwertszeit basierend auf dem radioaktiven Zerfall, der über die 10 Messungen beobachtet wurde.
- Der Radionuklid-Identitätsassay wird an derselben Probe wie der Halbwertszeit-Assay durchgeführt, indem eine Gammaspektrometrie-Analyse mit dem Gamma-Zähler durchgeführt wird, wobei die 511 keV- und 1077 keV-Peaks von Annihilationsphotonen gesucht werden.
- Beurteilung der radionukliden Reinheit nach einer Abklingzeit von 48 h der vorherigen Probe. Führen Sie eine 120-minütige Messung im Gamma-Zähler durch, die den Nachweis von in situ gebildeter 68-Ga-Restaktivität durch den Durchbruch von 68Ge und anderen Radionuklidverunreinigungen mit langer Halbwertszeit ermöglicht.
8. Stabilität des Präparats [68Ga]Ga-3BP-3940
- Bewerten Sie drei Testchargen auf Stabilität im Zeitverlauf. Zu diesem Zweck entnehmen Sie stündlich etwa 200 μl des Präparats aus dem terminalen Fläschchen unmittelbar nach der EoS und bis zu 4 h nach der Synthese.
- Führen Sie zu jedem Zeitpunkt eine Radio-HPLC-Analyse durch, um die RCP durch HPLC gemäß dem oben beschriebenen Verfahren zu messen. Führen Sie zu jedem Zeitpunkt Radio-TLC-Analysen durch, um RCP durch TLC gemäß dem zuvor beschriebenen Verfahren zu messen.
Ergebnisse
Der auf dem GAIA-Modul entwickelte Syntheseprozess ermöglicht die schnelle 68-Ga-Radiomarkierung von 3BP-3940 in 21-22 min. Dieses Protokoll wurde für die Verwendung mit dem pharmazeutischen 68Ge/68Ga-Generator GALLIAD entwickelt, der 1,1 ml 68Ga-Eluat in 0,1 M HCl produziert. Das Volumen und die Molarität des Reaktionspuffers wurden entsprechend dieser Säuremenge fein abgestimmt, um einen Reaktions-pH-Wert zwischen 3,5 und 4 zu erhalten, d...
Diskussion
In dieser Arbeit wird ein GMP-konformes automatisiertes Präparationsprotokoll für die Synthese von [68Ga]Ga-3BP-3940 unter Verwendung eines GAIA-Moduls und eines GALLIAD-Generators vorgestellt. Diese Methode wurde mit leichten Modifikationen von Protokollen adaptiert, die in unserem Zentrum für die Radiomarkierung von Vektoren wie PSMA-Liganden44 und anderen FAP-Inhibitoren 43,46 für die kli...
Offenlegungen
Die Autoren haben keine kommerziellen Partnerschaften oder Finanzierungsquellen, die zu einem tatsächlichen oder vermeintlichen Interessenkonflikt in Bezug auf diese Arbeit führen würden.
Danksagungen
Die Autoren danken Yasmine Soualy, Stéphane Renaud und Élodie Gaven für ihre Hilfe bei der Vorbereitung der Radiomarkierungsreaktionen, die in diesem Manuskript vorgestellt werden.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
Referenzen
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753 (2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68 (2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967 (2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16 (2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566 (2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821 (2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Osterkamp, F., et al. Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541 (2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452 (2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61 (2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141 (2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392 (2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4 (2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30 (2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211 (2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27 (2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824 (2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884 (2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448 (2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23 (2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034 (2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten