È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione automatizzata di [68Ga]Ga-3BP-3940 su un modulo di sintesi per l'imaging PET del microambiente tumorale
In questo articolo
Riepilogo
Questa ricerca descrive il processo automatizzato per la produzione di [68Ga]Ga-3BP-3940 con il sintetizzatore GAIA V2, per l'imaging PET della proteina di attivazione dei fibroblasti. Vengono inoltre presentati i risultati dei test di controllo qualità eseguiti su tre lotti di prova.
Abstract
Un metodo rapido ed efficiente è stato sviluppato sul modulo di sintesi GAIA per la radiomarcatura automatizzata del gallio-68 di 3BP-3940, una sonda di imaging molecolare che ha come bersaglio la proteina di attivazione dei fibroblasti per l'imaging con tomografia a emissione di positroni del microambiente tumorale. Le condizioni di reazione hanno coinvolto tampone acetato (concentrazione finale: 0,1 M), metionina come agente anti-radiolisi (concentrazione finale: 5,4 mg/mL) e 30 μg di 3BP-3940, con riscaldamento per 8 minuti a 98 °C. Un'ultima fase di purificazione su una cartuccia C18 è stata necessaria per ottenere un prodotto radiomarcato di elevata purezza. Al contrario, il 68Ga prodotto dal generatore è stato utilizzato direttamente senza una fase di concentrazione su una cartuccia a scambio cationico. La produzione di tre lotti di validazione ha confermato l'affidabilità del metodo, consentendo la sintesi di [68Ga]Ga-3BP-3940 in 22,3 ± 0,6 min con elevata purezza radiochimica (RCP), come determinato sia da radio-HPLC (99,1% ± 0,1%) che da radio-TLC (99,2% ± 0,1%). La resa radiochimica media, basata sui valori RCP misurati mediante radio-HPLC, è stata del 74,4% ± del 3,3%. La stabilità del prodotto radiomarcato è stata dimostrata fino a 4 ore dopo la preparazione. Questo protocollo fornisce una metodologia affidabile, rapida ed efficiente per la preparazione di [68Ga]Ga-3BP-3940, che può essere facilmente trasposta in un contesto clinico.
Introduzione
Negli ultimi anni, il targeting del microambiente tumorale (TME) ha suscitato un notevole interesse nelle applicazioni diagnostiche e terapeutiche1. L'abbondanza di tipi di cellule, molecole di segnalazione e macromolecole di matrice extracellulare (ECM) all'interno della TME offre un'ampia gamma di potenziali bersagli molecolari2. Tra le cellule ospiti residenti e infiltranti, i fibroblasti associati al cancro (CAF) formano un sottogruppo distinto di fibroblasti all'interno della TME, fenotipicamente diversi dai fibroblasti normali. I CAF svolgono un ruolo cruciale nella progressione tumorale, nelle metastasi, nell'evasione immunitaria e nella resistenza alla terapia grazie a caratteristiche cellulari e molecolari uniche3. Queste cellule mesenchimali mostrano un fenotipo attivato caratterizzato dall'espressione della proteina di attivazione dei fibroblasti (FAP). Molecolarmente, i CAF secernono una complessa serie di citochine, chemochine, fattori di crescita (ad esempio, TGF-β, IL-6 e CXCL12) e proteine della MEC (ad esempio, collagene, fibronectina), che rimodellano la MEC e favoriscono un ambiente pro-tumorigenico4.
Essendo una proteina altamente specifica che è sovraespressa e localizzata sulla superficie extracellulare della membrana CAF, la FAP mostra tutte le caratteristiche di un bersaglio molecolare affidabile, specialmente per la medicina nucleare e le applicazioni radiofarmaceutiche5. In questo contesto, sono stati sviluppati inibitori di piccole molecole di FAP a base di chinolina (FAPI), funzionalizzati con un gruppo DOTA, e rapidamente introdotti nell'uso clinico 6,7,8. In particolare, FAPI-04 e FAPI-46 radiomarcati con gallio-68 (emettitore β+, t1/2 = 68 min) per l'imaging con tomografia a emissione di positroni (PET) hanno dimostrato un valore significativo nelle malattie fibrotiche, in cardiologia e in oncologia 8,9, in particolare per i tumori in cui il [18F]fluorodesossiglucosio ([18F]FDG) ha un'utilità limitata10. Tuttavia, mentre i loro contributi all'oncologia e all'imaging delle malattie non maligne sono innegabili, i FAPI a piccole molecole mostrano alcune limitazioni per le applicazioni di terapia con radionuclidi mirati (TRT), in particolare a causa del loro tempo di permanenza intratumorale non ottimale, che può portare a un'irradiazione involontaria del tessuto sano11. Per affrontare questo problema, sono state esplorate diverse strategie, come la progettazione di ligandi multivalenti11,12 o l'uso di radionuclidi terapeutici con emivite brevi 13,14,15. Sono stati inoltre sviluppati nuovi scaffold molecolari con un'elevata affinità per la FAP e che innescano un'alta percentuale di internalizzazione cellulare.
Uno di questi è il derivato pseudopeptidico FAP-2286. Contiene una sequenza di 7 aminoacidi, ciclizzata e legata a un chelante DOTA da una porzione 1,3,5-benzenetrimetanetiolo16. Uno studio iniziale sull'uomo ha dimostrato che [68Ga]Ga-FAP-2286 mostra un profilo di biodistribuzione simile a [68Ga]Ga-FAPI-46, con un assorbimento fisiologico leggermente superiore nel fegato, nei reni e nel cuore17. In questo studio, 64 pazienti, principalmente con tumori del collo, del fegato, dello stomaco, del pancreas, delle ovaie e dell'esofago, sono stati sottoposti a imaging PET con [68Ga]Ga-FAP-2286 per la stadiazione del cancro o il rilevamento della recidiva: l'assorbimento di [68Ga]Ga-FAP-2286 è stato notevolmente superiore a [18F]FDG nei tumori primari, nelle metastasi linfonodali e nelle metastasi a distanza, migliorando il contrasto dell'immagine e la rilevabilità della lesione. Tutti i tumori primari erano visibili con [68Ga]Ga-FAP-2286 PET/CT, mentre [18F]FDG PET/CT ha mancato quasi il 20% delle lesioni. Per i linfonodi coinvolti, i tassi di rilevamento erano più alti con [68Ga]Ga-FAP-2286, così come per le metastasi ossee e viscerali. Un altro studio in un gruppo più piccolo di 21 pazienti con una varietà di malattie tumorali ha anche dimostrato l'eccellente sensibilità di questo agente di imaging, riflettendo l'efficienza diagnostica di [68Ga]Ga-FAP-228618. Studi più specifici si sono concentrati su un singolo tipo di cancro, come il cancro uroteliale o polmonare, evidenziando ancora una volta l'alto potenziale di [68Ga]Ga-FAP-2286 per l'imaging molecolare clinico 4,5. Per quanto riguarda la terapia, uno studio preliminare ha esaminato l'uso di FAP-2286 radiomarcato con lutezio-177 (emettitore di β-, t1/2 = 6,7 d) in 11 pazienti con diversi tumori metastatici progressivi19. La maggior parte dei pazienti ha ricevuto due cicli di trattamento distanziati di 8 settimane l'uno dall'altro e la dose media somministrata per ciclo è stata di 5,8 ± 2,0 GBq di [177Lu]Lu-FAP-2286. Il farmaco ha dimostrato una prolungata ritenzione intratumorale, con un'emivita efficace di circa 44 ore nelle metastasi ossee. Dati gli effetti collaterali accettabili, questi risultati hanno aperto la strada a studi clinici su larga scala: la sicurezza e l'efficacia di [177Lu]Lu-FAP-2286 sono attualmente in fase di valutazione nello studio clinico di fase 1/2 LuMIERE, sponsorizzato da Novartis (NCT04939610)7,8. Ulteriori protocolli di ricerca su scala ridotta sono documentati in letteratura 9,20 e sono stati pubblicati diversi casi clinici 21,22,23,24,25,26, dimostrando l'efficacia e l'eccellente tollerabilità di questa TRT.
Le modifiche minime apportate alla struttura del FAP-2286 hanno portato all'analogico ottimizzato 3BP-3940 (Figura 1)27. Sebbene la letteratura scientifica su questa molecola vettore rimanga limitata, sono stati condotti i primi studi sia per l'imaging che per le applicazioni terapeutiche. Un rapporto preliminare descrive l'uso di [68Ga]Ga-3BP-3940 in 18 pazienti con vari carcinomi metastatici allo stadio terminale e conclude che questo radiofarmaco è un agente di imaging PET adatto, sottolineando il suo eccellente rapporto tumore-fondo e la captazione renale molto bassa28. In un altro lavoro, un singolo paziente con carcinoma pancreatico con metastasi epatiche ha ricevuto 150 MBq di [68Ga]Ga-3BP-3940 per l'imaging PET, che ha dimostrato un'intensa captazione nel tumore primario e nelle lesioni metastatiche29. Lo stesso paziente ha successivamente ricevuto una singola dose di 9,7 GBq di [177Lu]Lu-3BP-3940 per TRT. Il trattamento è stato ben tollerato, senza cambiamenti significativi nei segni vitali o nei parametri biologici. Un altro studio ha presentato i risultati iniziali sull'uomo di un approccio teranostico utilizzando 3BP-3940: i pazienti sono stati selezionati con l'imaging PET [68Ga]Ga-3BP-3940 e poi hanno ricevuto 3BP-3940 marcato con diversi isotopi (177Lu, 90Y o 225Ac), somministrato da solo o in combinazioni tandem (ad esempio, 177Lu + 225Ac) in 1-5 cicli di trattamento30. Gli esiti includevano una remissione completa, quattro remissioni parziali, tre malattie stabili e 12 progressioni della malattia. La sopravvivenza globale mediana della coorte (n = 28) è stata di 9 mesi dall'inizio della TRT.

Figura 1: Struttura chimica di [68Ga]Ga-3BP-3940. Clicca qui per visualizzare una versione più grande di questa figura.
Il processo di radiomarcatura a 68Ga per radiofarmaci sperimentali come FAP-2286 e 3BP-3940 prevede generalmente un modulo di sintesi per automatizzare la fase di preparazione. In particolare, l'automazione dei metodi garantisce la robustezza del processo e la conformità alle GMP e riduce al minimo l'esposizione dell'operatore alle radiazioni rispetto ai metodi di preparazione manuale 31,32,33. In molti casi, tale protocollo è atteso dalle autorità regolatorie come parte di un dossier di medicinale sperimentale (IMPD) prima di autorizzare un centro a produrre il corrispondente radiofarmaco sperimentale34. Ad oggi, in letteratura sono disponibili pochissime informazioni dettagliate sulla radiomarcatura automatizzata del 68Ga degli pseudopeptidi anti-FAP 29,35,36,37,38. Inoltre, i dati riportati si applicano generalmente solo a un dato modello di sintetizzatore. Il tipo di generatore da 68Ga utilizzato può anche portare alcune specificità, poiché le diverse soluzioni disponibili in commercio sono caratterizzate da volumi specifici di eluato 68Ga3+ in HCl (solitamente 0,1 M), che possono avere un impatto diretto sulle condizioni di radiomarcatura automatizzata.
In questo contesto, presentiamo un protocollo dettagliato per la radiomarcatura automatizzata rapida ed efficiente dello pseudopeptide 3BP-3940 con 68Ga, utilizzando il modulo di sintesi GAIA V2. Questo sintetizzatore si basa sull'uso di un set di tubi composto da tre rampe di cinque collettori ciascuna, collegate a una pompa peristaltica per controllare il flusso del fluido. Dispone inoltre di un forno a fiala per il riscaldamento del mezzo di reazione, diverse sonde di radioattività e un sensore di pressione per monitorare questi parametri all'interno del sistema. Anche se non così diffuso come alcuni altri modelli, questo automa viene utilizzato abitualmente nel nostro centro ed è installato in un numero crescente di strutture 31,39,40,41,42,43,44. In questo lavoro è stato utilizzato un generatore GALLIAD 68Ge/68Ga senza prepurificazione dell'eluato da 68Ga. Questo metodo è progettato per offrire una soluzione robusta, veloce e conveniente per la produzione di [68Ga]Ga-3BP-3940, ottimizzando anche la protezione dalle radiazioni per gli operatori durante la radiomarcatura. Questo è anche il primo protocollo di preparazione per questo radiofarmaco ad essere riportato su questo specifico modello di sintetizzatore, e in modo così dettagliato.
Protocollo
NOTA: Questo protocollo prevede il lavoro con i radioisotopi. Chiunque conduca questa procedura deve essere adeguatamente addestrato alla manipolazione di materiali radioattivi non sigillati e deve avere l'approvazione del responsabile della sicurezza delle radiazioni del proprio istituto. Il sintetizzatore automatico deve essere collocato in una cella calda schermata designata. Qualsiasi procedura manuale che coinvolga materiali radioattivi deve essere eseguita anche in una cella calda schermata o dietro un'adeguata schermatura dalle radiazioni.
1. Preparazione dei reagenti
NOTA: I reagenti necessari per la produzione automatizzata di [68Ga]Ga-3BP-3940 (vedi Tabella dei materiali) sono stati preparati in un'unità di preparazione di radiofarmaci (camera bianca GMP grado C). I reagenti possono essere preparati in qualsiasi ordine e fino a 2 ore prima della sintesi.
- Preparazione della soluzione tampone (acetato di sodio 0,8 M)
- Acquisisci la seguente materia prima: acetato di sodio triidrato EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- In un contenitore sterile (ad es. provetta da microcentrifuga, 5 ml) correttamente identificato, pesare una massa esatta di acetato di sodio triidrato vicina a 544,32 mg utilizzando una bilancia di precisione.
- Utilizzando una micropipetta calibrata e coni sterili, solubilizzare l'acetato di sodio in un volume di acqua per preparazioni iniettabili (WFI) vicino a 5 mL in modo che la WFI sia come descritto di seguito.
Volume WFI = (massa tampone pesata x 5)/544,32 - Agitare la soluzione e farla passare attraverso un bagno a ultrasuoni (40 kHz, ~1 min) per facilitare la solubilizzazione.
- Utilizzando una siringa da 10 ml dotata di ago da 21G, prelevare la soluzione tampone. Installare un filtro da 0,22 μm tra la siringa e un nuovo ago, quindi filtrare la soluzione tampone direttamente in una fiala sigillata sterile correttamente identificata (ad es. TC-ELU 5) dopo la disinfezione del setto.
- Preparazione di una soluzione di composto anti-radiolisi (metionina 10 mg/mL)
- Acquisisci la seguente materia prima: L-Metionina (Ph. Eur., USP) pura, di grado farmaceutico.
- In un contenitore sterile (ad es. provetta da microcentrifuga da 5 mL) correttamente identificato, pesare una massa esatta di L-metionina vicina a 50 mg utilizzando una bilancia di precisione.
- Utilizzando una micropipetta calibrata e coni sterili, solubilizzare la L-metionina in un volume di WFI vicino a 5 mL in modo che la WFI sia come descritto di seguito.
Volume WFI = (massa tampone pesata x 5)/50 - Agitare la soluzione e farla passare attraverso un bagno a ultrasuoni (40 kHz, ~1 min) per facilitare la solubilizzazione.
- Utilizzando una siringa da 10 ml dotata di un ago da 21 G, prelevare la soluzione di metionina. Installare un filtro da 0,22 μm tra la siringa e il nuovo ago, quindi filtrare la soluzione direttamente in una fiala sterile sigillata correttamente identificata (ad es. TC-ELU 5, Curium) dopo la disinfezione del setto.
2. Predisposizione delle attrezzature per i controlli di qualità
- Controllo del pH del prodotto finale
- Dietro un apposito scudo protettivo, posizionare una striscia di carta pH per il successivo controllo del prodotto finale.
- Controllo della purezza radiochimica mediante radio-TLC
- Preparare due serbatoi di migrazione TLC contenenti le opportune fasi mobili. Fase mobile A: tampone citrato 0,1 M pH 4 in acqua, con Rf atteso = 0-0,2 per [68Ga]Ga-3BP-3940 e Rf = 0,8-1 per 68Ga3+ libero. Fase mobile B: tampone acetato di ammonio 1 M in una miscela 1:1 di acqua e metanolo (v/v), con Rf atteso = 0-0,2 per i colloidi di [68Ga]gallio e Rf = 0,8-1 per [68Ga]Ga-3BP-3940.
- Dietro un apposito scudo protettivo, posizionare le due vasche di migrazione TLC accanto a due piastre iTLC-SG per il successivo controllo dell'RCP del prodotto finale.
- Accendere il radiocromatografo e aprire il relativo software di ripresa sul computer operativo. Immettere in anticipo le informazioni di identificazione per la prima analisi da eseguire.
- Controllo della purezza radiochimica mediante radio-HPLC
- Verificare che sul sistema sia installato il modello di colonna necessario per l'analisi (C18 ACE Equivalence).
- Preparare la fase mobile fresca per l'HPLC, cioè l'acqua per l'HPLC + 0,1% TFA (solvente A) e l'acetonitrile + 0,1% TFA (solvente B). Collegare i flaconi del solvente A e del solvente B alle linee corrispondenti sul radio-HPLC.
- Accendere il computer operativo e collegarlo al software di controllo.
- Se necessario, aprire la valvola di spurgo sul modulo pompa e spurgare le linee che verranno utilizzate per l'analisi (ad esempio, la linea A e la linea B). Chiudere la valvola di spurgo dopo questa operazione.
- Lasciare equilibrare il sistema con una proporzione di solvente pari all'inizio del gradiente (cioè 95% A/5% B) con un flusso di 0,6 mL/min per almeno 20 minuti. Per la sequenza di analisi HPLC [68Ga]Ga-3BP-3940, utilizzare la velocità di flusso mantenuta a 0,6 mL/min e programmare il gradiente di fase mobile da 0,1% TFA in acqua (A) a 0,1% TFA in acetonitrile (B) come segue: 0 - 1 min 95/5 A/B; 1 - 8 min pendenza lineare da 95/5 A/B a 60/40 A/B; 8 - 9 minuti 60/40 A/B; 9 - 10 min pendenza lineare da 60/40 A/B a 95/5 A/B; 10 - 12 minuti 95/5 A/B.
- Selezionare il metodo analitico con il gradiente di fase mobile descritto al punto 2.3.5., quindi inserire preventivamente le informazioni di identificazione per la prima analisi da eseguire.
- In un contenitore schermato, preparare una fiala HPLC con un inserto in vetro per ricevere il campione da analizzare e posizionarla dietro un apposito scudo protettivo.
3. Preparazione del modulo di sintesi
- Accendi l'alimentazione e la luce della cella schermata. Accendi il laptop che controlla il sintetizzatore e accedi al software del modulo.
- Se necessario, rimuovere il vecchio kit dal sintetizzatore e smaltire i rifiuti negli appositi contenitori.
- Eseguire la pulizia dell'interno dell'armadio schermato che ospita il modulo di sintesi e del sintetizzatore stesso in conformità con le norme igieniche applicabili.
- Sul software del sintetizzatore, premere Utente, quindi selezionare un nome utente e inserire la password associata nella finestra pop-up. Premere Method e selezionare il protocollo automatizzato precedentemente configurato per la sintesi [68Ga]Ga-3BP-3940.
- Premere Preparazione e inserire il titolo della sintesi, il numero di lotto del vettore, il numero di lotto del kit di reagenti ed eventuali commenti nella casella di testo appropriata. In questa fase è possibile impostare e seguire anche una lista di controllo con le varie fasi di preparazione del kit (Figura supplementare 1).
4. Preparazione della cassetta di sintesi e installazione della cassetta
- Pulire il banco di lavoro del laboratorio di radiofarmacia con una salvietta e il disinfettante detergente appropriato e posizionare un telo sterile sul banco di lavoro.
- Procurarsi una cassetta di marcatura sterile [68Ga]Ga (riferimento RT-01-H) e un kit di reagenti (Figura supplementare 2). Le 3 rampe del set di tubi sono identificate come A, B e C da sinistra a destra sul modulo; i collettori di ogni rampa sono numerati da 1 a 5 dall'alto verso il basso (rampe A e C) o da sinistra a destra (rampa B).
- Assemblare la cassetta seguendo i passaggi seguenti.
- Scartare la busta della cassetta [68Ga], verificare la presenza di eventuali danni e serrare ogni connessione Luer sulla cassetta. Rimuovere tutti i cappucci delle punte.
- Utilizzando una siringa Luer Lock da 5 mL e un ago da 21G, prelevare 5 mL di etanolo assoluto dal kit di reagenti e passarlo molto lentamente sulla cartuccia C18 , quindi aspirare 5 mL di WFI (non fornito nel kit) e passarlo molto lentamente sulla stessa cartuccia C18 per precondizionarlo.
- Posizionare la rampa A del set di tubi sul modulo di sintesi e ruotare i due fermi per mantenere la rampa in posizione. Collegare l'estremità libera del tubo verticale A1 a un ago da 19G e inserirlo nella fiala di scarico.
- Aggiungere un ago di sfiato alla fiala di scarico e posizionarla all'indietro, in modo ottimale dietro il contenitore schermato che riceverà la fiala di evacuazione. Posizionare un filtro da 0,22 μm in posizione A4.
- Collegare il tubo A1 orizzontale al sensore di pressione in basso a sinistra del pannello frontale del modulo.
- Utilizzando un adattatore maschio/maschio, collegare in posizione orizzontale A5 una prolunga da 30 cm terminata da un filtro terminale da 0,22 μ e un ago da 80 mm 20G.
- Inserire l'ago da 20G sopra menzionato in una fiala di evacuazione sterile e sigillata (ad es. TC-ELU 5), aggiungere un ago di aerazione e posizionare la fiala di evacuazione nel suo contenitore schermato.
- Posizionare la linea del tubo che collega la verticale A1 alla verticale C1 dietro i ganci di fissaggio sopra la rampa B.
- Collegare i collettori orizzontali A2 e B1 con una linea di prolunga corta (non inclusa nel kit, o quella inizialmente collegata in posizione C5 orizzontale), utilizzando l'adattatore già montato in posizione A2.
- Posizionare la rampa B sul modulo di sintesi e ruotare i due fermi per mantenere la rampa in posizione.
- Collegare la cartuccia C18 precondizionata alla posizione C2 orizzontale, mantenendo l'adattatore che collega la valvola B5 orizzontale a C2 alla sua sinistra.
- Posizionare la rampa C sul modulo di sintesi e ruotare i due fermi per mantenere la rampa in posizione.
- Utilizzando un adattatore maschio/maschio, collegare una linea di prolunga da 50 cm da orizzontale C5 al generatore GALLIAD 68Ga.
- Posizionare la fiala di reazione in vetro colorato del set di tubi nel forno del modulo. Posizionare con cautela il tubo dalla verticale A5 alla verticale C5 nella pompa peristaltica, chiudere la pompa, verificando che la tubazione sia posizionata correttamente, e far passare la tubazione attraverso il sensore di attività sul lato sinistro della pompa.
- Eseguire un controllo intermedio per assicurarsi che la cassetta e il tubo siano assemblati sul radiosintetizzatore come mostrato nella Figura 2, senza ancora reagenti.
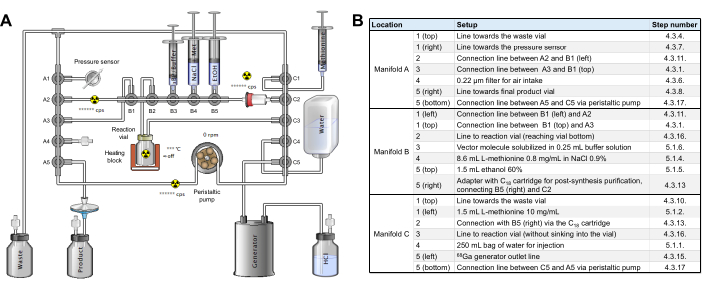
Figura 2: Configurazione del modulo di sintesi. (A) Predisposizione per la sintesi automatizzata di [68Ga]Ga-3BP-3940 sul modulo di sintesi. (B) Dettagli sulle posizioni dei reagenti per la produzione automatizzata di [68Ga]Ga-3BP-3940 utilizzando un modulo di sintesi GAIA. Clicca qui per visualizzare una versione più grande di questa figura.
5. Installazione dei reagenti
- Una volta installate le rampe sul modulo, installare i reagenti come descritto di seguito.
- Collegare la sacca WFI da 250 ml del kit di reagenti al tubo C4 utilizzando l'adattatore Spike e appendere la sacca all'apposito gancio sul lato destro del modulo.
- Utilizzando una siringa Luer Lock in tre pezzi da 3 mL dotata di ago da 20G, prelevare 1,5 mL della soluzione di L-metionina 10 mg/mL precedentemente preparata, collegare la siringa al tubo orizzontale C1 e appendere la siringa nell'apposita fessura sul lato destro del modulo. Lasciare circa 2 ml di aria tra la superficie del liquido e la guarnizione dello stantuffo della siringa per garantire il completo trasferimento del liquido.
- Utilizzando una siringa da 1 mL con un ago da 20G, prelevare 750 μL della soluzione di L-metionina da 10 mg/mL precedentemente preparata e iniettarla nel flaconcino di NaCl allo 0,9% (crimpatura blu) dal kit di reagenti, dopo la disinfezione del setto.
- Utilizzando una siringa Luer Lock in tre pezzi da 10 ml con ago da 20 G, prelevare il contenuto del flaconcino di NaCl + L-metionina allo 0,9% (crimpatura blu), regolare a 8,6 ml, rimuovere la punta in posizione B4, quindi collegare la siringa in B4. Lasciare circa 2 ml di aria tra la superficie del liquido e la guarnizione dello stantuffo della siringa per garantire il completo trasferimento del liquido.
- Utilizzando una siringa Luer Lock da 3 ml in tre pezzi con ago da 20G, prelevare il contenuto della fiala di etanolo al 60% (crimpatura arancione) dopo la disinfezione del setto. Verificare che il volume sia almeno pari a 1,5 mL, rimuovere la Spike in posizione B5, quindi collegare la siringa a B5. Lasciare circa 2 ml di aria tra la superficie del liquido e la guarnizione dello stantuffo della siringa per garantire il completo trasferimento del liquido.
- Utilizzando una siringa da 1 ml a basso volume morto con un ago da 20 G, prelevare 0,25 ml della soluzione tampone di acetato di sodio 0,8 M precedentemente preparata e iniettarla nel flaconcino contenente 30 μg di 3BP-3940 per solubilizzarlo mediante iniezioni/cicli di riaspirazione successivi. Prelevare la soluzione da 0,25 mL nella stessa siringa, scollegare l'ago e posizionare il tampone + siringa vettoriale in B3. Lasciare circa 0,25 ml di aria tra la superficie del liquido e lo stantuffo della siringa per garantire il completo trasferimento del liquido.
- Eseguire un controllo finale prima dell'inizio della sintesi come descritto di seguito.
- Verificare che tutti i reagenti siano collegati alla cassetta o al tubo, come mostrato nella Figura 3.
- Assicurarsi che ciascuno dei collegamenti del kit sia sufficientemente serrato. Assicurarsi che nessun tubo sia schiacciato o angolato.
- Il sistema è pronto. Chiudere il pannello frontale e attivare la ventilazione della cella schermata.

Figura 3: Configurazione del kit. Installazione finale del set di tubi e dei reagenti sul sintetizzatore per la radiomarcatura di 3BP-3940 con 68Ga. Clicca qui per visualizzare una versione più grande di questa figura.
6. Sequenza di radiomarcatura automatizzata per la produzione di [68Ga]Ga-3BP-3940
- Fare clic su Esegui sintesi quando tutti i reagenti sono posizionati sulle rampe e tutte le informazioni sono registrate correttamente nel software.
- Un profilo tipico della distribuzione della radioattività nel set di tubi durante la sequenza di sintesi è mostrato in Figura 4. Seguire i passaggi successivi nel metodo automatizzato per la preparazione di [68Ga]Ga-3BP-3940 come descritto di seguito.
- Test di integrità del kit: dopo un breve spurgo del tubo verso la fiala di scarico (essenzialmente per rimuovere l'eventuale liquido residuo nella cartuccia C18 ), il sistema aumenta la sua pressione interna aprendo A4 e pompando aria filtrata tramite la pompa peristaltica. Non appena il sensore di pressione collegato ad A1 rileva una pressione della tubazione > 1500 mbar, il sistema si chiude e la pompa peristaltica si ferma. Se la caduta di pressione non supera i 400 mbar nell'arco di 15 s, valutare il successo del test di integrità del kit e iniziare la sintesi. Se il test fallisce, sospettare una perdita di sistema e interrompere la sequenza di sintesi.
- Aggiunta del vettore alla fiala di reazione: Assicurarsi che il 3BP-3940 solubilizzato nella soluzione tampone venga aspirato nella fiala di reazione in circa 30 s, attraverso il collettore B2.
- Aggiunta di L-metionina al flaconcino di reazione: Assicurarsi che la soluzione di metionina contenuta nella siringa in corrispondenza di C1 sia trasferita al flaconcino di reazione attraverso il collettore B2, la rampa di discesa C e quindi la rampa di salita A per diramarsi alla rampa B tramite il collettore A2.
- Attivazione della cartuccia C18 con WFI: Assicurarsi che il WFI contenuto nella sacca al C4 venga fatto passare sopra la cartuccia C18 , risciacquando anche le rampe A, B e C sui percorsi seguiti dalle soluzioni vettoriale e metionina. Gli stessi percorsi vengono poi lavati con aria filtrata per garantire che non rimanga acqua nei tubi per le fasi successive.
- Eluizione del generatore in fiala di reazione (intervento manuale): Per eluire il generatore GALLIAD, ruotare la manopola verde sulla parte superiore del generatore di 90° rispetto alla posizione di carico prima di attendere 10-20 s: questo tempo consente al generatore di preparare un volume di eluato fisso di 1,1 mL. Riportare la manopola verde nella posizione iniziale e fare clic sul suggeritore sul software di controllo. La pompa peristaltica aspira quindi l'eluato di 68Ga nella fiala di reazione per un periodo di 3 minuti. In questo intervallo di tempo, la temperatura della fiala di reazione viene gradualmente aumentata a 60 °C in 1 minuto, quindi a 90 °C in 2 minuti, per raggiungere più rapidamente la temperatura impostata per la fase di radiomarcatura.
- Radiomarcatura: verificare che all'inizio della fase di radiomarcatura venga applicata una temperatura nominale di 120 °C per 30 s per consentire un riscaldamento rapido ed efficiente. Verificare che la temperatura nominale sia quindi regolata a 98 °C per 2 minuti. A causa del riscaldamento e dell'aumento di pressione nella fiala di reazione, parte del mezzo di reazione tende a rifluire nel tubo collegato a B2. Per limitare questo problema, viene impostato uno spurgo della linea di 10 secondi dopo 2 minuti di riscaldamento; Quindi la radiomarcatura continua per circa 5,5 minuti.
- Intrappolamento sulla cartuccia C18 : Assicurarsi che l'aria filtrata venga pompata nel recipiente di reazione da C3. La pressione esercitata sulla superficie del liquido permette al mezzo di reazione di fluire verso l'alto attraverso il tubo collegato a B2 e quindi alla cartuccia SPE. La fiala di reazione viene quindi risciacquata con WFI dalla sacca a C4 e questo liquido di risciacquo viene trasferito alla cartuccia SPE allo stesso modo. La cartuccia viene infine risciacquata con WFI fresco e risciacquata con aria filtrata.
- Eluizione della cartuccia e della formulazione di C18 (aggiunta di NaCl 0,9% + L-metionina): la cartuccia SPE trattiene inizialmente il prodotto radiomarcato e gli eventuali colloidi di gallio e lascia passare 68Ga3+ liberi. Per eluire la cartuccia e recuperare [68Ga]Ga-3BP-3940 nel flaconcino terminale, assicurarsi che frazioni successive di etanolo 60% e metionina ~0,9 mg/mL in NaCl 0,9% (3x 0,5 mL ciascuna) siano aspirate sulla cartuccia per l'eluizione. L'intero contenuto della siringa in B4 viene quindi fatto passare attraverso la cartuccia C18 in una fase di formulazione per raggiungere una concentrazione finale di etanolo del <10% nel flaconcino terminale.
- Test di integrità del filtro (intervento manuale): Dopo la sintesi e la rimozione della fiala terminale, seguire il prompt che richiede di collegare il filtro terminale alla fiala di scarico e rimuovere il filtro di sfiato dalla fiala di scarico per verificare l'integrità del filtro terminale mediante un test del punto di bolla. Durante il test del punto di bolla, il filtro viene inizialmente bagnato da WFI per 30 s. Dopo lo spurgo delle linee, la pressione nel sistema viene aumentata lentamente fino a >2500 mbar in <2 minuti, durante i quali il sintetizzatore verifica che non vi sia alcun aumento di pressione sull'uscita del filtro. Quindi, il sistema aumenta lentamente la pressione per controllare il punto di bolla. Il sintetizzatore registrerà infine la pressione quando la pressione aumenta sull'uscita del filtro per determinare la pressione del punto di bolla.
- Al termine della sintesi, il software dell'automa genera un rapporto di sintesi che descrive l'andamento della marcatura radiografica e tiene traccia delle temperature nella fiala di reazione, delle pressioni nel sistema e delle quantità di radioattività coinvolte (Figura 4). A complemento, calcolare manualmente la resa radiochimica corretta per il decadimento (RCY) secondo la formula:
RCY =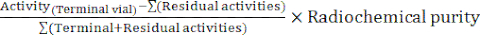
con attività residue che descrivono le attività rimanenti nella fiala di reazione, sulla cartuccia C18 e nella fiala di scarto al termine della sintesi.
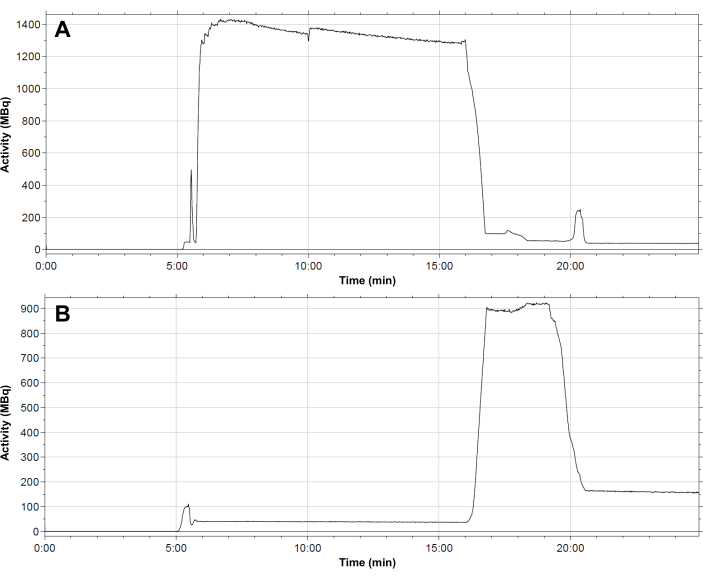
Figura 4: Profilo tipico di distribuzione della radioattività all'interno del modulo. (A) fiala di reazione; (B) Cartuccia C18 durante la sintesi di [68Ga]Ga-3BP-3940. Il flusso di eluato di 68Ga nella fiala di reazione avviene a 6 minuti. L'attività rimane nella fiala di reazione per tutta la durata della reazione di radiomarcatura. Dopo 16 minuti, l'attività viene trasferita alla cartuccia SPE. La cartuccia viene eluita dopo 19,5 minuti, dopodiché rimane un'attività residua di circa 150 MBq in fase stazionaria. Clicca qui per visualizzare una versione più grande di questa figura.
7. Erogazione e controlli di qualità di [68Ga]Ga-3BP-3940
- Trasferire il flaconcino terminale in una cella schermata appropriata per la misurazione della radioattività e la preparazione della dose al paziente.
- Misurare l'attività della fiala terminale con un calibratore di dose opportunamente calibrato e registrare la preparazione sul computer.
- Identificare correttamente il flaconcino e riporlo in un apposito contenitore schermato. Utilizzando tecniche asettiche e tecniche di radioprotezione appropriate, prelevare un campione di ~0,5 ml dalla fiala terminale per i controlli di qualità.
- Valutare l'aspetto del preparato mediante ispezione visiva. Valutare il pH del preparato depositando una goccia di soluzione di prodotto sulla striscia di carta per pH.
- Misurare la purezza radiochimica mediante radio-TLC depositando una goccia di soluzione di prodotto su ciascuna delle due piastre iTLC-SG precedentemente preparate. Quindi, lasciare che le piastre migrino nelle fasi mobili corrispondenti e che vengano lette dal radiocromatografo. Integrare il radiocromatogramma risultante misurando l'area sotto la curva del segnale del prodotto e del segnale di impurità, quindi calcolare la purezza radiochimica secondo la formula:
RCP (%) = 100 -Impurità 1 -Impurità 2 - Misurare la purezza radiochimica mediante radio-HPLC iniettando ~50 μl del preparato nel flaconcino HPLC precedentemente preparato (vedere il passaggio 2.3.7). Posizionare la fiala nell'autocampionatore HPLC nella posizione desiderata e avviare la sequenza di analisi. Una volta che il campione è stato iniettato nel sistema, rimuovere la fiala dall'autocampionatore e riposizionarla nel suo contenitore schermato per ridurre al minimo l'irradiazione. Al termine dell'analisi, integrare il radiocromatogramma risultante misurando l'area sotto la curva del segnale del prodotto e i segnali delle impurità, quindi calcolare la purezza radiochimica secondo la formula:
RCP (%) = 100 - Σ(%AUCimpurità) - Controllare l'emivita (contatore gamma) del radioisotopo contenuto nel preparato aggiungendo ~5 μL di preparato a una provetta contatore gamma contenente 1 mL di WFI. Contare la provetta con il contatore gamma 10 volte consecutivamente (conteggi di 1 min ciascuno). Calcola l'emivita in base al decadimento radioattivo osservato nelle 10 misurazioni.
- Eseguire il test dell'identità radionuclidica sullo stesso campione del test dell'emivita conducendo analisi di spettrometria gamma utilizzando il contatore gamma, ricercando i picchi di 511 keV e 1077 keV dai fotoni di annichilazione.
- Valutare la purezza radionuclidica dopo un periodo di decadimento di 48 ore del campione precedente. Eseguire una misurazione di 120 minuti nel contatore gamma, consentendo il rilevamento di qualsiasi attività residua di 68Ga formata in situ dalla rottura di 68Ge e da altre impurità di radionuclidi a lunga emivita.
8. Stabilità della preparazione [68Ga]Ga-3BP-3940
- Valutare la stabilità nel tempo di tre lotti di prova. A tale scopo, prelevare circa 200 μL di preparato dal flaconcino terminale ogni ora immediatamente dopo l'EoS e fino a 4 ore dopo la sintesi.
- Eseguire un'analisi radio-HPLC in ogni momento per misurare l'RCP mediante HPLC secondo la procedura sopra descritta. Eseguire analisi Radio-TLC in ogni punto temporale per misurare RCP per TLC secondo la procedura precedentemente descritta.
Risultati
Il processo di sintesi sviluppato sul modulo GAIA consente la radiomarcatura rapida a 68Ga di 3BP-3940 in 21-22 min. Questo protocollo è stato progettato per funzionare con il generatore di grado farmaceutico 68Ge/68Ga GALLIAD, che produce 1,1 mL di eluato di 68Ga in 0,1 M HCl. Il volume e la molarità del tampone di reazione sono stati finemente regolati in base a questa quantità di acido per ottenere un pH di reazione compreso tra 3,5 e 4, ...
Discussione
Questo lavoro presenta un protocollo di preparazione automatizzato conforme alle GMP per la sintesi di [68Ga]Ga-3BP-3940 utilizzando un modulo GAIA e un generatore GALLIAD. Questo metodo è stato adattato dai protocolli utilizzati nel nostro centro per la radiomarcatura al gallio-68 di vettori come i ligandi PSMA44 e altri inibitori FAP 43,46 per l'imaging clinico PET, con lievi modifiche.
<...Divulgazioni
Gli autori non hanno partnership commerciali o fonti di finanziamento che comportino un conflitto di interessi reale o percepito relativo a questo lavoro da divulgare.
Riconoscimenti
Gli autori ringraziano Yasmine Soualy, Stéphane Renaud ed Élodie Gaven per il loro aiuto nella preparazione delle reazioni di radiomarcatura presentate in questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
Riferimenti
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753 (2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68 (2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967 (2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16 (2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566 (2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821 (2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Osterkamp, F., et al. Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541 (2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452 (2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61 (2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141 (2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392 (2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4 (2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30 (2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211 (2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27 (2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824 (2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884 (2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448 (2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23 (2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034 (2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon