Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tümör Mikroçevresinin PET Görüntülemesi için Bir Sentez Modülünde [68Ga] Ga-3BP-3940'ın Otomatik Hazırlanması
Bu Makalede
Özet
Bu araştırma, fibroblast aktivasyon proteininin PET görüntülemesi için GAIA V2 sentezleyici ile [68Ga] Ga-3BP-3940 üretimi için otomatik süreci açıklamaktadır. Üç test partisi üzerinde gerçekleştirilen kalite kontrol testlerinin sonuçları da sunulmaktadır.
Özet
Tümör mikroçevresinin pozitron emisyon tomografisi görüntülemesi için fibroblast aktivasyon proteinini hedefleyen bir moleküler görüntüleme probu olan 3BP-3940'ın otomatik galyum-68 radyo-işaretlemesi için GAIA sentez modülünde hızlı ve verimli bir yöntem geliştirilmiştir. Reaksiyon koşulları, asetat tamponu (nihai konsantrasyon: 0.1 M), bir anti-radyoliz ajanı olarak metiyonin (nihai konsantrasyon: 5.4 mg / mL) ve 30 μg 3BP-3940, 98 ° C'de 8 dakika ısıtma ile içeriyordu. Yüksek saflıkta radyoaktif işaretli bir ürün elde etmek için bir C18 kartuşu üzerinde son bir saflaştırma adımı gerekliydi. Buna karşılık, jeneratör tarafından üretilen 68Ga, bir katyon değişim kartuşu üzerinde bir konsantrasyon adımı olmadan doğrudan kullanıldı. Üç doğrulama partisinin üretimi, yöntemin güvenilirliğini doğruladı ve hem radyo-HPLC (% 99.1 ± % 0.1) ± radyo-TLC (% 99.2 ± 0.1) ile yüksek radyokimyasal saflıkta (RCP) 22.3 0.6 dakikada [68Ga]Ga-3BP-3940'ın sentezine izin verdi. Radyo-HPLC ile ölçülen RCP değerlerine dayanan ortalama radyokimyasal verim %74.4 ± %3.3 idi. Radyoaktif işaretli ürünün stabilitesi, hazırlandıktan sonra 4 saate kadar gösterilmiştir. Bu protokol, klinik bir ortama kolayca aktarılabilen [68Ga]Ga-3BP-3940'ın hazırlanması için güvenilir, hızlı ve verimli bir metodoloji sağlar.
Giriş
Son yıllarda, tümör mikroçevresinin (TME) hedef alınması, tanı ve tedavi uygulamalarında büyük ilgi görmüştür1. TME içindeki hücre tiplerinin, sinyal moleküllerinin ve hücre dışı matris (ECM) makromoleküllerinin bolluğu, çok çeşitli potansiyel moleküler hedefler sunar2. Yerleşik ve sızan konakçı hücreler arasında, kanserle ilişkili fibroblastlar (CAF'ler), normal fibroblastlardan fenotipik olarak farklı olan TME içinde farklı bir fibroblast alt kümesi oluşturur. CAF'ler, benzersiz hücresel ve moleküler özellikler sayesinde tümör ilerlemesi, metastazı, immün kaçış ve tedavi direncinde çok önemli roller oynar3. Bu mezenkimal hücreler, fibroblast aktivasyon proteininin (FAP) ekspresyonu ile işaretlenmiş aktive edilmiş bir fenotip sergiler. Moleküler olarak, CAF'ler karmaşık bir dizi sitokin, kemokin, büyüme faktörü (örneğin, TGF-β, IL-6 ve CXCL12) ve ECM proteinleri (örneğin, kollajen, fibronektin), ECM'yi yeniden şekillendiren ve pro-tümörjenik bir ortamı teşvik eden4.
CAF zarının hücre dışı yüzeyinde aşırı eksprese edilen ve lokalize olan oldukça spesifik bir protein olan FAP, özellikle nükleer tıp ve radyofarmasötik uygulamalar için güvenilir bir moleküler hedefin tüm özelliklerini gösterir5. Bu bağlamda, bir DOTA grubu ile işlevselleştirilen FAP'ın kinolin bazlı küçük moleküllü inhibitörleri (FAPI) geliştirilmiş ve hızlı bir şekilde klinik kullanıma sunulmuştur 6,7,8. Spesifik olarak, pozitron emisyon tomografisi (PET) görüntüleme için FAPI-04 ve FAPI-46, galyum-68 (β+ yayıcı, t1/2 = 68 dakika) ile radyoaktif olarak işaretlenmiştirfibrotik hastalıklar, kardiyoloji ve onkoloji 8,9, özellikle [18 F]florodeoksiglukozun ([18F]FDG) sınırlı faydaya sahip olduğu kanserler için10. Bununla birlikte, onkoloji ve malign olmayan hastalıkların görüntülenmesine katkıları yadsınamaz olsa da, küçük moleküllü FAPI'ler, özellikle sağlıklı dokunun istenmeyen ışınlanmasına yol açabilen suboptimal intratümöral kalma süreleri nedeniyle, hedefe yönelik radyonüklid tedavi (TRT) uygulamaları için belirli sınırlamalar sergilemektedir11. Bu sorunu ele almak için, çok değerlikli ligandların 11,12 tasarımı veya kısa yarı ömürlere sahip terapötik radyonüklidlerinkullanımı 13,14,15 gibi çeşitli stratejiler araştırılmıştır. FAP için yüksek afiniteye sahip ve yüksek oranda hücre içselleştirmesini tetikleyen yeni moleküler iskeleler de geliştirilmiştir.
Bunlardan biri psödopeptit türevi FAP-2286'dır. Siklize edilmiş ve bir 1,3,5-benzentrimetatiol parçası16 ile bir DOTA şelatörüne bağlanmış bir 7-amino asit dizisi içerir. İnsanlarda yapılan ilk bir çalışma, [68Ga]Ga-FAP-2286'nın [68Ga]Ga-FAPI-46'ya benzer bir biyodağılım profili sergilediğini ve karaciğer, böbrekler ve kalpte biraz daha yüksek fizyolojik alım olduğunu gösterdi17. Bu çalışmada, başta boyun, karaciğer, mide, pankreas, yumurtalık ve yemek borusu kanserleri olan 64 hastaya, kanser evrelemesi veya nüksün tespiti için [68Ga]Ga-FAP-2286 ile PET görüntüleme uygulandı: [68Ga]Ga-FAP-2286 alımı, primer tümörlerde, lenf nodu metastazlarında ve uzak metastazlarda [18F]FDG'den önemli ölçüde daha yüksekti, bu da görüntü kontrastını ve lezyon tespit edilebilirliğini artırdı. Tüm primer tümörler [68Ga]Ga-FAP-2286 PET/BT ile görülebilirken, [18F]FDG PET/BT lezyonların neredeyse %20'sini kaçırdı. İlgili lenf nodları için, tespit oranları [68Ga] Ga-FAP-2286 ile ve ayrıca kemik ve viseral metastazlar için daha yüksekti. Çeşitli kanser hastalıkları olan 21 hastadan oluşan daha küçük bir grupta yapılan bir başka çalışmada, [68Ga]Ga-FAP-228618'in tanısal etkinliğini yansıtan bu görüntüleme ajanının mükemmel duyarlılığı da gösterilmiştir. Daha spesifik çalışmalar, ürotelyal veya akciğer kanseri gibi tek bir kanser türüne odaklanmış ve klinik moleküler görüntüleme için [68Ga]Ga-FAP-2286'nın yüksek potansiyelini bir kez daha vurgulamıştır 4,5. Tedavi ile ilgili olarak, bir ön çalışma, çeşitli progresif, metastatik kanserleri olan 11 hastada lutesyum-177 (β-yayıcı, t1/2 = 6.7 d) ile radyoaktif işaretli FAP-2286'nın kullanımını araştırdı19. Çoğu hastaya 8 hafta arayla iki tedavi döngüsü verildi ve döngü başına ortalama uygulanan doz 5.8 ± 2.0 GBq [177Lu]Lu-FAP-2286 idi. İlaç, kemik metastazlarında yaklaşık 44 saatlik etkili bir yarılanma ömrü ile uzun süreli intratümöral retansiyon gösterdi. Kabul edilebilir yan etkiler göz önüne alındığında, bu bulgular daha büyük ölçekli klinik çalışmaların yolunu açtı: [177Lu]Lu-FAP-2286'nın güvenliği ve etkinliği şu anda Novartis (NCT04939610)7,8 tarafından desteklenen faz 1/2 LuMIERE klinik çalışmasında değerlendirilmektedir. Literatürdedaha küçük ölçekli araştırma protokolleri belgelenmiştir 9,20 ve bu TRT'nin etkinliğini ve mükemmel tolere edilebilirliğini gösteren çok sayıda vaka raporu 21,22,23,24,25,26 yayınlanmıştır.
FAP-2286 üzerinde yapılan minimal yapı değişiklikleri, optimize edilmiş analog 3BP-3940'a yol açtı (Şekil 1)27. Bu vektör molekülü ile ilgili bilimsel literatür sınırlı kalmakla birlikte, hem görüntüleme hem de terapötik uygulamalar için erken çalışmalar yapılmıştır. Bir ön rapor, çeşitli son dönem metastatik karsinomları olan 18 hastada [68Ga]Ga-3BP-3940'ın kullanımını açıklar ve bu radyofarmasötikin uygun bir PET görüntüleme ajanı olduğu sonucuna varır, mükemmel tümör-arka plan oranını ve çok düşük böbrek alımını vurgular28. Başka bir çalışmada, karaciğer metastazı olan tek bir pankreas kanseri hastası, PET görüntüleme için 150 MBq [68Ga]Ga-3BP-3940 aldı ve bu da primer tümör ve metastatik lezyonlarda yoğun tutulum gösterdi29. Aynı hasta daha sonra TRT için tek doz 9.7 GBq [177Lu]Lu-3BP-3940 aldı. Tedavi, yaşamsal belirtilerde veya biyolojik parametrelerde önemli bir değişiklik olmaksızın iyi tolere edildi. Farklı bir çalışma, 3BP-3940 kullanılarak teranostik bir yaklaşımın ilk insan sonuçlarını sundu: hastalar [68Ga] Ga-3BP-3940 PET görüntüleme ile seçildi ve daha sonra farklı izotoplarla (177Lu, 90Y veya 225Ac) etiketlenmiş 3BP-3940 aldı, tek başına veya tandem kombinasyonlarda (ör., 177Lu + 225Ac) 1-5 tedavi döngüsünde30. Sonuçlar arasında bir tam remisyon, dört kısmi remisyon, üç stabil hastalık ve 12 hastalık ilerlemesi vardı. Kohortun (n = 28) medyan genel sağkalımı TRT'nin başlangıcından itibaren 9 aydı.

Şekil 1: [68Ga]Ga-3BP-3940'ın kimyasal yapısı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
FAP-2286 ve 3BP-3940 gibi deneysel radyofarmasötikler için 68Ga radyoetiketleme işlemi genellikle hazırlama adımını otomatikleştirmek için bir sentez modülü içerir. Özellikle, metot otomasyonu, proses sağlamlığını ve GMP uyumluluğunu sağlar ve manuel hazırlama yöntemlerine kıyasla operatörün radyasyona maruz kalmasını en aza indirir 31,32,33. Çoğu durumda, böyle bir protokol, ilgili deneysel radyofarmasötik34'ü üretmek için bir merkeze yetki vermeden önce, bir araştırma tıbbi ürün dosyasının (IMPD) bir parçası olarak düzenleyici makamlar tarafından beklenir. Bugüne kadar, anti-FAP psödopeptitlerinin otomatik 68Ga radyo-işaretlemesi hakkında çok az ayrıntılı bilgi literatürdemevcuttur 29,35,36,37,38. Ayrıca, rapor edilen veriler genellikle yalnızca belirli bir sentezleyici modeli için geçerlidir. Kullanılan 68Ga jeneratör tipi, ticari olarak mevcut farklı çözümler, otomatik radyoetiketleme koşulları üzerinde doğrudan bir etkiye sahip olabilen HCl'de (genellikle 0,1 M) belirli hacimlerde 68Ga3+ elüat ile karakterize edildiğinden, belirli özgüllükler de getirebilir.
Bu bağlamda, GAIA V2 sentez modülünü kullanarak 68Ga ile psödopeptid 3BP-3940'ın hızlı ve verimli otomatik radyo-etiketlemesi için ayrıntılı bir protokol sunuyoruz. Bu sentezleyici, sıvı akışını kontrol etmek için peristaltik bir pompaya bağlı, her biri beş manifolddan oluşan üç rampadan oluşan bir boru setinin kullanımına dayanır. Ayrıca, reaksiyon ortamı ısıtması için bir flakon fırınına, birkaç radyoaktivite probuna ve sistem içindeki bu parametreleri izlemek için bir basınç sensörüne sahiptir. Diğer bazı modeller kadar yaygın olmasa da, bu otomat merkezimizde rutin olarak kullanılmakta ve giderek artan sayıdatesise kurulmaktadır 31,39,40,41,42,43,44. Bu çalışmada 68Ga elüat ön saflaştırılmadan bir GALLIAD 68 Ge/68Ga jeneratörü kullanılmıştır. Bu yöntem, [68Ga]Ga-3BP-3940 üretimi için sağlam, hızlı ve kullanışlı bir çözüm sunmak üzere tasarlanmıştır ve ayrıca radyoetiketleme sırasında operatörler için radyasyon korumasını optimize eder. Bu aynı zamanda, bu spesifik sentezleyici modelinde ve bu kadar ayrıntılı olarak rapor edilen bu radyofarmasötik için ilk hazırlık protokolüdür.
Protokol
NOT: Bu protokol radyoizotoplarla çalışmayı içerir. Bu prosedürü uygulayan herkes, mühürsüz radyoaktif maddelerin kullanımı konusunda uygun şekilde eğitilmiş olmalı ve kurumlarının radyasyon güvenliği görevlisinden onay almalıdır. Otomatik sentezleyici, belirlenmiş korumalı bir sıcak hücreye yerleştirilmelidir. Radyoaktif malzemeleri içeren herhangi bir manuel prosedür de korumalı bir sıcak hücrede veya uygun radyasyon kalkanının arkasında gerçekleştirilmelidir.
1. Reaktiflerin hazırlanması
NOT: [68Ga]Ga-3BP-3940'ın otomatik üretimi için gerekli reaktifler (Malzeme Tablosuna bakınız) bir radyofarmasötik hazırlama ünitesinde (GMP derece C temiz oda) hazırlanmıştır. Reaktifler herhangi bir sırayla ve sentezden 2 saat öncesine kadar hazırlanabilir.
- Tampon çözeltisinin hazırlanması (sodyum asetat 0.8 M)
- Aşağıdaki hammaddeyi edinin: sodyum asetat trihidrat EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- Doğru şekilde tanımlanmış steril bir kapta (örneğin, mikrosantrifüj tüpü, 5 mL), hassas bir terazi kullanarak 544.32 mg'a yakın tam bir sodyum asetat trihidrat kütlesini tartın.
- Kalibre edilmiş bir mikropipet ve steril koniler kullanarak, sodyum asetatı 5 mL'ye yakın bir enjeksiyon için su hacminde (WFI) çözündürün, böylece WFI aşağıda açıklandığı gibi olur.
WFI hacmi = (tartılan tampon kütlesi x 5)/544.32 - Çözeltiyi vorteksleyin ve çözündürmeyi kolaylaştırmak için ultrasonik bir banyodan (40 kHz, ~ 1 dakika) geçirin.
- 21G iğne ile donatılmış 10 mL'lik bir şırınga kullanarak tampon çözeltisini geri çekin. Şırınga ile yeni bir iğne arasına 0.22 μm'lik bir filtre takın, ardından septumunun dezenfeksiyonundan sonra tampon çözeltisini doğrudan uygun şekilde tanımlanmış steril sızdırmaz bir şişeye (örn., TC-ELU 5) filtreleyin.
- Anti-radyoliz bileşik çözeltisinin hazırlanması (metiyonin 10 mg / mL)
- Aşağıdaki hammaddeyi elde edin: L-Metionin (Ph. Eur., USP) saf, ilaç sınıfı.
- Doğru şekilde tanımlanmış steril bir kapta (örneğin, 5 mL'lik mikrosantrifüj tüpü), hassas bir terazi kullanarak 50 mg'a yakın tam bir L-metiyonin kütlesini tartın.
- Kalibre edilmiş bir mikropipet ve steril koniler kullanarak, L-metiyonini 5 mL'ye yakın bir WFI hacminde çözündürün, böylece WFI aşağıda açıklandığı gibi olur.
WFI hacmi = (tartılan tampon kütlesi x 5)/50 - Çözeltiyi vorteksleyin ve çözündürmeyi kolaylaştırmak için ultrasonik bir banyodan (40 kHz, ~ 1 dakika) geçirin.
- 21G iğne ile donatılmış 10 mL'lik bir şırınga kullanarak metiyonin çözeltisini geri çekin. Şırınga ile yeni iğne arasına 0,22 μm'lik bir filtre takın, ardından septumunun dezenfeksiyonundan sonra çözeltiyi doğrudan uygun şekilde tanımlanmış steril sızdırmaz bir şişeye (örneğin, TC-ELU 5, Curium) filtreleyin.
2. Kalite kontrolleri için ekipmanın hazırlanması
- Nihai ürünün pH kontrolü
- Uygun bir koruyucu kalkanın arkasına, nihai ürünün daha sonra kontrol edilmesi için bir pH kağıdı şeridi yerleştirin.
- Radyo-TLC ile radyokimyasal saflık kontrolü
- Uygun mobil fazları içeren iki TLC geçiş tankı hazırlayın. Mobil faz A: sitrat tamponu 0.1 M pH 4 suda, [68Ga]Ga-3BP-3940 için beklenen Rf = 0-0.2 ve serbest 68Ga3+ için Rf = 0.8-1. Mobil faz B: 1: 1 su ve metanol (v / v) karışımında 1 M amonyum asetat tamponu, [68Ga] galyum kolloidleri için beklenen Rf = 0-0.2 ve [68Ga] Ga-3BP-3940 için Rf = 0.8-1.
- Uygun bir koruyucu kalkanın arkasında, nihai ürünün RCP'sinin daha sonraki kontrolü için iki TLC migrasyon tankını iki iTLC-SG plakasının yanına yerleştirin.
- Radyokromatografı açın ve ilgili edinme yazılımını işletim bilgisayarında açın. Gerçekleştirilecek ilk analiz için kimlik bilgilerini önceden girin.
- Radyo-HPLC ile radyokimyasal saflık kontrolü
- Analiz için gerekli olan kolon modelinin (C18 ACE Eşdeğerliği) sistem üzerinde kurulu olduğunu kontrol ediniz.
- HPLC için taze mobil faz hazırlayın, yani HPLC +% 0.1 TFA (çözücü A) ve asetonitril +% 0.1 TFA (çözücü B) için su. Solvent A ve solvent B şişelerini radyo-HPLC üzerindeki ilgili hatlara bağlayın.
- İşletim bilgisayarını açın ve kontrol yazılımına bağlanın.
- Gerekirse, pompa modülündeki tahliye vanasını açın ve analiz için kullanılacak hatları (yani A hattı ve B hattı) boşaltın. Bu işlemden sonra tahliye vanasını kapatın.
- Sistemin, en az 20 dakika boyunca 0,6 mL/dk'lık bir akışla gradyanın başlangıcına eşit bir çözücü oranıyla (yani, %95 A /%5 B) dengelenmesine izin verin. [68Ga]Ga-3BP-3940 HPLC analiz dizisi için, 0,6 mL/dk'da tutulan akış hızını kullanın ve mobil faz gradyanını suda (A) %0,1 TFA'dan asetonitril (B)'de %0,1 TFA'ya aşağıdaki gibi programlayın: 0 - 1 dk 95/5 A/B; 95/5 A/B'den 60/40 A/B'ye kadar 1 - 8 dakikalık doğrusal gradyan; 8 - 9 dk 60/40 A/B; 60/40 A/B'den 95/5 A/B'ye 9 - 10 dakika doğrusal gradyan; 10 - 12 dk 95/5 A/B.
- Adım 2.3.5.'te açıklanan mobil faz gradyanına sahip analitik yöntemi seçin, ardından gerçekleştirilecek ilk analiz için tanımlama bilgilerini önceden girin.
- Korumalı bir kapta, analiz edilecek numuneyi almak için cam uçlu bir HPLC şişesi hazırlayın ve uygun bir koruyucu kalkanın arkasına yerleştirin.
3. Sentez modülünün hazırlanması
- Korumalı hücrenin gücünü ve ışığını açın. Sentezleyiciyi kontrol eden dizüstü bilgisayarı açın ve modül yazılımında oturum açın.
- Gerekirse, eski kiti sentezleyiciden çıkarın ve atıkları uygun kaplara atın.
- Sentez modülünü muhafaza eden korumalı kabinin içini ve sentezleyicinin kendisini geçerli hijyen standartlarına uygun olarak temizleyin.
- Sentezleyici yazılımında Kullanıcı tuşuna basın, ardından bir kullanıcı adı seçin ve açılır pencereye ilgili şifreyi girin. Yöntem'e basın ve [68Ga]Ga-3BP-3940 sentezi için önceden yapılandırılmış otomatik protokolü seçin.
- Hazırlık'a basın ve sentez başlığını, vektör parti numarasını, reaktif kiti parti numarasını ve tüm yorumları uygun metin kutusuna girin. Bu aşamada çeşitli kit hazırlama adımlarını içeren bir kontrol listesi de oluşturulabilir ve takip edilebilir (Ek Şekil 1).
4. Sentez kasetinin hazırlanması ve kaset montajı
- Radyofarmasi laboratuvarı tezgahını bir mendil ve uygun deterjan dezenfektanı ile temizleyin ve tezgahın üzerine steril bir örtü yerleştirin.
- Steril bir [68Ga]Ga etiketleme kaseti (referans RT-01-H) ve bir reaktif kiti (Ek Şekil 2) edinin. Boru setinin 3 rampası, modül üzerinde soldan sağa A, B ve C olarak tanımlanır; her rampanın manifoldları 1'den 5'e kadar yukarıdan aşağıya (rampa A ve C) veya soldan sağa (rampa B) numaralandırılmıştır.
- Aşağıdaki adımları izleyerek kaseti monte edin.
- [68Ga]Ga kaset zarfını açın, herhangi bir hasar olup olmadığını kontrol edin ve kasetteki her bir Luer bağlantısını sıkın. Tüm sivri kapakları çıkarın.
- 5 mL'lik bir Luer Lock şırıngası ve 21G iğnesi kullanarak, reaktif kitinden 5 mL mutlak etanol çekin ve çok yavaş bir şekilde C18 kartuşunun üzerinden geçirin, ardından 5 mL WFI (kitte verilmez) çekin ve ön koşullandırma için aynı C18 kartuşunun üzerinden çok yavaş bir şekilde geçirin.
- Boru setinin A rampasını sentez modülüne yerleştirin ve rampayı yerinde tutmak için iki mandalı çevirin. Dikey A1 hortumunun serbest ucunu 19G'lik bir iğneye bağlayın ve atık şişesine yerleştirin.
- Atık şişesine bir havalandırma iğnesi ekleyin ve tahliye şişesini alacak korumalı kabın arkasına en uygun şekilde geriye doğru konumlandırın. A0.22 konumuna 4 μm'lik bir filtre yerleştirin.
- Yatay A1 hortumunu modül ön panelinin sol alt kısmındaki basınç sensörüne bağlayın.
- Bir erkek/erkek adaptör kullanarak, 0,22 μ terminal filtresi ve 80 mm 20G iğne ile biten 30 cm'lik bir uzatmayı yatay A5 konumunda bağlayın.
- Yukarıda belirtilen 20G iğnesini kapalı, steril bir tahliye şişesine (örn., TC-ELU 5) yerleştirin, bir havalandırma iğnesi ekleyin ve tahliye şişesini korumalı kabına yerleştirin.
- Dikey A1'i dikey C1'e bağlayan boru hattını, rampa B'nin üzerindeki tutma kancalarının arkasına yerleştirin.
- A2 ve B1 yatay manifoldlarını, halihazırda A5 konumuna monte edilmiş adaptörü kullanarak kısa bir uzatma hattıyla (ya kite dahil değildir ya da başlangıçta yatay C2 konumuna bağlanmış olan) bağlayın.
- Rampa B'yi sentez modülüne yerleştirin ve rampayı yerinde tutmak için iki mandalı çevirin.
- YatayB18 valfini C2'ye bağlayan adaptörü solunda tutarak önceden koşullandırılmış C 5 kartuşunu yatay C2 konumuna bağlayın.
- Rampa C'yi sentez modülüne yerleştirin ve rampayı yerinde tutmak için iki mandalı çevirin.
- Bir erkek/erkek adaptör kullanarak yatay C50'ten 5 cm'lik bir uzatma hattını GALLIAD 68Ga jeneratörüne bağlayın.
- Boru setinin vitray reaksiyon şişesini modülün fırınına yerleştirin. Boruyu dikey A5'ten dikey C5'e kadar peristaltik pompaya dikkatlice yerleştirin, pompayı kapatın, borunun doğru yerleştirildiğini kontrol edin ve boruyu pompanın sol tarafındaki aktivite sensöründen geçirin.
- Kaset ve hortumun Şekil 2'de gösterildiği gibi henüz reaktifler olmadan radyosentezleyiciye monte edildiğinden emin olmak için bir ara kontrol yapın.
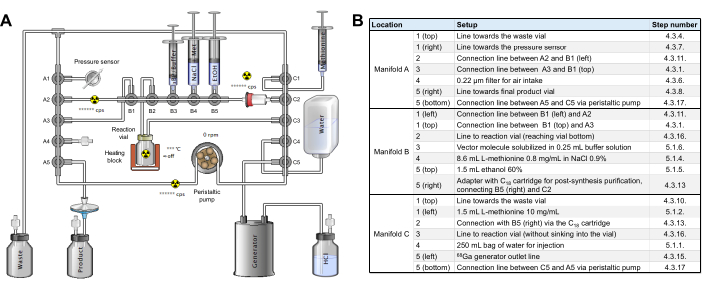
Şekil 2: Sentez modülü konfigürasyonu. (A) Sentez modülünde [68Ga]Ga-3BP-3940'ın otomatik sentezi için kurulum. (B) Bir GAIA sentez modülü kullanılarak [68Ga]Ga-3BP-3940'ın otomatik üretimi için reaktif pozisyonlarına ilişkin ayrıntılar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Reaktif kurulumu
- Rampalar modüle takıldıktan sonra, reaktifleri aşağıda açıklandığı gibi kurun.
- WFI 250 mL'lik torbayı reaktif kitinden Spike adaptörünü kullanarak C4 hortumuna bağlayın ve torbayı modülün sağ tarafındaki özel kancaya asın.
- 20G iğne ile donatılmış 3 mL'lik üç parçalı Luer Lock şırıngası kullanarak, önceden hazırlanmış L-metiyonin 10 mg / mL çözeltisinden 1.5 mL çekin, şırıngayı yatay C1 tüpüne bağlayın ve şırıngayı modülün sağ tarafındaki özel yuvaya asın. Tam sıvı transferini sağlamak için sıvı yüzeyi ile şırınga piston contası arasında yaklaşık 2 mL hava bırakın.
- 20G iğneli 1 mL'lik bir şırınga kullanarak, önceden hazırlanmış 10 mg / mL L-metiyonin çözeltisinden 750 μL çekin ve septumun dezenfeksiyonundan sonra reaktif kitinden %0.9 NaCl şişesine (mavi kıvrım) enjekte edin.
- 20G iğneli 10 mL'lik üç parçalı Luer Lock şırınga kullanarak,% 0.9 NaCl + L-metiyonin şişesinin (mavi kıvrım) içeriğini geri çekin, 8.6 mL'ye ayarlayın, Spike'ı B4 konumunda çıkarın, ardından şırıngayı B4'e bağlayın. Tam sıvı transferini sağlamak için sıvı yüzeyi ile şırınga piston contası arasında yaklaşık 2 mL hava bırakın.
- 20G iğneli 3 mL'lik üç parçalı Luer Lock şırınga kullanarak, septumun dezenfeksiyonundan sonra% 60 etanol şişesinin (turuncu kıvrım) içeriğini geri çekin. Hacmin en az 1,5 mL'ye eşit olduğunu kontrol edin, Spike'ı B5 konumunda çıkarın, ardından şırıngayı bunun yerine B5'e bağlayın. Tam sıvı transferini sağlamak için sıvı yüzeyi ile şırınga piston contası arasında yaklaşık 2 mL hava bırakın.
- 20G iğneli düşük ölü hacimli 1 mL'lik bir şırınga kullanarak, önceden hazırlanmış 0.8 M sodyum asetat tampon çözeltisinin 0.25 mL'sini geri çekin ve ardışık enjeksiyonlar / yeniden aspirasyon döngüleri ile çözündürmek için 30 μg 3BP-3940 içeren şişeye enjekte edin. 0.25 mL çözeltiyi aynı şırıngaya çekin, iğneyi ayırın ve tampon + vektör şırıngasını B3'e yerleştirin. Tam sıvı transferini sağlamak için sıvı yüzeyi ile şırınga pistonu arasında yaklaşık 0.25 mL hava bırakın.
- Sentezin başlamasından önce aşağıda açıklandığı gibi son bir kontrol yapın.
- Şekil 3'te gösterildiği gibi tüm reaktiflerin kasete veya boruya bağlı olduğunu doğrulayın.
- Kitin bağlantılarının her birinin yeterince sıkı olduğundan emin olun. Borunun sıkışmadığından veya açılı olmadığından emin olun.
- Sistem hazır. Ön paneli kapatın ve korumalı hücrenin havalandırmasını açın.

Şekil 3: Kit kurulumu. 68Ga ile 3BP-3940'ın radyo-etiketlemesi için boru setinin ve reaktiflerin sentezleyici üzerindeki son kurulumu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. [68Ga]Ga-3BP-3940 üretimi için otomatik radyo etiketleme dizisi
- Tüm reaktifler rampalara yerleştirildiğinde ve tüm bilgiler yazılıma doğru bir şekilde kaydedildiğinde Sentezi Çalıştır'a tıklayın.
- Sentez dizisi boyunca boru setindeki tipik bir radyoaktivite dağılımı profili şurada gösterilmiştir: Şekil 4. Hazırlamak için otomatik yöntemdeki ardışık adımları izleyin [68Ga]Ga-3BP-3940 aşağıda açıklandığı gibi.
- Kit bütünlük testleri: Borunun atık şişeye doğru kısa bir tahliyesinden sonra (esasen C18 kartuşunda kalan sıvıyı çıkarmak için), sistem A4'ü açarak ve peristaltik pompa aracılığıyla filtrelenmiş havayı pompalayarak iç basıncını artırır. A1'e bağlı basınç sensörü 1500 mbar'> bir boru basıncı algıladığı anda sistem kapanır ve peristaltik pompa durur. Basınç düşüşü 15 saniye boyunca 400 mbar'ı aşmazsa, kitin bütünlük testinin başarılı olduğunu değerlendirin ve senteze başlayın. Test başarısız olursa, bir sistem sızıntısından şüphelenin ve sentez dizisini iptal edin.
- Reaksiyon şişesine vektör ilavesi: Tampon çözeltisinde çözündürülen 3BP-3940'ın, manifold B2 aracılığıyla yaklaşık 30 saniye içinde reaksiyon şişesine çekildiğinden emin olun.
- Reaksiyon şişesine L-metiyonin ilavesi: C1'deki şırıngada bulunan metiyonin çözeltisinin, manifold B2 aracılığıyla, aşağı rampa C ve daha sonra rampa A'da manifold A2 ile dallanmak üzere rampa A'ya aktarıldığından emin olun.
- C18 kartuşunun WFI ile etkinleştirilmesi: Torbada C4'te bulunan WFI'nin C18 kartuşunun üzerinden geçtiğinden emin olun, ayrıca vektör ve metiyonin çözeltilerinin izlediği yollarda A, B ve C rampalarını durulayın. Aynı yollar daha sonra filtrelenmiş hava ile yıkanır, böylece sonraki adımlar için boruda su kalmamasını sağlar.
- Reaksiyon şişesinde jeneratör elüsyonu (manuel müdahale): GALLIAD jeneratörünü boşaltmak için, 10-20 saniye beklemeden önce jeneratörün üstündeki yeşil düğmeyi yükleme konumuna 90° çevirin: bu süre jeneratörün 1,1 mL'lik sabit bir elüat hacmi hazırlamasına izin verir. Yeşil düğmeyi başlangıç konumuna getirin ve Kontrol yazılımındaki prompter'a tıklayın. Peristaltik pompa daha sonra 68Ga elüatı 3 dakikalık bir süre boyunca reaksiyon şişesine çeker. Bu zaman aralığı boyunca, reaksiyon şişesinin sıcaklığı, radyoetiketleme adımı için ayarlanan sıcaklığa daha hızlı ulaşmak için kademeli olarak 1 dakika boyunca 60 °C'ye, ardından 2 dakika boyunca 90 °C'ye yükseltilir.
- Radyoetiketleme: Radyoetiketleme adımının başlangıcında, hızlı ve verimli ısıtma sağlamak için 30 saniye boyunca 120 °C'lik bir ayar noktası sıcaklığının uygulandığını kontrol edin. Ayar noktası sıcaklığının daha sonra 2 dakika boyunca 98 °C'ye ayarlandığını kontrol edin. Reaksiyon şişesindeki ısınma ve basınç artışı nedeniyle, reaksiyon ortamının bir kısmı B2'ye bağlı boruya geri akma eğilimindedir. Bunu sınırlamak için, 2 dakikalık ısıtmadan sonra 10 saniyelik bir hat temizleme ayarlanır; Daha sonra radyoetiketleme yaklaşık 5,5 dakika devam eder.
- C18 kartuşunda yakalama: Filtrelenmiş havanın reaksiyon kabına C3 tarafından pompalandığından emin olun. Sıvının yüzeyine uygulanan basınç, reaksiyon ortamının B2'ye bağlı borudan yukarı doğru akmasına ve ardından SPE kartuşuna akmasına izin verir. Reaksiyon şişesi daha sonra C4'teki torbadan WFI ile durulanır ve bu durulama sıvısı aynı şekilde SPE kartuşuna aktarılır. Kartuş sonunda taze WFI ile durulanır ve filtrelenmiş hava ile yıkanır.
- C18 kartuşunun ve formülasyonunun elüsyonu (NaCl %0.9 + L-metiyonin ilavesi): SPE kartuşu başlangıçta radyoaktif işaretli ürünü ve herhangi bir galyum kolloidini tutar ve serbest 68Ga3 + 'nın geçmesine izin verir. Kartuşu elüte etmek ve terminal şişesinde [68Ga] Ga-3BP-3940'ı geri kazanmak için, NaCl% 0.9 (her biri 3x 0.5 mL) içinde ardışık etanol fraksiyonlarının% 60 ve metiyonin ~ 0.9 mg / mL fraksiyonlarının elüsyon için kartuşun üzerine çekildiğinden emin olun. B4'teki şırınganın tüm içeriği daha sonra terminal şişesinde %<10'luk bir nihai etanol konsantrasyonu elde etmek için bir formülasyon adımında C18 kartuşundan geçirilir.
- Filtre bütünlük testi (manuel müdahale): Terminal şişesinin sentezi ve çıkarılmasından sonra, bir kabarcık noktası testi kullanarak terminal filtrenin bütünlüğünü kontrol etmek için terminal filtresini atık şişeye bağlamanızı ve havalandırma filtresini atık şişeden çıkarmanızı isteyen istemi izleyin. Kabarcık noktası testi sırasında, filtre başlangıçta WFI tarafından 30 saniye boyunca ıslatılır. Hatlar temizlendikten sonra, sistemdeki basınç <2 dakika boyunca yavaş yavaş >2500 mbar'a kadar yükseltilir, bu sırada sentezleyici filtrenin çıkışında basınç artışı olup olmadığını kontrol eder. Ardından, sistem kabarcık noktasını kontrol etmek için basıncı yavaşça artırır. Sentezleyici, kabarcık noktası basıncını belirlemek için filtre çıkışındaki basınç arttığında son olarak basıncı kaydedecektir.
- Sentezin sonunda, otomat yazılımı, radyoetiketlemenin seyrini açıklayan ve reaksiyon şişesindeki sıcaklıkları, sistemdeki basınçları ve ilgili radyoaktivite miktarlarını izleyen bir sentez raporu oluşturur (Şekil 4). Tamamlayıcı olarak, bozunmaya göre düzeltilmiş radyokimyasal verimi (RCY) aşağıdaki formüle göre manuel olarak hesaplayın:
RCY =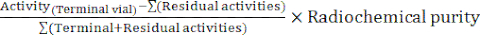
reaksiyon şişesinde, C18 kartuşunda ve sentezin sonunda atık şişede kalan aktiviteleri tanımlayan kalıntı aktiviteler ile.
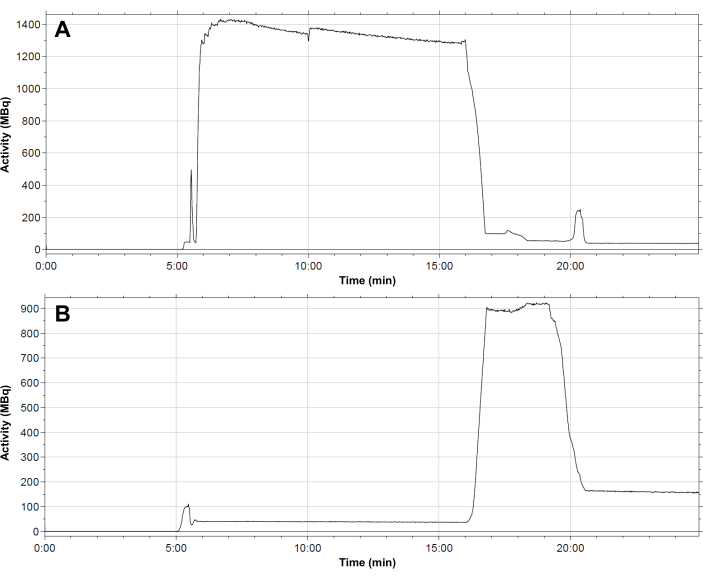
Şekil 4: Modül içindeki radyoaktivitenin tipik dağılım profili. (A) reaksiyon şişesi; (B) [68Ga]Ga-3BP-3940 sentezi sırasında C18 kartuşu. 68Ga elüatın reaksiyon şişesine akışı 6 dakikada gerçekleşir. Aktivite, radyoetiketleme reaksiyonu boyunca reaksiyon şişesinde kalır. 16 dakika sonra, aktivite SPE kartuşuna aktarılır. Kartuş 19,5 dakika sonra ayrıştırılır, bundan sonra sabit fazda yaklaşık 150 MBq'lik bir kalıntı aktivite kalır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. [68Ga] Ga-3BP-3940'ın dağıtım ve kalite kontrolleri
- Terminal şişeyi radyoaktivite ölçümü ve hasta dozu hazırlığı için uygun bir korumalı hücreye aktarın.
- Terminal şişenin aktivitesini uygun şekilde kalibre edilmiş bir doz kalibratörü ile ölçün ve hazırlığı bilgisayara kaydedin.
- Şişeyi doğru bir şekilde tanımlayın ve uygun korumalı bir kaba koyun. Uygun aseptik teknikler ve radyasyondan korunma teknikleri kullanarak, kalite kontrolleri için terminal şişeden ~ 0,5 mL'lik bir numune çekin.
- Preparatın görünümünü görsel inceleme ile değerlendirin. pH kağıt şeridi üzerine bir damla ürün çözeltisi bırakarak preparatın pH'ını değerlendirin.
- Önceden hazırlanmış iki iTLC-SG plakasının her birine bir damla ürün çözeltisi bırakarak radyo-TLC ile radyokimyasal saflığı ölçün. Ardından, plakaların ilgili mobil fazlara geçmesine ve radyokromatograf tarafından okunmasına izin verin. Ürün sinyalinin eğrisi altındaki alanı ve safsızlık sinyalini ölçerek elde edilen radyokromatogramı entegre edin, ardından radyokimyasal saflığı aşağıdaki formüle göre hesaplayın:
RCP (%) = 100 - %AUCsafsızlık 1 - %AUCsafsızlık 2 - Önceden hazırlanmış HPLC şişesine ~ 50 μL preparat enjekte ederek radyo-HPLC ile radyokimyasal saflığı ölçün (bkz. adım 2.3.7). Şişeyi HPLC otomatik numune alma cihazında gerekli konuma yerleştirin ve analiz sırasını başlatın. Numune sisteme enjekte edildikten sonra, şişeyi otomatik numune alma cihazından çıkarın ve ışınlamayı en aza indirmek için korumalı kabına yerleştirin. Analizin sonunda, ürün sinyalinin eğrisi altındaki alanı ve safsızlık sinyallerini ölçerek elde edilen radyokromatogramı entegre edin, ardından radyokimyasal saflığı aşağıdaki formüle göre hesaplayın:
RCP (%) = 100 - Σ(%AUCsafsızlıkları) - 1 mL WFI içeren bir gama sayaç tüpüne ~ 5 μL preparat ekleyerek preparatta bulunan radyoizotopun yarı ömrünü (gama sayacı) kontrol edin. Tüpü gama sayacı ile art arda 10x sayın (her biri 1 dakikalık sayılarla). 10 ölçümde gözlemlenen radyoaktif bozunmaya dayalı olarak yarı ömrü hesaplayın.
- Yok olma fotonlarından 511 keV ve 1077 keV tepe noktalarını arayarak, gama sayacını kullanarak gama spektrometrisi analizi yaparak yarı ömür testi ile aynı numune üzerinde radyonüklidik kimlik testini gerçekleştirin.
- Önceki numunenin 48 saatlik bir bozunma periyodundan sonra radyonüklidik saflığı değerlendirin. Gama sayacında 120 dakikalık bir ölçüm gerçekleştirin, bu da 68Ge atılımından ve diğer uzun yarı ömürlü radyonüklid safsızlıklarından yerinde oluşan herhangi bir kalıntı 68Ga aktivitesinin tespit edilmesine izin verir.
8. [68Ga]Ga-3BP-3940 preparatının kararlılığı
- Zaman içinde stabilite için üç test partisini değerlendirin. Bu amaçla, EoS'tan hemen sonra ve sentezden 4 saat sonrasına kadar her saat terminal flakondan yaklaşık 200 μL preparat çekin.
- Yukarıda açıklanan prosedüre göre RCP'yi HPLC ile ölçmek için her zaman noktasında bir radyo-HPLC analizi yapın. Daha önce açıklanan prosedüre göre RCP'yi TLC ile ölçmek için her zaman noktasında Radyo-TLC analizleri gerçekleştirin.
Sonuçlar
GAIA modülünde geliştirilen sentez işlemi, 3BP-3940'ın 21-22 dakikada hızlı bir şekilde 68Ga radyo-etiketlenmesine izin verir. Bu protokol, 0,1M HCl'de 1,1 mL 68 Ga elüat üreten farmasötik sınıf 68Ge/68Ga jeneratör GALLIAD ile çalışmak üzere tasarlanmıştır. Reaksiyon tamponunun hacmi ve molaritesi, optimum radyoetiketleme45 için gerekli olan 3.5 ile 4 arasında bir reaksiyon pH'ı elde etmek için b...
Tartışmalar
Bu çalışma, bir GAIA modülü ve bir GALLIAD jeneratörü kullanarak [68Ga]Ga-3BP-3940'ın sentezi için GMP uyumlu bir otomatik hazırlama protokolü sunmaktadır. Bu yöntem, klinik PET görüntülemesi için PSMA ligandları44 ve diğer FAP inhibitörleri 43,46 gibi vektörlerin galyum-68 radyo-işaretlemesi için merkezimizde kullanılan protokollerden hafif modifikasyonlarla uyarlanmış...
Açıklamalar
Yazarların, bu çalışmayla ilgili olarak ifşa edilecek gerçek veya algılanan bir çıkar çatışmasına yol açacak hiçbir ticari ortaklığı veya finansman kaynağı yoktur.
Teşekkürler
Yazarlar, bu makalede sunulan radyoetiketleme reaksiyonlarının hazırlanmasındaki yardımları için Yasmine Soualy, Stéphane Renaud ve Élodie Gaven'e teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
Referanslar
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753 (2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68 (2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967 (2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16 (2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566 (2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821 (2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Osterkamp, F., et al. Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541 (2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452 (2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61 (2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141 (2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392 (2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4 (2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30 (2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211 (2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27 (2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824 (2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884 (2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448 (2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23 (2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034 (2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır