A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנה אוטומטית של [68Ga]Ga-3BP-3940 במודול סינתזה להדמיית PET של מיקרו-סביבת הגידול
In This Article
Summary
מחקר זה מתאר את התהליך האוטומטי לייצור [68Ga]Ga-3BP-3940 עם סינתיסייזר GAIA V2, להדמיית PET של חלבון הפעלה פיברובלסטים. כמו כן מוצגות תוצאות בדיקות בקרת איכות שבוצעו בשלוש קבוצות בדיקה.
Abstract
שיטה מהירה ויעילה פותחה במודול הסינתזה של GAIA לתיוג רדיו אוטומטי של גליום-68 של 3BP-3940, בדיקת הדמיה מולקולרית המכוונת לחלבון הפעלת הפיברובלסטים להדמיית טומוגרפיה של פליטת פוזיטרונים של מיקרו-סביבת הגידול. תנאי התגובה כללו מאגר אצטט (ריכוז סופי: 0.1 M), מתיונין כחומר אנטי-רדיוליזה (ריכוז סופי: 5.4 מ"ג/מ"ל), ו-30 מיקרוגרם של 3BP-3940, עם חימום למשך 8 דקות ב-98 מעלות צלזיוס. שלב טיהור אחרון על מחסנית C18 היה הכרחי כדי להשיג מוצר עם תווית רדיו בעל טוהר גבוה. לעומת זאת, ה-68Ga המיוצר על ידי הגנרטור שימש ישירות ללא שלב ריכוז על מחסנית חילופי קטיונים. הייצור של שלוש אצוות אימות אישר את אמינות השיטה, ואפשר סינתזה של [68Ga]Ga-3BP-3940 תוך 22.3 ±-0.6 דקות עם טוהר רדיוכימי גבוה (RCP), כפי שנקבע הן על ידי רדיו-HPLC (99.1% ± 0.1%) והן על ידי רדיו-TLC (99.2% ±-0.1%). התפוקה הרדיוכימית הממוצעת, המבוססת על ערכי RCP שנמדדו על ידי radio-HPLC, הייתה 74.4% ±-3.3%. היציבות של המוצר המסומן ברדיו הודגמה עד 4 שעות לאחר ההכנה. פרוטוקול זה מספק מתודולוגיה אמינה, מהירה ויעילה להכנה של [68Ga]Ga-3BP-3940, שניתן להעביר בקלות לסביבה קלינית.
Introduction
בשנים האחרונות, התמקדות במיקרו-סביבת הגידול (TME) משכה עניין רב ביישומים אבחנתיים וטיפוליים1. שפע סוגי התאים, מולקולות האיתות והמקרומולקולות של מטריצה חוץ-תאית (ECM) בתוך ה-TME מציע מגוון רחב של מטרות מולקולריות פוטנציאליות2. בקרב התאים המארחים השוכנים והחודרים, פיברובלסטים הקשורים לסרטן (CAFs) יוצרים תת-קבוצה מובחנת של פיברובלסטים בתוך ה-TME, השונה פנוטיפית מפיברובלסטים רגילים. CAFs ממלאים תפקידים מכריעים בהתקדמות הגידול, גרורות, התחמקות חיסונית ועמידות לטיפול באמצעות מאפיינים תאיים ומולקולריים ייחודיים3. תאים מזנכימליים אלה מציגים פנוטיפ מופעל המסומן על ידי ביטוי של חלבון הפעלת פיברובלסטים (FAP). מבחינה מולקולרית, CAFs מפרישים מערך מורכב של ציטוקינים, כימוקינים, גורמי גדילה (למשל, TGF-β, IL-6 ו-CXCL12), וחלבוני ECM (למשל, קולגן, פיברונקטין), המעצבים מחדש את ה-ECM ומטפחים סביבה פרו-גידולית4.
כחלבון ספציפי ביותר המתבטא יתר על המידה וממוקם על פני השטח החוץ-תאיים של קרום ה-CAF, FAP מציג את כל המאפיינים של מטרה מולקולרית אמינה, במיוחדעבור יישומי רפואה גרעינית ורדיו-פרמצבטיקה. בהקשר זה, מעכבי מולקולות קטנות מבוססי קינולין של FAP (FAPI), הפועלים עם קבוצת DOTA, פותחו והוכנסו במהירות לשימוש קליני 6,7,8. באופן ספציפי, FAPI-04 ו-FAPI-46 המסומנים עם גליום-68 (פולט β+, t1/2 = 68 דקות) להדמיית טומוגרפיה של פליטת פוזיטרונים (PET) הוכיחו ערך משמעותי במחלות פיברוטיות, קרדיולוגיה ואונקולוגיה 8,9, במיוחד עבור סרטן שבו [18F]fluorodeoxyglucose ([18F]FDG) הוא בעל תועלת מוגבלת10. עם זאת, בעוד שלא ניתן להכחיש את תרומתם להדמיית אונקולוגיה ומחלות לא ממאירות, FAPIs של מולקולות קטנות מציגות מגבלות מסוימות ליישומי טיפול רדיונוקלידים ממוקדים (TRT), במיוחד בשל זמן השהייה התוך-גידולי הלא אופטימלי שלהם, מה שעלול להוביל להקרנה לא מכוונת של רקמה בריאה11. כדי לטפל בבעיה זו, נבחנו מספר אסטרטגיות, כגון תכנון ליגנדים רב-ערכיים11,12 או שימוש ברדיונוקלידים טיפוליים עם זמן מחצית חיים קצר 13,14,15. כמו כן פותחו פיגומים מולקולריים חדשים עם זיקה גבוהה ל-FAP ומעוררים שיעור גבוה של הפנמת תאים.
אחד מהם הוא נגזרת הפסאודופפטיד FAP-2286. הוא מכיל רצף של 7 חומצות אמינו, מחזוריות ומקושר לכלטור DOTA על ידי חלק 16 של 1,3,5-בנזנטרימטנתיול. מחקר ראשוני בבני אדם הראה כי [68Ga]Ga-FAP-2286 מציג פרופיל התפלגות ביולוגית דומה ל-[68Ga]Ga-FAPI-46, עם קליטה פיזיולוגית מעט גבוהה יותר בכבד, בכליות ובלב17. במחקר זה, 64 חולים, בעיקר עם סרטן הצוואר, הכבד, הקיבה, הלבלב, השחלות והוושט, עברו הדמיית PET עם [68Ga]Ga-FAP-2286 לצורך קביעת שלב סרטן או גילוי הישנות המחלה: קליטה של [68Ga]Ga-FAP-2286 הייתה גבוהה באופן משמעותי מ-[18F]FDG בגידולים ראשוניים, גרורות בבלוטות הלימפה וגרורות מרוחקות, מה ששיפר את ניגודיות התמונה ואת יכולת זיהוי הנגעים. כל הגידולים הראשוניים נראו עם [68Ga]Ga-FAP-2286 PET/CT, בעוד ש-[18F]FDG PET/CT החמיץ כמעט 20% מהנגעים. עבור בלוטות לימפה מעורבות, שיעורי הזיהוי היו גבוהים יותר עם [68Ga]Ga-FAP-2286, כמו גם עבור גרורות בעצמות ובקרביים. מחקר אחר בקבוצה קטנה יותר של 21 חולים עם מגוון מחלות סרטן הדגים גם הוא את הרגישות המצוינת של חומר הדמיה זה, המשקף את יעילות האבחון של [68Ga]Ga-FAP-228618. מחקרים ספציפיים יותר התמקדו בסוג אחד של סרטן, כגון סרטן דרכי השתן או סרטן הריאות, והדגישו שוב את הפוטנציאל הגבוה של [68Ga]Ga-FAP-2286 להדמיה מולקולרית קלינית 4,5. בנוגע לטיפול, מחקר ראשוני בדק את השימוש ב-FAP-2286 עם תווית רדיו עם לוטטיום-177 (פולט β, t1/2 = 6.7 d) ב-11 חולים עם סרטן גרורתי מתקדם מגוון. רוב המטופלים קיבלו שני מחזורי טיפול במרווחים של 8 שבועות זה מזה, והמינון הממוצע שניתן למחזור היה 5.8 ±-2.0 GBq של [177Lu]Lu-FAP-2286. התרופה הדגימה שימור תוך גידולי ממושך, עם זמן מחצית חיים יעיל של כ-44 שעות בגרורות בעצמות. בהתחשב בתופעות הלוואי המקובלות, ממצאים אלה סללו את הדרך לניסויים קליניים בקנה מידה גדול יותר: הבטיחות והיעילות של [177Lu]Lu-FAP-2286 מוערכות כעת בניסוי הקליני שלב 1/2 LuMIERE, בחסות נוברטיס (NCT04939610)7,8. פרוטוקולי מחקר נוספים בקנה מידה קטן יותר מתועדים בספרות 9,20, ודיווחי מקרים מרובים פורסמו 21,22,23,24,25,26, המדגימים את היעילות והסבילות המצוינת של TRT זה.
שינויים מינימליים במבנה שנעשו ב-FAP-2286 הובילו ל-3BP-3940 האנלוגי האופטימלי (איור 1)27. למרות שהספרות המדעית על מולקולת וקטור זו נותרה מוגבלת, נערכו מחקרים מוקדמים הן להדמיה והן ליישומים טיפוליים. דו"ח ראשוני מתאר את השימוש ב-[68Ga]Ga-3BP-3940 ב-18 חולים עם קרצינומות גרורתיות שונות בשלב הסופי ומסיק כי תרופה רדיו-פרמצבטית זו היא חומר הדמיה PET מתאים, תוך שימת דגש על יחס הגידול לרקע המצוין שלה וספיגת כליות נמוכה מאוד28. בעבודה אחרת, חולה סרטן לבלב יחיד עם גרורות בכבד קיבל 150 MBq של [68Ga]Ga-3BP-3940 להדמיית PET, שהדגימה קליטה אינטנסיבית בגידול הראשוני ובנגעים גרורתיים29. אותו מטופל קיבל לאחר מכן מנה בודדת של 9.7 GBq של [177Lu]Lu-3BP-3940 עבור TRT. הטיפול נסבל היטב, ללא שינויים משמעותיים בסימנים החיוניים או בפרמטרים ביולוגיים. מחקר אחר הציג את התוצאות האנושיות הראשוניות של גישה תרנוסטית באמצעות 3BP-3940: מטופלים נבחרו עם הדמיית PET [68Ga]Ga-3BP-3940 ולאחר מכן קיבלו 3BP-3940 עם איזוטופים שונים (177Lu, 90Y או 225Ac), שניתנו לבד או בשילובים מקבילים (למשל, 177Lu + 225Ac) ב-1-5 מחזורי טיפול30. התוצאות כללו הפוגה מלאה אחת, ארבע הפוגות חלקיות, שלוש מחלות יציבות ו-12 התקדמות המחלה. ההישרדות הכוללת החציונית של הקבוצה (n = 28) הייתה 9 חודשים מתחילת TRT.

איור 1: המבנה הכימי של [68Ga]Ga-3BP-3940. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תהליך תיוג הרדיו של 68Ga עבור תרופות רדיו-פרמצבטיות ניסיוניות כגון FAP-2286 ו-3BP-3940 כולל בדרך כלל מודול סינתזה לאוטומציה של שלב ההכנה. יש לציין כי אוטומציה של שיטות מבטיחה חוסן תהליכים ועמידה ב-GMP וממזערת את החשיפה לקרינה של המפעיל בהשוואה לשיטות הכנה ידניות 31,32,33. במקרים רבים, פרוטוקול כזה צפוי על ידי רשויות רגולטוריות כחלק מתיק מוצר רפואי ניסיוני (IMPD) לפני אישור מרכז לייצר את הרדיו-פרמצבטיקה הניסיוניתהמקבילה 34. נכון להיום, מעט מאוד מידע מפורט על תיוג רדיו אוטומטי של 68Ga של פסאודופפטידים נגד FAP זמין בספרות 29,35,36,37,38. יתר על כן, הנתונים המדווחים חלים בדרך כלל רק על דגם נתון של סינתיסייזר. סוג מחולל 68Ga המשמש יכול גם להביא ספציפיות מסוימת, שכן הפתרונות השונים הזמינים מסחרית מאופיינים בנפחים ספציפיים של 68Ga3+ eluate ב-HCl (בדרך כלל 0.1 M), מה שיכול להשפיע ישירות על תנאי תיוג הרדיו האוטומטיים.
בהקשר זה, אנו מציגים פרוטוקול מפורט לתיוג רדיו אוטומטי מהיר ויעיל של הפסאודופפטיד 3BP-3940 עם 68Ga, תוך שימוש במודול הסינתזה GAIA V2. סינתיסייזר זה מסתמך על שימוש בסט צינורות המורכב משלוש רמפות של חמש סעפות כל אחת, המחוברות למשאבה פריסטלטית כדי לשלוט בזרימת הנוזל. הוא כולל גם תנור בקבוקון לחימום בינוני תגובה, מספר בדיקות רדיואקטיביות וחיישן לחץ לניטור פרמטרים אלה בתוך המערכת. למרות שאינו נפוץ כמו כמה דגמים אחרים, אוטומטון זה משמש באופן שגרתי במרכז שלנו ומותקן במספר הולך וגדל של מתקנים 31,39,40,41,42,43,44. בעבודה זו נעשה שימוש בגנרטור GALLIAD 68Ge/68Ga ללא טיהור מוקדם של ה-68Ga eluate. שיטה זו נועדה להציע פתרון חזק, מהיר ונוח לייצור [68Ga]Ga-3BP-3940, תוך אופטימיזציה של הגנת הקרינה עבור מפעילים במהלך תיוג רדיו. זהו גם פרוטוקול ההכנה הראשון של רדיו-פרמצבטיקה זו שדווח על מודל סינתיסייזר ספציפי זה, ובפירוט כזה.
Protocol
הערה: פרוטוקול זה כולל עבודה עם רדיואיזוטופים. כל מי שמבצע הליך זה חייב להיות מאומן כראוי בטיפול בחומרים רדיואקטיביים לא אטומים וחייב לקבל אישור מממונה בטיחות הקרינה של המוסד שלו. יש למקם את הסינתיסייזר האוטומטי בתא חם מסוכך ייעודי. כל הליכים ידניים הכוללים חומרים רדיואקטיביים צריכים להתבצע גם בתא חם מוגן או מאחורי מיגון קרינה מתאים.
1. הכנת ריאגנטים
הערה: הריאגנטים הנדרשים לייצור אוטומטי של [68Ga]Ga-3BP-3940 (ראה טבלת חומרים) הוכנו ביחידת הכנת תרופות רדיו-פרמצבטיות (חדר נקי בדרגת GMP C). ניתן להכין ריאגנטים בכל סדר ועד שעתיים לפני הסינתזה.
- הכנת תמיסת חיץ (נתרן אצטט 0.8 מ')
- רכוש את חומר הגלם הבא: נתרן אצטט טריהידרט EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- במיכל סטרילי (למשל, צינור מיקרוצנטריפוגה, 5 מ"ל) שזוהה כהלכה, שקלו מסה מדויקת של נתרן אצטט טריהידרט קרוב ל-544.32 מ"ג באמצעות איזון מדויק.
- באמצעות מיקרופיפטה מכוילת וקונוסים סטריליים, ממיסים נתרן אצטט בנפח מים להזרקה (WFI) קרוב ל-5 מ"ל כך ש-WFI יהיה כמתואר להלן.
נפח WFI = (מסת מאגר שקולה x 5)/544.32 - מערבל את התמיסה והעביר אותה דרך אמבטיה אולטרסאונד (40 קילו-הרץ, ~1 דקה) כדי להקל על המסה.
- בעזרת מזרק של 10 מ"ל המצויד במחט 21G, משוך את תמיסת החיץ. התקן מסנן של 0.22 מיקרומטר בין המזרק למחט חדשה, ולאחר מכן סנן את תמיסת החיץ ישירות לבקבוקון אטום סטרילי שזוהה כהלכה (למשל, TC-ELU 5) לאחר חיטוי המחיצה שלו.
- הכנת תמיסת תרכובת אנטי רדיוליזה (מתיונין 10 מ"ג/מ"ל)
- רכוש את חומר הגלם הבא: L-מתיונין (Ph. Eur., USP) טהור, בדרגת פארמה.
- במיכל סטרילי (למשל, צינור מיקרוצנטריפוגה 5 מ"ל) שזוהה כהלכה, שקלו מסה מדויקת של L-מתיונין קרוב ל-50 מ"ג באמצעות איזון מדויק.
- באמצעות מיקרופיפטה מכוילת וחרוטים סטריליים, יש להמיס L-מתיונין בנפח של WFI קרוב ל-5 מ"ל כך ש-WFI יהיה כמתואר להלן.
נפח WFI = (מסת מאגר שקולה x 5)/50 - מערבל את התמיסה והעביר אותה דרך אמבטיה אולטרסאונד (40 קילו-הרץ, ~1 דקה) כדי להקל על המסה.
- בעזרת מזרק של 10 מ"ל המצויד במחט 21G, משוך את תמיסת המתיונין. התקן מסנן של 0.22 מיקרומטר בין המזרק למחט החדשה, ולאחר מכן סנן את התמיסה ישירות לבקבוקון אטום סטרילי שזוהה כהלכה (למשל, TC-ELU 5, Curium) לאחר חיטוי המחיצה שלו.
2. הכנת ציוד לבקרת איכות
- בקרת pH של המוצר הסופי
- מאחורי מגן מגן מתאים, מקם רצועת נייר pH לבדיקה לאחר מכן של המוצר הסופי.
- בקרת טוהר רדיוכימית על ידי רדיו-TLC
- הכן שני מיכלי הגירה TLC המכילים שלבים ניידים מתאימים. שלב נייד A: מאגר ציטראט 0.1 M pH 4 במים, עם Rf = 0-0.2 צפוי עבור [68Ga]Ga-3BP-3940 ו-Rf = 0.8-1 בחינם 68Ga3+. שלב B נייד: מאגר אמוניום אצטט 1 M בתערובת של 1:1 של מים ומתנול (v/v), עם Rf = 0-0.2 צפוי עבור [68Ga] קולואידים של גליום ו-Rf = 0.8-1 עבור [68Ga]Ga-3BP-3940.
- מאחורי מגן מגן מתאים, מקם את שני מיכלי הנדידה TLC ליד שתי לוחות iTLC-SG לשליטה לאחר מכן ב-RCP של המוצר הסופי.
- הפעל את הרדיוכרומטוגרף ופתח את תוכנת הרכישה המשויכת במחשב ההפעלה. הזן מראש את פרטי הזיהוי לניתוח הראשון שיבוצע.
- בקרת טוהר רדיוכימית על ידי רדיו-HPLC
- בדוק שמודל העמודות הנדרש לניתוח (C18 ACE Equivalence) מותקן במערכת.
- הכן שלב נייד טרי עבור HPLC, כלומר מים עבור HPLC + 0.1% TFA (ממס A) ואצטוניטריל + 0.1% TFA (ממס B). חבר את בקבוקי הממס A והממס B לקווים המתאימים ברדיו-HPLC.
- הפעל את מחשב ההפעלה והתחבר לתוכנת הבקרה.
- במידת הצורך, פתח את שסתום הטיהור במודול המשאבה ונקה את הקווים שישמשו לניתוח (כלומר, קו A וקו B). סגור את שסתום הטיהור לאחר פעולה זו.
- אפשר למערכת להתאזן עם שיעור של ממס השווה לתחילת השיפוע (כלומר, 95% A/5% B) עם זרימה של 0.6 מ"ל/דקה למשך 20 דקות לפחות. עבור רצף ניתוח HPLC [68Ga]Ga-3BP-3940, השתמש בקצב הזרימה הנשמר על 0.6 מ"ל/דקה, ותכנת את שיפוע הפאזה הנייד מ-0.1% TFA במים (A) ל-0.1% TFA באצטוניטריל (B) כדלקמן: 0 - 1 דקה 95/5 A/B; שיפוע ליניארי של 1 - 8 דקות מ- 95/5 A/B עד 60/40 A/B; 8 - 9 דקות 60/40 A/B; שיפוע ליניארי של 9 - 10 דקות מ- 60/40 A/B ל- 95/5 A/B; 10 - 12 דקות 95/5 A/B.
- בחר את השיטה האנליטית עם שיפוע הפאזה הנייד המתואר בשלב 2.3.5., ולאחר מכן הזן מראש את פרטי הזיהוי לניתוח הראשון שיבוצע.
- במיכל מסוכך, הכינו בקבוקון HPLC עם תוספת זכוכית כדי לקבל את הדגימה לניתוח ומקמו אותה מאחורי מגן מגן מתאים.
3. הכנת מודול הסינתזה
- הפעל את החשמל והאור של התא הממוגן. הפעל את המחשב הנייד השולט בסינתיסייזר והיכנס לתוכנת המודול.
- במידת הצורך, הוציאו את הערכה הישנה מהסינתיסייזר והשליכו פסולת למיכלים המתאימים.
- בצע ניקוי של פנים הארון המוגן המכיל את מודול הסינתזה ושל הסינתיסייזר עצמו בהתאם לתקני ההיגיינה החלים.
- בתוכנת הסינתיסייזר, לחץ על משתמש, ולאחר מכן בחר שם משתמש והזן את הסיסמה המשויכת בחלון המוקפץ. לחץ על שיטה ובחר את הפרוטוקול האוטומטי שהוגדר בעבר עבור הסינתזה [68Ga]Ga-3BP-3940.
- לחץ על הכנה והזן את כותרת הסינתזה, מספר אצווה וקטורית, מספר אצווה של ערכת ריאגנטים וכל הערות בתיבת הטקסט המתאימה. ניתן גם להגדיר רשימת בדיקה עם שלבי הכנת הערכה השונים ולעקוב אחריה בשלב זה (איור משלים 1).
4. הכנת קלטת הסינתזה והתקנת הקסטה
- נקו את שולחן העבודה של מעבדת הרדיו-פארמה עם מגבון וחומר החיטוי המתאים והניחו וילון סטרילי מעל שולחן העבודה.
- השג קלטת תיוג סטרילית [68Ga]Ga (התייחסות RT-01-H) וערכת ריאגנטים (איור משלים 2). 3 הרמפות של ערכת הצינורות מזוהות כ-A, B ו-C משמאל לימין במודול; הסעפות של כל רמפה ממוספרות מ-1 עד 5 מלמעלה למטה (רמפות A ו-C) או משמאל לימין (רמפה B).
- הרכיבו את הקסטה לפי השלבים הבאים.
- פרקו את מעטפת הקסטה [68Ga]Ga, בדקו אם יש נזק והדק כל חיבור Luer על הקסטה. הסר את כל מכסי הדוקרנים.
- בעזרת מזרק Luer Lock של 5 מ"ל ומחט 21G, משוך 5 מ"ל אתנול מוחלט מערכת הריאגנטים והעביר אותו לאט מאוד על מחסנית C18 , ואז משוך 5 מ"ל של WFI (לא מסופק בערכה) והעביר אותו לאט מאוד על אותה מחסנית C18 כדי לחמם אותו מראש.
- מקם את רמפה A של ערכת הצינורות על מודול הסינתזה וסובב את שני התפסים כדי להחזיק את הרמפה במקומה. חבר את הקצה החופשי של צינור A1 האנכי למחט 19G והכנס אותו לבקבוקון הפסולת.
- הוסף מחט אוורור לבקבוקון הפסולת ומקם אותה לאחור, בצורה אופטימלית מאחורי המיכל הממוגן שיקבל את בקבוקון הפינוי. הנח מסנן של 0.22 מיקרומטר במיקום A4.
- חבר את צינור ה-A1 האופקי לחיישן הלחץ בפינה השמאלית התחתונה של הפאנל הקדמי של המודול.
- באמצעות מתאם זכר/זכר, חבר במצב A5 אופקי הארכה של 30 ס"מ המסתיימת במסנן מסוף של 0.22 μ ומחט 80 מ"מ 20G.
- הכנס את מחט ה-20G הנ"ל לבקבוקון פינוי אטום וסטרילי (למשל, TC-ELU 5), הוסף מחט אוורור ומקם את בקבוקון הפינוי במיכל הממוגן שלו.
- הנח את קו הצינור המחבר את האנכי A1 ל-C1 האנכי מאחורי ווי השמירה מעל רמפה B.
- חבר את הסעפות האופקיות A2 ו-B1 עם קו הארכה קצר (או שאינו כלול בערכה, או זה שמחובר בתחילה במצב C5 אופקי), באמצעות המתאם שכבר מותקן במצב A2.
- מקם את רמפה B על מודול הסינתזה וסובב את שני התפסים כדי להחזיק את הרמפה במקומה.
- חבר את מחסנית C18 הממוזגת מראש למצב C2 האופקי, תוך שמירה על המתאם המחבר את שסתום B5 האופקי ל-C2 משמאלו.
- מקם את רמפה C על מודול הסינתזה וסובב את שני התפסים כדי להחזיק את הרמפה במקומה.
- באמצעות מתאם זכר/זכר, חבר קו הארכה של 50 ס"מ מ-C5 אופקי לגנרטור GALLIAD 68Ga.
- הנח את בקבוקון התגובה הצבעוני של ערכת הצינורות בתנור של המודול. הנח בזהירות את הצינור מ-A5 אנכי ל-C5 אנכי במשאבה הפריסטלטית, סגור את המשאבה, בדוק שהצינור ממוקם נכון, והעביר את הצינור דרך חיישן הפעילות בצד שמאל של המשאבה.
- בצע בדיקת ביניים כדי לוודא שהקסטה והצינורות מורכבים על הרדיו-סינתיסייזר כפי שמוצג באיור 2, ללא ריאגנטים עדיין.
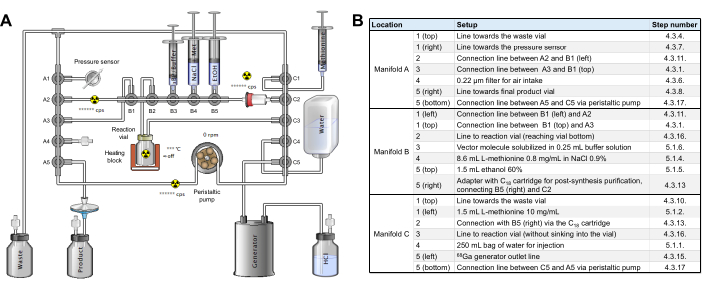
איור 2: תצורת מודול סינתזה. (A) הגדרה עבור סינתזה אוטומטית של [68Ga]Ga-3BP-3940 במודול הסינתזה. (ב) פרטים על מיקומי הריאגנטים לייצור אוטומטי של [68Ga]Ga-3BP-3940 באמצעות מודול סינתזה של GAIA. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
5. התקנת ריאגנטים
- לאחר התקנת הרמפות על המודול, התקן את הריאגנטים כמתואר להלן.
- חבר את שקית WFI 250 מ"ל מערכת הריאגנט לצינור C4 באמצעות מתאם הספייק, ותלה את השקית על הוו הייעודי בצד ימין של המודול.
- באמצעות מזרק Luer Lock 3 מ"ל שלושה חלקים המצויד במחט 20G, משוך 1.5 מ"ל מתמיסת L-מתיונין 10 מ"ג/מ"ל שהוכנה בעבר, חבר את המזרק לצינור C1 האופקי ותלה את המזרק בחריץ הייעודי בצד ימין של המודול. השאירו כ-2 מ"ל אוויר בין משטח הנוזל לאטם הבוכנה של המזרק כדי להבטיח העברת נוזלים מלאה.
- באמצעות מזרק של 1 מ"ל עם מחט של 20 גרם, משוך 750 מיקרוליטר מתמיסת L-מתיונין שהוכנה בעבר בנפח 10 מ"ג/מ"ל והזריק לבקבוקון NaCl 0.9% (לחיצה כחולה) מערכת הריאגנטים, לאחר חיטוי המחיצה.
- בעזרת מזרק Luer Lock 10 מ"ל שלושה חלקים עם מחט 20G, משוך את תכולת בקבוקון ה-0.9% NaCl + L-methionine (לחיצה כחולה), התאם ל-8.6 מ"ל, הסר את ה-Spike במצב B4, ולאחר מכן חבר את המזרק ב-B4 במקום זאת. השאירו כ-2 מ"ל אוויר בין משטח הנוזל לאטם הבוכנה של המזרק כדי להבטיח העברת נוזלים מלאה.
- בעזרת מזרק Luer Lock 3 מ"ל שלושה חלקים עם מחט 20G, משוך את תכולת בקבוקון האתנול 60% (מלחץ כתום) לאחר חיטוי המחיצה. בדוק שעוצמת הקול שווה לפחות ל-1.5 מ"ל, הסר את הספייק במצב B5 ולאחר מכן חבר את המזרק ל-B5 במקום זאת. השאירו כ-2 מ"ל אוויר בין משטח הנוזל לאטם הבוכנה של המזרק כדי להבטיח העברת נוזלים מלאה.
- באמצעות מזרק בנפח מת נמוך של 1 מ"ל עם מחט 20G, משוך 0.25 מ"ל מתמיסת חיץ נתרן אצטט 0.8 M שהוכנה בעבר והזריק לתוך הבקבוקון המכיל 30 מיקרוגרם של 3BP-3940 כדי להמיס אותו על ידי מחזורי הזרקה/שאיבה חוזרת עוקבים. משוך את תמיסת ה-0.25 מ"ל לאותו מזרק, נתק את המחט והנח את מזרק המאגר + וקטור ב-B3. השאירו כ-0.25 מ"ל אוויר בין משטח הנוזל לבוכנת המזרק כדי להבטיח העברת נוזלים מלאה.
- בצע בדיקה אחרונה לפני תחילת הסינתזה כמתואר להלן.
- ודא שכל הריאגנטים מחוברים לקסטה או לצינור, כפי שמוצג באיור 3.
- ודא שכל אחד מחיבורי הערכה הדוק מספיק. ודא שאף צינור אינו צבוט או בזווית.
- המערכת מוכנה. סגור את הלוח הקדמי והפעל את אוורור התא המוגן.

איור 3: הגדרת ערכה. התקנה סופית של סט הצינורות והריאגנטים על הסינתיסייזר לתיוג רדיו של 3BP-3940 עם 68Ga. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
6. רצף תיוג רדיו אוטומטי לייצור [68Ga]Ga-3BP-3940
- לחץ על הפעל סינתזה כאשר כל הריאגנטים ממוקמים על הרמפות וכל המידע נרשם כהלכה בתוכנה.
- פרופיל טיפוסי של התפלגות רדיואקטיביות במערכת הצינורות לאורך רצף הסינתזה מוצג ב איור 4. בצע את השלבים העוקבים בשיטה האוטומטית להכנת [68Ga]Ga-3BP-3940 כמתואר להלן.
- בדיקות תקינות הערכה: לאחר טיהור קצר של הצינור לכיוון בקבוקון הפסולת (בעיקר כדי להסיר את כל הנוזלים שנותרו במחסנית C18 ), המערכת מגבירה את הלחץ הפנימי שלה על ידי פתיחת A4 ושאיבת אוויר מסונן דרך המשאבה הפריסטלטית. ברגע שחיישן הלחץ המחובר ל-A1 מזהה לחץ צינור >-1500 mbar, המערכת נסגרת והמשאבה הפריסטלטית נעצרת. אם ירידת הלחץ אינה עולה על 400 mbar על פני 15 שניות, הערך את בדיקת התקינות של הערכה כמוצלחת והתחל בסינתזה. אם הבדיקה נכשלת, יש לחשוד בדליפת מערכת ולבטל את רצף הסינתזה.
- הוספת וקטור לבקבוקון התגובה: ודא שה-3BP-3940 המסיס בתמיסת המאגר נמשך לתוך בקבוקון התגובה בסביבות 30 שניות, דרך סעפת B2.
- הוספת L-מתיונין לבקבוקון התגובה: ודא שתמיסת המתיונין הכלולה במזרק ב-C1 מועברת לבקבוקון התגובה דרך סעפת B2, במורד רמפה C ולאחר מכן במעלה רמפה A כדי להסתעף ברמפה B על ידי סעפת A2.
- הפעלת מחסנית C18 עם WFI: ודא שה-WFI הכלול בתיק ב-C4 מועבר מעל מחסנית C18 , תוך שטיפת רמפות A, B ו-C בנתיבים שאחריהם תמיסות הווקטור והמתיונין. לאחר מכן אותם מסלולים נשטפים באוויר מסונן כדי להבטיח שלא יישארו מים בצינור לשלבים הבאים.
- פליטת גנרטור בבקבוקון תגובה (התערבות ידנית): כדי לנטרל את גנרטור GLIAD, סובב את הכפתור הירוק על גבי הגנרטור ל-90° למצב הטעינה לפני ההמתנה של 10-20 שניות: זמן זה מאפשר לגנרטור להכין נפח פליטה קבוע של 1.1 מ"ל. החזר את הכפתור הירוק למקומו ההתחלתי ולחץ על ההנחיה בתוכנת הבקרה. לאחר מכן המשאבה הפריסטלטית שואבת את ה-68Ga לתוך בקבוקון התגובה במשך תקופה של 3 דקות. במהלך מרווח זמן זה, הטמפרטורה של בקבוקון התגובה עולה בהדרגה ל-60 מעלות צלזיוס במשך דקה אחת, ולאחר מכן ל-90 מעלות צלזיוס במשך 2 דקות, כדי להגיע לטמפרטורה שנקבעה לשלב תיוג הרדיו מהר יותר.
- תיוג רדיו: בדוק שבתחילת שלב תיוג הרדיו, מופעלת טמפרטורת נקודת הגדרה של 120 מעלות צלזיוס למשך 30 שניות כדי לאפשר חימום מהיר ויעיל. בדוק שטמפרטורת נקודת ההגדרה מותאמת ל-98 מעלות צלזיוס למשך 2 דקות. בשל עליית החימום והלחץ בבקבוקון התגובה, חלק ממדיום התגובה נוטה לזרום חזרה למעלה לתוך הצינור המחובר ל-B2. כדי להגביל זאת, נקבע טיהור קו של 10 שניות לאחר חימום של 2 דקות; לאחר מכן תיוג הרדיו נמשך כ-5.5 דקות.
- לכידה על מחסנית C18 : ודא שאוויר מסונן נשאב לתוך כלי התגובה על ידי C3. הלחץ המופעל על פני הנוזל מאפשר למדיום התגובה לזרום כלפי מעלה דרך הצינור המחובר ב-B2 ולאחר מכן למחסנית SPE. לאחר מכן שוטפים את בקבוקון התגובה עם WFI מהשקית ב-C4, ונוזל שטיפה זה מועבר למחסנית SPE באותו אופן. המחסנית נשטפת בסופו של דבר ב-WFI טרי ונשטפת באוויר מסונן.
- הסרת מחסנית C18 ופורמולה (תוספת של NaCl 0.9% + L-מתיונין): מחסנית ה-SPE שומרת בתחילה על המוצר המסומן ברדיו וכל קולואידים של גליום ומאפשרת מעבר חופשי של 68Ga3+ . כדי לנטרל את המחסנית ולשחזר [68Ga]Ga-3BP-3940 בבקבוקון המסוף, ודא ששברים עוקבים של אתנול 60% ומתיונין ~0.9 מ"ג/מ"ל ב-NaCl 0.9% (3x 0.5 מ"ל כל אחד) נמשכים מעל המחסנית לצורך פליטה. לאחר מכן, כל תכולת המזרק ב-B4 מועברת דרך מחסנית C18 בשלב ניסוח כדי להשיג ריכוז אתנול סופי של <10% בבקבוקון הסופי.
- בדיקת תקינות המסנן (התערבות ידנית): לאחר סינתזה והסרה של בקבוקון המסוף, עקוב אחר ההנחיה המבקשת לחבר את מסנן המסוף לבקבוקון הפסולת ולהסיר את מסנן האוורור מבקבוקון הפסולת על מנת לבדוק את תקינות מסנן המסוף באמצעות בדיקת נקודת בועות. במהלך בדיקת נקודת הבועה, המסנן נרטב בתחילה על ידי WFI למשך 30 שניות. לאחר טיהור הקווים, הלחץ במערכת מוגבר לאט עד >2500 מבר במשך <2 דקות, במהלכן הסינתיסייזר בודק שאין עליית לחץ על יציאת המסנן. לאחר מכן, המערכת מגבירה לאט את הלחץ כדי לבדוק את נקודת הבועה. הסינתיסייזר יתעד לבסוף את הלחץ כאשר הלחץ עולה על יציאת המסנן כדי לקבוע את לחץ נקודת הבועה.
- בסוף הסינתזה, תוכנת האוטומטון מייצרת דוח סינתזה המתאר את מהלך תיוג הרדיו ועוקב אחר הטמפרטורות בבקבוקון התגובה, הלחצים במערכת וכמויות הרדיואקטיביות המעורבות (איור 4). כהשלמה, חשב ידנית את התפוקה הרדיוכימית המתוקנת לדעיכה (RCY) על פי הנוסחה:
RCY =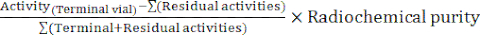
עם פעילויות שיוריות המתארות את הפעילויות שנותרו בבקבוקון התגובה, על מחסנית C18 ובבקבוקון הפסולת בסוף הסינתזה.
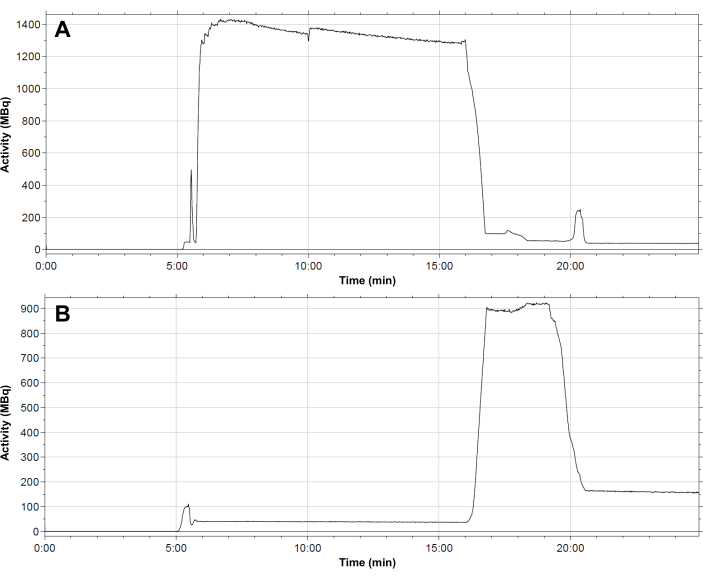
איור 4: פרופיל התפלגות טיפוסי של רדיואקטיביות בתוך המודול. (A) בקבוקון תגובה; (B) מחסנית C18 במהלך סינתזה של [68Ga]Ga-3BP-3940. הזרימה של 68Ga נפלטת לתוך בקבוקון התגובה מתרחשת תוך 6 דקות. הפעילות נשארת בבקבוקון התגובה לאורך כל תגובת תיוג הרדיו. לאחר 16 דקות, הפעילות מועברת למחסנית SPE. התרמיל נפלט לאחר 19.5 דקות, ולאחר מכן נותרה פעילות שיורית של כ-150 MBq בשלב הנייח. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
7. חלוקה ובקרת איכות של [68Ga]Ga-3BP-3940
- העבר את הבקבוקון הסופי לתא מוגן מתאים למדידת רדיואקטיביות והכנת מינון המטופל.
- מדוד את פעילות בקבוקון המסוף עם כיול מינון מכויל כהלכה ורשום את התכשיר במחשב.
- זהה את הבקבוקון בצורה נכונה והנח אותו במיכל מוגן מתאים. באמצעות טכניקות אספטיות מתאימות וטכניקות הגנה מפני קרינה, משוך דגימה של ~0.5 מ"ל מהבקבוקון הסופי לצורך בקרת איכות.
- העריכו את מראה התכשיר על ידי בדיקה חזותית. העריכו את ה-pH של התכשיר על ידי הפקדת טיפת תמיסת המוצר על רצועת נייר ה-pH.
- מדוד את הטוהר הרדיוכימי על ידי רדיו-TLC על ידי הפקדת טיפת תמיסת מוצר על כל אחת משתי לוחות ה-iTLC-SG שהוכנו בעבר. לאחר מכן, אפשר ללוחות לנדוד לשלבים הניידים המתאימים ולקרוא על ידי הרדיוכרומטוגרף. שלב את הרדיוכרומטוגרמה המתקבלת על ידי מדידת השטח מתחת לעקומת אות המוצר ואות הטומאה, ולאחר מכן חשב את הטוהר הרדיוכימי לפי הנוסחה:
RCP (%) = 100 - %טומאה AUC 1 - %טומאה AUC 2 - מדוד את הטוהר הרדיוכימי על ידי רדיו-HPLC על ידי הזרקת ~50 מיקרוליטר של התכשיר בבקבוקון HPLC שהוכן מראש (ראה שלב 2.3.7). מקם את הבקבוקון בדגימה האוטומטית של HPLC במיקום הנדרש והתחל את רצף הניתוח. לאחר הזרקת הדגימה למערכת, הסר את הבקבוקון מהדגימה האוטומטית והחלף אותו במיכל הממוגן שלו כדי למזער את ההקרנה. בתום הניתוח, שלב את הרדיוכרומטוגרמה המתקבלת על ידי מדידת השטח מתחת לעקומת אות המוצר ואותות הזיהומים, ולאחר מכן חשב את הטוהר הרדיוכימי לפי הנוסחה:
RCP (%) = 100 - Σ (%זיהומים של AUC) - בדוק את זמן מחצית החיים (מונה גמא) של הרדיואיזוטופ הכלול בתכשיר על ידי הוספת ~5 מיקרוליטר של תכשיר לצינור מונה גמא המכיל 1 מ"ל WFI. ספרו את הצינור עם מונה הגמא פי 10 ברציפות (ספירה של דקה אחת כל אחד). חשב את זמן מחצית החיים על סמך הדעיכה הרדיואקטיבית שנצפתה במהלך 10 המדידות.
- בצע את בדיקת הזהות הרדיונוקלידית על אותה דגימה כמו בדיקת מחצית החיים על ידי ביצוע ניתוח ספקטרומטריית גמא באמצעות מונה הגמא, בחיפוש אחר שיאי 511 keV ו-1077 keV מפוטוני השמדה.
- העריכו את הטוהר הרדיונוקלידי, לאחר תקופת דעיכה של 48 שעות של הדגימה הקודמת. בצע מדידה של 120 דקות במונה הגמא, המאפשר זיהוי של כל פעילות שיורית של 68Ga שנוצרה באתרה מפריצת דרך של 68Ge וזיהומים רדיונוקלידים ארוכים אחרים במחצית החיים.
8. יציבות הכנת [68Ga]Ga-3BP-3940
- הערך שלוש קבוצות בדיקה ליציבות לאורך זמן. למטרה זו, משוך כ-200 מיקרוליטר תכשיר מהבקבוקון הסופי כל שעה מיד לאחר ה-EoS ועד 4 שעות לאחר הסינתזה.
- בצע ניתוח רדיו-HPLC בכל נקודת זמן כדי למדוד RCP על ידי HPLC בהתאם לנוהל המתואר לעיל. בצע ניתוחי Radio-TLC בכל נקודת זמן כדי למדוד RCP על ידי TLC בהתאם לנוהל שתואר קודם לכן.
תוצאות
תהליך הסינתזה שפותח במודול GAIA מאפשר תיוג רדיו מהיר של 68Ga של 3BP-3940 תוך 21-22 דקות. פרוטוקול זה תוכנן לעבוד עם מחולל 68Ge/68Ga בדרגה פרמצבטית GALLIAD, המייצר 1.1 מ"ל של 68Ga eluate ב-0.1 M HCl. הנפח והמולריות של מאגר התגובה כוונו היטב בהתאם לכמות זו של חומצה כדי להשיג pH תגוב...
Discussion
עבודה זו מציגה פרוטוקול הכנה אוטומטי תואם GMP לסינתזה של [68Ga]Ga-3BP-3940 באמצעות מודול GAIA ומחולל GLIAD. שיטה זו הותאמה מהפרוטוקולים המשמשים במרכז שלנו לתיוג רדיו של גליום-68 של וקטורים כגון ליגנדים PSMA44 ומעכבי FAP אחרים43,46 להדמיית PET...
Disclosures
למחברים אין שותפויות מסחריות או מקורות מימון שיגרמו לניגוד אינטרסים אמיתי או מדומיין הקשור לעבודה זו.
Acknowledgements
המחברים מודים ליסמין סואלי, סטפן רנו ואלודי גייבן על עזרתם בהכנת תגובות תיוג הרדיו המוצגות בכתב היד הזה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
References
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753 (2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68 (2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967 (2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16 (2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566 (2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821 (2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Osterkamp, F., et al. Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541 (2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452 (2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61 (2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141 (2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392 (2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4 (2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30 (2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211 (2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27 (2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824 (2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884 (2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448 (2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23 (2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034 (2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved