É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação automatizada de [68Ga]Ga-3BP-3940 em um módulo de síntese para imagens PET do microambiente tumoral
Neste Artigo
Resumo
Esta pesquisa descreve o processo automatizado para produção de [68Ga]Ga-3BP-3940 com o sintetizador GAIA V2, para imagens PET da proteína de ativação de fibroblastos. Os resultados dos testes de controle de qualidade realizados em três lotes de teste também são apresentados.
Resumo
Um método rápido e eficiente foi desenvolvido no módulo de síntese GAIA para radiomarcação automatizada de gálio-68 de 3BP-3940, uma sonda de imagem molecular direcionada à proteína de ativação de fibroblastos para imagens de tomografia por emissão de pósitrons do microambiente tumoral. As condições de reação envolveram tampão acetato (concentração final: 0,1 M), metionina como agente anti-radiólise (concentração final: 5,4 mg/mL) e 30 μg de 3BP-3940, com aquecimento por 8 min a 98 °C. Uma etapa final de purificação em um cartucho C18 foi necessária para obter um produto radiomarcado de alta pureza. Em contraste, o 68Ga produzido pelo gerador foi usado diretamente sem uma etapa de concentração em um cartucho de troca catiônica. A produção de três lotes de validação confirmou a confiabilidade do método, permitindo a síntese de [68Ga]Ga-3BP-3940 em 22,3 ± 0,6 min com alta pureza radioquímica (RCP), conforme determinado por radio-HPLC (99,1% ± 0,1%) e rádio-TLC (99,2% ± 0,1%). O rendimento radioquímico médio, com base nos valores de RCP medidos por radio-HPLC, foi de 74,4% ± 3,3%. A estabilidade do produto radiomarcado foi demonstrada por até 4 h após o preparo. Este protocolo fornece uma metodologia confiável, rápida e eficiente para a preparação de [68Ga]Ga-3BP-3940, que pode ser facilmente transposta para um ambiente clínico.
Introdução
Nos últimos anos, o direcionamento do microambiente tumoral (TME) tem atraído considerável interesse em aplicações diagnósticas e terapêuticas1. A abundância de tipos de células, moléculas de sinalização e macromoléculas de matriz extracelular (MEC) dentro do TME oferece uma ampla gama de alvos moleculares potenciais2. Entre as células hospedeiras residentes e infiltrantes, os fibroblastos associados ao câncer (CAFs) formam um subconjunto distinto de fibroblastos dentro do TME, fenotipicamente diferente dos fibroblastos normais. Os CAFs desempenham papéis cruciais na progressão do tumor, metástase, evasão imunológica e resistência à terapia por meio de características celulares e moleculares únicas3. Essas células mesenquimais exibem um fenótipo ativado marcado pela expressão da proteína de ativação de fibroblastos (FAP). Molecularmente, as CAFs secretam uma matriz complexa de citocinas, quimiocinas, fatores de crescimento (por exemplo, TGF-β, IL-6 e CXCL12) e proteínas ECM (por exemplo, colágeno, fibronectina), que remodelam a ECM e promovem um ambiente pró-tumorigênico4.
Como uma proteína altamente específica que é superexpressa e localizada na superfície extracelular da membrana CAF, a FAP exibe todas as características de um alvo molecular confiável, especialmente para aplicações em medicina nuclear e radiofármaco5. Nesse contexto, inibidores de pequenas moléculas de FAP (FAPI) à base de quinolina, funcionalizados com um grupo DOTA, foram desenvolvidos e rapidamente introduzidos em uso clínico 6,7,8. Especificamente, FAPI-04 e FAPI-46 radiomarcados com gálio-68 (emissor β+, t1/2 = 68 min) para tomografia por emissão de pósitrons (PET) demonstraram valor significativo em doenças fibróticas, cardiologia e oncologia 8,9, particularmente para cânceres em que [18F]fluorodesoxiglicose ([18F]FDG) tem utilidade limitada10. No entanto, embora suas contribuições para a oncologia e imagens de doenças não malignas sejam inegáveis, os FAPIs de moléculas pequenas exibem certas limitações para aplicações de terapia com radionuclídeos direcionados (TRT), particularmente devido ao seu tempo de residência intratumoral abaixo do ideal, o que pode levar à irradiação não intencional de tecido saudável11. Para resolver essa questão, várias estratégias têm sido exploradas, como o desenho de ligantes multivalentes11,12 ou o uso de radionuclídeos terapêuticos com meias-vidas curtas 13,14,15. Novos andaimes moleculares com alta afinidade por FAP e desencadeando uma alta proporção de internalização celular também foram desenvolvidos.
Um deles é o derivado pseudopeptídico FAP-2286. Contém uma sequência de 7 aminoácidos, ciclizada e ligada a um quelante DOTA por uma porção 1,3,5-benzenotrimetantiol16. Um estudo inicial em humanos demonstrou que o [68Ga]Ga-FAP-2286 exibe um perfil de biodistribuição semelhante ao [68Ga]Ga-FAPI-46, com captação fisiológica ligeiramente maior no fígado, rins e coração17. Neste estudo, 64 pacientes, principalmente com câncer de pescoço, fígado, estômago, pâncreas, ovários e esôfago, foram submetidos a imagens PET com [68Ga]Ga-FAP-2286 para estadiamento do câncer ou detecção de recorrência: a captação de [68Ga]Ga-FAP-2286 foi notavelmente maior do que [18F]FDG em tumores primários, metástases linfonodais e metástases à distância, aumentando o contraste da imagem e a detectabilidade da lesão. Todos os tumores primários foram visíveis com [68Ga]Ga-FAP-2286 PET/CT, enquanto [18F]FDG PET/CT perderam quase 20% das lesões. Para linfonodos envolvidos, as taxas de detecção foram maiores com [68Ga]Ga-FAP-2286, bem como para metástases ósseas e viscerais. Outro estudo em um grupo menor de 21 pacientes com uma variedade de doenças oncológicas também demonstrou a excelente sensibilidade desse agente de imagem, refletindo a eficiência diagnóstica do [68Ga]Ga-FAP-228618. Estudos mais específicos têm se concentrado em um único tipo de câncer, como câncer urotelial ou de pulmão, destacando mais uma vez o alto potencial do [68Ga]Ga-FAP-2286 para imagens moleculares clínicas 4,5. Em relação à terapia, um estudo preliminar investigou o uso de FAP-2286 radiomarcado com lutécio-177 (emissor β-, t1/2 = 6,7 d) em 11 pacientes com diversos cânceres metastáticos progressivos19. A maioria dos pacientes recebeu dois ciclos de tratamento com intervalo de 8 semanas, e a dose média administrada por ciclo foi de 5,8 ± 2,0 GBq de [177Lu]Lu-FAP-2286. A droga demonstrou retenção intratumoral prolongada, com meia-vida efetiva de aproximadamente 44 h em metástases ósseas. Dados os efeitos colaterais aceitáveis, esses achados abriram caminho para ensaios clínicos em larga escala: a segurança e a eficácia do [177Lu]Lu-FAP-2286 estão atualmente sendo avaliadas no ensaio clínico de fase 1/2 LuMIERE, patrocinado pela Novartis (NCT04939610)7,8. Outros protocolos de pesquisa em menor escala estão documentados na literatura 9,20, e vários relatos de casos foram publicados 21,22,23,24,25,26, demonstrando a eficácia e excelente tolerabilidade desse TRT.
Modificações mínimas na estrutura feitas no FAP-2286 levaram ao análogo otimizado 3BP-3940 (Figura 1)27. Embora a literatura científica sobre essa molécula vetorial permaneça limitada, estudos iniciais foram conduzidos para aplicações terapêuticas e de imagem. Um relatório preliminar descreve o uso de [68Ga]Ga-3BP-3940 em 18 pacientes com vários carcinomas metastáticos em estágio terminal e conclui que este radiofármaco é um agente de imagem PET adequado, enfatizando sua excelente relação tumor-fundo e captação renal muito baixa28. Em outro trabalho, um único paciente com câncer de pâncreas com metástases hepáticas recebeu 150 MBq de [68Ga]Ga-3BP-3940 para PET, que demonstrou intensa captação no tumor primário e lesões metastáticas29. O mesmo paciente recebeu posteriormente uma dose única de 9,7 GBq de [177Lu]Lu-3BP-3940 para TRT. O tratamento foi bem tolerado, sem alterações significativas nos sinais vitais ou parâmetros biológicos. Um estudo diferente apresentou os resultados humanos iniciais de uma abordagem teranóstica usando 3BP-3940: os pacientes foram selecionados com imagens PET [68Ga]Ga-3BP-3940 e, em seguida, receberam 3BP-3940 marcado com diferentes isótopos (177Lu, 90Y ou 225Ac), administrados isoladamente ou em combinações em tandem (por exemplo, 177Lu + 225Ac) em 1-5 ciclos de tratamento30. Os resultados incluíram uma remissão completa, quatro remissões parciais, três doenças estáveis e 12 progressões da doença. A sobrevida global mediana da coorte (n = 28) foi de 9 meses desde o início do TRT.

Figura 1: Estrutura química de [68Ga]Ga-3BP-3940. Clique aqui para ver uma versão maior desta figura.
O processo de radiomarcação de 68Ga para radiofármacos experimentais, como FAP-2286 e 3BP-3940, geralmente envolve um módulo de síntese para automatizar a etapa de preparação. Notavelmente, a automação do método garante a robustez do processo e a conformidade com as BPF e minimiza a exposição do operador à radiação em comparação com os métodos de preparação manual 31,32,33. Em muitos casos, tal protocolo é esperado pelas autoridades regulatórias como parte de um dossiê de medicamento experimental (IMPD) antes de autorizar um centro a fabricar o radiofármaco experimental correspondente34. Até o momento, muito pouca informação detalhada sobre a radiomarcação automatizada de 68Ga de pseudopeptídeos anti-FAP está disponível na literatura 29,35,36,37,38. Além disso, os dados relatados geralmente se aplicam apenas a um determinado modelo de sintetizador. O tipo de gerador de 68Ga utilizado também pode trazer certas especificidades, pois as diferentes soluções disponíveis comercialmente são caracterizadas por volumes específicos de eluato de 68Ga3+ em HCl (geralmente 0,1 M), o que pode ter um impacto direto nas condições de radiomarcação automatizada.
Neste contexto, apresentamos um protocolo detalhado para a radiomarcação automatizada rápida e eficiente do pseudopeptídeo 3BP-3940 com 68Ga, utilizando o módulo de síntese GAIA V2. Este sintetizador depende do uso de um conjunto de tubos composto por três rampas de cinco coletores cada, conectadas a uma bomba peristáltica para controlar o fluxo de fluido. Ele também possui um forno de frascos para aquecimento do meio de reação, várias sondas de radioatividade e um sensor de pressão para monitorar esses parâmetros dentro do sistema. Embora não seja tão difundido quanto alguns outros modelos, este autômato é usado rotineiramente em nosso centro e é instalado em um número crescente de instalações 31,39,40,41,42,43,44. Um gerador GALLIAD 68Ge/68Ga foi utilizado neste trabalho sem pré-purificação do eluato de 68Ga. Este método foi projetado para oferecer uma solução robusta, rápida e conveniente para a produção de [68Ga]Ga-3BP-3940, otimizando também a proteção contra radiação para os operadores durante a radiomarcação. Este também é o primeiro protocolo de preparação para este radiofármaco a ser relatado neste modelo específico de sintetizador, e com tantos detalhes.
Protocolo
NOTA: Este protocolo envolve o trabalho com radioisótopos. Qualquer pessoa que conduza este procedimento deve ser devidamente treinada no manuseio de materiais radioativos não selados e deve ter a aprovação do oficial de segurança de radiação de sua instituição. O sintetizador automatizado deve ser colocado em uma célula quente blindada designada. Quaisquer procedimentos manuais que envolvam materiais radioativos também devem ser realizados em uma célula quente blindada ou atrás de uma proteção contra radiação apropriada.
1. Preparação de reagentes
NOTA: Os reagentes necessários para a produção automatizada de [68Ga]Ga-3BP-3940 (ver Tabela de Materiais) foram preparados em uma unidade de preparação de radiofármacos (sala limpa GMP grau C). Os reagentes podem ser preparados em qualquer ordem e até 2 h antes da síntese.
- Preparação da solução tampão (acetato de sódio 0,8 M)
- Adquira a seguinte matéria-prima: acetato de sódio trihidratado EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- Em um recipiente estéril (por exemplo, tubo de microcentrífuga, 5 mL) corretamente identificado, pesar uma massa exata de acetato de sódio tri-hidratado próxima a 544,32 mg usando uma balança de precisão.
- Usando uma micropipeta calibrada e cones estéreis, solubilize o acetato de sódio em um volume de água para injeção (WFI) próximo a 5 mL para que o WFI seja conforme descrito abaixo.
Volume WFI = (massa tampão pesada x 5)/544.32 - Vortex a solução e passe-a por um banho ultrassônico (40 kHz, ~ 1 min) para facilitar a solubilização.
- Usando uma seringa de 10 mL equipada com uma agulha 21G, retire a solução tampão. Instale um filtro de 0,22 μm entre a seringa e uma agulha nova e, em seguida, filtre a solução tampão diretamente em um frasco para injetáveis estéril selado devidamente identificado (por exemplo, TC-ELU 5) após a desinfecção de seu septo.
- Preparação de solução composta anti-radiólise (metionina 10 mg/mL)
- Adquira a seguinte matéria-prima: L-Metionina (Ph. Eur., USP) pura, grau farmacêutico.
- Em um recipiente estéril (por exemplo, tubo de microcentrífuga 5 mL) corretamente identificado, pesar uma massa exata de L-metionina próxima a 50 mg usando uma balança de precisão.
- Usando uma micropipeta calibrada e cones estéreis, solubilize a L-metionina em um volume de WFI próximo a 5 mL para que o WFI seja conforme descrito abaixo.
Volume WFI = (massa tampão pesada x 5)/50 - Vortex a solução e passe-a por um banho ultrassônico (40 kHz, ~ 1 min) para facilitar a solubilização.
- Usando uma seringa de 10 mL equipada com uma agulha 21G, retire a solução de metionina. Instale um filtro de 0,22 μm entre a seringa e a agulha nova e, em seguida, filtre a solução diretamente para um frasco para injetáveis estéril selado devidamente identificado (por exemplo, TC-ELU 5, Cúrio) após a desinfecção do septo.
2. Preparação de equipamentos para controles de qualidade
- Controle de pH do produto final
- Atrás de um escudo protetor apropriado, posicione uma tira de papel de pH para posterior verificação do produto final.
- Controle de pureza radioquímica por rádio-TLC
- Prepare dois tanques de migração TLC contendo fases móveis apropriadas. Fase móvel A: tampão citrato 0,1 M pH 4 em água, com Rf esperado = 0-0,2 para [68Ga]Ga-3BP-3940 e Rf = 0,8-1 para 68Ga3+ livre. Fase móvel B: tampão acetato de amônio 1 M em uma mistura 1:1 de água e metanol (v/v), com Rf esperado = 0-0,2 para colóides de [68Ga]gálio e Rf = 0,8-1 para [68Ga]Ga-3BP-3940.
- Atrás de um escudo protetor apropriado, posicione os dois tanques de migração TLC ao lado de duas placas iTLC-SG para controle subsequente do RCP do produto final.
- Ligue o radiocromatógrafo e abra o software de aquisição associado no computador operacional. Insira previamente as informações de identificação para a primeira análise a ser realizada.
- Controlo da pureza radioquímica por radio-HPLC
- Verifique se o modelo de coluna necessário para a análise (C18 Equivalência ACE) está instalado no sistema.
- Prepare a fase móvel fresca para HPLC, ou seja, água para HPLC + TFA 0,1% (solvente A) e acetonitrila + TFA 0,1% (solvente B). Ligar os frascos do solvente A e do solvente B às linhas correspondentes na radio-HPLC.
- Ligue o computador operacional e conecte-se ao software de controle.
- Se necessário, abra a válvula de purga no módulo da bomba e purgue as linhas que serão usadas para análise (ou seja, linha A e linha B). Feche a válvula de purga após esta operação.
- Deixe o sistema se equilibrar com uma proporção de solvente igual ao início do gradiente (ou seja, 95% A/5% B) com um fluxo de 0.6 mL/min por pelo menos 20 min. Para a sequência de análise de HPLC [68Ga]Ga-3BP-3940, use a taxa de fluxo mantida em 0,6 mL/min e programe o gradiente de fase móvel de 0,1% de TFA em água (A) a 0,1% de TFA em acetonitrila (B) da seguinte forma: 0 - 1 min 95/5 A/B; Gradiente linear de 1 a 8 min de 95/5 A/B a 60/40 A/B; 8 - 9 min 60/40 A/B; Gradiente linear de 9 a 10 min de 60/40 A/B a 95/5 A/B; 10 - 12 min 95/5 A/B.
- Selecionar o método analítico com o gradiente de fase móvel descrito no passo 2.3.5 e, em seguida, introduzir previamente as informações de identificação para a primeira análise a efetuar.
- Num recipiente blindado, preparar um frasco para HPLC com um folheto de vidro para receber a amostra a analisar e posicioná-lo atrás de um escudo protector adequado.
3. Preparação do módulo de síntese
- Ligue a energia e a luz da célula blindada. Ligue o laptop que controla o sintetizador e faça logon no software do módulo.
- Se necessário, remova o kit antigo do sintetizador e descarte os resíduos nos recipientes apropriados.
- Realize a limpeza do interior do gabinete blindado que abriga o módulo de síntese e do próprio sintetizador de acordo com as normas de higiene aplicáveis.
- No software sintetizador, pressione Usuário, selecione um nome de usuário e digite a senha associada na janela pop-up. Pressione Method e selecione o protocolo automatizado configurado anteriormente para a síntese [68Ga]Ga-3BP-3940.
- Pressione Preparação e insira o título da síntese, o número do lote do vetor, o número do lote do kit de reagentes e quaisquer comentários na caixa de texto apropriada. Uma lista de verificação com as várias etapas de preparação do kit também pode ser configurada e seguida nesta fase (Figura Suplementar 1).
4. Preparação do de síntese e instalação do
- Limpe a bancada do laboratório de radiofarmácia com um lenço umedecido e o desinfetante detergente apropriado e coloque uma cortina estéril sobre a bancada.
- Obtenha um de rotulagem estéril [68Ga]Ga (referência RT-01-H) e um kit de reagentes (Figura Suplementar 2). As 3 rampas do conjunto de tubos são identificadas como A, B e C da esquerda para a direita no módulo; as variedades de cada rampa são numeradas de 1 a 5 de cima para baixo (rampas A e C) ou da esquerda para a direita (rampa B).
- Monte o seguindo as etapas abaixo.
- Desembrulhe o envelope do [68Ga]Ga, verifique se há danos e aperte cada conexão Luer no. Remova todas as tampas dos espigões.
- Usando uma seringa Luer Lock de 5 mL e uma agulha 21G, retire 5 mL de etanol absoluto do kit de reagentes e passe-o muito lentamente sobre o cartucho C18 , depois retire 5 mL de WFI (não fornecido no kit) e passe-o muito lentamente sobre o mesmo cartucho C18 para pré-condicioná-lo.
- Posicione a rampa A do conjunto de tubos no módulo de síntese e gire as duas travas para manter a rampa no lugar. Conecte a extremidade livre do tubo A1 vertical a uma agulha de 19G e insira-a no frasco de resíduos.
- Adicione uma agulha de ventilação ao frasco de resíduos e posicione-o para trás, de forma ideal atrás do recipiente blindado que receberá o frasco de evacuação. Coloque um filtro de 0.22 μm na posição A4.
- Conecte a tubulação horizontal A1 ao sensor de pressão na parte inferior esquerda do painel frontal do módulo.
- Usando um adaptador macho/macho, conecte na posição horizontal A5 uma extensão de 30 cm terminada por um filtro de terminal de 0.22 μ e uma agulha 80G 20G.
- Insira a agulha 20G acima mencionada em um frasco de evacuação estéreil e selado (por exemplo, TC-ELU 5), adicione uma agulha de aeração e posicione o frasco de evacuação em seu recipiente blindado.
- Coloque a linha de tubulação que conecta a vertical A1 à vertical C1 atrás dos ganchos de retenção acima da rampa B.
- Conecte os coletores horizontais A2 e B1 com uma linha de extensão curta (não incluída no kit ou a inicialmente conectada na posição C5 horizontal), usando o adaptador já montado na posição A2.
- Posicione a rampa B no módulo de síntese e gire as duas travas para manter a rampa no lugar.
- Conecte o cartucho C18 pré-condicionado à posição horizontal C2, mantendo o adaptador conectando a válvula B5 horizontal a C2 à esquerda.
- Posicione a rampa C no módulo de síntese e gire as duas travas para manter a rampa no lugar.
- Usando um adaptador macho/macho, conecte uma linha de extensão de 50 cm da horizontal C5 ao gerador GALLIAD 68Ga.
- Coloque o frasco de reação de vitral do conjunto de tubos no forno do módulo. Coloque cuidadosamente a tubulação da vertical A5 para a vertical C5 na bomba peristáltica, feche a bomba, verificando se a tubulação está posicionada corretamente, e passe a tubulação pelo sensor de atividade no lado esquerdo da bomba.
- Execute uma verificação intermediária para garantir que o e a tubulação estejam montados no radiossintetizador conforme mostrado na Figura 2, ainda sem reagentes.
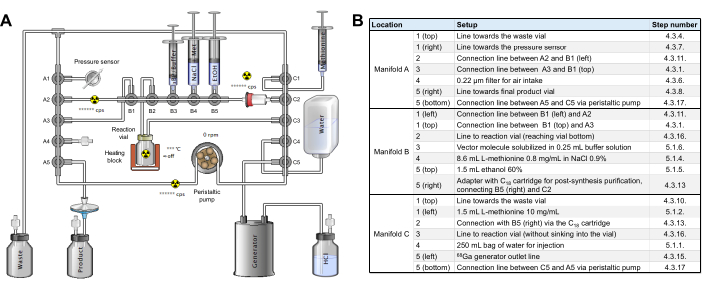
Figura 2: Configuração do módulo de síntese. (A) Configuração para síntese automatizada de [68Ga]Ga-3BP-3940 no módulo de síntese. (B) Detalhes sobre as posições dos reagentes para produção automatizada de [68Ga]Ga-3BP-3940 usando um módulo de síntese GAIA. Clique aqui para ver uma versão maior desta figura.
5. Instalação de reagentes
- Uma vez instaladas as rampas no módulo, instale os reagentes conforme descrito abaixo.
- Conecte a bolsa WFI de 250 mL do kit de reagentes ao tubo C4 usando o adaptador Spike e pendure a bolsa no gancho dedicado no lado direito do módulo.
- Usando uma seringa Luer Lock de três peças de 3 mL equipada com uma agulha 20G, retire 1,5 mL da solução de L-metionina 10 mg/mL previamente preparada, conecte a seringa ao tubo C1 horizontal e pendure a seringa no slot dedicado no lado direito do módulo. Deixe aproximadamente 2 mL de ar entre a superfície do líquido e a vedação do êmbolo da seringa para garantir a transferência completa do líquido.
- Usando uma seringa de 1 mL com uma agulha de 20G, retire 750 μL da solução de L-metionina de 10 mg / mL previamente preparada e injete no frasco de NaCl a 0,9% (friso azul) do kit de reagentes, após a desinfecção do septo.
- Usando uma seringa Luer Lock de três peças de 10 mL com uma agulha de 20G, retire o conteúdo do frasco para injetáveis de NaCl + L-metionina a 0,9% (crimpagem azul), ajuste para 8,6 mL, remova o Spike na posição B4 e, em seguida, conecte a seringa em B4. Deixe aproximadamente 2 mL de ar entre a superfície do líquido e a vedação do êmbolo da seringa para garantir a transferência completa do líquido.
- Usando uma seringa Luer Lock de três peças de 3 mL com uma agulha de 20G, retire o conteúdo do frasco para injetáveis de etanol a 60% (crimpagem laranja) após a desinfecção do septo. Verifique se o volume é pelo menos igual a 1,5 mL, remova o Spike na posição B5 e, em seguida, conecte a seringa a B5. Deixe aproximadamente 2 mL de ar entre a superfície do líquido e a vedação do êmbolo da seringa para garantir a transferência completa do líquido.
- Usando uma seringa de baixo volume morto de 1 mL com uma agulha de 20G, retire 0,25 mL da solução tampão de acetato de sódio 0,8 M previamente preparada e injete no frasco contendo 30 μg de 3BP-3940 para solubilizá-lo por sucessivos ciclos de injeções / reaspirações. Retire a solução de 0,25 ml para a mesma seringa, desligue a agulha e coloque a seringa tampão + vector em B3. Deixe aproximadamente 0,25 mL de ar entre a superfície do líquido e o êmbolo da seringa para garantir a transferência completa do líquido.
- Efectue uma verificação final antes do início da síntese, conforme descrito abaixo.
- Verifique se todos os reagentes estão conectados ao ou tubo, conforme mostrado na Figura 3.
- Certifique-se de que cada uma das conexões do kit esteja suficientemente apertada. Certifique-se de que nenhum tubo esteja comprimido ou inclinado.
- O sistema está pronto. Feche o painel frontal e ligue a ventilação da célula blindada.

Figura 3: Configuração do kit. Instalação final do conjunto de tubos e reagentes no sintetizador para a radiomarcação de 3BP-3940 com 68Ga. Clique aqui para ver uma versão maior desta figura.
6. Sequência de radiomarcação automatizada para produção de [68Ga]Ga-3BP-3940
- Clique em Executar síntese quando todos os reagentes forem colocados nas rampas e todas as informações forem registradas corretamente no software.
- Um perfil típico de distribuição de radioatividade no conjunto de tubos ao longo da sequência de síntese é mostrado em Figura 4. Siga as etapas sucessivas no método automatizado para preparar [68Ga]Ga-3BP-3940 conforme descrito abaixo.
- Testes de integridade do kit: após uma breve purga da tubulação em direção ao frasco de resíduos (essencialmente para remover qualquer líquido restante no cartucho C18 ), o sistema aumenta sua pressão interna abrindo A4 e bombeando ar filtrado através da bomba peristáltica. Assim que o sensor de pressão conectado a A1 detecta uma pressão da tubulação > 1500 mbar, o sistema fecha e a bomba peristáltica para. Se a queda de pressão não exceder 400 mbar em 15 s, avalie o teste de integridade do kit como bem-sucedido e inicie a síntese. Se o teste falhar, suspeite de um vazamento do sistema e aborte a sequência de síntese.
- Adição de vetor ao frasco de reação: Certifique-se de que o 3BP-3940 solubilizado na solução tampão seja puxado para o frasco de reação em cerca de 30 s, através do coletor B2.
- Adição de L-metionina ao frasco de reação: Certifique-se de que a solução de metionina contida na seringa em C1 seja transferida para o frasco de reação através do coletor B2, descendo a rampa C e, em seguida, subindo a rampa A para ramificar na rampa B pelo coletor A2.
- Ativação do cartucho C18 com WFI: Certifique-se de que o WFI contido no saco em C4 seja passado sobre o cartucho C18 , enxaguando também as rampas A, B e C nos caminhos seguidos pelas soluções de vetor e metionina. As mesmas rotas são então lavadas com ar filtrado para garantir que nenhuma água permaneça na tubulação para as etapas subsequentes.
- Eluição do gerador no frasco de reação (intervenção manual): Para eluir o gerador GALIAAD, gire o botão verde na parte superior do gerador a 90° para a posição de carga antes de aguardar 10-20 s: este tempo permite que o gerador prepare um volume de eluído fixo de 1,1 mL. Retorne o botão verde para sua posição inicial e clique no prompter no software Control. A bomba peristáltica então puxa o eluato de 68Ga para o frasco de reação durante um período de 3 minutos. Durante esse intervalo de tempo, a temperatura do frasco de reação é gradualmente aumentada para 60 ° C ao longo de 1 min, depois para 90 ° C ao longo de 2 min, para atingir a temperatura definida para a etapa de radiomarcação mais rapidamente.
- Radiomarcação: Verifique se no início da etapa de radiomarcação, uma temperatura de ponto de ajuste de 120 °C é aplicada por 30 s para permitir um aquecimento rápido e eficiente. Verifique se a temperatura do ponto de ajuste é ajustada para 98 °C por 2 min. Devido ao aquecimento e aumento de pressão no frasco de reação, parte do meio de reação tende a fluir de volta para a tubulação conectada a B2. Para limitar isso, uma purga de linha de 10 segundos é definida após 2 min de aquecimento; Em seguida, a radiomarcação continua por cerca de 5,5 min.
- Retenção no cartucho C18 : Certifique-se de que o ar filtrado seja bombeado para o recipiente de reação por C3. A pressão exercida na superfície do líquido permite que o meio de reação flua para cima através da tubulação conectada em B2 e depois para o cartucho SPE. O frasco de reação é então enxaguado com WFI do saco em C4, e este líquido de enxágue é transferido para o cartucho SPE da mesma maneira. O cartucho é eventualmente enxaguado com WFI fresco e lavado com ar filtrado.
- Eluição do cartucho C18 e formulação (adição de NaCl 0,9% + L-metionina): O cartucho SPE inicialmente retém o produto radiomarcado e quaisquer colóides de gálio e permite a passagem livre de 68Ga3+ . Para eluir o cartucho e recuperar [68Ga]Ga-3BP-3940 no frasco terminal, certifique-se de que frações sucessivas de etanol 60% e metionina ~ 0,9 mg/mL em NaCl 0,9% (3x 0,5 mL cada) sejam puxadas sobre o cartucho para eluição. Todo o conteúdo da seringa em B4 é então passado através do cartucho C18 em uma etapa de formulação para atingir uma concentração final de etanol de <10% no frasco terminal.
- Teste de integridade do filtro (intervenção manual): Após a síntese e remoção do frasco terminal, siga o prompt que pede para conectar o filtro terminal ao frasco de resíduos e remover o filtro de ventilação do frasco de resíduos para verificar a integridade do filtro terminal usando um teste de ponto de bolha. Durante o teste do ponto de bolha, o filtro é inicialmente umedecido por WFI por 30 s. Após a purga das linhas, a pressão no sistema é aumentada lentamente até >2500 mbar ao longo de <2 min, durante o qual o sintetizador verifica se não há aumento de pressão na saída do filtro. Em seguida, o sistema aumenta lentamente a pressão para verificar o ponto da bolha. O sintetizador finalmente registrará a pressão quando a pressão aumentar na saída do filtro para determinar a pressão do ponto de bolha.
- No final da síntese, o software do autômato gera um relatório de síntese descrevendo o curso da radiomarcação e rastreando as temperaturas no frasco de reação, as pressões no sistema e as quantidades de radioatividade envolvidas (Figura 4). Como complemento, calcular manualmente o rendimento radioquímico corrigido pelo decaimento (RCY) de acordo com a fórmula:
RCY =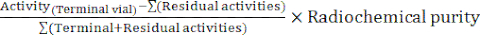
com atividades residuais descrevendo as atividades restantes no frasco de reação, no cartucho C18 e no frasco de resíduos no final da síntese.
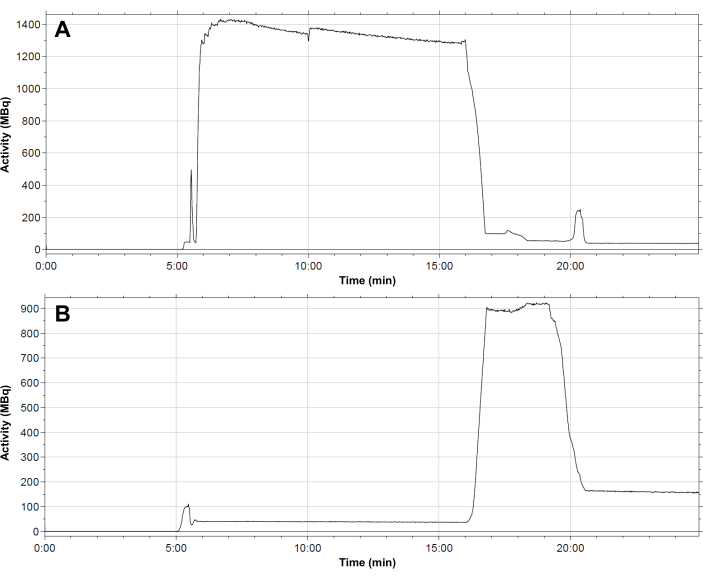
Figura 4: Perfil de distribuição típico da radioatividade dentro do módulo. (A) frasco de reação; (B) Cartucho C18 durante a síntese de [68Ga]Ga-3BP-3940. O fluxo de eluato de 68Ga para o frasco de reação ocorre em 6 min. A atividade permanece no frasco de reação durante toda a reação de radiomarcação. Após 16 min, a atividade é transferida para o cartucho SPE. O cartucho é eluído após 19,5 min, após o qual uma atividade residual de cerca de 150 MBq permanece na fase estacionária. Clique aqui para ver uma versão maior desta figura.
7. Dispensação e controles de qualidade de [68Ga]Ga-3BP-3940
- Transfira o frasco para injetáveis terminal para uma célula blindada apropriada para medição da radioatividade e preparação da dose do paciente.
- Meça a atividade do frasco terminal com um calibrador de dose devidamente calibrado e registre a preparação no computador.
- Identifique o frasco para injetáveis corretamente e coloque-o em um recipiente blindado apropriado. Usando técnicas assépticas apropriadas e técnicas de proteção contra radiação, retire uma amostra de ~ 0,5 mL do frasco terminal para controles de qualidade.
- Avalie a aparência da preparação por inspeção visual. Avalie o pH da preparação depositando uma gota da solução do produto na tira de papel de pH.
- Meça a pureza radioquímica por radio-TLC depositando uma gota de solução de produto em cada uma das duas placas iTLC-SG previamente preparadas. Em seguida, deixe as placas migrarem para as fases móveis correspondentes e lidas pelo radiocromatógrafo. Integrar o radiocromatograma resultante medindo a área sob a curva do sinal do produto e o sinal de impureza e, em seguida, calcular a pureza radioquímica de acordo com a fórmula:
RCP (%) = 100 - %AUCimpureza 1 - %AUCimpureza 2 - Medir a pureza radioquímica por radio-HPLC injectando ~50 μL da preparação no frasco para injetáveis de HPLC previamente preparado (ver passo 2.3.7). Posicione o frasco no amostrador automático de HPLC na posição desejada e inicie a sequência de análise. Uma vez que a amostra tenha sido injetada no sistema, remova o frasco do amostrador automático e recoloque-o em seu recipiente blindado para minimizar a irradiação. No final da análise, integrar o radiocromatograma resultante medindo a área sob a curva do sinal do produto e os sinais de impurezas e, em seguida, calcular a pureza radioquímica de acordo com a fórmula:
RCP (%) = 100 - Σ (% deimpurezas AUC) - Verifique a meia-vida (contador gama) do radioisótopo contido na preparação adicionando ~ 5 μL de preparação a um tubo contador gama contendo 1 mL de WFI. Conte o tubo com o contador gama 10x consecutivamente (contagens de 1 min cada). Calcule a meia-vida com base no decaimento radioativo observado ao longo das 10 medições.
- Realize o ensaio de identidade radionuclídica na mesma amostra que o ensaio de meia-vida, realizando análise de espectrometria gama usando o contador gama, buscando os picos de 511 keV e 1077 keV dos fótons de aniquilação.
- Avaliar a pureza radionuclídica após um período de decaimento de 48 h da amostra anterior. Realize uma medição de 120 minutos no contador gama, permitindo a detecção de qualquer atividade residual de 68Ga formada in situ a partir de ruptura de 68Ge e outras impurezas de radionuclídeos de meia-vida longa.
8. Estabilidade da preparação [68Ga]Ga-3BP-3940
- Avalie três lotes de teste quanto à estabilidade ao longo do tempo. Para este fim, retire aproximadamente 200 μL de preparação do frasco terminal a cada hora imediatamente após o EoS e até 4 h após a síntese.
- Efectuar uma análise radio-HPLC em cada momento para medir a PCR por HPLC de acordo com o procedimento acima descrito. Realize análises de Radio-TLC em cada ponto de tempo para medir o RCP por TLC de acordo com o procedimento descrito anteriormente.
Resultados
O processo de síntese desenvolvido no módulo GAIA permite a rápida radiomarcação de 68Ga de 3BP-3940 em 21-22 min. Este protocolo foi projetado para funcionar com o gerador GALLIAD de grau farmacêutico 68Ge/68Ga, que produz 1,1 mL de eluato de 68Ga em HCl 0,1 M. O volume e a molaridade do tampão de reação foram finamente ajustados de acordo com essa quantidade de ácido para obter um pH de reação entre 3,5 e 4, necessário para a mar...
Discussão
Este trabalho apresenta um protocolo de preparação automatizado compatível com GMP para a síntese de [68Ga]Ga-3BP-3940 usando um módulo GAIA e um gerador GALIAD. Este método foi adaptado de protocolos usados em nosso centro para radiomarcação de gálio-68 de vetores como ligantes de PSMA44 e outros inibidores de FAP 43,46 para imagens clínicas de PET, com pequenas modificações.
Divulgações
Os autores não têm parcerias comerciais ou fontes de financiamento que resultem em um conflito de interesse real ou percebido relacionado a este trabalho para divulgar.
Agradecimentos
Os autores agradecem a Yasmine Soualy, Stéphane Renaud e Élodie Gaven por sua ajuda na preparação das reações de radiomarcação apresentadas neste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
Referências
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753 (2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68 (2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967 (2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16 (2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566 (2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821 (2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Osterkamp, F., et al. Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541 (2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452 (2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61 (2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141 (2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392 (2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4 (2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30 (2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211 (2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27 (2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824 (2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884 (2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448 (2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23 (2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034 (2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados