需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
淀粉样β-蛋白,阿尔茨海默氏病的病原体适配的选择
摘要
适配选定的短ribo-/deoxyribo-oligonucleotides基于对特定目标的亲和力的进化方法。适配与多才多艺的治疗,诊断和研究中的应用的分子识别工具。我们表现出淀粉样β-蛋白,阿尔茨海默氏病的病原体选择适配方法。
摘要
阿尔茨海默氏病(AD)是一个渐进的,年龄依赖性的神经退行性疾病,一个阴险的过程中呈现其症状前诊断困难 1 。明确AD的诊断是只取得了尸检,从而确立了症状前诊断,早在公元2,3有效的治疗方法开发和管理的关键。
淀粉样β蛋白(Aβ)是AD的发病机制的核心。水溶性,低聚Aβ的集会被认为影响到公元4,5神经毒性的潜在的突触功能障碍和神经元的损失。各种形式的可溶性Aβ组件已被描述,然而,他们的相互关系,并到AD的病因和发病机制相关的复杂,并不能很好地理解6。特定的分子识别工具可能解开Aβ的集会之间的关系,并促进这些组件的检测和表征,在病程的早期症状出现前。分子识别通常依赖于抗体。然而,替代类分子识别工具,适配,提供了重要的优势相抗体 7,8 。适配是生成的寡核苷酸在体外选择:指数富集(SELEX)9,10配体系统进化。 SELEX是一个反复的过程,类似于达尔文的进化论,允许选择,放大,浓缩,并长期存在的属性,例如,狂热的,具体的,配体结合(适配)或催化活性(核酶和DNAzymes)。
尽管作为现代生物技术和医药11工具适配的出现,他们一直在淀粉样蛋白领域得到充分利用。少数RNA或单链DNA适配已选定反对各种形式的朊蛋白(PRP)12-16。针对重组牛朊蛋白产生一种RNA适体识别牛的PRP -β17,一种可溶性的寡聚体,β-折叠丰富的全长度的PrP构象的变体,形成淀粉样纤维18。使用单体和一些纤维状的β2 -微球蛋白(β2米 ),发现除了β2米纤维19绑定某些其他淀粉样蛋白纤维的形式产生的适配。 Ylera 等人 。描述对固定单体Aβ4020选定的RNA适配。没想到,这些适配约束纤维状Aβ40。总之,这些数据提出了几个重要问题。为什么对单体蛋白质选定的适配认识到自己的聚合物的形式是什么?对淀粉样蛋白的单体和/或低聚物形式的适配得到吗?为了解决这些问题,我们试图选择适配为共价键稳定的低聚Aβ40产生的光致交联未修改的蛋白质(PICUP)22,23 21 。 17,19,20以前的研究结果相似,这些适配Aβ和其他几个可能承认一个潜在的共同的淀粉样蛋白的结构aptatope 21的淀粉样蛋白纤维的反应。在这里,我们目前的SELEX方法用于生产这些适配21。
研究方案
第1部分:蛋白制备和交联
最初,为SELEX实验中使用的蛋白质是1,1,1,3,3,3 -六氟-2 -丙醇(异丙醇)预处理,获得同质化,聚合的筹备工作, 以前 23描述。这一步是必要的,因为预先形成的集合体导致淀粉样蛋白的快速聚集,导致实验的重复性差24,unaggregated,非纤维状的蛋白质形式的选择适配是不可取的。
- 称量〜800微克(〜180 nmol)纯Aβ40使用一个天平。干冻干肽转移到标记,涂硅,低吸附1.6毫升离心管。
- 1,1,1,3,3,3 -六氟-2 -丙醇(异丙醇,400μL)获得0.5毫米肽溶液溶解于100%的肽前面描述的23。
- 分成4个100μL分装,每管包含〜45 nmolAβ40名义上,这个解决方案。继续异丙醇去除所述以前23。
- 溶解在异丙醇处理的肽交联反应的缓冲之前,准备交联和淬火试剂。称取过硫酸铵(APS,分子量228.2克/摩尔),并准备在10 mM磷酸钠,pH值7.4的40毫米的解决方案。混合使用一个旋涡,直到解决的办法是明确的。
- 准备在10 mM磷酸钠,pH值7.4 2毫米的Tris溶液(2,2 - 联吡啶)dichlororuthenium(二)六水(RuBpy,分子量748.63克/摩尔)。混合使用一个旋涡,并确认完全溶解。保护使用铝箔的光管。
- 准备淬火剂。称取二硫苏糖醇(DTT,分子量154.5克/摩尔)和溶解在去离子水或10 mM磷酸钠,pH值7.4,至1米。
- 前面描述的完全一样23,25,但目的是获取〜60微米肽的解决方案,溶解在异丙醇处理的肽。
- 执行PICUP生成低聚Aβ40的混合物, 所述以前23。一个典型的PICUP反应是在体积20μL终浓度的蛋白质,RuBpy,和APS是30微米,0.05毫米和1毫米,分别为23。在这里,PICUP使用的混合物中含有蛋白108μL,6μLRuBpy,6μL的APS,和1μL数码地面电视和蛋白质浓度,RuBpy,和APS都一倍,相对于典型的反应。这减少了PICUP反应进行的数量和增加的蛋白浓度为脱盐。
第2部分:脱盐蛋白制备
在使用SELEX蛋白质之前,脱盐是执行删除的交联所用试剂为PICUP。这PICUP反应混合物中含有交联试剂和〜55微米(名义浓度)的蛋白质。
- 删除关闭了5毫升的脱盐柱的顶盖,支持一个独立的列,列插座下方放置一个烧杯中,并删除插座插头。让存储缓冲区流过,并收集到烧杯中。
- 列在10 mM醋酸铵,pH值8.3平衡。加入3毫升分装在5树脂床这个缓冲区的容量(25毫升)的列,并允许它流过。
- 同时,标签8低吸附剂,硅涂层1.6毫升管,并放置在一个试管架。
- 后柱是平衡的,适用于0.5 - 0.7毫升分装的每单脱盐使用列PICUP反应混合物(列可水洗,存储,以供日后使用平衡)。允许蛋白质混合物浸泡入列树脂和丢弃在烧杯中的流过。
- 将列插座下面的第一个收集管。列加入0.5毫升的醋酸缓冲液和收集流经的第一个0.5毫升的一小部分。
- 重复步骤2.4和2.5,并收集多达8个0.5毫升的分数在相应的管。
- 另一套编号8低吸附剂,硅涂层,小管0.6毫升,并放置在机架。标签为另一管“的空白。”到标有0.6毫升管取出150μL的每个分数和转让。 20μL用于SDS - PAGE分析(图1)所示, 以前 23 。
- 转移到150μL10 mM的醋酸铵,pH值8.3,空白管。使用此管设置在分光光度计的空白。
- 在石英比色皿在λ= 280 nm处的每个分数在130μL测量吸光度。
- 吸光度测量后,结合蛋白质含量最高的(通常分数3-5)的分数,轻轻地混合使用吸管,10μL等份保持氨基酸分析,以确定实际的蛋白浓度(未显示)。
- 分成多个等份每管1〜2 nmol蛋白样品和冻干冻干机的样品。
- 冻干完成后,在采集标本之前治疗100%异丙醇。
- 存放于-20 ° C的管每个SELEX循环使用一管(下同)。
第3部分:合成的随机单链DNA库通过PCR扩增
SELEX这里用于合成的单链DNA库,包括49个随机核苷酸(A:T:G:C = 25:25:25:25%)两侧的克隆网站 (巴姆您好 ,生态RI)和T7启动子组成的恒定区,作为以前26介绍。
- 要健全库,设立了一个标准的PCR反应如下:202μL去离子水,40μL10X Taq DNA聚合酶缓冲,2μL的单链DNA模板(0.5 nmol),120μL25毫米MgCl 2的28μL10毫米脱氧核苷三磷酸混合(dNTPs),1μL正向引物(300 pmol),1μL反向引物(300 pmol),和4μLTaq DNA聚合酶。
- 使用以下设置一个热循环仪进行PCR反应:5分钟94 ° C初始变性,20个循环94 ° C,每30秒30秒,52℃退火,72 ° C为30秒延伸,最后延伸72℃7分钟。
- PCR反应完成后,每制造商的指示使用Qiagen公司QiaQuick PCR纯化试剂盒纯化扩增产物。一般来说,在这些实验中的DNA的浓度和产量是160 ± 10毫微克/μL,50μL。
- 2%琼脂糖凝胶电泳,确认PCR扩增后的DNA量。
第4部分: 体外转录生成32个P -标记的RNA
- 设置最多一个Ø -环的上限,1.6 -毫升管转录反应根据一些如下修改制造商的指示:20μL5倍T7转录缓冲液,7.5μL100毫米RATP rGTP rUTP,1μL100 5-10微克毫米RCTP,2μLα32个P - CTP(3000次/毫摩尔),纯化的DNA模板(约30-40μL纯化的DNA产品),10μL酶混合,使最终体积为100 μL加入无核酸酶水。
- 轻轻吸管混合的解决方案,离心机的混合物,在37℃过夜孵育。
- 在反应结束时,DNA为模板已被删除。 RQ1无RNase的DNA酶,以一个1 U /微克DNA模板和孵育4小时浓度在37 ° C至消化DNA模板。
- 4 h后,提取的RNA,加入1卷柠檬酸饱和酚:氯仿:异戊醇(125:24:1,pH值4.7)。 〜1分钟,离心旋涡混合2分钟,在16000 克 。
- 上层水相转移到一个新的试管底部阶段或放弃使用微量的愿望。加入1体积氯仿:异戊醇(24:1),1分和4.4描述的离心旋涡混合。
- 上层水相转移到一个新的试管底部阶段或放弃使用微量的愿望。通过执行一个快速旋转离心去除与微管的底部阶段(10秒),可去除残留氯仿。在这一步,很容易删除,而不是上清底部阶段。
- 沉淀的RNA,加入相当于0.1体积的3M醋酸钠,pH值5.2,和1体积相当于2 - 丙醇。混合并放置在-20℃冷冻15分钟。
- 经过15分钟,以最快的速度旋转,最好在冷冻离心,在4 ° C,为20-30分钟,以沉淀RNA产物。
- 仔细吸出上清液,用0.5毫升70%的乙醇,在4 ° C离心RNA的沉淀和丢弃的愿望乙醇。
- 管中的RNA沉淀转移到散热块和颗粒在37 ° C干燥5分钟。
- 在150毫米的STE缓冲,pH值8.0(插图ProbeQuant的G - 50 microcolumns提供)或无核酸酶水溶解RNA样品在体外转录反应,100μL(4.1步)卷。
- 热管含有RNA的产品在70 ° C的热块和一个漩涡混合10分钟,以方便RNA解散。
- 以最快的速度在室温下1分钟离心。
- 保持一个标记闪烁计数管和TBE -尿素聚丙烯酰胺凝胶电泳(6)0.6毫升的RNA 1μL等份。
第5部分:拆除非法人核苷酸,RNA脱盐,闪烁计数
为了消除非法人核苷酸,使用两个G - 50列,根据制造商的指示。
- 反转列涡悬浮树脂和混合。
- 对齐在穿孔列的底部封闭使用塑料套件中提供的工具,并确保离开插座不变。松开转第一个季度,放入干净的收集管在G提供列-50套件。
- 在收集管旋转730 克为1分的列删除存储缓冲区。
- 列传输到两个新的O形圈皑皑,1.6毫升管和负载50μL32个P -标记直接到树脂的RNA样品,每列不干扰树脂的情况下。
- 在旋转730 克为2分钟,收集纯化标记的RNA 。完成这一步后,丢弃的列。
- 1μL的G - 50纯化的RNA转移到0.6毫升管闪烁计数和电泳(第6部分)。商店库存的RNA在-20 ° C,直到为SELEX使用。这是可取的,RNA是用于标签,以避免其退化和失去活性后2天之内。
- 使用两个步骤4.14和5.6的RNA 1μL等份,来衡量每分钟计数(CPM /μL)用闪烁计数器。在这里,我们使用的Triathler台式闪烁计数器。
- 传输管内含有RNA样品为32个P点票使用的塑料适配器,Triathler提供。把管和适配器计数室内,关闭室的盖子, 选择32个 P点票,并按下启动开始计数。
- 计算%的标签法团,即α32个P - CTP =(CPM /μL的“G - 50”样品÷“总”样本CPM /μL)× 100%纳入。总样本前的G - 50纯化样品。
- 后闪烁计数%纳入计算,计算RNA和RNA的特定活动的收益。例如,如果前(237370 CPM /μL)后的RNA池计数的G - 50纯化(191330 CPM /μL)产量81%的法团,然后以下是之前获得的RNA产量计算:
从第4.1步中,金额在3000次/毫摩尔,10μCi/μLα32个P - CTP是: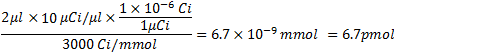 。
。
未标记的CTP的使用量是: 。
。
使用CTP的总额100006.7pmol。 RNA的分子量计算公式如下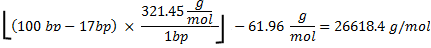
321.45克/摩尔27 rNTPs的平均质量,100 bp的碱基序列号,和17 bp的T7启动子的基地,是不转录。为61.96克/摩尔从寡核苷酸分子量加减考虑搬迁的HPO 2(63.98)和另外两个氢原子(2.02)27。因为,4 rNTPs,CTP版是限制的试剂,如果所有的CTP纳入RNA的产生本来的理论质量: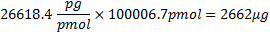 。
。
不过,因为法团的81%,这种大规模现在是2156微克。然后将每微克的RNA的控罪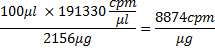
100μL转录反应体积,并在痣:26618.4微克/μmolx 8874 CPM /微克= 2.4x10 8 CPM /μmol。从这里,nmol和适当的音量量的RNA与蛋白质的孵化例如,可以计算出5μLRNA将包含〜4 nmol RNA,即,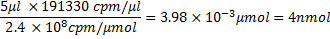
在这些实验中,300 pmol 1 nmol蛋白和4 nmol加入100 nmol RNA使用21。
第6部分:电泳和放射自显影的RNA产物的表征
- 为了准备电泳样品,使用之前和之后的G - 50纯化步骤4.14和5.6的RNA 1μL等份,分别为。加入4μL的STE缓冲液和5μL2X NOVEX TBE -尿素样品缓冲液。
- 样品的温度在70 ° C为5分钟,通常RNA电泳(加热被认为是不必要的,因为与不加热的RNA样品的凝胶的分辨率是相同的,在这个实验装置)的建议。
- 组装6%TBE -尿素 - 聚丙烯酰胺凝胶,凝胶运行中的设备,填补1X NOVEX TBE -尿素缓冲内外商会。预制凝胶冲洗水井,用1毫升吸管缓冲区。
- 离心机的RNA管和负载的样本(10μL总)使用凝胶加载提示。凝胶在180 V 50分钟运行。
- 50分钟后,拆卸的凝胶分裂塑料模具,删除和丢弃只有更短的凝胶模的支持,但离开凝胶的支持不再支持。
- 清洁工作区表面DECON(或其他适当的放射性去污剂),确保所有的放射性污染点被删除。
- 铺设了两层塑料保鲜膜;在两个应用保鲜膜包装的硅胶和塑料的后盾。
- 暴露在塑料包装一个表凝胶utoradiography X光片,在漆黑的房间里接触卡式内,在安全的光。留在-20 ° C为60-90分钟的录像带。
- 发展在黑暗的房间后60-90分钟,使用自动薄膜开发(图2)安全光线下的电影。
第7部分:RNA蛋白质的孵化和过滤器绑定
首先,RNA和蛋白质在溶液中培养,然后结合的蛋白质的RNA序列是从非粘结剂分离。 SELEX循环的进展,过滤器绑定会给蛋白质的RNA结合富集的迹象。
- 在90℃孵育10分钟变性,然后在室温为10分钟缓慢复性的RNA。
- 在8μL60毫米氢氧化钠溶解步骤2.12的蛋白质,并添加36μL无核酸酶的去离子水。超声1分钟的混合物,并添加36μL2X RNA结合缓冲液(20毫米三,氯化钠300毫米,10毫米氯化镁 2,pH值7.5) 。
- 适量的RNA 20μL10X RNA结合缓冲液混合,并加入无核酸酶水200μL的体积。标签“阴性对照管。”
- 混合20μL10X RNA结合缓冲液20μL的蛋白质和所需的RNA量和弥补体积200μL无核酸酶水。标签“反应”管。
- 混合并在室温下30分钟的孵育管。同时准备的过滤器,并为下一步的筛选约束力的设置。
- 将真空入口侧臂瓶125毫升。将一个预清洁侧臂瓶上的过滤器,多孔玻璃支持。
- 3滤膜1X RNA在一个35x10毫米为10-15分钟的Petri菜的结合缓冲液2-3毫升平衡。第一个过滤器将用于调整真空吸,第二次将RNA的单独使用,负控制过滤器结合,而第三个将被用于RNA -蛋白质混合物的过滤器绑定。
- 30分钟后,离心约束力的反应,以最快的速度和控制管在室温下5分钟。
- 打开真空和地方多孔玻璃膜。使用微量,滴到膜RNA结合缓冲液0.5毫升和调整的真空,让每个缓冲区的下降缓慢流动,通过膜。
- 放置到多孔玻璃的第二个膜,并使用相同的流量,应用到膜的负调控。
- 应用4x0.5毫升分装1X RNA结合缓冲液洗膜和丢弃的流量通过。请注意,如果预结算,流过需要保持RNA提取。预结算删除绑定到过滤器的RNA序列。
- 删除相应的标记1.6毫升的液体闪烁计数管的负控制膜和地方。
- 多孔玻璃替换预清洗第二多孔玻璃支持。
- 将第三个磁盘上的多孔玻璃和应用的反应混合物。步骤7.11清洗过滤器和丢弃的流量通过。在以后的SELEX循环清洗的数量可以增加,增加SELEX实验条件的严格。
- 删除标有“反应混合物”1.6毫升管过滤器的磁盘和地点,并不断闪烁计数。
- 步骤5.8执行闪烁计数,并记下各自的过滤器的计数。
- 计算的放射性总量的膜(%约束力)相比,过滤器绑定放射性水平。这将给约束力浓缩为SELEX进展的迹象。
第8部分:RNA提取过滤器
RNA提取的过滤器来获得结合的蛋白质序列。这些序列扩增为未来的SELEX循环。
- 闪烁计数后,删除的结合反应管过滤器(从7.15步)到清洁,干燥,35x10毫米培养皿和地点。
- 使用干净的手术刀和镊子,切小块膜。
- 使用镊子,更换标记步骤8.1在同一管膜裁片。
- 加入400μL洗脱缓冲液(7 M尿素,3 mM的EDTA,100 mM柠檬酸钠,pH值5.0)和管在95℃孵育10分钟。
- 在室温下的最高速度离心管,吸出,并收集到一个新的标记管的提取黄油。
- 剩余的放射性计数测量管膜件含闪烁计数,以评估的提取效率。
- 三次重复提取过程(步骤8.4-8.6)。 3拔牙后的效率通常是〜95-96%。
- 在含有RNA的提取管中,加1柠檬酸饱和量(400μL)(pH 4.7)的苯酚:氯仿:异戊醇(125:24:1)。一个旋涡混合约1分钟,离心GE在16000 克为2分钟。
- 上层水相转移到一个新的试管底部阶段或放弃使用微量的愿望。
- 加入1体积氯仿:异戊醇(24:1),混合为1分钟,离心2分钟,在16000 克的旋涡。
- 上层水相转移到一个新的试管底部阶段或放弃使用微量的愿望。
- 沉淀的RNA,加入0.1体积的3 M醋酸钠,pH值5.2,3-4μL糖原作为RNA coprecipitant(10微克/微升),2 - 丙醇和1体积相当于。混合,并在-20 ° C冰箱中放置过夜。
- 以最快的速度旋转,最好在4 ° C的20-30分钟,离心沉淀RNA的步骤8.12。
- 离心后,RNA在一个隐约可见的液相分离。仔细吸上清液没有撞出在试管底部隐约可见的沉淀相。
- 用0.5毫升70%的乙醇洗涤RNA的“沉淀”,以最快的速度为5分钟离心机在4 ° C和愿望没有撞出隐约可见的沉淀阶段丢弃乙醇。
- 在50μL的STE缓冲液溶解的RNA沉淀,并进行第5步中的G - 50纯化。
第9部分:继续SELEX循环逆转录和PCR扩增
要继续下一个周期的SELEX,RNA反转录DNA和PCR扩增。
- 5标记0.6毫升管,混合3μL纯化,2 8倍稀释反向引物液脱盐的G - 50 - RNA。标签一管阴性对照。“
- 在70 ° C孵育5分钟,然后在另一个5分钟冰的混合物,让杂交的RNA引物。
- 这对冰的混合物,添加6.4μL无核酸酶水,4μLImProm - II 5倍的反应缓冲液,1.6μLMgCl 2的25毫米,1μL10 mM的dNTP混合液,1μLRNasein核糖核酸酶抑制剂,1μLImProm - II反转录酶共15μL。
- 阴性对照,添加7.4μL无核酸酶水,离开了逆转录。相应地标注管。包括阴性对照,以确认污染前一个周期的DNA是不为未来的SELEX循环放大。这一步的测试步骤4.3由RQ1无RNase的DNA酶消化DNA模板的有效性。
- 使用热循环到反应混合物在25 ° C孵育5分钟,42℃1小时退火和延伸第一链的DNA,分别为70,C为° C至15分钟灭活逆转录酶。
- 逆转录反应后,建立了PCR混合物。加入30μL无核酸酶的水,10μL10X Taq酶缓冲,30μL25毫米MgCl 2的7μL10 mM的dNTP混合液,引物各1μL,1μLTaq DNA聚合酶在所有的管。
- 运行PCR程序为9-14个周期的第3部分。
- 净化步骤3.3中的DNA产品。
- 混合的DNA产物8μL,2μLDNA上样染料和2%琼脂糖electrophorese 15-20分钟(图3)在100 V。
- 被转录标记的RNA在第4部分,并为下一个周期的SELEX的DNA产品已准备就绪。
第10部分:代表结果
SELEX实验,Aβ40为目标,每个周期使用RNA的质量,和成功的RNA提取和扩增后每个周期所用的低聚物的性质是重要的。我们使用PICUP生成低聚Aβ40SELEX净化后,去除的交联试剂的混合物。脱盐第2部分所述的实验通常会导致50-55%的蛋白质损失。使用吸光度测量(λ= 280)和SDS - PAGE(图1),蛋白质的数量和质量进行评估。 Aβ40洗脱液从一个典型的SDS - PAGE个人资料,在这些实验之一洗脱Aβ40覆盖5个独立的实验平均吸光度曲线如图1所示。有关数据显示,该蛋白一贯洗脱分数3-5和交联试剂后分数6洗脱(吸光度增加分数7,图1)列。 SDS - PAGE电泳显示典型的Aβ40低聚物分布22。这种分布是重复性的,被冻干后的蛋白组分(2.11),异丙醇(2.11),resolubilized(7.1)治疗,并经SDS - PAGE分析。
每个SELEX循环RNA的完整性也很重要迭代SELEX进展,尤其是在敏感核酸的核糖体的寡核苷酸。 RNA扩增和标签(4)后,标记的RNA的质量进行评估TBE -尿素聚丙烯酰胺凝胶电泳。一个完整的标记的RNA产品的一个典型剖面之前和之后的G - 50纯化(P第5条)如图2所示。
每个SELEX循环后,RNA是从绑定后过滤膜(第八部分)和反转录(第九部分)的DNA进行PCR扩增(步骤9.5)中提取。前一个周期的DNA为模板,然后用于生成32个P -标记的RNA(4)为下一个周期。如果坚持在标记的RNA产品后, 在体外转录反应(4)从上一个周期的一些污染的DNA为模板,SELEX循环的效率将会降低,需要更多的周期。为了控制这个问题,每个SELEX周期和相应的反转录PCR反应后,琼脂糖凝胶电泳(9.12)。在负调控的反应管(9.4)的DNA产品的缺席表示周期(图3)从以前的SELEX的DNA为模板成功拆除。如果在负对照管观察DNA PCR扩增,这是表示RQ1 DNA酶(4.3)的孵化时间延长。制造商建议RQ1 DNA酶的孵化时间是15分钟,但是,我们发现,需要较长的孵化(4-5小时),完全去除DNA模板(图3)。
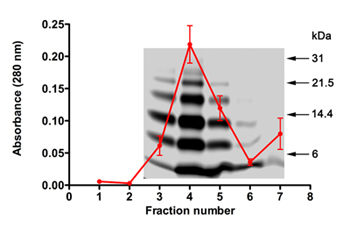
图1 SDS - PAGE和吸光度PICUP生成,脱盐Aβ40低聚物的形象。从5个人脱盐列的平均吸光度轮廓,并覆有代表性的凝胶。分子量标记显示在右边。

图2:TBE -尿素聚丙烯酰胺凝胶电泳RNA产物之前和之后的G - 50纯化。 RNA产物的迁移方向是从负极到正极表示。
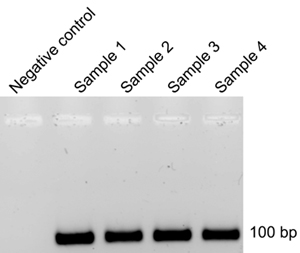
图3产品反转录和PCR扩增后的DNA琼脂糖凝胶电泳。
讨论
SELEX过程的出发点是随机寡核苷酸库,通常含10月12日-10月15日序列的合成。在DNA SELEX,这个库是直接使用后,产生一个单链DNA池,而在RNA SELEX,这里演示,单链DNA库先转换到一个RNA池通过体外转录酶。然后,SELEX进行迭代,即每个周期包括曝光和预定目标寡核苷酸结合,不具约束力的序列,并结合序列洗脱的粘合剂分区。在以后的周期中,目标和RNA和/或清洗化学计量可以改...
披露声明
致谢
这项工作是从加州公共卫生部从美国国立卫生研究院/国家行政学院和07-65798补助AG030709支持。我们承认,伊丽莎白楼纽费尔德博士帮助和支持的项目,智红博士B.陈提供的支持和试剂最初的步骤,合成肽和氨基酸分析和安德鲁博士ð玛格丽特M. Condron 。埃林顿有益的讨论。
材料
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Aβ40 | UCLA Biopolymers Laboratory | Lyophilized powder | ||
| MX5 Automated-S Microbalance | Mettler Toledo | |||
| Silicon-coated, 1.6-ml tubes | Denville Scientific | C19033 or C19035 | ||
| 1,1,1,3,3,3-hexafluoro-2-propanol (HFIP) | TCI America | H0424 | Use in a fume hood. | |
| Ammonium persulfate | Sigma | A-7460 | Vortex until the solution is clear. APS is prepared freshly each time and should be used within 48 h. | |
| Tris(2,2-bipridyl)dichlororuthenium(II) hexahydrate | Sigma | 224758-1G | Vortex until the solution is clear. Cover the RuBpy tube with foil to protect the reagent from ambient light. RuBpy is prepared freshly each time and should be used within 48 h. | |
| Dithiothreitol (DTT) | Sigma | 43815 | ||
| D-Salt™ Excellulose™ desalting columns | Thermo Scientific | 20449 | ||
| Ammonium acetate | Fisher Scientific | A637-500 | ||
| Silicon-coated, 0.6-ml tubes | Denville Scientific | C19063 | ||
| Novex Tricine Gels (10–20%) | Invitrogen | EC6625B0X | 10-well; mini size (8 cm X 8 cm); 25 μl loading volume per well; separation range 5 kDa to 40 kDa | |
| Quartz cuvette | Hellma | 105.250-QS | ||
| Beckman DU 640 spectrophotometer | Beckman | |||
| ssDNA library | Integrated DNA Technologies | Custom-ordered | The library was designed to contain 49 random nucleotides flanked by two constant regions containing primer-binding and cloning sites: 5'-TAA TAC GAC TCA CTA TAG GGA ATT CCG CGT GTG C (N:25:25:25:25%) (N)49 G TCC GTT CGG GAT CCT C-3' | |
| Taq DNA polymerase | USB Corporation | 71160 | Recombinant Thermus aquaticus DNA Polymerase supplied with 10× PCR Buffer and a separate tube of 25 mM MgCl2 for routine PCR. | |
| PCR Nucleotide Mix, 10 mM solution | USB Corporation | 77212 | (10 mM each dATP, dCTP, dGTP, dTTP) | |
| Forward primer | Integrated DNA Technologies | Custom-ordered | 5'-TAA TAC GAC TCA CTA TAG GGA ATT CCG CGT GTG C-3' | |
| Reverse primer | Integrated DNA Technologies | Custom-ordered | 5'-GAG GAT CCC GAA CGG AC-3' | |
| Thermal cycler | Denville Scientific | Techne TC-312 | ||
| QIAquick PCR Purification Kit (50) | QIAGEN | 28104 | ||
| Agarose | Denville Scientific | CA3510-8 | ||
| Conical, sterile 1.6-ml tubes with caps attached with O-rings | Denville Scientific | C19040-S | ||
| RiboMAX™ Large Scale RNA Production System–T7 | Promega | P1300 | The kit contains: 120 μl Enzyme Mix (RNA polymerase, recombinant RNasin® ribonuclease inhibitor and recombinant inorganic pyrophosphatase); 240 μl transcription 5 buffer; 100 μl each of 4 rNTPs, 100 mM; 110 U RQ1 RNase-free DNase, 1 U/μl; 10 μl linear control DNA, 1 mg/ml; 1 ml 3M sodium acetate (pH 5.2); 1.25 ml nuclease-Free water | |
| α-32P-cytidine 5'-triphosphate, 250 μCi (9.25 MBq), | Perkin Elmer | BLU008H250UC | Specific Activity: 3000 Ci (111 TBq)/mmol, 50 mM Tricine (pH 7.6) | |
| Citrate-saturated phenol:chloroform:isoamyl alcohol (125:24:1, pH 4.7) | Sigma (Fluka) | 77619 | ||
| Chloroform:Isoamyl alcohol (24:1) | Sigma | C0549 | ||
| Absolute ethanol for molecular biology | Sigma | E7023 | ||
| Z216-MK refrigerated microcentrifuge | Denville Scientific | C0216-MK | ||
| illustra ProbeQuant™ G-50 Micro Columns | GE Healthcare | Obtained from Fisher Scientific (45-001-487) | Prepacked with Sephadex™ G-50 DNA Grade and pre-equilibrated in STE buffer containing 0.15% Kathon as Biocide | |
| Triathler Bench-top Scintillation counter | Hidex Oy, Turku, Finland | Triathler LSC Model: 425-034 | ||
| Novex® TBE-Urea Sample Buffer (2×) | Invitrogen | LC6876 | ||
| 6% TBE-Urea Gels 1.0 mm, 10 wells | Invitrogen | EC6865BOX | ||
| Novex® TBE Running Buffer (5×) | Invitrogen | LC6675 | ||
| Radioactivity decontaminant | Fisher Scientific | 04-355-67 | ||
| Gel-loading tips | Denville Scientific | P3080 | ||
| XCell SureLock Mini-Cell | Invitrogen | EI0001 | XCell SureLock Mini-Cell | |
| Autoradiography film | Denville Scientific | E3018 | Use in complete darkness | |
| Autoradiography film, Hyperfilm™ ECL | Amersham Biosciences | RPN3114K | Can be used under red safe light. | |
| Membrane discs | Millipore | GSWP02500 | Mixed cellulose ester, hydrophilic, 0.22-μm disc membranes | |
| Fritted glass support base for 125-ml flask | VWR | 26316-696 | ||
| Petri dishes | Fisher Scientific | 08-757-11YZ | ||
| Urea | Fisher Scientific | AC32738-0050 | ||
| EDTA | Fisher Scientific | 118430010 | ||
| Glycogen | Sigma | G1767 | ||
| 2-Propanol for molecular biology | Sigma | I9516 | ||
| Recombinant RNase inhibitor | USB Corporation | 71571 | ||
| ImProm-II™Reverse Transcription System | Promega | A3802 | ||
| Recombinant RNase inhibitor | USB Corporation | 71571 | ||
| RapidRun™ Loading Dye | USB Corporation | 77524 |
参考文献
- Monien, B. H., Apostolova, L. G., Bitan, G. Early diagnostics and therapeutics for Alzheimer's disease-how early can we get there. Expert. Rev. Neurother. 6, 1293-1306 (2006).
- Nestor, P. J., Scheltens, P., Hodges, J. R. Advances in the early detection of Alzheimer's disease. Nat. Med. 10, S34-S41 (2004).
- Kawas, C. H. Clinical practice. Early Alzheimer's disease. N. Engl. J. Med. 349, 1056-1063 (2003).
- Haass, C., Selkoe, D. J. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid β-peptide. Nat. Rev. Mol. Cell. Biol. 8, 101-112 (2007).
- Kirkitadze, M. D., Bitan, G., Teplow, D. B. Paradigm shifts in Alzheimer's disease and other neurodegenerative disorders: the emerging role of oligomeric assemblies. J. Neurosci. Res. 69, 567-577 (2002).
- Rahimi, F., Shanmugam, A., Bitan, G. Structure-function relationships of pre-fibrillar protein assemblies in Alzheimer's disease and related disorders. Curr. Alzheimer Res. 5, 319-341 (2008).
- Jayasena, S. D. Aptamers: an emerging class of molecules that rival antibodies in diagnostics. Clin. Chem. 45, 1628-1650 (1999).
- Bunka, D. H., Stockley, P. G. Aptamers come of age - at last. Nat. Rev. Microbiol. 4, 588-596 (2006).
- Ellington, A. D., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346, 818-822 (1990).
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249, 505-510 (1990).
- Lee, J. F., Stovall, G. M., Ellington, A. D. Aptamer therapeutics advance. Curr. Opin. Chem. Biol. 10, 282-289 (2006).
- Weiss, S. RNA aptamers specifically interact with the prion protein PrP. J. Virol. 71, 8790-8797 (1997).
- Bibby, D. F. Application of a novel in vitro selection technique to isolate and characterise high affinity DNA aptamers binding mammalian prion proteins. J. Virol. Methods. 151, 107-115 (2008).
- Rhie, A. Characterization of 2'-fluoro-RNA aptamers that bind preferentially to disease-associated conformations of prion protein and inhibit conversion. J. Biol. Chem. 278, 39697-39705 (2003).
- King, D. J., Safar, J. G., Legname, G., Prusiner, S. B. Thioaptamer interactions with prion proteins: sequence-specific and non-specific binding sites. J. Mol. Biol. 369, 1001-1014 (2007).
- Proske, D. Prion-protein-specific aptamer reduces PrPSc formation. ChemBioChem. 3, 717-725 (2002).
- Murakami, K., Nishikawa, F., Noda, K., Yokoyama, T., Nishikawa, S. Anti-bovine prion protein RNA aptamer containing tandem GGA repeat interacts both with recombinant bovine prion protein and its β isoform with high affinity. Prion. 2, 73-80 (2008).
- Luhrs, T., Zahn, R., Wuthrich, K. Amyloid formation by recombinant full-length prion proteins in phospholipid bicelle solutions. J. Mol. Biol. 357, 833-841 (2006).
- Bunka, D. H. Production and characterization of RNA aptamers specific for amyloid fibril epitopes. J. Biol. Chem. 282, 34500-34509 (2007).
- Ylera, F., Lurz, R., Erdmann, V. A., Furste, J. P. Selection of RNA aptamers to the Alzheimer's disease amyloid peptide. Biochem. Biophys. Res. Commun. 290, 1583-1588 (2002).
- Rahimi, F., Murakami, K., Summers, J. L., Chen, C. H., Bitan, G. RNA aptamers generated against oligomeric Aβ40 recognize common amyloid aptatopes with low specificity but high sensitivity. PLoS ONE. 4, e7694-e7694 (2009).
- Bitan, G., Lomakin, A., Teplow, D. B. Amyloid β-protein oligomerization: prenucleation interactions revealed by photo-induced cross-linking of unmodified proteins. J. Biol. Chem. 276, 35176-35184 (2001).
- Rahimi, F., Maiti, P., Bitan, G. Photo-induced cross-linking of unmodified proteins (PICUP) applied to amyloidogenic peptides. J. Vis. Exp. , (2009).
- Bitan, G., Fradinger, E. A., Spring, S. M., Teplow, D. B. Neurotoxic protein oligomers-what you see is not always what you get. Amyloid. 12, 88-95 (2005).
- Bitan, G. Structural study of metastable amyloidogenic protein oligomers by photo-induced cross-linking of unmodified proteins. Methods Enzymol. 413, 217-236 (2006).
- Chen, C. H., Chernis, G. A., Hoang, V. Q., Landgraf, R. Inhibition of heregulin signaling by an aptamer that preferentially binds to the oligomeric form of human epidermal growth factor receptor-3. Proc. Natl. Acad. Sci. USA. 100, 9226-9231 (2003).
- Adams, D. S. . Lab math: a handbook of measurements, calculations, and other quantitative skills for use at the bench. , (2003).
- Gopinath, S. C. Methods developed for SELEX. Anal. Bioanal. Chem. 387, 171-182 (2007).
- Takahashi, T., Tada, K., Mihara, H. RNA aptamers selected against amyloid β-peptide (Aβ) inhibit the aggregation of Aβ. Mol. Biosyst. 5, 986-991 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。