需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微流控装置重新创建一个肿瘤微环境
摘要
我们的程序重新异质性肿瘤微环境的微流体装置,制造和操作。肿瘤组织内的凋亡中的变异量化使用荧光染料和化疗药物到肿瘤组织中阿霉素的有效扩散系数进行了评价。
摘要
我们已经开发出一种微流体装置,模仿送货和药物异构三维肿瘤组织在体外的全身清除。交付血管的营养物质无法到达所有部位的肿瘤,可行的,静态的和坏死的细胞类型组成的异质性的微环境。许多治疗癌症的药物无法有效地渗透和治疗所有类型的细胞,因为这种异质性。单分子膜的癌细胞不模仿这种异质性,使其难以测试癌症药物与合适的体外模型。我们的编造出来的PDMS微流体装置使用软光刻技术。矩形室设备上的多细胞肿瘤球体,所形成的悬滴法,插入和约束,并保持连续介质灌注一侧。腔室在设备上创建的矩形形状的线性梯度在组织内。荧光染料被用来量化个Ë在组织内细胞凋亡的变化。在设备上的肿瘤治疗与荧光化疗药物阿霉素,时间推移显微镜被用来监测其扩散到组织中,和估计的有效扩散系数。悬滴法可以迅速形成均匀的球体从多种肿瘤细胞株。设备启用增长的球体3天。接近流动介质中最小的细胞凋亡细胞和,那些远离通道的凋亡,从而精确地模仿血管肿瘤邻近地区。与以前报道的价值在人类乳腺癌的阿霉素扩散系数的估计值一致。因为在实体肿瘤药物的渗透和保留会影响其功效,我们认为这是一个重要的工具,在了解药物的行为,并开发新的癌症疗法。
研究方案
1。设备制造
在弹性体材料中的微流体的功能的基础上复制达菲等人所描述的方法。
- 的混合弹性体(聚二甲基硅氧烷PDMS)和固化剂的有机硅弹性体套件( 道康宁密歇根州米德兰市)9:1的重量比,倒在主形成一个4毫米厚的一层。脱气以除去气泡,并在60℃下固化该混合物5小时。剥离固化的PDMS从模具上的弹性体中的流动特性,得到一张邮票。
- 使用1.5毫米活检冲头(MILTEX,纽约,宾夕法尼亚州)的入口和出口的打孔安装在一台钻床。拉出任何碎片。
- 主题特性方面的邮票和干净的载玻片上的氧等离子体中的氧等离子体刻蚀机8分钟。立即接触带来的表面经过处理的,在它们之间形成一个键。幻灯片上的回暖至少5个小时,保持在60°C的组装s到加强债券。
- 0.032“ID PTFE管( 科尔帕默 ,弗农山,IL)使用的接口阳鲁尔锁连接器连接到刺阴鲁尔锁连接器(Qosina,旅游Edgewood,NY)的入口和出口。
- 设置使用关断阀和一个Y形连接件( 厄普丘奇科学 ,Oak Harbor的,WA,图1)的流动组件。安装设备的显微镜。将注射器管使用20G 1.5“针(BD生物科学中心,Rockville,MD)。
2。形成统一的细胞球体
椭球粒子的形成的悬滴法2,3。
- Trypsinize细胞在无菌的细胞培养罩。
- 胰蛋白酶处理的细胞以2000rpm离心5分钟,并再悬浮在6毫升新鲜培养基。原液稀释到所需的最终浓度(表1)。
- 取下盖子的48孔板,将其倒置在科技教育rilized罩。对应于每口井的圆形区域是显而易见的封面上。填充的板的各孔用1ml无菌水以保持湿度。将20微升滴的每一个圆形区域,用微量稀释的细胞液中。小心地翻转盖,并把它放在一个孔板,确保滴不触摸各孔的边缘。
- 在37°C孵育孔板为指定的天数(表1)。球体将在每个悬滴形成。
3。的细胞球体的介绍到设备
请参阅图1和表2本节。
- 消毒装置,由通过流入口引入用70%乙醇冲洗。随后,冲洗用PBS,然后由HEPES缓冲的细胞培养基。发表中期注射器S F连接管。
- 绘制2-3球体注射器S P,点击注射器,以消除气泡,附加到该装置的包装入口。
- 打开进水阀V 引脚和密切的V 翅 。打开出口阀V POUT和密切的V FOUT。握住包装的注射器针朝下垂直;观看作为球体定居到路厄氏锁定连接器的针的注射器底部。在包装上的注射器和手表球体推动柱塞进入到器件中的油管和流量。因为只有包装出口阀是打开的,椭球体将输入的装置的腔室,并保留在背面(图2)内的职位。
- 关闭进水阀V 引脚和出口阀V 功率输出 。安装的注射器注射泵,S F。打开阀V FIN和:阀V FOUT。 3μl/ min的流介质进入的移动设备。
4。介绍细胞凋亡检测剂(CaspGLOW)
在与球体的包装室,让平衡为up到24小时,以建立营养梯度和微环境之前,引入细胞凋亡检测或治疗剂。由于腔室中的组织接触坚不可摧从顶部和底部壁,有没有营养梯度沿厚度(0.15毫米)的组织。温育24小时后,所有的电池层沿着组织的厚度因此,等效的,在远离流路的方向的唯一的非均质性。
- 关闭V 翅 ,停止注射泵,取出注射器S F,取而代之的是从泵的注射器中含0.25微升/毫升的CaspGLOW红活性caspase-3的标记(红色-DEVD-FMK, 描述BioVision,山景, CA)。
- 0.7毫升上述溶液通过手动冲洗设备以确保位移较旧的介质。安装在泵上的注射器,重新启动流程,开V 翅 。经过一段5-8小时,细胞凋亡检测剂扩散到T他组织和荧光亮度在细胞凋亡的地区。细胞凋亡检测剂在此浓度维持在随后的所有流程解决方案到设备。
注:
- 组织异质性可以确认获得线性荧光强度分布在第6。配置文件应该显示在细胞凋亡中的空间梯度,确认该组织是异质性细胞活力。
- CaspGLOW格林主动Caspase-3的标记物(荧光素-DEVD-FMK;产品描述BioVision)也可以被用于检测细胞凋亡。此标记包含了绿色荧光的荧光,而不是红色荧光的罗丹明。
5。治疗剂简介
- 按照程序步骤4.1-4.2介绍10μM盐酸阿霉素(阿霉素,Sigma-Aldrich公司, 圣路易斯 ,MO)细胞凋亡检测剂。
- 继续流动的therapeutic剂溶液一段固定的时间。切断阀V 翅关闭注射泵。更换新鲜培养基含有细胞凋亡检测剂的注射器治疗注射器。连续监测在显微镜下的组织的同时,允许流动的新鲜培养基中为24 -36小时。
6。时间推移显微镜和药物扩散系数的估计
为了获得干净的荧光数据,获取所有影像聚焦显微镜组织的底层。因为有没有营养梯度在垂直方向上(参见第4节),底部层细胞是上述所有其它层的良好的代表。
- 使用自定义的脚本在IPLab(BD生物科学中心,Rockville,MD),整个收购过程实现了自动化。掌握在10倍放大倍率的填充的旋转椭球体,每30分钟(图3A)的透射光图像和荧光图像。 Acquire一个图像的背景荧光之前引入的Dox。为了适应大尺寸的腔室(1000微米×300微米),获得两个相邻的图像和瓷砖在一起。
- 有关药物的扩散系数的数学估计,第一个步骤是,以产生平均的线性强度档案Dox诱导荧光使用ImageJ。选择一个矩形的感兴趣区域(ROI),涵盖了组织室。使用“剧情简介”命令来生成配置文件的平均强度为流道之间距离的函数。重复多达3个不同的时间点。
- 获取的背景前,阿霉素来衡量组织的自体荧光的荧光图像。减去平均背景所获得的强度和荧光强度正常化的每个配置文件,以获得相应的最大强度
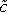 (X,T)(图3的B)。
(X,T)(图3的B)。 - 接下来的步骤是,以评估肿瘤组织内的有效扩散系数 D的Dox。阿霉素的扩散可以由下面的式(5)表示

其中,erfc是余误差函数,x是从通道进入组织的距离,而t是时间后引入的Dox(参考图3)。使用下面的迭代计划,在每个时间点考虑:- 猜一个价值为 D
- 在每个位置 x,计算右侧的方程
- 计算双方之间的误差平方和(剩余)
- 修改 D尽量减少剩余
- 平均得到的D的最佳值,在每个时间点,在组织中估计的平均的有效扩散系数的Dox。
7。代表性的成果:
微流体装置提供1毫米所述0.3×0.15毫米光学访问文化室的三维肿瘤组织的生长。多细胞肿瘤球体流入这些商会,并保留过滤器由两个职位在后面。悬滴法允许从几个细胞系一致的大小和形状的球状体的快速形成。椭球粒子的设备上成功地生长至3天。在商会的增长是与内球体的微环境,可重复的修改。在细胞凋亡发生较少的附近的流道和更高的进入组织更深。该装置被用来估计在肿瘤组织中阿霉素的扩散系数。所获得的值与值9.1×10 -7 cm 2 s以下-1 8.75×10 -7 cm 2的-1同意在乳腺癌中的以前的报告6。| 细胞系 | 所需的细胞浓度 | 培养时间 |
| LS174T | 300个细胞/μL | 2-3天 |
| T47D | 750个细胞/μL | 3-4天 |
| MDA-MB-231 | 150个细胞/μL | 5-6天 |
悬滴细胞球体的参数见表1。
| 部分 | 描述 |
| S F | 流动注射 |
| S P | 包装注射器 |
| V 翅 | 流进气阀 |
| V 引脚 | 包装进气阀 |
| V FOUT | 流出口阀 |
| V 功率输出, | 包装出口阀 |
表2。注射器和阀门流量设置

图1。的流量设置V 翅和V FOUT:流量入口和出口阀,V 引脚和V 功率输出 :包装进,出口阀门,S F和S P:流量和包装注射器的示意图。入口和出口阀的填充注射器和包装时使用的旋转椭球体的腔室流入。的流量的注射器和流量的入口和出口阀被用于流动介质其后。
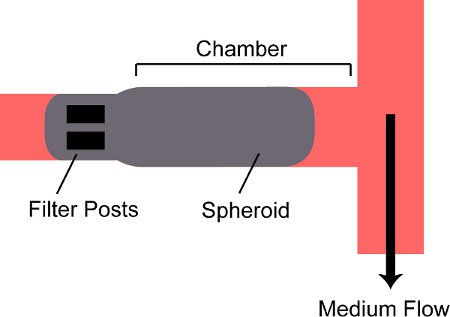
图2。被困在设备上的一个腔室的球状体的示意图。旋转椭球体流入到设备上的腔室和由两个过滤器位置被挡日ts在背面的腔室。

图3。设备上的肿瘤组织中阿霉素的扩散。 A.合并透射光及红色荧光图像的组织中,示出的位置和浓度的多柔比星(红色)。比例尺为250μm。B.归一化线性阿霉素荧光强度分布。
Access restricted. Please log in or start a trial to view this content.
讨论
在肿瘤的血管稀疏和虐待发达7,8。有些地区距离远(> 100微米)的血管,是无法提供的营养物质和药物虽然血管9。异质微的效果有限,许多化疗药物10。这里开发的微流体装置,再现了异质性肿瘤微环境的特点是增殖,静态和凋亡或坏死的细胞,在体外。接近的通道中的单元是可行的,但扩散限制引起的营养缺陷凋亡区域远离通道。的流路表示血管和旋转椭球体表示相?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
这项工作是由美国国家卫生学院授予#1R01CA120825-01A1,生物医药合作研究发展计划(CBR)在马萨诸塞州阿姆赫斯特大学,和普山J. Toley的的伊森伯格奖学金为支持。我们非常感谢詹姆斯·谢弗,摄影师,叙述者,该视频的编辑作出的宝贵贡献。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录号 | 评论 |
|---|---|---|---|
| 有机硅弹性体套件 | 安士澳粘合剂 | 184银ELAST套件 | |
| MILTEX活检冲 | MedexSupply | MTX-33-31AA | 1.5毫米 |
| PTFE管 | 科尔帕默 | EW-06417-31 | 0.032“ID |
| 阳鲁尔锁连接器 | Qosina | 65111 | |
| 刺阴鲁尔锁连接器 | Qosina | 11556 | |
| 切断阀 | IDEX健康与科学 | P-721 | |
| Y-连接器 | IDEX健康与科学 | P-513 | |
| 20G 1.5“针 | BD BiosciencË | 305176 | |
| 胰蛋白酶-EDTA | Invitrogen公司 | 25300-054 | |
| HEPES | 西格玛 | H-4034 | |
| CaspGLOW荧光 | 产品描述BioVision | K183-25 | |
| CaspGLOW红 | 产品描述BioVision | K193-25 | |
| 盐酸阿霉素 | 西格玛 | 44583 | |
| LS174T | ATCC | CCL-188 | 人结肠癌细胞系 |
| T47D | ATCC | HTB-133 | 人类性导管癌的细胞株 |
| MDA-MB-231 | ATCC | HTB-26 | 人类乳腺腺癌细胞系 |
参考文献
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol. Bioeng. 83, 173-180 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods. Mol. Med. 140, 141-151 (2007).
- Kasinskas, R. W., Forbes, N. S. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol. Bioeng. 94, 710-721 (2006).
- Walsh, C. L. A multipurpose microfluidic device designed to mimic microenvironment gradients and develop targeted cancer therapeutics. Lab. Chip. 9, 545-554 (2009).
- Lankelma, J., Fernandez Luque, R., Dekker, H., Schinkel, W., Pinedo, H. M. A mathematical model of drug transport in human breast cancer. Microvasc. Res. 59, 149-161 (2000).
- Less, J. R., Skalak, T. C., Sevick, E. M., Jain, R. K. Microvascular architecture in a mammary carcinoma: branching patterns and vessel dimensions. Cancer. Res. 51, 265-273 (1991).
- Brown, J. M., Giaccia, A. J. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer. Res. 58, 1408-1416 (1998).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br. J. Cancer. 9, 539-549 (1955).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat. Rev. Cancer. 6, 583-592 (2006).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。