Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dispositif microfluidique pour Recréer un microenvironnement des tumeurs
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons la procédure pour la fabrication et le fonctionnement d'un dispositif microfluidique qui recrée hétérogènes micro-environnements tumoraux In vitro. La variabilité dans l'apoptose au sein du tissu tumoral a été quantifiée en utilisant des colorants fluorescents et le coefficient de diffusion effectif de la doxorubicine médicament chimiothérapeutique dans le tissu tumoral a été évalué.
Résumé
Nous avons développé un dispositif microfluidique qui imite la livraison et la clairance systémique de médicaments hétérogènes tridimensionnels tissus tumoraux in vitro. Les éléments nutritifs fournis par le système vasculaire ne parviennent pas à atteindre toutes les parties de tumeurs, ce qui donne lieu à des micro-environnements hétérogènes constitués de types de cellules viables, de repos et nécrotiques. Médicaments contre le cancer ne parviennent pas à pénétrer efficacement et de traiter tous les types de cellules en raison de cette hétérogénéité. Des monocouches de cellules cancéreuses ne pas imiter cette hétérogénéité, il est difficile de tester des médicaments anticancéreux avec un modèle in vitro approprié. Nos dispositifs microfluidiques ont été fabriquées à partir de PDMS en utilisant la lithographie douce. Multicellulaires sphéroïdes tumoraux, formées par la méthode de la goutte suspendue, ont été insérés dans des chambres de contrainte et rectangulaires sur le dispositif de perfusion et maintenu à support continu sur un côté. La forme rectangulaire des chambres sur le dispositif créé dégradés linéaires dans les tissus. Colorants fluorescents ont été utilisés pour quantifier ela variabilité e dans l'apoptose dans les tissus. Les tumeurs de l'appareil ont été traités avec la doxorubicine fluorescente chimiothérapeutique drogue, time-lapse microscopie a été utilisé pour contrôler sa diffusion dans les tissus, et le coefficient de diffusion effectif a été estimé. La méthode de la goutte suspendue a permis la formation rapide de sphéroïdes uniformes de plusieurs lignées de cellules cancéreuses. Le terminal est activée croissance des sphéroïdes pour un maximum de 3 jours. Les cellules se trouvant à proximité de faire circuler l'agent apoptotique sont très peu et loin de ceux de la chaîne sont plus apoptotique, ainsi fidèlement imitant les régions adjacentes dans les tumeurs des vaisseaux sanguins. La valeur estimée du coefficient de diffusion d'accord avec la doxorubicine une valeur précédemment rapportés dans le cancer du sein humain. Parce que la pénétration et la rétention de médicaments dans les tumeurs solides affecte leur efficacité, nous pensons que ce dispositif est un outil important pour comprendre le comportement de la drogue, et qui développe des thérapies contre le cancer.
Protocole
1. Fabrication de périphériques
La réplication des caractéristiques microfluidiques dans les matériaux élastomères est basée sur la méthode décrite par Duffy et al 1.
- Élastomère Mix (polydiméthylsiloxane; PDMS) et l'agent de durcissement à partir du Kit élastomère de silicone (Dow Corning, Midland, MI) dans un rapport pondéral de 9:1 à verser sur le maître pour former une couche de 4 mm d'épaisseur. Dégazer pour enlever les bulles d'air et durcir le mélange à 60 ° C pendant 5 heures. Peler durcie du moule PDMS pour obtenir un tampon de caractéristiques d'écoulement de l'élastomère.
- Percez des trous pour les entrées et les sorties à l'aide d'une biopsie de 1,5 mm (Miltex, York, PA) monté sur une perceuse à colonne. Retirez tout débris.
- Soumettre le côté caractéristiques du timbre et une lame de verre propre à un plasma d'oxygène pendant 8 minutes dans un plasma d'oxygène graveur. Amener les surfaces traitées en contact immédiatement pour former une liaison entre eux. Maintenir l'ensemble à 60 ° C sur une lame chaude pendant au moins 5 heuress pour renforcer le lien.
- Connectez 0.032 "ID Tuyau en PTFE (Cole Parmer, Vernon Hills, IL) pour les entrées et sorties à l'aide d'une interface de connecteurs luer lock mâle attaché à barbelés connecteurs femelles luer lock (Qosina, Edgewood, NY).
- Mettre en place l'ensemble d'écoulement à l'aide robinets et un connecteur en Y (Upchurch Scientific, Oak Harbor, WA; Figure 1). Monter l'appareil sur le microscope. Fixer seringues de tubage à l'aide 20G 1.5 "aiguilles (BD Bioscience, Rockville, MD).
2. Formation de sphéroïdes uniformes
Sphéroïdes sont formées par la méthode de la goutte suspendue 2,3.
- Trypsiniser cellules sous une hotte de culture cellulaire stérile.
- Centrifuger les cellules trypsinisées à 2000 rpm pendant 5 minutes et remettre en suspension dans 6 ml de milieu frais. Diluer la solution mère à une concentration finale désirée (tableau 1).
- Retirez le couvercle d'une plaque de 48 puits et placez-le à l'envers dans le sterilized capot. Régions circulaires correspondant à chaque puits sont apparents sur la couverture. Remplir chaque puits de la plaque avec 1 ml d'eau stérilisée pour maintenir l'humidité. Mettez une goutte de 20 ul de la solution diluée de cellules dans chaque région circulaire à l'aide d'une micropipette. Retourner avec précaution le couvercle et placez-le sur la plaque ainsi, faire en sorte que les gouttes ne touche pas les bords des puits.
- Incuber la plaque de puits à 37 ° C pendant un nombre spécifié de jours (tableau 1). Un sphéroïde se former dans chaque goutte suspendue.
3. Introduction de sphéroïdes dans le dispositif
Reportez-vous à la figure 1 et le tableau 2 pour cette section.
- Stériliser le dispositif de rinçage avec de l'éthanol 70% introduit à travers l'entrée d'écoulement. Par la suite, rincer avec du PBS suivie d'HEPES tampon milieu de culture cellulaire. Laisser la seringue moyen F S attaché à la tubulure.
- Dessinez 2-3 sphéroïdes en P seringue S, appuyez sur la seringue pour éliminer les bulles d'air, etattacher à l'entrée du dispositif d'emballage.
- Ouvert entrée de la vanne V Pin et près Fin V. Ouvrir la vanne de sortie Pout V et V près Fout. Tenez la seringue d'emballage verticale avec l'aiguille pointée vers le bas; regarder sphéroïdes se déposent au fond de la seringue dans le connecteur luer-lock de l'aiguille. Poussez le piston de la seringue d'emballage et de sphéroïdes montres entrer dans le tube et le débit dans l'appareil. Parce que la vanne de sortie emballage est ouvert, un sphéroïde pénètre dans la chambre de l'appareil et être conservé par les postes à l'arrière (Fig. 2).
- Fermer entrée de la vanne V Pin et Pout sortie de la vanne V. Monter la seringue S F sur une pompe à seringue. Ouvrir le robinet et la vanne V Fin V Fout. Type de fluide dans le dispositif à 3 pi / min.
4. Présentation de l'agent apoptose de détection (CaspGLOW)
Après l'emballage des chambres avec sphéroïdes, pour permettre l'équilibrage up à 24 heures pour établir des gradients de nutriments et micro-environnements, avant l'introduction de l'apoptose ou de la détection d'agents thérapeutiques. Parce que les tissus dans des chambres sont en contact avec des murs impénétrables du haut et du bas, il n'ya pas de gradients de nutriments le long de l'épaisseur (0,15 mm) du tissu. Après 24 heures d'incubation, les couches de cellules le long de l'épaisseur du tissu est donc équivalent et que l'hétérogénéité est dans une direction s'éloignant du canal d'écoulement.
- Couper V Fin, arrêter la pompe seringue, retirez F seringue S de la pompe et la remplacer par une seringue ayant moyennes contenant 0,25 ug / ml de CaspGLOW Red active Caspase-3 marqueur (rouge-DEVD-FMK, Biovision, Mountain View, CA).
- Vider manuellement les 0,7 ml de cette solution à travers le dispositif pour assurer le déplacement des personnes âgées à moyen terme. Monter la seringue de la pompe, redémarrez l'écoulement, et ouvert V Fin. Sur une période de 5-8 heures, la détection de l'apoptose diffuse agents en til tissu fluorescent et lumineuses dans les régions apoptotiques. Agent de l'apoptose détecter à cette concentration est maintenue dans toutes les solutions de flux ultérieurs dans le dispositif.
Note:
- L'hétérogénéité des tissus peut être confirmé par l'obtention de profils d'intensité de fluorescence linéaire tel que décrit dans la section 6. Les profils doivent montrer gradients spatiaux dans l'apoptose, ce qui confirme que le tissu est hétérogène en ce qui concerne la viabilité des cellules.
- CaspGLOW vert active Caspase-3 marqueur (fluorescéine-DEVD-FMK, Biovision) peuvent également être utilisés pour détecter l'apoptose. Ce marqueur contient la fluorescéine fluorophore vert au lieu de la rhodamine fluorochrome rouge.
5. Présentation de l'agent thérapeutique
- Suivez la procédure des étapes 4.1 à 4.2 pour introduire 10 uM chlorhydrate de doxorubicine (Dox; Sigma-Aldrich, St. Louis, MO) contenant l'apoptose agent de détection.
- Continuer écoulement du therapeUTIC solution d'agent pendant une période de temps déterminée. Vanne d'arrêt V Fin et éteindre la pompe à seringue. Remplacez la seringue traitement avec une seringue contenant un milieu frais apoptose agent de détection. Permettre l'écoulement du milieu frais pendant 24 -36 heures tout en surveillant continuellement les tissus au microscope.
6. Time-lapse de microscopie et estimation des coefficients Diffusivité médicaments
Pour obtenir plus propres données de fluorescence, d'acquérir toutes les images en mettant l'accent sur le microscope les basses couches de tissus. Parce qu'il n'y a pas de gradients de nutriments dans le sens vertical (voir la section 4), les couches inférieures de cellules sont de bons représentants de toutes les autres couches ci-dessus.
- Le processus d'acquisition a été automatisé en utilisant un script personnalisé dans IPLab (BD Bioscience, Rockville, MD). Acquérir des images transmises lumière et de la fluorescence du sphéroïde emballé à un grossissement de 10x toutes les 30 minutes (figure 3A). Acquire une image de la fluorescence de fond avant l'introduction de Dox. Pour tenir compte de la grande taille de la chambre (1000 x 300 um um), l'acquisition de deux images adjacentes et les tuiles ensemble 4.
- Pour l'estimation mathématique des coefficients de diffusivité de drogue, la première étape consiste à générer des profils d'intensité moyennes linéaires de Dox fluorescence en utilisant ImageJ. Sélectionner une région rectangulaire d'intérêt (ROI) entourant le tissu dans la chambre. Utilisez la commande Profil Terrain pour générer un profil d'intensités moyennes en fonction de la distance entre le canal d'écoulement. Répétez l'opération pour jusqu'à 3 points de temps différents.
- Obtenir une image de fluorescence de fond avant l'introduction Dox pour mesurer l'autofluorescence de tissu. Soustraire l'intensité de fond de fluorescence moyenne des profils d'intensité obtenus et normaliser chaque profil correspondant à l'intensité maximale pour obtenir
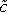 (X, t) (Fig. 3B).
(X, t) (Fig. 3B). - L'étape suivante consiste à évaluer l'efficacité coefficient de diffusion D de Dox au sein du tissu tumoral. Dox diffusion peut être représentée par l'équation suivante 5

où erfc est la fonction d'erreur complémentaire, x est la distance dans le tissu de la chaîne, et t est le temps après l'introduction de Dox (voir Fig. 3). Utilisez le schéma itératif suivant à chaque point de temps considéré:- Devinez une valeur de D
- Calculer côté droit de l'équation à chaque position x
- Calculer la somme des carrés des erreurs (résiduelle) entre les deux parties
- Modifier D pour minimiser le résidu
- Moyenne des valeurs optimales de D obtenue à chaque point temporel pour estimer le coefficient de diffusion effectif moyen de Dox dans le tissu.
7. Les résultats représentatifs:
Les dispositifs microfluidiques fourni 1mm x 0,3 mm x 0,15 mm optiquement chambres de culture accessibles pour la croissance de tissu tumoral à trois dimensions. Sphéroïdes tumoraux multicellulaires ont volé dans ces chambres et ont été retenus par deux postes de filtre à l'arrière. La méthode de la goutte suspendue a permis la formation rapide de sphéroïdes de taille uniforme et la forme de plusieurs lignées cellulaires. Sphéroïdes ont été cultivées avec succès sur l'appareil pour un maximum de 3 jours. La croissance dans les chambres a été associée à une modification reproductible des micro-environnements au sein de sphéroïdes. L'apoptose dans les cellules ont été moins à proximité du canal d'écoulement et plus profondément dans les tissus. Le dispositif a été utilisé pour estimer le coefficient de diffusion de la doxorubicine dans le tissu tumoral. La valeur obtenue de 8,75 x 10 -7 cm -1 2 s est en accord avec la valeur de 9,1 x 10 -7 cm 2 s -1 signalé précédemment 6 dans le cancer du sein humain.
| Lignée cellulaire | Concentration cellulaire nécessaire | Temps d'incubation |
| LS174T | 300 cellules / uL | 2-3 jours |
| T47D | 750 cellules / uL | 3-4 jours |
| MDA-MB-231 | 150 cellules / uL | 5-6 jours |
Tableau 1 Paramètres. Pour Sphéroïdes goutte suspendue
| Partie | Description |
| S F | Seringue flux |
| S P | Emballage seringue |
| V Fin | Soupape d'admission de flux |
| V Pin | Emballage soupape d'admission |
| V Fout | Vanne de sortie de flux |
| Pout V | Emballage vanne de sortie |
Seringues Tableau 2. Vannes et dans la configuration de débit

Figure 1 Schéma de l'écoulement de l'installation V et V Fin Fout:. Entrée de débit et de vannes de sortie; V Pin et Pout V: entrée d'emballage et de soupapes d'échappement; S F et S P: Débit et des seringues d'emballage. La seringue d'emballage et de conditionnement soupapes d'admission et de sortie sont utilisés lors d'un sphéroïde est effectué dans la chambre. La seringue d'écoulement et de débit d'entrée et valves de sortie sont utilisés pour s'écouler ensuite milieu.
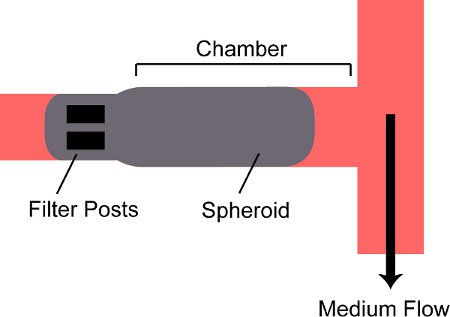
Figure 2. Schéma d'un sphéroïde pris au piège dans une chambre sur l'appareil. Un sphéroïde s'écoule dans la chambre de l'appareil et est bloqué par deux pos filtrect à l'arrière de la chambre.

Figure 3. Diffusion doxorubicine dans le tissu tumoral sur l'appareil. A. Fusionné transmise image lumineuse et fluorescente rouge de tissu, indiquant l'emplacement et la concentration de doxorubicine (en rouge). La barre d'échelle représente 250 um. B. Profil normalisé intensité linéaire de la fluorescence de la doxorubicine.
Discussion
La vascularisation des tumeurs sont rares et mal développés 7,8. Il ya des régions éloignées (> 100 um) à partir des vaisseaux sanguins qui sont inaccessibles aux nutriments et les médicaments fournis si le 9 vasculaire. Le micro-environnement hétérogène résultant contribue à l'efficacité limitée de plusieurs agents chimiothérapeutiques 10. Le dispositif microfluidique développée ici recrée un microenvironnement tumoral hétérogène, caractérisée par la prolif...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par l'Institut national de la santé de subvention # 1R01CA120825-01A1, la recherche biomédicale en collaboration (PRC) de l'Université du Massachusetts à Amherst, et la bourse Isenberg pour Bhushan J. Toley. Nous tenons à souligner la précieuse contribution de James Schafer, le vidéaste, le narrateur, et rédacteur en chef de cette vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Kit d'élastomère de silicone | Ellsworth Adhesives | 184 Sil Elast Kit | |
| Miltex biopsie | MedexSupply | MTX-33-31AA | 1,5 mm |
| Tuyau PTFE | Cole Parmer | EW-06417-31 | 0.032 "ID |
| Connecteur Luer mâle de verrouillage | Qosina | 65111 | |
| Barbed connecteur luer lock femelle | Qosina | 11556 | |
| Vanne d'arrêt | Idex la santé et des sciences | P-721 | |
| Y-connecteur | Idex la santé et des sciences | P-513 | |
| 20G 1.5 "aiguilles | BD Bioscience | 305176 | |
| Trypsine-EDTA | Invitrogen | 25300-054 | |
| HEPES | Sigma | H-4034 | |
| CaspGLOW fluorescéine | Biovision | K183-25 | |
| CaspGLOW Rouge | Biovision | K193-25 | |
| Chlorhydrate de doxorubicine | Sigma | 44583 | |
| LS174T | ATCC | CCL-188 | Lignée cellulaire humaine de carcinome du côlon |
| T47D | ATCC | HTB-133 | Ligne d'Ductal cellulaire Carcinome |
| MDA-MB-231 | ATCC | HTB-26 | Human ligne cellulaire d'adénocarcinome mammaire |
Références
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol. Bioeng. 83, 173-180 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods. Mol. Med. 140, 141-151 (2007).
- Kasinskas, R. W., Forbes, N. S. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol. Bioeng. 94, 710-721 (2006).
- Walsh, C. L. A multipurpose microfluidic device designed to mimic microenvironment gradients and develop targeted cancer therapeutics. Lab. Chip. 9, 545-554 (2009).
- Lankelma, J., Fernandez Luque, R., Dekker, H., Schinkel, W., Pinedo, H. M. A mathematical model of drug transport in human breast cancer. Microvasc. Res. 59, 149-161 (2000).
- Less, J. R., Skalak, T. C., Sevick, E. M., Jain, R. K. Microvascular architecture in a mammary carcinoma: branching patterns and vessel dimensions. Cancer. Res. 51, 265-273 (1991).
- Brown, J. M., Giaccia, A. J. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer. Res. 58, 1408-1416 (1998).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br. J. Cancer. 9, 539-549 (1955).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat. Rev. Cancer. 6, 583-592 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon