A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מכשיר microfluidic ליצירה מחדש של גידול microenvironment
* These authors contributed equally
In This Article
Summary
אנו מציגים את הליך הייצור ותפעול של מכשיר microfluidic המשחזר microenvironments סרטני הטרוגניות במבחנה. ההשתנות באפופטוזיס בתוך רקמת גידול כומתה באמצעות כתמי ניאון ומקדם דיפוזיה יעילה של דוקסורוביצין התרופה כימותרפית לתוך רקמת גידול הוערך.
Abstract
פתחנו מכשיר microfluidic המחקה את המשלוח והאישור מערכתי של סמים לרקמות סרטניות בשלושת ממדים הטרוגניים במבחנה. חומרים מזינים מועברים על ידי מערכת כלי דם אינם מצליחין להגיע לכל החלקים של גידולים, והוליד microenvironments הטרוגנית מורכבים מסוגי תאי קיימא, רדומים ונימקים. תרופות לסרטן ביעילות רבות נכשלות לחדור ולטפל בכל סוגי תאים, בגלל ההטרוגניות הזאת. Monolayers של תאים סרטניים אינו מחקה את ההטרוגניות הזאת, שהופך אותו קשה לבדוק עם תרופות נגד הסרטן מתאים במודל מבחנה. התקני microfluidic היו מפוברקים מתוך PDMS באמצעות ליתוגרפיה הרכה. שספרואידים תאיים סרטניים, שהוקמו על ידי שיטת הטיפה התלויה, הוכנסו ומוגבלים לתאים מלבניים על המכשיר ומתוחזק עם זלוף הרציף הבינוני בצד אחד. הצורה המלבנית של תאים במכשיר נוצרה הדרגתית ליניארי בתוך רקמה. כתמי פלורסנט שמשו לכמת ההשתנות דואר באפופטוזיס בתוך רקמה. גידולים על המכשיר טופלו בתרופה כימותרפית דוקסורוביצין מיקרוסקופיה הניאון, זמן לשגות שמשה כדי לפקח דיפוזיה שלה לתוך רקמות, ומקדמת דיפוזיה יעילה הוערכה. שיטת הטיפה התלויה אפשרה היווצרות מהירה של שספרואידים אחידים ממספר סוגים של תאים סרטניים. המכשיר אפשר צמיחה של שספרואידים לעד 3 ימים. התאים בקרבה זורם בינוני היו מינימאלי אפופטוטיים ואלה רחוקים מהערוץ היו יותר אפופטוטיים, ובכך מחקו במדויק אזורים בגידולים סמוכים לכלי דם. הערך המשוער של מקדם הדיפוזיה דוקסורוביצין הסכים עם ערך שדווח בעבר בסרטן השד אנושי. בגלל החדירה והשמירה של תרופות בגידולים מוצקים משפיעות על היעילות שלהם, אנו מאמינים כי מכשיר זה הוא כלי חשוב בהבנת התנהגות של תרופות, ופיתוח תרופות לסרטן חדשות.
Protocol
1. ייצור מכשיר
שכפול של תכונות microfluidic בחומרים אלסטומרי התבסס על השיטה שתוארה על ידי דאפי ואח' 1.
- אלסטומר מיקס (polydimethylsiloxane; PDMS) וסוכן ריפוי מקיט סיליקון אלסטומר (Dow Corning, Midland, MI) במשקל יחס 09:01 ויוצקים מעל את תבנית הבסיס כדי ליצור שכבה עבה 4 מ"מ. הדגה להסיר בועות אוויר ולרפא את התערובת על 60 מעלות צלזיוס במשך 5 שעות. הפיל נרפא מעובש PDMS לקבל חותמת של תכונות זרימה באלסטומר.
- לנקב חורים לפתחי כניסה ושקעים באמצעות 1.5 מ"מ ביופסית אגרוף (Miltex, יורק, פנסילבניה) רכובים על מקדחה. משוך את כל פסולת.
- להכפיף את צד התכונות של הבול ושקופית זכוכית נקיה לפלזמת חמצן במשך 8 דקות בתחריט פלזמת חמצן. להביא את המשטחים שטופלו במגע באופן מיידי כדי ליצור קשר ביניהם. לשמור על ההרכבה ב 60 ° C בשקופית חמה לפחות 5 שעהזה כדי לחזק את הקשר.
- חבר 0.032 "צינורות PTFE זיהוי (קול לבן זוג, ורנון הילס, אילינוי) לפתחי הכניסה והשקעים באמצעות ממשק של מנעול luer זכר מחברים המצורפים למחברי תיל נשיים luer מנעול (Qosina, אדג'ווד, ניו יורק).
- הגדרת הרכבת הזרימה באמצעות שסתומי בים ו- Y מחבר (אפצ'רץ' מדעי, האלון הארבור, וושינגטון; איור 1). הר המכשיר למיקרוסקופ. צרף מזרקים לצינורות באמצעות מחטי 20G 1.5 "(BD Bioscience, רוקוויל, מרילנד).
2. היווצרות spheroids האחיד
Spheroids נוצרו בשיטת הטיפה התלויה 2,3.
- Trypsinize תאים מתחת לברדס תרבות תא סטרילי.
- צנטריפוגה תאי trypsinized ב2000 סל"ד במשך 5 דקות וresuspend במדיום 6 מ"ל טרי. לדלל את תמיסת המנייה לריכוז סופי רצוי (טבלה 1).
- הסר את הכיסוי של צלחת גם 48 ולמקם אותו במהופך בsterilized מכסה מנוע. מתאימים לכל האזורים גם מעגליים לכאורה על העטיפה. ממלא כל היטב של הצלחת עם 1 מיליליטר מים מעוקרים כדי לשמור על לחות. שים טיפת μl 20 מתוך פתרון התא המהול בכל אזור מעגלי באמצעות micropipette. זהירות להפוך את המכסה ומניח אותו על הצלחת היטב, להבטיח כי את הטיפין לא נוגעות בקצוות של הבארות.
- דגירה את הצלחת היטב על 37 מעלות צלזיוס למספר מסוים של ימים (טבלה 1). אליפטית תהווה בכל טיפת תלייה.
3. מבוא של spheroids התקנים לתוך
ראה איור 1 ולוח 2 לסעיף זה.
- לעקר את המכשיר על ידי שטיפה עם אתנול 70% הציג דרך כניסת הזרימה. לאחר מכן, לשטוף עם PBS ואחרי HEPES נאגר מדיום תרבות תא. השאר F S המזרק הבינוני המחובר לצינורות.
- צייר 2-3 שספרואידים לP S המזרק, קש על מזרק כדי להסיר בועות אוויר, ולצרף למפרצון האריזה של המכשיר.
- פתח כניסת שסתום V פין וסנפיר V קרוב. שרבוב שפות פתוח יציאת שסתום V וFout V הקרוב. החזק את המזרק האנכי עם המחט כלפי מטה האריזה; לצפות שספרואידים ליישב לתחתית של המזרק לתוך המחבר לנעול luer של המחט. דוחף את בוכנת מזרק על אריזה ושספרואידים לצפות להיכנס לצינורות והזרימה לתוך המכשיר. כי רק את השסתום לשקע אריזה פתוח, ספרואיד יהיה להיכנס לחדרו של המכשיר ולהישמר על ידי הודעות בחלק האחורי (איור 2).
- סגור כניסת שסתום V פין ושרבוב שפות V יציאת שסתום. הר F S המזרק במשאבת מזרק. שסתום פתוח V סנפיר והשסתום V Fout. מדיום לזרום לתוך המכשיר בשעה 3 μl / דקה.
4. הקדמה של סוכן אפופטוזיס זיהוי (CaspGLOW)
לאחר אריזת תאים עם שספרואידים, מאפשר איזון עבור uעמ '24 שעות כדי להקים הדרגתי וmicroenvironments תזונתיים, לפני החדרת אפופטוזיס גילוי או סוכנים טיפוליים. מכיוון שהרקמות בתאים נמצאות במגע עם קירות בלתי חדירים מחלק העליון ותחתון, אין שיפועים תזונתיים לאורך העובי (0.15mm) של הרקמה. לאחר 24 שעות של דגירה, כל שכבות התאים לאורך העובי של הרקמה ולכן הם שווות ערך וההטרוגניות היחידה היא בכיוון הפוך מן ערוץ הזרימה.
- כבה את V סנפיר, להפסיק את משאבת המזרק, להסיר F-S מזרק מהמשאבה ולהחליף אותו עם מזרק שמכיל מדיום 0.25 μl / מ"ל של CaspGLOW האדום פעיל סמן caspase-3 (האדום DEVD-FMK; Biovision, Mountain View, ע"א).
- לשטוף ידני 0.7 מ"ל של פתרון זה דרך המכשיר כדי להבטיח תזוזה של מדיום ישן יותר. הר את המזרק במשאבה, הפעל מחדש את הזרימה, וסנפיר V הפתוח. במשך תקופה של 5-8 שעות, אפופטוזיס איתור מתמוסס לתוך סוכן tהוא רקמות ומאיר בהיר באזורים אפופטוטיים. סוכן איתור אפופטוזיס בריכוז הזה נשמר בכל פתרוני הזרימה הבאות למכשיר.
הערה:
- ההטרוגניות רקמות שניתן לאשר על ידי קבלת פרופילי עצמה ליניארי של קרינה כמפורטת בסעיף 6. הפרופילים צריכים להראות הדרגתיים מרחביים באפופטוזיס, המאשר כי הרקמה היא הטרוגנית ביחס לכדאיויות תא.
- גרין סמן CaspGLOW הפעיל caspase-3 (fluorescein-DEVD-FMK; Biovision) יכול גם לשמש כדי לזהות אפופטוזיס. סמן זה מכיל fluorescein fluorophore הירוק במקום rhodamine fluorophore האדום.
5. הקדמה של סוכן טיפולי
- בצע את ההליך בשלבים 4.1-4.2 להציג hydrochloride 10 מיקרומטר דוקסורוביצין (דוקס; סיגמה אולדריץ, סנט לואיס, מיזורי) המכיל אפופטוזיס איתור סוכן.
- המשך זרימת therapeפתרון הסוכן utic לתקופה קצובה של זמן. כבה את סנפיר V סתום ולכבות את משאבת המזרק. החלף את מזרק הטיפול עם מזרק בינוני טרי המכיל אפופטוזיס איתור הסוכן. לאפשר זרימה של מדיום טרי במשך 24 -36 שעות ברציפות תוך ניטור הרקמות תחת מיקרוסקופ.
6. מיקרוסקופיה זמן לשגות ואמיד של מקדמי diffusivity סמים
לקבלת נתוני קרינה נקיים, לרכוש את כל התמונות על ידי התמקדות מיקרוסקופ על השכבות התחתונות של רקמות. מכיוון שאין שיפועים תזונתיים בכיוון האנכי (ראה סעיף 4), השכבות התחתונות של תאים הן נציגים טובים של כל השכבות האחרות מעל.
- תהליך הרכישה כולו אוטומטי באמצעות סקריפט מותאם אישית בIPLab (BD Bioscience, רוקוויל, מרילנד). לרכוש תמונות אור פלואורסצנטי ומועברים במגע של אליפטית ארוזה בהגדלת 10x כל 30 דקות (איור 3 א). Acquirדואר תמונה של קרינת הרקע שקדם לכניסתה של דוקס. כדי להתאים לגודלו של החדר (1000 x 300 מיקרומטר מיקרומטר), לרכוש שתי תמונות ורעפיהם ביחד 4 סמוכות.
- להערכה מתמטית של מקדמי diffusivity סמים, הצעד הראשון הוא ליצור פרופילים בממוצע ליניארי בעצמה של דוקס פלואורסצנטי באמצעות ImageJ. בחר אזור מלבני של עניין (ROI) המקיף את הרקמה בבית הבליעה. השתמש בפקודת פרופיל המגרש כדי ליצור פרופיל של עוצמות ממוצעות כפונקציה של מרחק מערוץ הזרימה. חזור לעד 3 נקודתי זמן שונות.
- להשיג תמונת קרינת רקע לפני הצגת דוקס למדוד autofluorescence מהרקמות. חיסור עוצמת קרינת הרקע הממוצעת מהפרופילים בעצמה שהושגו ולנרמל את כל פרופיל בעוצמתו המרבית המקבילה להשיג
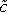 (X, t) (3 איורב).
(X, t) (3 איורב). - הצעד הבא הוא להעריך את מקדם הדיפוזיה D היעיל של דוקס בתוך רקמת גידול. דיפוזיה דוקס יכולה להיות מיוצגת על ידי המשוואה הבאה 5

בי ERFC הוא פונקצית השגיאה המשלימה, x הוא מרחק לרקמה מהערוץ, ולא הוא זמן לאחר כניסתה של דוקס (ראה איור. 3). השתמש בתכנית הבאה איטרטיבי בכל נקודת זמן נחשב:- נחש ערך עבור D
- חישוב צד ימני של משוואה בכל x מיקום
- לחשב את סכום ריבועי שגיאות (שייר) בין שני הצדדים
- שינוי D כדי למזער את השיורים
- הערכים האופטימליים של D המתקבלים בכל נקודת זמן כדי להעריך את המקדם הממוצע האפקטיבי דיפוזיה של דוקס ברקמה ממוצעת.
7. נציג תוצאות:
<כיתת p = "jove_content"> מכשירי microfluidic ספקו 1mm x 0.3mm x 0.15mm אופטי תאי תרבות נגישים לצמיחה של רקמת גידול בתלת ממד. שספרואידים גידול תאיים הוטסו לתאים אלה ונשמרו על ידי שתי הודעות מסננות בחלק האחורי. שיטת הטיפה התלויה אפשרה היווצרות מהירה של שספרואידים של גודל וצורה מכמה שורות תאים עקביים. Spheroids גדלו בהצלחה על המכשיר לתקופה של עד 3 ימים. צמיחה בתאים הייתה קשורה בשינוי לשחזור של microenvironments בתוך שספרואידים. אפופטוזיס התרחש פחות בתאים בקרבתו של ערוץ הזרימה והעמוקה יותר לרקמות. המכשיר היה בשימוש כדי להעריך את מקדם הדיפוזיה של דוקסורוביצין ברקמת גידול. הערך המתקבל של 8.75 x 10 -7 סנטימטרים 2 של -1 מסכים עם הערך של 9.1 x 10 -7 סנטימטרים 2 של -1 שדווח בעבר 6 בסרטן השד אנושי.| קו סלולרי | ריכוז תא נדרש | זמן דגירה |
| LS174T | 300 תאים / μL | 2-3 ימים |
| T47D | 750 תאים / μL | 3-4 ימים |
| מד"א-MB-231 | 150 תאים / μL | 5-6 ימים |
לוח 1. פרמטרים לspheroids Drop התלוי
| חלק | תיאור |
| S F | מזרק זרימה |
| S P | אריזת מזרק |
| V Fin | שסתום כניסת זרימה |
| V פין | אריזת שסתום כניסה |
| V Fout | Valve אאוטלט זרימה |
| שרבוב שפות V | אריזת שסתום אאוטלט |
טבלה 2. מזרקים ושסתום בהגדרת זרימה

איור 1 סכמטי של זרימת התקנת V הסנפיר וV Fout:. כניסת זרימה ושסתום דואליים; V הפין ושרבוב שפות V: כניסת אריזה ושסתומים דואליים; S F ו-S P: הזרימה ומזרקי אריזה. מזרק האריזה ואריזת כניסה ושסתומים לשקע משמש כאשר אליפטית הוא הוטס לבית הבליעה. מזרק הזרימה וכניסת זרימה ושסתומה לשקע משמשים לזרום בינוני לאחר מכן.
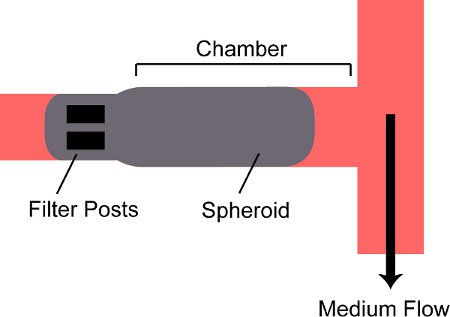
איור 2. תרשים סכמטי של אליפטית לכוד בתא במכשיר. אליפטית היא זרם לתוך התא במכשיר ונחסם על ידי שני pos המסנןts בחלק האחורי של החדר.

איור 3. דוקסורוביצין דיפוזיה ברקמת גידול במכשיר. א Merged תמונה משודרת אור ניאון והאדומה של רקמה, המראה את המיקום ואת הריכוז של דוקסורוביצין (באדום). סרגל קנה מידה מייצג 250 מיקרומטר. פרופיל ב מנורמל ליניארי מעוצמת פלואורסצנטי דוקסורוביצין.
Access restricted. Please log in or start a trial to view this content.
Discussion
מערכת כלי הדם בגידולים היא דלילה וחולה פתחה 7,8. יש אזורים הממוקמים רחוק (> 100 מיקרומטר) מכלי הדם שאינם נגישים לחומרים מזינים ותרופות שסופקו למרות 9 vasculature. Microenvironment הטרוגנית כתוצאה תורם ליעילות המוגבלת של chemotherapeutics רב 10. מכשיר microfluidic פותח כאן משחזר גי...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לבריאות מענק # 1R01CA120825-01A1, מחקר המשותף ביו (CBR) התכנית באוניברסיטת מסצ'וסטס אמהרסט, ומלגות אייזנברג לBhushan ג'Toley. אנו מכירים תודה על התרומה החשובה של ג'יימס שפר, צלם וידאו, מספר, והעורך של הווידאו הזה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגים | תגובות |
|---|---|---|---|
| ערכת סיליקון אלסטומר | דבקי Ellsworth | 184 סיל Elast קיט | |
| Miltex ביופסית האגרוף | MedexSupply | MTX-33-31AA | 1.5 מ"מ |
| צינורות PTFE | הקול בן זוגו | EW-06417-31 | .032 "מזהה |
| luer זכר נעילת מחבר | Qosina | 65111 | |
| מחבר מנעול תיל נשי luer | Qosina | 11556 | |
| שסתום ניתוק | IDEX בריאות ומדע | P-721 | |
| Y-מחבר | IDEX בריאות ומדע | P-513 | |
| 20G 1.5 "מחטים | BD Biosciencדואר | 305176 | |
| טריפסין-EDTA | Invitrogen | 25300-054 | |
| HEPES | סיגמא | H-4034 | |
| CaspGLOW fluorescein | Biovision | ק '183-25 | |
| CaspGLOW אדום | Biovision | K193-25 | |
| דוקסורוביצין הידרוכלוריד | סיגמא | 44583 | |
| LS174T | ATCC | CCL-188 | שורת תאי קרצינומה מעי גס אנושית |
| T47D | ATCC | HTB-133 | קו תא אנושי ductal קרצינומה |
| מד"א-MB-231 | ATCC | HTB-26 | קו תא אנושי חלב אדנוקרצינומה |
References
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol. Bioeng. 83, 173-180 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods. Mol. Med. 140, 141-151 (2007).
- Kasinskas, R. W., Forbes, N. S. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol. Bioeng. 94, 710-721 (2006).
- Walsh, C. L. A multipurpose microfluidic device designed to mimic microenvironment gradients and develop targeted cancer therapeutics. Lab. Chip. 9, 545-554 (2009).
- Lankelma, J., Fernandez Luque, R., Dekker, H., Schinkel, W., Pinedo, H. M. A mathematical model of drug transport in human breast cancer. Microvasc. Res. 59, 149-161 (2000).
- Less, J. R., Skalak, T. C., Sevick, E. M., Jain, R. K. Microvascular architecture in a mammary carcinoma: branching patterns and vessel dimensions. Cancer. Res. 51, 265-273 (1991).
- Brown, J. M., Giaccia, A. J. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer. Res. 58, 1408-1416 (1998).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br. J. Cancer. 9, 539-549 (1955).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat. Rev. Cancer. 6, 583-592 (2006).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved