Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микрофлюидных устройство для воссоздания микроокружение опухоли
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы представляем порядок изготовления и эксплуатации микрофлюидных устройство, которое воссоздает гетерогенной опухоли микроокружения В пробирке. Изменчивости апоптоза в опухолевой ткани была количественно с помощью флуоресцентных красителей и эффективный коэффициент диффузии химиотерапевтического препарата доксорубицина в опухолевой ткани была оценена.
Аннотация
Мы разработали микрофлюидных устройство, которое имитирует доставки и системный клиренс препаратов для гетерогенных трехмерной опухолевой ткани в пробирке. Питательные вещества доставляются на сосудистую не в состоянии охватить все районы опухоли, что приводит к гетерогенным микросреды, состоящей из жизнеспособных, покоя и некротические типов клеток. Многие лекарства от рака не в состоянии эффективно проникать и лечения всех типов клеток из-за этой неоднородности. Монослои раковые клетки не имитировать эту неоднородность, что делает его трудным для тестирования противораковых препаратов с подходящей моделью в пробирке. Наши микрофлюидных устройства были изготовлены из PDMS помощью мягкой литографии. Многоклеточных опухолевых сфероидов, образованных методом висячей капли, были вставлены и ограничены в прямоугольных камерах на устройство и поддерживается с непрерывной перфузии среды на одной стороне. Прямоугольной формы камер на устройство создано линейные градиенты в тканях. Флуоресцентные пятна были использованы для количественной йэлектронной изменчивости апоптоза в ткани. Опухоли на устройство обрабатывали флуоресцентным химиотерапевтического препарата доксорубицина, покадровой микроскопии был использован для мониторинга его диффузии в ткани, и эффективный коэффициент диффузии был оценен. Висячей капли метод позволил быстро формирование единого сфероидов из нескольких линий раковых клеток. Устройство включено роста сфероидов на срок до 3 дней. Клетки в непосредственной близости от протекающей среды было минимальным апоптоза и тех, недалеко от канала были более апоптоза, таким образом, точно имитируя регионах, прилегающих к опухоли кровеносных сосудов. Расчетная величина коэффициента диффузии доксорубицин согласился с ранее сообщал значение в человеческой рака молочной железы. Из-за проникновения и удержания препаратов в твердых опухолей влияет на их эффективность, мы считаем, что это устройство является важным инструментом в понимании поведения наркотиков, и разработка новых терапии рака.
протокол
1. Устройство изготовления
Репликация микрофлюидных особенности в эластомерных материалов была основана на методике, описанной Даффи и др. 1.
- Mix эластомер (полидиметилсилоксана; PDMS) и отвердитель из комплекта кремнийорганический каучук (Dow Corning, Midland, MI) в соотношении 9:1 веса и залить мастер с образованием 4 мм толщины слоя. Дега, чтобы удалить пузырьки воздуха и вылечить смеси при 60 ° C в течение 5 часов. Пил вылечить PDMS из пресс-формы для получения штампа потока особенности на эластомера.
- Удар отверстия для входа и выхода использовании 1,5 мм биопсии удар (Miltex, Йорк, Пенсильвания), установленных на буровой прессы. Вытащить любой мусор.
- Подвергать особенностей стороне штамп и чистое предметное стекло для кислородной плазме в течение 8 минут в гравер плазме кислорода. Принесите обработанных поверхностей, контактирующих непосредственно с образованием связи между ними. Поддерживать сборки при 60 ° C на слайде теплее, по крайней мере, 5 часас укрепления связей.
- Подключите 0,032 "ID PTFE трубки (Cole Parmer, Vernon Hills, IL) на входах и выходах с помощью интерфейса мужской Luer Lock разъемы прикреплены к колючей женщины Luer Lock разъемы (Qosina, Edgewood, Нью-Йорк).
- Настройка потока сборки с помощью запорных клапанов и Y-разъем (Upchurch научных, Oak Harbor, Вашингтон; рис. 1). Установите устройство на микроскопе. Прикрепите шприц с трубкой использованием 20G 1,5 "иглы (BD Bioscience, Роквилл, штат Мэриленд).
2. Формирование единого сфероидов
Сфероидов были сформированы методом висячей капли 2,3.
- Trypsinize клеток в стерильных капот культуре клеток.
- Центрифуга трипсинизированных клеток при 2000 оборотов в минуту в течение 5 минут и ресуспендируют в 6 мл свежей среды. Разбавьте раствор до желаемой конечной концентрации (табл. 1).
- Снимите крышку 48-луночный планшет и поместите его вниз головой в Sterilized капот. Циркуляр областях, соответствующих каждой скважине являются очевидными на обложке. Заполните каждую лунку планшета с 1 мл стерильной воды для поддержания влажности. Поместите 20 мкл капли разбавленного раствора ячейки в каждой круговой области использования микропипетки. Аккуратно перевернуть крышкой и поместите его над лунками, обеспечение того, чтобы капли не прикасаться к краям скважины.
- Инкубируйте а пластины при температуре 37 ° C в течение определенного количества дней (табл. 1). Сфероида будет формироваться в каждой висячей капли.
3. Введение сфероидов в устройство
Обратитесь к рисунку 1 и таблице 2 для этого раздела.
- Стерилизовать устройство промывки с 70% этанола вводят через потока на входе. Впоследствии, на одном уровне с PBS следуют HEPES буферной среде клеточной культуры. Оставьте F среду шприц S прикреплены к трубке.
- Ничья 2-3 сфероидов в шприц P S, нажмите шприц для удаления пузырьков воздуха, иприкрепляются к упаковке входе в устройство.
- Открыть впускной клапан V Pin и близких Fin V. Открыть выпускной клапан V Pout и близких Fout V. Держите упаковки шприцев вертикальные с иглы направлен вниз; наблюдать, как сфероидов оседают на дно шприца в Luer соединением замок иглы. Надавите на поршень на упаковке шприц и часы сфероидов ввести трубку и впадают в устройстве. Потому что только упаковка выпускной клапан открыт, сфероид войдет в камере устройства и храниться сообщения на спине (рис. 2).
- Закрыть впускной клапан V Pin и выпускной клапан V Pout. Установите F S шприц на шприц насоса. Откройте клапан V Fin и клапан V Fout. Поток среды в устройстве на 3 мкл / мин.
4. Введение апоптоза Обнаружение агента (CaspGLOW)
После упаковки камер с сфероидов, позволяющие равновесия для ир до 24 часов, чтобы установить питательных градиенты и микросреды, до введения апоптоза обнаружения или терапевтических агентов. Поскольку ткани в камере находятся в контакте с непроницаемой стены от верха и низа, нет никаких питательных градиенты по толщине (0,15 мм) ткани. После 24 часов инкубации, все клеточные слои по толщине ткани, следовательно, эквивалентны, и только неоднородности в направлении от потока канала.
- Отключите V Fin, остановить шприцевой насос, удалить F шприц S от насоса и заменить его с помощью шприца со средним уровнем содержащий 0,25 мкл / мл CaspGLOW Красной активность каспазы-3 маркера (красный-DEVD-FMK; BioVision, Mountain View, CA).
- Вручную очистить 0,7 мл этого раствора через устройство для обеспечения перемещения старше среды. Установите шприц на насос, перезапустить поток, и открытое V фин. В течение 5-8 часов, апоптоз обнаружения агента проникает тОн ткани и флуоресцирует ярче в апоптозе регионов. Апоптоз обнаружения агента на этом концентрация поддерживается во всех последующих решениях потока в устройство.
Примечание:
- Ткань неоднородность может быть подтверждена путем получения линейных профилей интенсивности флуоресценции, как описано в разделе 6. Профили должны показать пространственные градиенты в апоптозе, подтверждающие, что ткань неоднородна по отношению к жизнеспособности клеток.
- CaspGLOW Зеленый активность каспазы-3 маркера (флуоресцеин-DEVD-FMK; BioVision) также может быть использован для обнаружения апоптоза. Этот маркер содержит зеленый флуоресцеина флуорофора вместо красной родамина флуорофора.
5. Введение терапевтических агентов
- Следуйте инструкциям в шагах 4.1-4.2 ввести 10 мкМ доксорубицина гидрохлорид (Dox, Sigma-Aldrich, Сент-Луис, Миссури), содержащие апоптоза обнаружения агента.
- Продолжить поток therapeУтик решение агент в течение фиксированного периода времени. Запорный вентиль V Fin и выключить шприцевой насос. Заменить лечения шприц с новым шприцем среде, содержащей апоптоза обнаружения агента. Разрешить приток свежего среде в течение 24 -36 часов при непрерывном мониторинге ткани под микроскопом.
6. Замедленной микроскопии и оценивания коэффициентов температуропроводности наркотиков
Для получения чистых данные флуоресценции, приобретают все изображения при фокусировке микроскопа на нижних слоев ткани. Потому что нет никаких питательных градиенты в вертикальном направлении (см. раздел 4), нижний слои клеток хорошо представителей всех других слоев выше.
- Весь процесс приобретения были автоматизированы с помощью пользовательского сценария в IPLab (BD Bioscience, Роквилл, штат Мэриленд). Приобретать проходящем свете и флуоресценции изображений упакованы сфероида на 10-кратным увеличением каждые 30 минут (рис. 3А). Обретенияэлектронной изображение фоновой флуоресценции до введения Dox. Чтобы приспособить для большой размер камеры (1000 мкм х 300 мкм), приобретение двух смежных изображений и плитку их вместе 4.
- Для математической оценки коэффициентов диффузии наркотиков, первым шагом является получение усредненных линейных профилей интенсивности флуоресценции с помощью Dox ImageJ. Выбор прямоугольной области интереса (ROI) охватывает ткани в камере. Используйте команду участок профиля, чтобы создать профиль средней интенсивности в зависимости от расстояния от потока канала. Повторять до 3 различные моменты времени.
- Получить изображение фоновой флуоресценции до введения Dox для измерения автофлуоресценции из ткани. Вычтите средней интенсивности флуоресценции фон из полученных профилей интенсивности и нормализовать каждый профиль, соответствующий максимальной интенсивности для получения
 (X, T) (рис. 3B).
(X, T) (рис. 3B). - Следующий шаг заключается в оценке эффективного коэффициента диффузии D от Dox в опухолевой ткани. Dox диффузии может быть представлена следующим уравнением 5

где ERFC является дополнительной функцией ошибок, х расстояние в ткани из канала, и т время после введения Dox (см. рис. 3). Используйте следующие итерационная схема в каждый момент времени считается:- Угадайте значение D
- Рассчитать правой стороны уравнения в каждой точке х
- Вычислить сумму квадратов ошибок (остаточной) между двумя сторонами
- Изменить D чтобы свести к минимуму остаточные
- Средняя оптимальные значения D, полученные на каждый момент времени оценить средний эффективный коэффициент диффузии Dox в ткани.
7. Представитель Результаты:
<р = класса "jove_content"> микрофлюидных устройств при условии, 1 мм х 0,3 мм х 0,15 мм оптически доступными камерами культурой для выращивания трехмерных опухолевой ткани. Многоклеточных сфероидов опухоли были доставлены в этих камерах и были сохранены два фильтра сообщений на спине. Висячей капли метод позволил быстрого формирования сфероидов соответствует размеру и форме от нескольких клеточных линий. Сфероидов были успешно выращивают на устройство на срок до 3 дней. Рост в камерах было связано с воспроизводимыми изменения микросреды в сфероидов. Апоптоз произошел менее в клетках, в непосредственной близости от канала потока и более глубже в ткани. Устройство было использовано для оценки коэффициента диффузии доксорубицина в опухолевой ткани. Полученное значение 8,75 х 10 -7 см 2 с -1 согласен со значением 9,1 х 10 -7 см 2 с -1 сообщалось ранее 6 в человеческий рак молочной железы.| Клеточная линия | Требуемые концентрации клеток | Инкубационный время |
| LS174T | 300 клеток / мкл | 2-3 дней |
| T47D | 750 клеток / мкл | 3-4 дней |
| MDA-MB-231 | 150 клеток / мкл | 5-6 дней |
Таблица 1. Параметры для подвешивания сфероидов Выпадение
| Часть | Описание |
| S F | Поток Шприц |
| S P | Упаковка шприцев |
| В Fin | Клапан входе |
| V Pin | Упаковка впускного клапана |
| В Fout | Клапан Outlet |
| В Pout | Упаковка выпускной клапан |
Таблица 2. Шприцы и клапаны потока в установке

Рисунок 1 Схема потока установки V и V Fin Fout. Потока на входе и выходе клапана, V и V Pin Pout: Упаковка впускных и выпускных клапанов, S F и S P: Flow и упаковки шприцев. Упаковки шприцев и упаковки впускной и выпускной клапаны используются, когда сфероид прилетел в камере. Шприц потока и впускные и выпускные клапаны используются для текучей среды в дальнейшем.
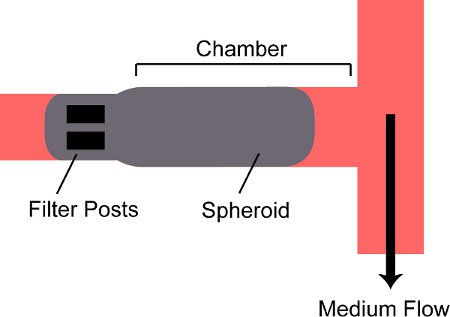
Рисунок 2. Схема сфероида попали в камеру на устройстве. Сфероида течет в камеру на устройстве и их два фильтра позTS в задней части камеры.

Рисунок 3. Доксорубицин диффузии в ткани опухоли на устройстве. А. Объединенный проходящем свете и красного флуоресцентного изображения тканей, с указанием расположения и концентрации доксорубицина (в красном). Шкала бар представляет 250 мкм. B. нормализованной линейного профиля интенсивности флуоресценции от доксорубицина.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Сосудистой В опухолей является редким и плохо разработанные 7,8. Есть регионы, расположенные далеко (> 100 мкм) из кровеносных сосудов, которые являются недоступными для питательных веществ и лекарств, поставляемых хотя сосудистой 9. В результате гетерогенной микроокружения ...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была выполнена при поддержке Национального института здравоохранения грант № 1R01CA120825-01A1, Совместного биомедицинских исследований (CBR) программа в Университете штата Массачусетс Амхерст, а также стипендии для Айзенберг Bhushan J. Toley. Мы выражаем глубокую признательность ценный вклад Джеймс Шафер, видеооператор, рассказчик, и редактор этого видео.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Комплект силиконовые эластомеры | Ellsworth клеи | 184 Sil Elast Kit | |
| Miltex биопсии удар | MedexSupply | MTX-33-31AA | 1,5 мм |
| PTFE трубки | Cole Parmer | EW-06417-31 | 0,032 "ID |
| Мужской Luer Lock разъем | Qosina | 65111 | |
| Колючая женщины Luer соединением замок | Qosina | 11556 | |
| Запорный клапан | Идекс здравоохранения и науки | P-721 | |
| Y-коннектор | Идекс здравоохранения и науки | P-513 | |
| 20G 1,5 "иглы | BD Biosciencэлектронной | 305176 | |
| Трипсина-EDTA | Invitrogen | 25300-054 | |
| HEPES | Сигма | H-4034 | |
| CaspGLOW Fluorescein | BioVision | K183-25 | |
| CaspGLOW красный | BioVision | K193-25 | |
| Доксорубицина гидрохлорид | Сигма | 44583 | |
| LS174T | ATCC | CCL-188 | Толстой кишки человека клеточной линии карциномы |
| T47D | ATCC | HTB-133 | Ductal человека клеточной линии рака |
| MDA-MB-231 | ATCC | HTB-26 | Молочной железы человека клеточной линии аденокарциномы |
Ссылки
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol. Bioeng. 83, 173-180 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods. Mol. Med. 140, 141-151 (2007).
- Kasinskas, R. W., Forbes, N. S. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol. Bioeng. 94, 710-721 (2006).
- Walsh, C. L. A multipurpose microfluidic device designed to mimic microenvironment gradients and develop targeted cancer therapeutics. Lab. Chip. 9, 545-554 (2009).
- Lankelma, J., Fernandez Luque, R., Dekker, H., Schinkel, W., Pinedo, H. M. A mathematical model of drug transport in human breast cancer. Microvasc. Res. 59, 149-161 (2000).
- Less, J. R., Skalak, T. C., Sevick, E. M., Jain, R. K. Microvascular architecture in a mammary carcinoma: branching patterns and vessel dimensions. Cancer. Res. 51, 265-273 (1991).
- Brown, J. M., Giaccia, A. J. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer. Res. 58, 1408-1416 (1998).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br. J. Cancer. 9, 539-549 (1955).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat. Rev. Cancer. 6, 583-592 (2006).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены