このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腫瘍微小環境を再作成するためのマイクロ流体デバイス
要約
私たちは、異種腫瘍微小環境を再現し、マイクロ流体デバイスの作製及び操作のための手順を紹介 in vitroで。腫瘍組織内アポトーシスの変動を評価した蛍光染色し、腫瘍組織への化学療法薬ドキソルビシンの有効拡散係数を用いて定量した。
要約
我々は、in vitroでの異種3次元腫瘍組織への薬物の送達及び全身クリアランスを模倣したマイクロ流体デバイスを開発しました。血管系で配信栄養素は、実行可能な静止および壊死細胞の種類により構成される異種微小環境を生み出して、腫瘍のすべての部分に到達しない。多くの抗がん剤は効果的に細胞のため、この異質のすべてのタイプを貫通し、治療に失敗する。がん細胞の単層は、それが困難なin vitroモデルを適当に抗がん剤をテストすること、この異質性を模倣することはできません。当社のマイクロ流体デバイスは、ソフトリソグラフィーを用いたPDMSから製造された。ハンギングドロップ法により形成された多細胞腫瘍スフェロイドは、挿入され、拘束装置の長方形のチャンバーに、片面に連続媒体の血流を維持した。デバイス上室の矩形形状は、組織内で線形グラデーションを作成しました。蛍光汚れは目を定量化するために使用された組織内のアポトーシスにおけるe変動。デバイス上の腫瘍が蛍光化学療法薬ドキソルビシンで処理した、タイムラプス顕微鏡組織への拡散を監視するために使用され、有効拡散係数を推定した。ハンギングドロップ法は、いくつかの癌細胞株からの均一なスフェロイドの迅速な形成を可能にした。デバイスは、最大3日間までスフェロイドの成長を可能にしました。媒体を流すの近傍の細胞がアポトーシスを起こしていた最低限、それらの遠い路からそれによって正確に血管に隣接する腫瘍内の領域を模倣し、より多くのアポトーシスであった。ドキソルビシンの拡散係数の推定値は、ヒト乳癌における以前に報告された値と一致していた。固形腫瘍における薬剤の浸透および保持は、その有効性に影響を与えるため、我々は、このデバイスは薬剤の挙動を理解し、新たながん治療薬を開発する上で重要なツールであると信じています。
プロトコル
1。デバイス製造
エラストマー材料のマイクロ流体の特徴のレプリケーションがダフィーらの方法に基づいていた。1
- ミックスエラストマー(ポリジメチルシロキサン、PDMS)および9:1の重量比でシリコーンエラストマーキット( ダウコーニング 、ミッドランド、ミシガン州)から硬化剤と4ミリメートル厚い層を形成するために、マスターの上に注ぐ。ドガは、5時間60℃で気泡を除去し、混合物を硬化させた。ピールエラストマー上の流れの特徴のスタンプを取得するための金型からPDMSを硬化させた。
- 1.5ミリメートル生検パンチ(Miltex、ヨーク、ペンシルバニア州)を用いて、入口と出口のためのパンチ穴はドリルプレスに搭載された。ごみを取り出し。
- スタンプの機能側と酸素プラズマエッチャーで8分間酸素プラズマにきれいなガラススライドを施す。それらの間の結合を形成するためにすぐに接触して処理された表面を持参してください。少なくとも5時間ウォーマースライド上60°Cでアセンブリを維持の結合を強化するために、S。
- 有刺鉄線メスルアーロックコネクタ(Qosina、エッジウッド、ニューヨーク州)に取り付けられたオスルアーロックのインターフェースコネクタを使用して入口と出口に0.032 "ID PTFEチューブ( コールパーマー 、ヴァーノンヒルズ、イリノイ州)を接続します。
- シャットオフバルブとYコネクタ(;図1 アップチャーチ·サイエンティフィック 、オークハーバー、ワシントン州)を用いて、フロー· アセンブリーを設定します。顕微鏡へのデバイスをマウントします。 20G 1.5 "針(BDバイオサイエンス 、ロックビル、MD)を用いて、チューブに注射器を取り付けます。
2。制服スフェロイドの形成
スフェロイドはハンギングドロップ法2,3によって形成された。
- 無菌細胞培養フードの下で細胞をトリプシン処理。
- 5分間2000rpmでトリプシン処理した細胞を遠心し、6 mlの新鮮な培地中に再懸濁します。所望の最終濃度(表1)に原液を希釈します。
- 48ウェルプレートのカバーを取り外して、ステレオに逆さに置きrilizedフード。各ウェルに対応する円形領域は、表紙に明らかである。湿度を維持するために、滅菌水1mlでプレートの各ウェルを埋める。マイクロピペットを用いて、各円形領域における希薄な細胞溶液の20μl滴を入れてください。慎重にカバーを反転させ、滴が井戸の縁に手を触れないことを確実に、ウェルプレート上に置きます。
- 指定した日数(表1)37℃でウェルプレートをインキュベートする。回転楕円体は、各ハンギングドロップで形成されます。
3。デバイスにスフェロイドの導入
このセクションの1、表、図2を参照してください。
- 流入口を介して導入を70%エタノールで洗浄して、デバイスを滅菌する。その後、PBSで洗浄し、細胞培養培地をHEPES緩衝続く。チューブに接続されている培地シリンジS Fのままにしておきます。
- 注射器S Pに2から3スフェロイドを描き、気泡を除去するために注射器をタップし、装置のパッキングインレットに接続します。
- オープンインレットバルブV ピンと近いVのフィン 。オープン出口弁V Poutと近いV Fout を 。下向きの針で垂直パッキングシリンジを保持;スフェロイドが針のルアーロックコネクターにシリンジの底に沈むように見守る。パッキングシリンジにプランジャーを押し込み、スフェロイドがデバイスにチューブとフローを入力見守る。唯一のパッキング出口弁が開いているため、回転楕円体は、装置のチャンバーに入り、戻って(図2)で投稿することによって保持される。
- インレットバルブV ピンと出口弁V Pout を閉じます。シリンジポンプのシリンジS Fをマウントします 。オープンバルブV フィンとバルブV Foutを 。 3μL/ minでデバイスに流れ媒体。
4。アポトーシス検出剤の紹介(CaspGLOW)
スフェロイドとチャンバーを梱包した後に、uの平衡を許可検出アポトーシスまたは治療剤を導入する前に、栄養勾配および微小環境を確立するために、24時間に電話。チャンバ内の組織が上部と下部から入り込めない壁に接触しているので、組織の厚さに沿った栄養勾配(0.15ミリメートル)がありません。 24時間のインキュベーション後、組織の厚さに沿ってすべての細胞層は、したがって等価であり、唯一の異質性が離れて流路からの方向である。
- Vのフィンをシャットオフし 、シリンジポンプを停止し、ポンプから注射器S Fを削除して、0.25μL/ CaspGLOW赤活性型カスパーゼ3マーカー(赤-DEVD-FMKのアンピシリンを含む培地を有するシリンジと交換し、 バイオビジョン 、マウンテンビュー、カリフォルニア州)。
- 手動で古い媒体の変位を確実にするためにデバイスを介して、この溶液0.7mlのをフラッシュします。 、ポンプのシリンジをマウントする流れを再起動して、開いているVのフィン 。 5-8時間の期間にわたって、アポトーシスは、tに薬剤が拡散を検出彼は組織およびアポトーシスの地域で明るい蛍光を発する。この濃度でアポトーシスを検出したエージェントは、デバイスへのすべての後続フローソリューションで維持されます。
注意:
- 組織の不均一性は、第6章で説明したように蛍光の直線強度プロファイルを取得することによって確認することができます。プロファイルには、組織は、細胞生存率に関して不均質であることが確認され、アポトーシスに空間的な勾配を示すべきである。
- CaspGLOWグリーン活性型カスパーゼ3マーカー(フルオレセイン-DEVD-FMK、バイオビジョン)もアポトーシスを検出するために用いることができる。このマーカーは、代わりに赤の蛍光色素ローダミンの緑色蛍光色素フルオレセインを含んでいます。
5。治療薬の導入
- アポトーシス検出剤を含む、10μMのドキソルビシン塩酸塩(Sigma-Aldrich社、 セントルイス 、ミズーリ州のDox)を導入するための手順4.1から4.2の手順に従ってください。
- therapeの流れを継続する一定期間utic剤溶液。バルブV フィンを切り、シリンジポンプをオフにします。エージェントを検出し、アポトーシスを含む新鮮な培地の注射器を用いた治療用の注射器を交換してください。連続して顕微鏡下で組織を監視しながら、24 -36時間のための新鮮な媒体の流れを許可します。
6。薬物拡散係数のタイムラプス顕微鏡と推定
きれいな蛍光データを得るためには、組織の下層に顕微鏡の焦点を合わせることによって、すべての画像を取得する。垂直方向には栄養素勾配が(セクション4を見てください)が存在しないため、セルの底層は、上記のすべての他の層の良好な代表である。
- 全体の取得処理はIPLabでカスタマイズされたスクリプト(BD Bioscience社 、ロックビル、MD)を用いて、自動化されました。 10倍の倍率で満員スフェロイド30分毎(図3A)の透過光と蛍光画像を取得する。 Acquir前Doxの導入にバックグラウンド蛍光の電子画像。チャンバーの大サイズ(1000ミクロン×300ミクロン)に対処するために、隣接する二つの画像と一緒にタイル4を獲得。
- 薬物の拡散係数の数学的な推定のために、最初のステップは、ImageJを使ってDoxの蛍光の平均線形強度プロファイルを生成することです。チャンバー内の組織を包含する関心の矩形領域(ROI)を選択します。流路からの距離の関数としての平均的な強度のプロファイルを生成するためにプロットprofileコマンドを使用します。最大3つの異なる時点のに対して、この手順を繰り返します。
- 組織からの自家蛍光を測定するためにDoxを導入する前に、バックグラウンド蛍光画像を得る。得られた強度プロファイルから平均バックグラウンド蛍光強度を減算し、取得するために対応する最大強度で各プロファイルを正常化する
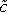 (x、t)は (図3B)。
(x、t)は (図3B)。 - 次のステップでは、腫瘍組織内Doxの有効拡散係数Dを評価することである。 Doxの拡散は、以下の式(5)で表すことができる。

ERFCは相補誤差関数であり、xはチャネルから組織への距離、tは Doxの導入(図3を参照)の後の時間です。と考え、各時点で、次の反復スキームを使用します。- Dの値を推測
- 各場所xでの式の右辺を計算する
- 両国間の二乗誤差(残差)の合計を計算する
- 残差を最小化するためにDを変更する
- 平均組織中のDoxの平均実効拡散係数を推定するために、各時点で得られたDの最適値。
7。代表的な結果:
マイクロ流体デバイスは、3次元の腫瘍組織の成長のために1ミリメートル×0.3 X 0.15ミリメートル光学的にアクセス可能な培養チャンバーを提供した。多細胞の腫瘍スフェロイドはこれらの室に流入していた、背面に2フィルタの投稿によって保持された。ハンギングドロップ法は、いくつかの細胞株からの一貫した大きさと形状のスフェロイドの迅速な形成を可能にした。最大3日間までスフェロイドが正常にデバイス上で増殖させた。チャンバ内の成長はスフェロイド内微小環境の再現性の修正と関連していた。アポトーシスは、流路の近傍の細胞が少なく、より高い組織に深く発生しました。デバイスは、腫瘍組織におけるドキソルビシンの拡散係数を推定するために使用されていました。 8.75×10 -7 cm 2 sで-1の得られた値は9.1の値と一致×10 -7 cm 2 sで-1はヒト乳癌に以前に6を報告した 。| 細胞株 | 必要な細胞濃度 | インキュベーション時間 |
| LS174T | 300細胞/μL | 2-3日 |
| T47D | 750細胞/μL | 3-4日 |
| MDA-MB-231 | 150細胞/μL | 5-6日 |
表1。ドロップスフェロイドを吊るすためのパラメータ
| 一部 | 説明 |
| S F | フローシリンジ |
| S P | シリンジの包装 |
| Vのフィン | フローインレットバルブ |
| V ピン | インレットバルブのパッキング |
| V Foutを | 流れ出口バルブ |
| Vのふくれっ面 | 出口バルブのパッキング |
表2。フロー設定にシリンジとバルブ

図1のフローセットアップV フィンとV Foutの回路図:フロー入口と出口弁、V ピンとV ふくれっ面 :パッキング入口と出口弁、S FとS、P:フローおよびパッキングシリンジ。回転楕円体をチャンバ内に流入したときの梱包や包装シリンジ入口と出口弁が使用されています。フローシリンジと流入口及び出口弁は、その後培地を流すために使用されます。
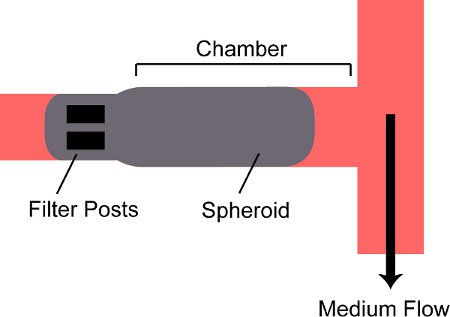
図2。デバイス上室に閉じ込められた回転楕円体の模式図。スフェロイドがデバイス上のチャンバ内に流入され、2つのフィルターposによってブロックされている室の奥のTS。

図3。デバイス上の腫瘍組織内ドキソルビシン拡散。 A.は、ドキソルビシンの位置や濃度を(赤)を示す、組織の透過光および赤色蛍光画像を合併。スケールバーは250μmを表しています。ドキソルビシン蛍光からBに正規化された線形強度プロファイルは。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
腫瘍内の血管系は、スパース行列で、病気7,8を開発しました 。血管系9にもかかわらず供給栄養素や薬にアクセスできない血管から遠い位置にある領域(>100μm)にあります。得られた不均一微小環境は、多くの化学療法剤10の限られた有効性に貢献しています。ここで開発したマイクロ流体デバイスは、in vitroで、静止し、アポトーシスまたはネクローシス?...
Access restricted. Please log in or start a trial to view this content.
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、厚生助成金総合研究所#1R01CA120825-01A1、マサチューセッツ大学アマースト校での共同医学研究(CBR)のプログラム、BhushanをJ. Toley用アイゼン奨学金によってサポートされていました。私たちは感謝してジェームズ·シェーファー、ビデオ撮影、ナレーター、そしてこのビデオの編集者の貴重な貢献を承諾します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
|---|---|---|---|
| シリコーンエラストマーキット | エルズワースの接着剤 | 184シルELASTキット | |
| Miltex生検パンチ | MedexSupply | MTX-33-31AA | 1.5ミリメートル |
| PTFEチューブ | コールパーマー | EW-06417から31 | 0.032 "ID |
| オス型ルアーロックコネクタ | Qosina | 65111 | |
| とげの雌型ルアーロックコネクタ | Qosina | 11556 | |
| 遮断弁 | IDEX健康科学 | P-721 | |
| Yコネクタ | IDEX健康科学 | P-513 | |
| 20G 1.5 "針 | BD Bioscienc電子 | 305176 | |
| トリプシン-EDTA | インビトロジェン | 25300-054 | |
| HEPES | シグマ | H-4034 | |
| CaspGLOWフルオレセイン | バイオビジョン | K183-25 | |
| CaspGLOW赤 | バイオビジョン | K193-25 | |
| 塩酸ドキソルビシン | シグマ | 44583 | |
| LS174T | ATCC | CCL-188 | ヒト結腸癌細胞株 |
| T47D | ATCC | HTB-133 | 人間の乳管癌細胞株 |
| MDA-MB-231 | ATCC | HTB-26 | ヒト乳腺腺癌細胞株 |
参考文献
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol. Bioeng. 83, 173-180 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods. Mol. Med. 140, 141-151 (2007).
- Kasinskas, R. W., Forbes, N. S. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol. Bioeng. 94, 710-721 (2006).
- Walsh, C. L. A multipurpose microfluidic device designed to mimic microenvironment gradients and develop targeted cancer therapeutics. Lab. Chip. 9, 545-554 (2009).
- Lankelma, J., Fernandez Luque, R., Dekker, H., Schinkel, W., Pinedo, H. M. A mathematical model of drug transport in human breast cancer. Microvasc. Res. 59, 149-161 (2000).
- Less, J. R., Skalak, T. C., Sevick, E. M., Jain, R. K. Microvascular architecture in a mammary carcinoma: branching patterns and vessel dimensions. Cancer. Res. 51, 265-273 (1991).
- Brown, J. M., Giaccia, A. J. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer. Res. 58, 1408-1416 (1998).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br. J. Cancer. 9, 539-549 (1955).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat. Rev. Cancer. 6, 583-592 (2006).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved