需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一个快速高分辨率的荧光成像的方法在半厚的脑片
摘要
在这里,我们描述了一个快速和简单的的方法,形象荧光标记的细胞在半厚的脑片。通过固定,切片,和光清除脑组织中,我们介绍了如何标准啶或共焦成像可用于个人完整的神经组织内的细胞和神经网络的可视化。
摘要
基础和临床神经科学的根本目标是为了更好地理解人的身份,分子结构和特点在正常和病变脑的神经元的连接模式。朝着这个,一个很大的努力一直放在建设高解析度神经解剖学地图1-3。随着分子遗传学和光镜的进步已经扩展能力查询,不仅神经元的形态,而且分子和细胞构成的单个神经元及其相关的网络4。标记和操纵通过转基因和基因打靶技术在啮齿类动物的神经元的能力的重大进展, 现在允许以5-6将“纲要”神经元亚群的调查。可以说,最有影响力的现代神经科学的贡献之一,已发现和克隆基因编码荧光蛋白(FPS)7-8,沿着他们的后续工程,在海洋无脊椎动物的产量不断扩大的一个至关重要的记者工具箱9。现在利用特定细胞类型的启动子活性的驱动器在离散的神经元群体针对性的FP表达给予神经解剖与遗传精密的调查。
工程FP神经元中表达,大大提高了我们的大脑结构和功能的认识。然而,成像的单个神经元和脑深部组织,或在三个方面及其相关的网络,仍然是一个挑战。由于脂肪含量高,神经组织,而不透明和展品自动荧光。这些固有的生物物理特性,很难想象和高分辨率的图像使用超过几十微米的深度标准啶或共聚焦显微镜荧光标记的神经元。为了规避这一挑战调查往往采用串行薄片成像和重建方法10,或双光子激光扫描显微镜11。目前这些方法的缺点是相关的劳动密集的组织准备,或成本高昂的仪器。
在这里,我们提出了一个相对快速和简单的的方法来可视化在固定半厚的小鼠大脑切片荧光标记的细胞,通过光学结算和成像。在附加协议中,我们描述的方法:1)固定在原地通过intracardial灌注,2)剥离和清除整个大脑,3)固定大脑包埋在琼脂糖,4)精密半厚片准备使用新vibratome仪器的脑组织光镜和Z - Stack的重建( 图1),5)通过甘油梯度结算脑组织,以及6)安装在载玻片上。
准备脑切片中,我们实现了一个相对较新的仪器,称为“Compresstome”,VF - 200(http://www.precisionary.com/products_vf200.html)。这台仪器是一种半自动切片机,配备一个电动推进和叶片振动系统与功能,在功能类似于其他vibratomes。与其他vibratomes不同的是,要切片的组织琼脂糖插件是安装在一个不锈钢圆筒内。该组织是在想要从汽缸厚度挤压,并向前推进的振动刀片切割。琼脂糖插件/气缸系统可重复性组织安装,对齐方式和精密切割。在我们手中,“Compresstome”产量高品质的电生理,免疫组织化学组织切片,并直接固定组织安装和成像。与光学清算相结合,在这里我们展示高分辨率荧光成像的固定半厚的脑片的准备。
研究方案
原位脑固定1。
*准备一个10毫升注射器(28号针头)与磷酸充满缓冲液(PBS)。
*准备一个充满了4%多聚甲醛(PFA)的PBS 10 ml注射器(28号针头)。保留一个额外的PFA / PBS后固定5-10毫升。
- 实验小鼠腹腔注射致死剂量的Avertin或戊巴比妥。
- 一旦鼠标镇静剂,湿用乙醇的腹部和安全鼠标与软木,蜡,或有机硅弹性体,使用夹层引脚分层的托盘底部。腹部朝上,安全的四个爪子表面 - 传播他们尽可能广泛。
- 抓斗皮肤与胸骨水平钳,切十字花暴露肝脏。削减横向,然后通过肋骨和隔膜。拆下肋骨组织瓣,并继续切割,直到心访问。
- 皮尔斯或剪断右心房漏传阅血液。
- 通过左心室灌注的PBS冲洗循环系统残血。
- 访问同一个针孔,整个鼠标的PBS / PFA随后通过左心室灌注修复。
2。解剖和大脑提取
- 皮肤切割耳道和眼轨道,向前拉动皮肤暴露头骨取出的头部,颈部,和头骨。
*步骤2.2)的说明,请参阅图2至2.5) - 使用骨剪,切眼横向通过鼻甲骨骼的插座。每边。横切应当前的眼睛和嗅球。
- 削减纵向从每个耳道眼圈。
- 使用一个小解剖剪刀,切割枕骨板覆其他小脑从一个耳道。
- 同一解剖剪刀,切割前方沿中线嗅球水平。
- 使用镊子,从大脑中删除的每个骨板,照顾,以消除任何结缔组织,使大脑完好无损抬离骨时。
- 剪断视神经和颅神经,切断上方的颈椎,然后取出固定液的大脑。
- 修正后为1-2小时,在4 ° C洗3次,每次15分钟,用PBS。
3。琼脂糖包埋
- 熔体2%的高强度,低凝点琼脂糖类型IB(Sigma公司的产品目录号:A0576)在PBS生理盐水微波炉。
- 熔化的琼脂糖转移到试管。试管放置在一个温暖的孵化器或水浴(40 ° -41 ° C),直至温度平衡。
- 胶固定的脑组织上的氰基丙烯酸酯胶( 图3A)的标本注射器的柱塞。刷饱和蔗糖PBS液对脑组织表面薄薄的一层,以方便以后的版本中的大脑切片的琼脂糖环。
- 绘制成柱塞住房柱塞与脑组织( 图3B)。
- 移液器或倒入柱塞住房暖琼脂糖,占地脑组织。避免气泡捕获到琼脂糖。琼脂糖中的气泡会妥协切片质量。
- 钳标本注射器冷(0 °至-25 ° C)寒蝉块1分钟,设置琼脂糖( 图3C)。
4。脑片切片的Compresstome
- 组装Compresstome( 图3D)将含有脑组织标本注射器。
- 密切与试样的注射器插座( 图3E)刀片的边缘对齐。
- 用PBS液缓冲罐填充。
- 千分尺一层厚旋转,拉伸试样的注射器琼脂糖脑组织块。
- 按“开始”按钮控制单元的Compresstome启动切片过程。
- 重复步骤4.4)4.5),直到获得所需的切片确定厚度。
- 用刷子或吸管小瓶或填充染色,用PBS( 图3F)井收获大脑切片。
5。光学结算
- 准备75%卷:卷的解决方案甘油:PBS。
- 倒入(或吸管)关闭从收集到的大脑切片PBS冲洗量的一半。
- 添加甘油/ PBS删除音量。
- 允许温和的混合平衡在4 ° C,直到片下沉。
- 重复步骤6.2)6.4),直到最后的甘油浓度达到75%。
- 90%甘油的PBS替代解决方案,并允许以平衡。
*请注意:小心不要引入气泡,而加入甘油的解决方案。 慢慢倒入解决方案,轻轻混匀,因为气泡会干扰统一equilibraTION和结转到幻灯片安装。
6。切片安装成像
- 切成一个开放的矩形双面密封胶(SA - S - 1L,格雷斯生物实验室),以适应一个微型幻灯片(Superfrost另外,25可视面积× 75 × 1毫米,#48311-703,VWR猫。 )与双方2-3毫米宽。
- 脑片内的胶带,用吸管或画笔,矩形的中心广场。卸下温柔的共同愿望甘油过剩。
- 幻灯片中所需的画笔秩序排列的大脑切片。
- ,轻轻地盖玻璃上的胶带(24 × 60毫米,猫。#48383-139,VWR),注意不要引入气泡。轻轻地应用到玻璃盖的压力,以确保与胶带接触。
- 吸从幻灯片和玻璃罩之间的边缘多余的甘油。
- 密封幻灯片和盖玻片,用透明指甲油。
- 晾干前成像,或长期存放在幻灯片框4 ° C。
7。代表性的成果:
处理,成像,分析荧光标记的脑组织已经成为不可缺少的神经生物学研究。这些调查都需要复杂的遗传操作获得记者表达,在有针对性的神经元亚群,其次是低收入和高清晰度的图像分析。通常,实验和技术的限制使得不可能获得相同的动物的这些类型的数据,或在一个快速的方式。制备光清除,半厚的荧光成像艾滋病的大脑在这一挑战部分。例如设计一个完整的厚脑片标有狂犬病毒转基因EGFP的表达,使用啶和共聚焦显微镜和成像, 如图 4 所示,图5分别。对于啶成像,我们使用了徕卡M205 FA,和我们使用的Zeiss LSM 510共聚焦图像采集。由于相对简单的附加议定书,这种方法是能产生荧光记者表达了不到一天的周转时间组织有用的图像数据,并与低收入和高清晰度光学显微镜兼容。
如果研究者选择纳入额外死后标记方法,免疫组织化学染色,或较薄,协议相应延长。然而,上面介绍的方法代表了至关重要的记者表达完整的大脑简单和相对高通量筛选模式的方法。
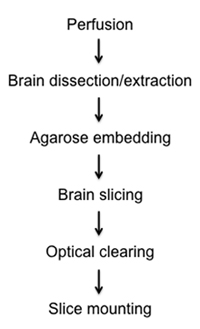
图1。diagraming固定,解剖,切片,结算,半厚的脑片和安装程序的流程图。
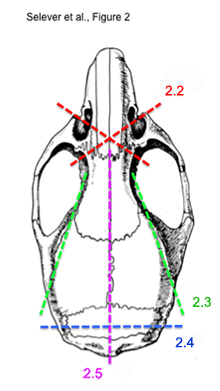
图2。顺序切割的步骤中提取完整的小鼠大脑中的图。

图3的步骤安装和切片使用Compresstome的脑组织。一)脑组织的位置上切割柱塞使用强力胶。二)安装的脑组织进入柱塞琼脂糖嵌入画下来。三)巩固琼脂糖脑插件使用冷冻压缩块。四)琼脂糖大脑插件和柱塞插入到Compresstome切割室。 E)对齐的razorblade柱塞设备。 F)的大脑切片的切割和收集到Compresstome缓冲液槽。
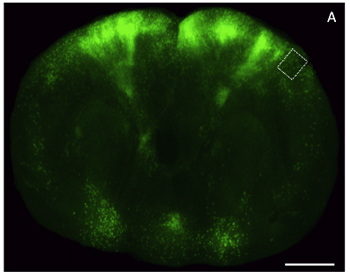
图4:从甘油清除脑组织通过额叶皮质表达增强型绿色荧光蛋白(EGFP)的厚片的光镜图像。一)通过鼠脑冠状切片(厚200 UM)病毒载体表达EGFP标记,并在低的分辨率使用啶立体成像。比例尺,2毫米。

图5。荧光标记的第5层/ 6在清除厚的脑片皮层神经元的高倍率图像。一)高分辨率的共聚焦图像通过突出的地区(图4)的Z - Stack(厚150 UM)最大的投影。比例尺,25微米。
讨论
鉴于广泛的应用,使用荧光蛋白为目标,通过光镜,需要迅速屏幕上,图像和分析完整的脑组织内神经网络已成为宝贵的调查的神经元亚群。
在用户友好的病毒载体,在体内电穿孔技术,转基因小鼠品系的发展技术进步提供了一个看似无限的源标记的细胞类型进行调查。然而,完整的脑组织图像分析仍是一个实验的瓶颈。这里介绍的方法已被证明为我们日常的脑组织?...
披露声明
建强香港Precisionary仪器公司,即制造商在这篇文章中使用的产品的雇员。
致谢
这项工作是由美国支持通过捷基金会,NARSAD,和NINDS授予R00NS064171 - 03。
材料
| Name | Company | Catalog Number | Comments |
| 该项目的名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| 骨剪刀 | FST | 16044-10 | 或同等 |
| 清扫剪刀 | FST | 14084-08 | 或同等 |
| Ib型琼脂糖 | 适马 | A0576 | |
| Compresstome | Precisionary仪器 | VF - 200 | 其他vibratomes兼容 |
| 双面胶 | 格雷斯生物实验室 | SA - S - 1L | |
| Superfrost加幻灯片 | VWR | 48311-703 | |
| 玻璃盖 | VWR | 48383-139 | |
| 甘油 | EMD的化学品公司 | GX0185 - 6 | 或同等 |
参考文献
- Pfister, H., Lichtman, J., Reid, C. . The Connectome Project. , (2009).
- Briggman, K. L., Denk, W. Towards neural circuit reconstruction with volume electron microscopy techniques. Curr Opin Neurobiol. 16, 562-570 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Arenkiel, B. R., Ehlers, . Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Capecchi, M. R. Altering the genome by homologous recombination. Science. 244, 1288-1292 (1989).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Shimomura, O., Johnson, F., Saiga, Y. Extraction, purification, and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell Comp Physiol. 59, 223-239 (1962).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W., Prasher, D. Gene fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. The fluorescent toolbox for assessing protein location and function. Science. 312, 217-224 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。