Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстрое подход к высоким разрешением флуоресценции в Semi-ломтики толщиной мозга
В этой статье
Резюме
Здесь мы опишем быстрый и простой способ изображения флуоресцентно меченых клеток в полу-ломтики толщиной мозга. Фиксируя, нарезка, и оптически очистки ткани мозга мы опишем, как стандартные epifluorescent или конфокальной микроскопии могут быть использованы для визуализации отдельных клеток и нейронных сетей в нетронутой нервной ткани.
Аннотация
A fundamental goal to both basic and clinical neuroscience is to better understand the identities, molecular makeup, and patterns of connectivity that are characteristic to neurons in both normal and diseased brain. Towards this, a great deal of effort has been placed on building high-resolution neuroanatomical maps1-3. With the expansion of molecular genetics and advances in light microscopy has come the ability to query not only neuronal morphologies, but also the molecular and cellular makeup of individual neurons and their associated networks4. Major advances in the ability to mark and manipulate neurons through transgenic and gene targeting technologies in the rodent now allow investigators to 'program' neuronal subsets at will5-6. Arguably, one of the most influential contributions to contemporary neuroscience has been the discovery and cloning of genes encoding fluorescent proteins (FPs) in marine invertebrates7-8, alongside their subsequent engineering to yield an ever-expanding toolbox of vital reporters9. Exploiting cell type-specific promoter activity to drive targeted FP expression in discrete neuronal populations now affords neuroanatomical investigation with genetic precision.
Engineering FP expression in neurons has vastly improved our understanding of brain structure and function. However, imaging individual neurons and their associated networks in deep brain tissues, or in three dimensions, has remained a challenge. Due to high lipid content, nervous tissue is rather opaque and exhibits auto fluorescence. These inherent biophysical properties make it difficult to visualize and image fluorescently labelled neurons at high resolution using standard epifluorescent or confocal microscopy beyond depths of tens of microns. To circumvent this challenge investigators often employ serial thin-section imaging and reconstruction methods10, or 2-photon laser scanning microscopy11. Current drawbacks to these approaches are the associated labor-intensive tissue preparation, or cost-prohibitive instrumentation respectively.
Here, we present a relatively rapid and simple method to visualize fluorescently labelled cells in fixed semi-thick mouse brain slices by optical clearing and imaging. In the attached protocol we describe the methods of: 1) fixing brain tissue in situ via intracardial perfusion, 2) dissection and removal of whole brain, 3) stationary brain embedding in agarose, 4) precision semi-thick slice preparation using new vibratome instrumentation, 5) clearing brain tissue through a glycerol gradient, and 6) mounting on glass slides for light microscopy and z-stack reconstruction (Figure 1).
For preparing brain slices we implemented a relatively new piece of instrumentation called the 'Compresstome' VF-200 (http://www.precisionary.com/products_vf200.html). This instrument is a semi-automated microtome equipped with a motorized advance and blade vibration system with features similar in function to other vibratomes. Unlike other vibratomes, the tissue to be sliced is mounted in an agarose plug within a stainless steel cylinder. The tissue is extruded at desired thicknesses from the cylinder, and cut by the forward advancing vibrating blade. The agarose plug/cylinder system allows for reproducible tissue mounting, alignment, and precision cutting. In our hands, the 'Compresstome' yields high quality tissue slices for electrophysiology, immunohistochemistry, and direct fixed-tissue mounting and imaging. Combined with optical clearing, here we demonstrate the preparation of semi-thick fixed brain slices for high-resolution fluorescent imaging.
протокол
1. В местах фиксации мозга
* Подготовить шприц 10 мл (28 иглы), заполненной фосфатным буферным раствором (PBS).
* Подготовить шприц 10 мл (28 иглы), заполненной 4% параформальдегида (PFA) в PBS. Резервный дополнительные 5-10 мл PFA / PBS для последующей фиксации.
- Inject экспериментальных внутрибрюшинно мыши с летальной дозой Avertin или Nembutal.
- Как только мышь седативные, влажные живота с этанолом и безопасной мыши на дно лотка слоистые с пробкой, воском, или силиконового эластомера использованием рассечение булавки. С животом вверх, безопасный четыре лапы на поверхность - распространяя их как можно шире.
- Захватите кожу щипцами на уровне грудины, и нарезать поперек, чтобы разоблачить печени. Вырезать сбоку, а затем вверх через ребра и диафрагму. Удалить лоскут ткани ребра и продолжают резки до сердца доступна.
- Пирс или надрез правое предсердие стечь циркулирующей крови.
- Флеш остаточной крови из кровеносной системы перфузии PBS через левый желудочек.
- Доступ же отверстие иглы, исправить все мыши последующими перфузии PBS / PFA через левый желудочек.
2. Препарирование мозга и добыча
- Снимите кожу с головы, шеи и черепа, сокращая вокруг канала уха и глаза орбиты, а затем, потянув за кожей кпереди подвергать черепа.
* См. рисунок 2 для иллюстрации шагов 2,2) до 2,5) - Использование кости ножницы, разрезать крест-накрест с высоты сокета носовых раковин костей. Сделайте это для каждой стороны. Поперечную должны быть впереди глаз и обонятельных луковиц.
- Разрезают вдоль друг от ушного канала, чтобы глаз.
- Использование маленькие ножницы рассечение, вырезать затылочной кости пластиной вышележащих мозжечка из одного наружного слухового прохода в другую.
- С той же ножницами рассечение, вырезать вперед по средней линии на уровне обонятельных луковиц.
- Использование пинцета, извлекайте каждый кости пластиной из головного мозга, заботясь, чтобы удалить все соединительные ткани так, что мозг остается неизменным при подъеме от костей.
- Snip оптические и черепно-мозговых нервов, вырезать верхнюю шейного позвонка, и удалить мозг в фиксатор.
- После исправления в течение 1-2 часов при температуре 4 ° С. Промыть 3 раза 15 мин каждый в PBS.
3. Агарозном вложение
- Растопите 2% высокопрочных, низкая точка-гель агарозы типа IB (Сигма номер по каталогу: A0576) в PBS солевых с микроволновой печью.
- Передача расплавленной агарозы в пробирке. Место пробирке в теплой ванне инкубатор или водой (40 ° -41 ° C) до температуры равновесия.
- Клей фиксированные ткани мозга на поршень шприца с образцом цианакрилатного клея (рис. 3А). Кисть тонкий слой насыщенного сахароза-би-эс раствора на поверхность ткани мозга для облегчения последующего высвобождения кольцо агарозы из мозга ломтиками.
- Перенос поршень с мозговой ткани в корпус плунжера (рис. 3В).
- Внесите или залить теплой агарозы в корпус плунжер, покрывая ткани головного мозга. Избежать захвата пузырьков воздуха в агарозы. Пузырьки воздуха в агарозном пойдет на компромисс срез качества.
- Зажим образца шприц с холодной (от 0 ° до -25 ° C) охлаждения блока в течение 1 минуты, чтобы установить агарозы (рис. 3С).
4. Секционирование мозга срез с Compresstome
- Соберите образец шприц, содержащий мозговой ткани в Compresstome (рис. 3D).
- Совместите край лезвия бритвы в тесном контакте с выходом образца шприц (рис. 3Е).
- Заполнение буферная емкость с раствором PBS.
- Поворот микрометра один ломтик толщиной вперед для выдавливания агарозном-мозговую ткань блок из образца шприц.
- Нажмите кнопку "Пуск" на блок управления Compresstome инициировать секционирования процесса.
- Повторите шаги 4,4) до 4,5) до желаемой ломтики получаются на определение толщины.
- Урожай мозга ломтики с кистью или пипеткой флаконах или окрашивания скважин, заполненных с PBS (рис. 3F).
5. Оптический Клиринговый
- Подготовка 75% по объему: том решением глицерина: PBS.
- Налейте (или пипетки) от половины объема PBS вымыть из собранных ломтики мозга.
- Плюс объем удален с глицерином / PBS.
- Разрешить, чтобы уравновесить с нежным смешивания при температуре 4 ° С до раковины ломтиками.
- Повторите шаги 6,2) до 6,4) до конечной концентрации глицерина достигает 75%.
- Замените решение с 90% глицерина в ФБР и позволить, чтобы уравновесить.
* Примечание: Будьте осторожны, чтобы не вводить пузырьков воздуха при добавлении глицерина решений. Налейте решения медленно и аккуратно перемешать, так как пузырьки воздуха будет вмешиваться в единый equilibraТион и будут перенесены на слайд монтажа.
6. Фрагмент монтажа для работы с изображениями
- Вырезать двусторонняя печать клея (SA-S-1L, Грейс Био-Labs) в открытый прямоугольник по размеру видимой области микро слайд (SuperFrost Кроме того, 25 X 75 X 1 мм, кат. # 48311-703, VWR ) со сторонами 2-3 мм шириной.
- Место мозга ломтики в центре клейкой лентой прямоугольник с помощью пипетки или кистью. Удалите излишки глицерина с нежным аспирации.
- Устройте ломтики мозга на слайде в желаемом порядке с кистью.
- Осторожно опустите покровного стекла (24 X 60 мм, кат. # 48383-139, VWR) на клейкой лентой, следя за тем, чтобы не вводить пузырьков воздуха. Осторожно надавливайте на покровное стекло, чтобы обеспечить контакт с помощью клейкой ленты.
- Аспирируйте избыток глицерина из ребра между горкой и покровного стекла.
- Печать слайдов и покровное с использованием четких лак для ногтей.
- Дайте высохнуть, прежде чем изображение или сохранить долгосрочный слайд ящиках при температуре 4 ° C.
7. Представитель Результаты:
Обработки, визуализации и анализа флуоресцентно меченных мозговой ткани стали незаменимыми для изучения нейробиологии. Многие из этих исследований требуют сложных генетических манипуляций получить репортер выражение в целевых нейронов подмножества, а затем как с низким и высоким разрешением, анализ изображений. Часто экспериментальные и технические ограничения не позволяют получить эти типы данных из того же животного, или в быстрой манере. Подготовка оптически очищается, полу-толстый мозга разделы для флуоресцентной визуализации помогает в этом проблема. Примером нетронутыми толстый ломтик мозга помечены генетически модифицированного вируса бешенства спроектирован, чтобы выразить EGFP и отображаемого использованием epifluorescent и конфокальной микроскопии показано на рисунках 4 и 5 соответственно. Для epifluorescent визуализации мы использовали Leica M205 Англии, так и для конфокальной захвата изображений мы использовали Zeiss LSM 510. Из-за относительной простоты прилагается протокол, этот метод может дать полезные данные изображения из ткани выражения флуоресцентные журналистам с оборотное время менее чем за один день, и совместим как с низким и высоким разрешением световой микроскопии.
Если следователь примет решение включить дополнительные посмертных маркировки методами, иммуногистохимического окрашивания, или сделать тоньше разделы, протокол удлиняется соответственно. Однако описанный выше метод представляет собой простой и относительно высокой пропускной методом проверки моделей жизненное проявление репортером в интактном мозге.
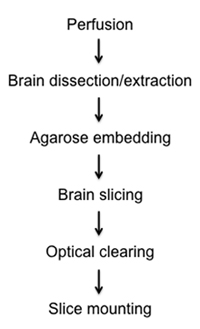
Рисунок 1. Схема diagraming фиксации, рассечение, нарезки, очистки, и монтажные процедуры полу-ломтики толщиной мозга.
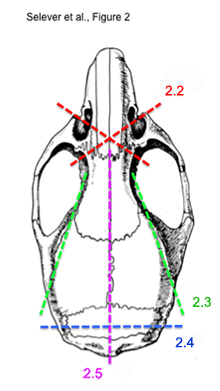
Рисунок 2. Схема последовательной резки шаги, чтобы извлечь неповрежденный мозг мыши.

Рисунок 3. Шаги для установки и нарезать мозговой ткани использованием Compresstome. ) Размещение мозговой ткани на режущих поршень использованием суперклеем. B) Рисунок вниз установлен мозговой ткани в поршень для встраивания агарозы. С) Укрепляя плагин агарозном головного мозга с использованием охлажденной блок компрессии. D) Включение агарозном подключить мозг и поршень в камере резки Compresstome. E) Выравнивание лезвие бритвы, чтобы устройство поршень. F), резки и сбор мозга ломтики в камеру буфера Compresstome.
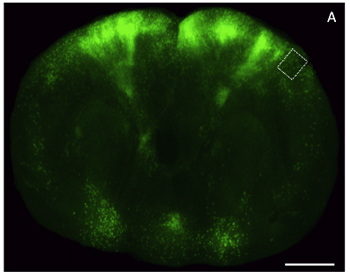
Рисунок 4. Свет изображений микроскопии толстый ломтик с глицерином-очищенный мозговой ткани через лобную кору выражения расширенной зеленого флуоресцентного белка (EGFP). А) корональные срез мозга мыши (200 мкм) помечены вирусный вектор выражения EGFP и отображаемого в низком разрешении использования epifluorescent стереоскоп. Шкала бар, 2 мм.

Рисунок 5. Высокая увеличения изображения флуоресцентно меченных слой 5 / 6 корковые нейроны в очищается толстый ломтик мозга. А) Высокое разрешение конфокальной образ максимальной проекции Z-Stack (150 мкм) по региону выделено (рис. 4). Шкала бар, 25 мкм.
Обсуждение
Учитывая широкое применение использования флуоресцентных белков для целевой нейронов подмножества для исследования с помощью световой микроскопии, заинтересованных в быстром экран, изображение и анализ нейронных сетей в неповрежденной ткани мозга стала бесценным.
Т...
Раскрытие информации
Цзянь-Цян Конг сотрудник Precisionary Instruments, Inc, которая производит продукт, используемый в этой статье.
Благодарности
Эта работа финансировалась поддержку через Фонд Макнейр, NARSAD и NINDS грант R00NS064171-03.
Материалы
| Name | Company | Catalog Number | Comments |
| Название пункта | О компании | Номер в каталоге | Комментарии (опционально) |
|---|---|---|---|
| Кости ножницы | FST | 16044-10 | Или эквивалент |
| Ножницы рассечение | FST | 14084-08 | Или эквивалент |
| Типа IB агарозном | Sigma | A0576 | |
| Compresstome | Precisionary инструменты | VF-200 | -Vibratomes других совместимых |
| Двухсторонней клейкой | Грейс Био-Labs | SA-S-1L | |
| SuperFrost Плюс слайдов | VWR | 48311-703 | |
| Крышка стекла | VWR | 48383-139 | |
| Глицерин | EMD химических ООО | GX0185-6 | Или эквивалент |
Ссылки
- Pfister, H., Lichtman, J., Reid, C. . The Connectome Project. , (2009).
- Briggman, K. L., Denk, W. Towards neural circuit reconstruction with volume electron microscopy techniques. Curr Opin Neurobiol. 16, 562-570 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Arenkiel, B. R., Ehlers, . Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Capecchi, M. R. Altering the genome by homologous recombination. Science. 244, 1288-1292 (1989).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Shimomura, O., Johnson, F., Saiga, Y. Extraction, purification, and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell Comp Physiol. 59, 223-239 (1962).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W., Prasher, D. Gene fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. The fluorescent toolbox for assessing protein location and function. Science. 312, 217-224 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены