Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un enfoque rápido para imágenes de fluorescencia de alta resolución en rodajas de cerebro semi-gruesa
En este artículo
Resumen
Aquí se describe un método rápido y sencillo a las células de la imagen marcados con fluorescencia en rodajas de cerebro semi-espesa. Mediante la fijación, corte, limpieza y ópticamente el tejido cerebral se describe la forma de imagen estándar de epifluorescencia y confocal se puede utilizar para visualizar las células individuales y las redes neuronales en el tejido nervioso intacto.
Resumen
Un objetivo fundamental tanto para la neurociencia básica y clínica es comprender mejor la identidad, estructura molecular, y los patrones de conectividad que son característicos de las neuronas en el cerebro, tanto normales y enfermos. Con este, un gran esfuerzo se ha puesto en la construcción de mapas de alta resolución neuroanatómicas 1-3. Con la expansión de la genética molecular y los avances en microscopía de luz ha llegado la posibilidad de consultar no sólo morfologías neuronal, sino también la composición molecular y celular de las neuronas individuales y sus redes asociadas 4. Los principales avances en la capacidad de marcar y manipular las neuronas a través de tecnologías para los transgénicos y de genes en los roedores, ahora permiten a los investigadores a subconjuntos neuronales "programa" a voluntad 5-6. Sin duda, una de las contribuciones más influyentes de la neurociencia contemporánea ha sido el descubrimiento y la clonación de genes que codifican las proteínas fluorescentes (PM) en los invertebrados marinos 8.7, junto con sus posteriores de ingeniería para producir una caja de herramientas cada vez mayor de periodistas vitales 9. La explotación de la célula de tipo específico para impulsar la actividad del promotor dirigido expresión FP en poblaciones neuronales discretos permite ahora la investigación neuroanatómica con precisión genética.
Ingeniería de expresión en las neuronas de FP ha mejorado enormemente nuestra comprensión de la estructura y función del cerebro. Sin embargo, las neuronas individuales de imágenes y sus redes asociadas en los tejidos cerebrales profundos, o en tres dimensiones, sigue siendo un desafío. Debido al alto contenido de lípidos, tejido nervioso, es más bien opaco y de fluorescencia muestra de automóviles. Estas propiedades biofísicas inherentes hacen que sea difícil de visualizar la imagen y las neuronas marcados con fluorescencia de alta resolución mediante microscopía confocal estándar epifluorescencia o más allá de las profundidades de decenas de micras. Para evitar este problema los investigadores suelen emplear serie de secciones delgadas de imágenes y 10 métodos de reconstrucción, o de 2 fotones microscopía de escaneo láser 11. Inconvenientes actuales de estos enfoques son los asociados de trabajo intensivo de preparación de tejidos, o la instrumentación un costo prohibitivo, respectivamente.
A continuación, presentamos un método relativamente rápido y sencillo para visualizar las células marcados con fluorescencia en semi fijos de grosor del cerebro del ratón en la limpieza de óptica y de imagen. En el protocolo que se adjunta se describen los métodos de: 1) la fijación de tejido cerebral in situ a través de la perfusión intracardíaca, 2) la disección y remoción de todo el cerebro, 3) incorporación del cerebro estacionario en agarosa, 4) la precisión semi-gruesa rebanada preparación utilizando nuevos instrumentos vibratome de compensación, 5) el tejido cerebral a través de un gradiente de glicerol, y 6) de montaje en portaobjetos de vidrio para microscopía de luz y z-stack de reconstrucción (Figura 1).
Para la preparación de cortes de cerebro se implementó una pieza relativamente nuevo de la instrumentación de la llamada 'Compresstome "VF-200 (http://www.precisionary.com/products_vf200.html). Este instrumento es un microtomo semi-automático equipado con un avance de motor y sistema de vibración hoja de características similares en función a vibratomes otros. A diferencia de otros vibratomes, el tejido a cortar está montado en un enchufe de agarosa dentro de un cilindro de acero inoxidable. El tejido se extruye a espesores que desee en el cilindro, y se corta con la hoja hacia adelante el avance de vibración. El tapón de agarosa / sistema de cilindro permite reproducir el tejido de montaje, alineación y corte de precisión. En nuestras manos, el 'Compresstome "altos rendimientos cortes de tejidos de calidad para electrofisiología, inmunohistoquímica y directa tejido fijado de montaje y de imagen. Combinado con la limpieza de óptica, aquí se demuestra la preparación de los semi-rodajas de cerebro fija de alta resolución de imagen fluorescente.
Protocolo
1. En la fijación del cerebro in situ
* Prepare una jeringa de 10 ml (28 aguja de calibre) lleno de solución salina de fosfato (PBS).
* Prepare una jeringa de 10 ml (28 aguja) llena con 4% paraformaldehído (PFA) en PBS. Reserva un 50-10 ml adicionales de PFA / PBS para la fijación del mensaje.
- Se inyecta por vía intraperitoneal ratón experimental con una dosis letal de Nembutal o Avertin.
- Una vez que el ratón está sedado, mojado el abdomen con etanol y seguro con el ratón al fondo de una bandeja con capas de corcho, la cera, o de elastómero de silicona con alfileres de disección. Con el abdomen hacia arriba, seguro las cuatro patas a la superficie - la difusión de ellas lo más amplia posible.
- Agarrar la piel con una pinza a nivel del esternón, y cortadas transversalmente para exponer el hígado. Cortar lateralmente y luego hacia arriba a través de las costillas y el diafragma. Quitar el colgajo de tejido costilla y continuar cortando hasta que el corazón es accesible.
- Perforar ni cortar la aurícula derecha para drenar la sangre circulando.
- Lavar la sangre residual del sistema circulatorio de una perfusión de PBS a través del ventrículo izquierdo.
- Acceso al agujero de la aguja misma, fijar ratón todo por perfusión posterior de PBS / PFA a través del ventrículo izquierdo.
2. La disección y extracción del cerebro
- Retire la piel de la cabeza, el cuello y cráneo cortando alrededor del canal auditivo y las órbitas oculares, seguido tirando de la piel para exponer la parte anterior del cráneo.
* Ver Figura 2 para una ilustración de los pasos 2,2) a 2,5) - Utilizando unas tijeras hueso, corte transversal del ojo de la toma de corriente a través de los huesos de los cornetes nasales. Haga esto para cada lado. El corte transversal debe ser anterior a los ojos y los bulbos olfatorios.
- Cortado a lo largo de cada canal auditivo para cuenca del ojo.
- Usando una tijera pequeña disección, corte al hueso occipital cubre el cerebelo en el canal auditivo de una a la otra.
- Con la misma tijera de disección, corte anterior a lo largo de la línea media con el nivel de los bulbos olfatorios.
- Con unas pinzas, retire cada placa ósea del cerebro, teniendo cuidado de eliminar cualquier tejido conectivo para que el cerebro permanece intacto cuando el levantamiento del hueso.
- Cortar los nervios ópticos y craneal, cortar la parte superior vértebras cervicales, y eliminar el cerebro en fijador.
- Después de fijar durante 1-2 horas a 4 ° C. Lavar 3 veces 15 minutos cada uno en PBS.
3. Agarosa incrustación
- Derrita 2% de alta resistencia, baja gel de agarosa al punto de tipo IB (número de catálogo de Sigma: A0576) en PBS solución salina con horno de microondas.
- Transferencia de agarosa fundida a un tubo de ensayo. Coloque el tubo de ensayo en un baño caliente o incubadora de agua (40 ° -41 ° C) hasta el equilibrio de temperatura.
- Pegue el tejido cerebral fija en el émbolo de la jeringa con la muestra de pegamento de cianoacrilato (Figura 3). Brocha una fina capa de grasa saturada de sacarosa PBS solución en la superficie del tejido cerebral para facilitar la posterior liberación del anillo de agarosa de los cortes de cerebro.
- Sacar el émbolo con el tejido cerebral en la caja del émbolo (Figura 3B).
- Pipeta o verter caliente de agarosa en el alojamiento del émbolo, que cubre el tejido cerebral. Evitar que queden atrapadas burbujas de aire en la agarosa. Burbujas de aire en la agarosa se compromete la calidad de división.
- Sujete la jeringa con una muestra de frío (0 ° a -25 ° C) Bloque de refrigeración durante 1 minuto para ajustar la agarosa (Figura 3C).
4. Seccionar parte del cerebro con la Compresstome
- Montar la muestra con una jeringa en el tejido cerebral en el Compresstome (Figura 3D).
- Alinear el borde de la hoja de afeitar en estrecha colaboración con la salida de la jeringa de la muestra (Figura 3E).
- Llene el tanque de reserva con una solución de PBS.
- Gire el micrómetro de un grosor de corte hacia adelante para la extrusión del bloque de tejido de agarosa-cerebro de la jeringa de la muestra.
- Pulse el botón "Inicio" en la unidad de control de la Compresstome para iniciar el proceso de corte.
- Repita los pasos 4,4) a 4,5) hasta que las rebanadas deseadas se obtienen al determinar el espesor.
- Rodajas de cerebro de la cosecha con un cepillo o una pipeta a viales o pozos tinción llena de PBS (Figura 3F).
5. Compensación óptica
- Prepare un 75% vol: vol solución de glicerol: PBS.
- Vierta (o pipeta) de la mitad del volumen de lavado PBS a partir de las rodajas de cerebro de recogida.
- Añadir de nuevo el volumen extraído con glicerol / PBS.
- Hasta que se estabilice con una mezcla suave a 4 ° C hasta que el disipador rodajas.
- Repita los pasos 6,2) a 6,4) hasta una concentración final de glicerol alcanza el 75%.
- Reemplace la solución con un 90% de glicerol en PBS y hasta que se estabilice.
* Nota: Tenga cuidado de no introducir burbujas de aire, mientras que la adición de soluciones de glicerol. Vierta las soluciones poco a poco y mezclar suavemente, ya que las burbujas de aire va a interferir con uniforme Equilibración y se llevará a la diapositiva de montaje.
6. Rebanada de montaje de imágenes
- Corte adhesivo de doble cara del sello (SA-S-1L, Grace Bio-Labs) en un rectángulo abierto para adaptarse a la zona más visible de una diapositiva micro (Superfrost Plus, 25 X 75 X 1 mm, cat. # 48311-703, VWR ) con los lados 2-3 mm de ancho.
- Coloque rebanadas de cerebro dentro del centro del rectángulo de cinta adhesiva con una pipeta o un pincel. Retire el exceso de glicerol con aspiración suave.
- Las rodajas de cerebro de la diapositiva en el orden deseado con un pincel.
- Vidrio con cuidado la tapa inferior (24 X 60 mm, cat. # 48383-139, VWR) en la cinta adhesiva, con cuidado de no introducir burbujas de aire. Para aplicar una suave presión sobre cubierta de vidrio para asegurar el contacto con cinta adhesiva.
- Aspirar glicerol exceso de los bordes entre las diapositivas y cubre objetos.
- Sello portaobjetos y un cubreobjetos con esmalte de uñas transparente.
- Deje que se seque antes de exponer, o almacenar a largo plazo en las cajas de diapositivas a 4 ° C.
7. Los resultados representativos:
Procesamiento, imágenes y análisis de los tejidos del cerebro marcados con fluorescencia se han convertido en indispensables para el estudio de la neurobiología. Muchas de estas investigaciones requieren sofisticadas manipulaciones genéticas para obtener reportero de la expresión en blanco subconjuntos neuronales, seguido de los dos análisis de imagen de alta y baja resolución. A menudo, las limitaciones experimentales y técnicas que hacen imposible la obtención de estos tipos de datos del mismo animal, o de una manera rápida. Preparación de la óptica con despacho, las secciones del cerebro semi-gruesa para fluorescentes ayudas imágenes en este desafío. Un ejemplo de una rodaja de cerebro intacto gruesa marcada con un virus genéticamente modificado para expresar la rabia EGFP, y utilizando imágenes de microscopía confocal de epifluorescencia y se muestra en la Figura 4 y Figura 5, respectivamente. Para obtener imágenes de epifluorescencia se utilizó un Leica M205 FA y para la adquisición de la imagen confocal se utilizó un Zeiss LSM 510. Debido a la relativa simplicidad del protocolo que se adjunta, este método es capaz de producir información útil imagen de los tejidos que expresan los reporteros fluorescentes con un tiempo de respuesta de menos de un día, y es compatible tanto con microscopía de luz de alta y baja resolución.
Si el investigador decide incorporar otros métodos de etiquetado post mortem, la tinción inmunohistoquímica, o hacer que las secciones más finas, el protocolo se alarga en consecuencia. Sin embargo, el método descrito anteriormente representa un método sencillo y relativamente de alto rendimiento para los patrones de detección del reportero de la expresión vital en el cerebro intacto.
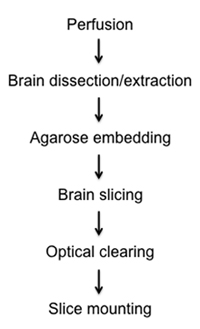
Figura 1. Diagrama de flujo de diagramación de la fijación, la disección, corte, limpieza, y el procedimiento de montaje de las secciones de cerebro semi-espesa.
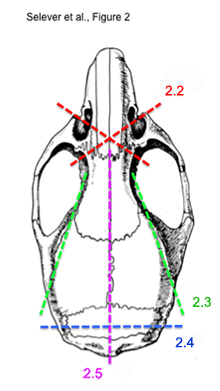
Figura 2. Esquema de los pasos secuenciales de corte para extraer el cerebro del ratón intacto.

Figura 3. Pasos para montar y cortar el tejido cerebral con el Compresstome. A) La colocación de tejido cerebral en el corte de émbolo con superglue. B) la elaboración por el tejido cerebral montado en el émbolo para la incorporación de agarosa. C) La solidificación un plug cerebro de agarosa utilizando un bloque de compresión refrigerados. D) La inserción de plug cerebro de agarosa y el émbolo en la cámara de corte Compresstome. E) La alineación de la hoja de afeitar en el dispositivo de émbolo. F) de corte y la recolección de las secciones de cerebro en la cámara de amortiguación Compresstome.
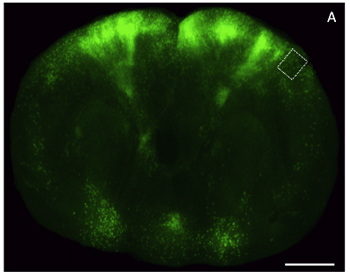
Figura 4. Imágenes de microscopía de luz de un buen pedazo de glicerol con despacho de tejido cerebral a través de la corteza frontal que expresa aumento de proteína verde fluorescente (EGFP). Una rebanada) coronal a través de un cerebro de ratón (200 um de espesor) una etiqueta con un vector viral que expresan EGFP y con imágenes a baja resolución utilizando un estereoscopio de epifluorescencia. Barra de escala, de 2 mm.

Figura 5. Ampliación de imagen en alta capa de la etiqueta fluorescente 6.5 neuronas corticales en un trozo del cerebro despejado de espesor. Una imagen) de alta resolución confocal de una proyección máxima Z-stack (150 um de espesor) a través de la región seleccionada en la (Figura 4). Barra de escala, de 25 um.
Discusión
Teniendo en cuenta la aplicación generalizada del uso de proteínas fluorescentes para apuntar subconjuntos neuronales para la investigación a través de microscopía de luz, la necesidad de rapidez de pantalla, la imagen, y analizar las redes neuronales en el tejido cerebral intacto se ha convertido en un valor incalculable.
Los avances técnicos en el desarrollo de funciones fáciles de vectores virales, en las técnicas de electroporación in vivo, y modificad...
Divulgaciones
Jian-Qiang Kong es un empleado de Precisionary Instruments, Inc., que fabrica un producto utilizado en este artículo.
Agradecimientos
Este trabajo fue financiado por el apoyo a través de la Fundación McNair, NARSAD y NINDS conceder R00NS064171-03.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del elemento | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Hueso tijeras | FST | 16044-10 | -O su equivalente |
| Tijeras de disección | FST | 14084-08 | -O su equivalente |
| Tipo IB agarosa | Sigma | A0576 | |
| Compresstome | Instrumentos Precisionary | VF-200 | -Otros vibratomes son compatibles |
| Adhesiva de doble cara | Grace Bio-Labs | SA-S-1L | |
| Superfrost Plus diapositivas | VWR | 48311-703 | |
| Cubierta de vidrio | VWR | 48383-139 | |
| Glicerol | EMD Chemicals Inc. | GX0185-6 | -O su equivalente |
Referencias
- Pfister, H., Lichtman, J., Reid, C. . The Connectome Project. , (2009).
- Briggman, K. L., Denk, W. Towards neural circuit reconstruction with volume electron microscopy techniques. Curr Opin Neurobiol. 16, 562-570 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Arenkiel, B. R., Ehlers, . Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Capecchi, M. R. Altering the genome by homologous recombination. Science. 244, 1288-1292 (1989).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Shimomura, O., Johnson, F., Saiga, Y. Extraction, purification, and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell Comp Physiol. 59, 223-239 (1962).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W., Prasher, D. Gene fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. The fluorescent toolbox for assessing protein location and function. Science. 312, 217-224 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados