Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine schnelle Annäherung an High-Resolution Fluoreszenz-Imaging in Semi-Thick Hirnschnitten
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine schnelle und einfache Methode, um Bild fluoreszenzmarkierten Zellen in semi-dicken Hirnschnitten. Durch die Fixierung, Schneiden und optisch Clearing Hirngewebe beschreiben wir, wie Standard-epifluoreszenten oder konfokale Bildgebung verwendet werden, um einzelne Zellen und neuronalen Netzwerken im intakten Nervengewebe zu visualisieren.
Zusammenfassung
Ein grundlegendes Ziel der Grundlagenforschung und der klinischen Neurowissenschaften ist es, ein besseres Verständnis der Identität, der molekularen Zusammensetzung und Muster der Konnektivität, die charakteristisch für Neuronen im normalen und erkrankten Gehirn. Gegen diese, hat einen großen Aufwand auf den Aufbau von hochauflösenden neuroanatomischen Karten 1-3 gelegt. Mit dem Ausbau der molekularen Genetik und der Fortschritte in der Lichtmikroskopie hat die Fähigkeit, nicht nur neuronale Morphologie Abfrage kommen, sondern auch die molekularen und zellulären Zusammensetzung der einzelnen Neuronen und ihre zugehörigen Netze 4. Große Fortschritte in der Fähigkeit zu markieren und zu manipulieren Neuronen durch transgenen und Gen-Targeting-Technologien in das Nagetier jetzt die Ermittler ein "Programm" neuronalen Teilmengen nach Belieben 5-6. Wohl hat einer der einflussreichsten Beiträge zur zeitgenössischen Neurowissenschaften der Entdeckung und Klonierung von Genen, fluoreszierenden Proteinen (FPs) in marinen Wirbellosen 7-8, zusammen mit ihren nachfolgenden Engineering zu einer ständig wachsenden Toolbox von entscheidender Reporter 9 Ertrag worden. Ausnutzen Zelltyp-spezifische Promotoraktivität gezielte FP Ausdruck in diskrete neuronale Populationen fahren jetzt bietet neuroanatomischen Untersuchung mit genetischen Präzision.
Engineering FP Expression in Neuronen hat erheblich unser Verständnis von Hirnstruktur und-funktion verbessert. Allerdings Bildgebung einzelnen Neuronen und die damit verbundenen Netzwerke in tiefen Hirngewebe oder in drei Dimensionen, blieb eine Herausforderung. Aufgrund der hohen Fettgehalt, ist Nervengewebe eher undurchsichtig und Exponate Autofluoreszenz. Diese inhärenten biophysikalischen Eigenschaften machen es schwierig zu visualisieren und Bild fluoreszenzmarkierten Neuronen bei hoher Auflösung mit Standard-epifluoreszenten oder konfokalen Mikroskopie über Tiefen von einigen zehn Mikrometern. Zur Umgehung dieser Herausforderung Ermittler oft beschäftigen serielle Dünnschicht-Imaging-und Rekonstruktionsverfahren 10, oder 2-Photonen-Laser-Scanning-Mikroskopie 11. Aktuelle Nachteile dieser Ansätze sind die damit verbundenen arbeits-Gewebe Zubereitung oder kostspielig Instrumentierung bzw..
Hier präsentieren wir eine relativ schnelle und einfache Methode, um fluoreszenzmarkierte Zellen in festen semi-dicke Maus Hirnschnitten visualisieren durch optische Clearing-und Imaging. In der beigefügten Protokoll beschreiben wir die Methoden aus: 1) Fixierung Hirngewebe in situ über intrakardiale Perfusion, 2) Zerlegung und Entfernung der gesamten Gehirns, 3) stationären Gehirn Einbettung in Agarose, 4) Präzision semi-dicke Scheibe Vorbereitung mit neuen Vibratom Instrumentierung , 5) Clearing Hirngewebe durch eine Glycerin-Gradienten, und 6) Montage auf Glas-Objektträger für die Lichtmikroskopie und Z-Stapel-Rekonstruktion (Abbildung 1).
Für die Herstellung Hirnschnitten wir implementiert ein relativ neues Stück Instrumentierung als "Compresstome" VF-200 (http://www.precisionary.com/products_vf200.html). Dieses Instrument ist eine semi-automatische Mikrotom mit einem motorisierten Voraus-und Blade-Vibrations-System mit Funktionen in der Funktion ähnlich zu anderen vibratomes ausgestattet. Im Gegensatz zu anderen vibratomes, ist das Gewebe geschnitten werden in einer Agarose-Plug in einem Zylinder aus rostfreiem Stahl montiert. Das Gewebe wird extrudiert gewünschten Dicken aus dem Zylinder, und schneiden in den zukunftsgerichteten Weiterentwicklung vibrierender Klinge. Die Agarose-Stecker / Zylinder-System ermöglicht eine reproduzierbare Gewebe Montage, Ausrichtung und präzise Schnitte. In unseren Händen, das "Compresstome 'liefert hochwertige Gewebeschnitten für die Elektrophysiologie, Immunhistochemie und direkte festen Gewebe Montage-und Imaging. Kombiniert mit optischen Lichtung, hier zeigen wir die Erstellung von semi-dicke feste Hirnschnitten für hochauflösende Fluoreszenz-Bildgebung.
Protokoll
1. In situ Gehirn Fixierung
* Bereiten Sie eine 10 ml Spritze (28 Gauge-Nadel) mit Phosphat gefüllt Kochsalzlösung (PBS).
* Bereiten Sie eine 10 ml Spritze (28 Gauge-Nadel) mit 4% Paraformaldehyd (PFA) in PBS gefüllt. Reserve eine zusätzliche 5-10 ml PFA / PBS für post-Fixierung.
- Inject experimentellen Maus intraperitoneal mit einer letalen Dosis von Avertin oder Nembutal.
- Sobald die Maus sediert, nassen Bauch mit Ethanol und sichern Sie die Maus auf dem Boden einer Schale mit Kork, Wachs oder Silikon-Elastomer mit Dissektion Pins geschichtet. Mit Bauch nach oben, sichern Sie die vier Pfoten an die Oberfläche - sie verbreitet, so weit wie möglich.
- Besorgen Sie sich die Haut mit einer Pinzette auf der Ebene des Brustbeins, und schneiden Sie quer zur Leber aussetzen. Cut seitlich und dann nach oben durch die Rippen und Zwerchfell. Entfernen Sie die Rippe Gewebelappen und weiter schneiden, bis das Herz zugänglich ist.
- Pierce oder snip den rechten Vorhof in Umlauf gebracht Blut aussaugen.
- Flush restliche Blut aus Kreislaufsystem durch Perfusion des PBS durch die linke Herzkammer.
- Zugriff auf die gleiche Nadel Loch, fix ganze Maus durch nachfolgende Perfusion des PBS / PFA durch die linke Herzkammer.
2. Dissection und Gehirn Extraktion
- Entfernen Sie die Haut von Kopf, Hals und Schädel, indem etwa Gehörgang und Augenhöhlen, gefolgt durch Ziehen der Haut nach vorne, um den Schädel freizulegen.
* Siehe Abbildung 2 für eine Darstellung der Schritte 2,2) bis 2,5) - Mittels eines Knochen-Schere, schnitt quer von den Augen der Steckdose durch die Nasenmuschel Knochen. Tun Sie dies für jede Seite. Die Kapp sollte anterior der Augen und Riechkolben.
- Cut Länge von jedem Gehörgang an Augenhöhle.
- Mit einem kleinen Dissektion Schere, schnitt das Hinterhauptbein Platte über dem Kleinhirn von einem Ohr zum anderen.
- Mit der gleichen Sektion Schere, nach vorne geschnitten entlang der Mittellinie auf der Ebene der Riechkolben.
- Mit einer Pinzette entfernen jedem Knochenplatte aus dem Gehirn, achten dabei auf die Bindegewebe zu entfernen, so dass das Gehirn intakt bleibt beim Abheben des Knochens.
- Snip Optik und Hirnnerven, schneiden Sie die Spitze Halswirbel, und entfernen Sie das Gehirn in Fixativ.
- Post-Fix für 1-2 Stunden bei 4 ° C waschen 3 mal je 15 min in PBS.
3. Agarose eingebettet
- Melt 2% hochfeste, niedrig-Gelpunkt Agarose Typ IB (Sigma Katalog-Nummer: A0576) in PBS Kochsalzlösung mit Mikrowelle.
- Transfer geschmolzene Agarose in ein Reagenzglas. Legen Reagenzglas in einem warmen Inkubator oder Wasserbad (40 ° -41 ° C), bis Temperaturausgleich.
- Kleber fixiert Hirngewebe auf den Kolben der Spritze mit Probe Sekundenkleber (Abbildung 3A). Pinsel eine dünne Schicht von gesättigten Saccharose-PBS-Lösung auf der Oberfläche des Hirngewebes der späteren Veröffentlichung der Agarose Ring aus dem Hirnschnitten zu erleichtern.
- Zeichnen Sie den Kolben mit Hirngewebe in den Kolben-Gehäuse (Abbildung 3B).
- Pipette oder pour warme Agarose in den Kolben-Gehäuse, für das Hirngewebe. Vermeiden Sie Lufteinschlüsse in die Agarose. Luftblasen in der Agarose beeinträchtigt die Scheibe Qualität.
- Klemmen Sie die Probe Spritze mit einer kalten (0 ° bis -25 ° C) gekühlt Block für 1 Minute bis die Agarose (Abbildung 3C) gesetzt.
4. Sectioning Hirnschnitt mit dem Compresstome
- Montieren Sie die Probe Spritze mit dem Hirngewebe in der Compresstome (Abbildung 3D).
- Richten Sie die Kante der Rasierklinge eng mit dem Ausgang des Muster-Spritze (Abb. 3E).
- Füllen Sie den Pufferspeicher mit PBS-Lösung.
- Drehen Sie den Mikrometer Dicke einer Scheibe nach vorne, um die Agarose-Hirngewebe Block extrudieren aus der Probe Spritze.
- Drücken Sie die Schaltfläche "Start" auf der Steuereinheit des Compresstome die Schnitte zu initiieren.
- Wiederholen Sie die Schritte 4,4) bis 4,5), bis die gewünschte Scheiben an bestimmen Dicke erhalten werden.
- Ernte Hirnschnitten mit Pinsel oder Pipette Fläschchen oder Färbung Vertiefungen mit PBS (Abbildung 3F) gefüllt.
5. Optische Clearing
- Bereiten Sie eine 75% vol: vol Lösung von Glycerin: PBS.
- Pour (oder Pipette) aus der Hälfte des Volumens des PBS waschen aus den vereinnahmten Hirnschnitten.
- Fügen Sie die Lautstärke mit Glycerin / PBS entfernt.
- Lassen Sie sich mit sanften Mischen bei 4 ° C äquilibriert, bis die Scheiben sinken.
- Wiederholen Sie die Schritte 6,2) auf 6,4) bis zu einer endgültigen Glycerinkonzentration 75% erreicht.
- Ersetzen Lösung mit 90% Glycerin in PBS und lassen Sie sie ins Gleichgewicht.
* Hinweis: Achten Sie darauf, um Luftblasen zu präsentieren, während Zugabe von Glycerin-Lösungen. Gießen Lösungen langsam und vorsichtig mischen, da Luftblasen mit einheitlichen Equilibra störenTION und übertragen werden, um Schienenführung.
6. Slice-Montage für die Bildgebung
- Cut doppelseitige Siegel-Klebstoff (SA-S-1L, Grace Bio-Labs) in ein offenes Rechteck, um den sichtbaren Bereich eines Mikro-Schlitten (Superfrost Plus, 25 fit X 75 X 1 mm, cat. # 48311-703, VWR ) mit den Seiten 2-3 mm breit.
- Legen Sie Hirnschnitten in der Mitte des Klebebandes Rechteck mit einer Pipette oder Pinsel. Entfernen Sie überschüssiges Glycerin mit sanften Aspiration.
- Vereinbaren Hirnschnitten auf Folie in der gewünschten Reihenfolge mit einem Pinsel.
- Senken Deckglas (24 x 60 mm, cat. # 48383-139, VWR) auf das Klebeband, kümmert sich nicht um Luftblasen zu bringen. Durch leichten Druck auf Deckglas, um Kontakt mit Klebeband sichern.
- Absaugen überschüssige Glycerin von den Kanten zwischen Objektträger und Deckglas.
- Seal Rutsche und Deckglas mit klarem Nagellack.
- Lassen Sie vor dem Imaging-trocken, oder lagern Sie langfristig in Dia-Boxen bei 4 ° C.
7. Repräsentative Ergebnisse:
Verarbeitung, Bildgebung und Analyse von fluoreszenzmarkierten Hirngewebe unverzichtbar geworden, um das Studium der Neurobiologie. Viele dieser Untersuchungen erfordern anspruchsvolle genetische Manipulationen an Reporter Ausdruck in gezielte neuronale Teilmengen, die sowohl von niedrig-und hoch auflösenden Bild-Analysen folgen zu erhalten. Oft experimentellen und technischen Beschränkungen machen es unmöglich, diese Art von Daten aus dem gleichen Tier zu erhalten, oder in eine schnelle Art und Weise. Herstellung von optisch-geräumt, semi-dicken Hirnschnitten für Fluoreszenz-Imaging Hilfsmittel in dieser Herausforderung. Ein Beispiel für eine intakte dicken Hirnschnitten mit einem genetisch veränderten Tollwutvirus markiert, um auszudrücken EGFP entwickelt und aufgenommen mit epifluoreszenten und konfokale Mikroskopie ist in Abbildung 4 dargestellt, und Abbildung 5 jeweils. Für epifluoreszenten Bildgebung verwendeten wir eine Leica M205 FA und für die konfokale Bildaufnahme verwendeten wir ein Zeiss LSM 510. Aufgrund der relativen Einfachheit der beigefügten Protokoll, ist diese Methode zu liefern vermag nützliche Bilddaten aus dem Gewebe exprimiert fluoreszierenden Reporter mit einer Bearbeitungszeit von weniger als einem Tag, und ist sowohl mit Low-und High-Resolution Lichtmikroskopie.
Wenn der Prüfer wählt, um weitere Obduktion Kennzeichnung Methoden, immunhistochemische Färbung, aufzunehmen oder zu dünner Schnitte, verlängert sich das Protokoll entsprechend. Allerdings stellt der oben beschriebenen Methode eine einfache und relativ hohem Durchsatz Verfahren zum Screening von Mustern von entscheidender Reporter Ausdruck in intakten Gehirn.
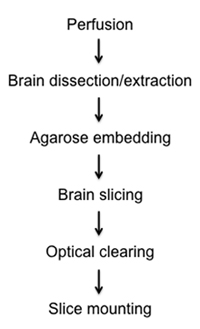
Abbildung 1. Ablaufschema diagraming die Fixierung, Dissektion, Schneiden, Löschen und Montage Verfahren der semi-dicken Hirnschnitten.
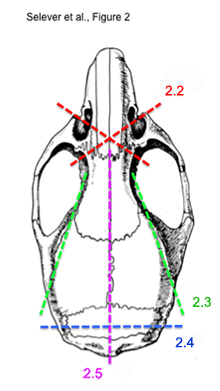
Abbildung 2. Diagramm der sequentiellen Schneiden Schritte, um das intakte Gehirn der Maus zu extrahieren.

Abbildung 3. Steps zu montieren und in Scheiben schneiden Hirngewebe mit dem Compresstome. A) Vermittlung von Hirngewebe auf Schneiden Kolben mit Sekundenkleber. B) Zeichnung unten montierten Hirngewebe in den Kolben für Agarose eingebettet. C) Die Festigung einer Agarose Gehirn Stecker mit einem gekühlten Kompression zu blockieren. D) Einsetzen der Agarose Gehirn Plug-and-Kolben in Compresstome Mahlkammer. E) Die Angleichung der Rasierklinge, den Kolben Gerät. F) Schneiden und Sammeln von Hirnschnitten in Compresstome Pufferkammer.
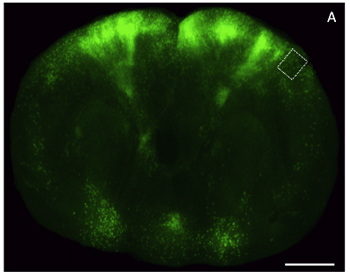
Abbildung 4. Lichtmikroskopie Bilder von einer dicken Scheibe aus Glycerin-geräumt Hirngewebe durch den frontalen Kortex zum Ausdruck Enhanced Green Fluorescent Protein (EGFP). A) Im koronaren Schnitt durch ein Gehirn der Maus (200 um dick) mit einer viralen Vektor, EGFP beschriftet und bebildert mit einer niedrigen Auflösung mit einer epifluoreszenten Stereoskop. Scale-bar, 2 mm.

Abbildung 5. Hohe Vergrößerung Bild von fluoreszenzmarkierten Schicht 5 / 6 kortikalen Neuronen in einem gelöschten dicken Hirnschnitten. A) Hohe Auflösung der konfokalen Bild einer maximalen Projektion Z-Stapel (150 um dick) durch die Region hervorgehoben (Abbildung 4). Scale-bar, 25 um.
Diskussion
Angesichts der weit verbreiteten Anwendung der unter Verwendung von fluoreszierenden Proteinen zu neuronalen Teilmengen für die Untersuchung über die Lichtmikroskopie, die Notwendigkeit, rasch Bildschirm, Bild-und Analyse neuronaler Netze innerhalb intakten Hirngewebe geworden unschätzbare Ziel.
Technische Fortschritte in der Entwicklung von benutzerfreundlichen viralen Vektoren in vivo Elektroporation Techniken und genetisch veränderte Mausstämme bietet nun eine scheinbar unbe...
Offenlegungen
Jian-Qiang Kong ist ein Mitarbeiter von Precisionary Instruments, Inc., dass ein Produkt in diesem Artikel verwendet produziert.
Danksagungen
Diese Arbeit wurde durch die Unterstützung durch die McNair-Stiftung, NARSAD und NINDS gewähren R00NS064171-03 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Eintrags | Unternehmen | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| Knochen Schere | FST | 16044-10 | -Oder gleichwertiger |
| Sektion Schere | FST | 14084-08 | -Oder gleichwertiger |
| Type IB Agarose | Sigma | A0576 | |
| Compresstome | Precisionary Instruments | VF-200 | -Andere vibratomes sind kompatibel |
| Doppelseitig klebenden | Grace Bio-Labs | SA-S-1L | |
| Superfrost Plus Objektträger | VWR | 48311-703 | |
| Cover Glas | VWR | 48383-139 | |
| Glycerin | EMD Chemicals Inc. | GX0185-6 | -Oder gleichwertiger |
Referenzen
- Pfister, H., Lichtman, J., Reid, C. . The Connectome Project. , (2009).
- Briggman, K. L., Denk, W. Towards neural circuit reconstruction with volume electron microscopy techniques. Curr Opin Neurobiol. 16, 562-570 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Arenkiel, B. R., Ehlers, . Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Capecchi, M. R. Altering the genome by homologous recombination. Science. 244, 1288-1292 (1989).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Shimomura, O., Johnson, F., Saiga, Y. Extraction, purification, and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell Comp Physiol. 59, 223-239 (1962).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W., Prasher, D. Gene fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. The fluorescent toolbox for assessing protein location and function. Science. 312, 217-224 (2006).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten