需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
吸血鬼从细胞外液分离
摘要
模式生物 C.线虫使用pseudocoelomic的流体作为被动的循环系统。直接测定该流体一直没有以前可能。在这里,我们提出了一种新的技术直接检测细胞外空间,并使用系统沉默信号在原则的例子作为证明RNAi反应。
摘要
模式生物的基因听话的C.线虫提供了无数的生物学问题的洞察,启用其生成时间短,易于生长,体积小。这种体积小,但是,不允许在其他模型系统的一些技术方法。例如,在哺乳动物系统中和在植物中的接枝技术启用输血提问循环系统组合物和信令。循环系统的蠕虫病毒,pseudocoelom,直到最近是不可能的直接检测。回答问题间的信令和循环系统组成C.线虫的研究人员已经转向传统的遗传分析,细胞/组织特定的救援,马赛克分析。这些技术提供了一种手段来推断细胞之间发生了什么事,但不是普遍适用于细胞外分子的识别和表征。在这里,我们提出了一个NEWLY开发的技术直接测定pseudocoelomic的流体的C.线虫 。该技术开始与任一遗传或物理处理,增加细胞外液的体积。随后的动物受到吸血鬼反向显微注射技术,使用一个微妙的平衡压力控制的显微注射钻机,允许的。细胞外液分离后,可以通过转移到其他的动物,或通过分子装置测定所收集的流体。为了证明这一技术的有效性,我们提出了一个详细的方法测定细胞外的信号分子,长dsRNA的具体示例的系统性RNAi反应期间。虽然系统性的RNAi技术鉴定证明的原则,例如,我们可以看到这种技术为适应解答各种循环系统的组成和信号的问题。
研究方案
1。材料制备中的
吸血鬼反向显微注射所必需的物质是类似的,所需的的标准显微注射技术用于使转基因C.的菌株1。虽然一些试剂(如测定板)是由实验转移的日子,许多材料必须协调超过8天的期间( 见表1的时间表)制备。因此,重要的是要仔细提前计划使用这种技术时,( 见表2)必要的试剂和设备。
注射垫:
- 车型在2%琼脂糖溶液的H 2 O和热,直至溶解。分装在1ml等分于1.5 mL离心管中,并存储在4°C
- 布局22×50 mm的盖玻片,其边缘稍微突出,替补出场的顶部边缘,以方便他们迅速在工作台上。
- 博爱EA小孔,在离心管的盖子(图钉),以允许通风。试管置于15毫升烧杯中,用约5毫升的水,和微波炉熔化(约35秒)。
- 使用巴斯德吸移管和灯泡的地方一滴(约35μL)的盖玻璃上熔化的琼脂糖,并立即在第一个90°的角度放置在下拉式菜单中的第二盖玻璃。其他几个盖玻片重复上述步骤。
- 琼脂糖已凝固后,取出玻璃盖,并允许垫在空气中完全干燥过夜(如果需要的话越早,幻灯片可以放置在50-80℃的烘箱中15-30分钟)。
- 焊盘然后可被储存在一个玻璃盖框在室温下无限期。
检测板:
对于测定与PAL-1 RNA干扰技术,检测板的准备工作应在胚胎致死的日子吸血鬼的实验。我们的目标是向房委会VE最小的细菌草坪,而不会饿死你的蠕虫病毒。过厚的草坪,得分PAL-1的幼虫非常困难的,半透明的小变形L1可以很容易地失去了在食品动物。板准备工作应进行优化,以赢得利益的表型。
- 准备OP50:种子5mLs的LB肉汤培养基用一个单一的OP50的LB琼脂平板上生长的菌落。在37°C过夜孵育OP50一阵晃动,然后将其存储在4°C
- 根据基本协议(见注1),35毫米的NGM板准备。
- 现货20μL的隔夜OP50文化(1.7)到每一个NGM板。允许,LB-OP50干燥(这应该少于20分钟)。
注射针头:
- 拉硼硅玻璃毛细管使用P97燃烧/棕色微量移液器拉马萨特仪器(请参阅图1为代表针状)的注射针头。
- 商店注射针持针器构造一个培养皿造型粘土(参见图1)。
2。制备蠕虫
一个成年人C.的的估计pseudocoelomic体积雌雄同体的线虫是40〜80皮升(PERS COM。大卫霍尔)。从这样一个小水库至获得细胞外液的样品,它是有利的,以增加总的可用资源。我们已经确定了三种方法,大大提高了可用的流体捐助蠕虫。我们的主要的方法,利用clr进行-1(e1745)突变体的表型,这可能导致在细胞外液量( 图2)的10倍或更大的提高。的两种可供选择的方法利用的事实,即占近三分之一的蠕虫的总体积,它的去除由GLP-1(RNAi)的或激光烧蚀结果pseudocoelomic流体在动物的生殖细胞的种系的空隙填充( 图2) 2 </ SUP>。
制备捐助蠕虫使用CLR-1(e1745)
参见图3为CLR-1(e1745)传输试验工作流程
- 表达双链RNA为单菌落LB +25μg/mL羧苄青霉素板的出细菌数。为这个演示中,我们将使用PAL-1的dsRNA产生菌。孵育过夜,在37°C。
- 从挑染LB +25μg/ mL的羧苄青霉素板检测pal-1(RNAi)的细菌,挑选的单菌落,接种到3毫升补充有25μg/mL羧苄青霉素的LB培养过夜。
- 吸取15μL的过夜培养到35毫米NGM板用25μg/ mL的羧苄青霉素和1mM IPTG的补充。确保板的细菌断板中心。允许干燥(约20分钟)。
- 500μL新鲜的漂白剂溶液(1:1 5M KOH:NaHypochlorite)的。
- 吸取10μL的漂白剂溶液的种子板块。请务必吨Ø将漂白剂液滴远离细菌性斑点病。
- 为了获得一个小的,干净的,同步的人口CLR-1(e1745)动物的反向显微注射,挑2-10妊娠成人的漂白下降。成人溶解,留下干净,局部发育上演的胚胎。然后,这些胚胎孵化,幼虫会爬行的食物。
- 在20℃下孵育四天
- 移位板至25℃保温4小时,以诱导肿胀。
- 选择的蠕虫的的非种子选手NGM板,并允许的时间来清除细菌的角质层。 (可选步骤)冲洗蠕虫M9,而转移到NGM板。
- 移动L4/Young成人(YA)的收件人虫到非种子选手板的NGM板和允许的时间来清除细菌的角质层。 (可选步骤)冲洗蠕虫M9,而转移到NGM板。
A2)替代制备的供体蠕虫利用GLP-1(RNA干扰 )
- 从挑染板的+ 25μg/ mL的羧苄青霉素的LB接种补充有羧苄青霉素的LB用的GLP-1(RNAi)的细菌的单菌落3毫升过夜培养。孵育,37℃培养过夜。
- 移液器15μL的GLP-1(RNAi)的过夜培养到35 mm的NGM补充了25μg/ mL的羧苄青霉素和1mM IPTG的板。在室温下孵育过夜。
- 将五L3/L4动物转移到的GLP-1(RNAi)的板。在20℃下温育两天RNA干扰GLP-1的结果与生殖细胞增殖缺陷的后代。无法充分开发的生殖结果在无人居住的空间充满了细胞外液。优化的RNAi食物产生的后代,进展到成年没有增殖的种系的可能是必需的。
- 已经准备好PAL-L板(RNAi)技术的clr-1(e1745)蠕虫准备协议上面的步骤2.1-2.3。
- 一个新的漂白剂溶液正确的指令(1:1 5M KOH:NaHypochlorite)的。
- 吸取10μL的漂白剂溶液对种子PAL-1(RNAi)的板。一定要放在远离细菌性斑点病的漂白剂滴。
- 移植胚胎的漂白剂液滴采摘2-10妊娠GLP-1(RNAi)的成人。
- 在20℃下孵育四天
- 挑选的蠕虫到的非种子选手60毫米NGM板,并让时间来清除细菌的角质层。 (可选步骤)冲洗蠕虫M9,而转移到NGM板。
B2)替代供体的蠕虫利用生殖激光消融编制
- 细菌表达的dsRNA的单个菌落在LB + 25μg/ mL的羧苄青霉素板连胜满分。为这个演示中,我们将使用PAL-1的dsRNA产生菌。孵育过夜,在37°C。
- 从与羧苄青霉素的平板接种3mL的补充用25μg/ mL的羧苄青霉素的LB培养过夜。
- 吸取15μL日Ë过夜培养PAL-1表达双链RNA的细菌到35毫米的NGM平板与25μg/ mL的羧苄青霉素和1mM IPTG。允许干通宵。
- 隔离L1动物从标准OP50板和激光烧蚀的体细胞胚系前体细胞的Z1和Z4的使用标准协议3。
- 恢复激光烧蚀蠕虫上述PAL-1 RNA干扰板。
- 在20℃下孵育3天
- 选择到一个干净的NGM板的蠕虫和允许的时间来清除细菌的角质层。 (可选步骤)冲洗蠕虫M9,而转移到NGM板。
收件人蠕虫的制备
- LB平板上的单菌落数出OP50。孵育过夜,在37°C。
- 从LB平板上接种3毫升的LB过夜培养。
- 吸取15μL过夜培养到35毫米NGM板。确保板的细菌断板中心。晾干(约20分钟)。
- 一个新的漂白剂溶液(1:1 5M KOH:NaHypochlorite)的。
- 吸取10μL的漂白剂溶液的种子板块。一定要放在远离细菌性斑点病的漂白剂滴。
- 采摘2-10妊娠的漂白剂液滴的N2成人,移植胚胎。
- 在20℃下孵育三天
- 移动蠕虫干净,非种子选手NGM板和孵化,在20℃至少30分钟。
3。吸血鬼的细胞外液的分离
下面的协议是特定的微注射集组成的一个PLI-100微微喷油器,显微操作保持在一个固定针,和一个浮动的阶段,在这阶段,蠕虫可以进针滑动。然而,广义的方法是插入一个空的成体动物的显微注射针,同时保持足够的压力,以防止矿物油的流动毛细血管进入前和蜂窝麻terial而穿透体壁组织。同时针内的供体动物的压力被降低到允许毛细管填充针与细胞外液,然后可以移动针到的收件人蠕虫和通过增加压力足够排出。去除的液体通过毛细作用也可以使用填充的协助下,或吸,功能的微型注射器。这种广义的技术应该很容易适应其他微注射系统,使控制平衡压力。
- 倒置显微镜,在解剖显微镜,和pico式喷射器( 见图1)打开。
- 的Pico喷射器将选择旋钮到P 明确 ,检查的电流测量,以psi。阅读,清晰的压力,输入压力,并应约0磅。
- 检查主阀,在氮原子上的稳压罐,以确保该输出被关闭(打开counterclockwise,直到旋钮,是松)。
- 打开液氮罐阀门。该稳压器计最接近N2罐现在应该读取罐的内部压力。
- 主调节阀顺时针转动,慢慢地增加了压力。监控的压力越来越大的微型注射器(这是更准确的输出压力读数调节器计)。慢慢增加至100 psi的压力。不允许超过105磅。
- 当达到100磅,选择切换到P 注入和注射压力至30 psi使用Pinject旋钮。
- 选择旋钮切换到P的平衡 。
- 将15μL液滴的矿物油的清洁捐赠者和接受者板。
- 封面2%琼脂糖凝胶注射垫在矿物油中。
- 负载拉微量移液器针在支架和调整。
- 在解剖显微镜,安装1供体和1个收件人蠕虫靠近对方的琼脂糖p广告。
- 使用低倍率和位置蠕虫带来针到附近的捐赠者的矿物油。
- 移到针附近pseudocoelomic腔高功率和位置。
- 增加约10磅的压力平衡。注意矿物油塞在针尖。
- 蠕虫推进针定位针尖在pseudocoelomic腔通过移动的阶段。
- 注意在矿物油中的针的前端的位置的跳转。
- 减少压力平衡,让毛细作用,填补了针。 (也可以使用填充功能,以加速过程)。
- 在收集液幻灯片的蠕虫针距。
- 切换到低功率放大倍率和位置的针由收件人蠕虫(不要让针尖离开的矿物油)。 [另外,缝合针夹持器可除去的流体转移到微量离心管中的液滴。]
- 切换回高倍率并移动到收件人蠕虫针滑动显微镜载物台。
- 一旦定位在收件人蠕虫的使用注射(在35psi)函数来注入的pseudocoelomic的液体收集捐助。
- 卸下针从收件人蠕虫中,在相反的方向上滑动的显微镜载物台,用于输入收件人。
- 随着出的蠕虫针,提高针距,从注射垫。
- 注射垫取出,然后将一小滴M9的蠕虫恢复。
- 放置10μL液滴M9检测板。
- 到M9选择收件人蠕虫的检测板。
4。含量测定的RNAi表型传输
- 允许恢复蠕虫的增长在20℃下24小时
- 删除收件人成人板,使胚胎和孵化后代。一个额外的24小时内,在20℃下孵育板
- 分数后代为不能孵化,孵化,但表型突变体或野生型幼虫。
笔记
- NGM媒体是通过添加18克的琼脂,2.5克细菌胨,3克氯化钠和H 2 O在1升的批次搅拌棒和高压釜。高压灭菌后,将烧瓶在搅拌盘,并允许媒体冷却至60℃,同时搅拌。的媒体已经冷却之后,添加1毫升的胆固醇(5毫克/毫升在乙醇中),1毫升1M的CaCl 2,1毫升1M用MgSO 4,25毫升的磷酸钾缓冲液(pH值6.0)。如果板是要用于RNA干扰的NGM补充后,冷却至60℃,用1毫升的1M的IPTG,25 mg / mL的羧苄青霉素和1 mL板倒在35毫米(3.5毫升的NGM)或60毫米(8.5毫升的NGM)氏培养皿。
- 在2%的琼脂糖水。存放在冰箱。熔体和流体隔离pseudocoelomic提前一天垫。垫的干燥度使得蠕虫坚持到该压焊盘,和最小空气干燥1天是必要的垫干够。如果注射垫过于干燥和您的捐助者蠕虫的失水速度比你可以操纵他们,你可以添加额外的水分注射垫的垫呼吸,然后再添加矿物油。无论工作能力迅速的蠕虫变干之前到隔离pseudocoelomic的流体是绝对必要的。
- 我们用羧苄青霉素在我们的RNAi技术准备食物的所有步骤,氨苄青霉素抗性选择标记。羧苄青霉素的是氨苄青霉素类似物,这是更稳定和结果,在比氨苄青霉素更少的卫星菌落。
- 我们利用RNAi板用1mM IPTG和25μg/ mL的羧苄青霉素NGM补充。供给的RNAi载体的HT115 E. coli菌株,这是缺乏的双链RNA特异性核酸。
- (可选步骤),我们发现,一个小时的非种子选手NGM板供体和受体的蠕虫做了充分的工作,失去角质层结合的细菌是由进料板。这是不正确的,虽然供体动物的干扰流动性的RNAi目标的情况下(例如UNC-22(RNAi)技术 )。因此,它成为必要的协助,在这个过程中。要做到这一点,我们使用了抑郁症滑动约50μL的M9。采摘到M9的蠕虫从供给的RNAi板,然后搅拌一个标准的铂金蠕虫挑足以消除大部分附着的细菌。
5。代表性的成果
是代表结果为实验从细胞外液转移CLR-1(e1745)上生长的细菌表达双链RNA针对PAL-1的蠕虫。死亡的供体动物的后代和/或展出后的图形缺陷。然后,我们将细胞外液从这些动物的pseudocoelom的的RNAi天真的野生型蠕虫。随后收件人动物后代的一部分,然后显示了预期的朋友-1突变体的表型( 图4)。这是在受体动物的后代,无论是的标准细菌的食物或只显示背景的杀伤力水平( 图4)的控制RNAi载体,细菌生长在从供体动物细胞外液。虽然后代的细胞外液中的收件人从供体动物进行RNA干扰的双链RNA诱导的表型的频率表现出显着的增长,外显率是不一样强大的供体动物的后代,后代未孵化的胚胎死亡,近100%的和罕见的,严重变形的动物孵化。
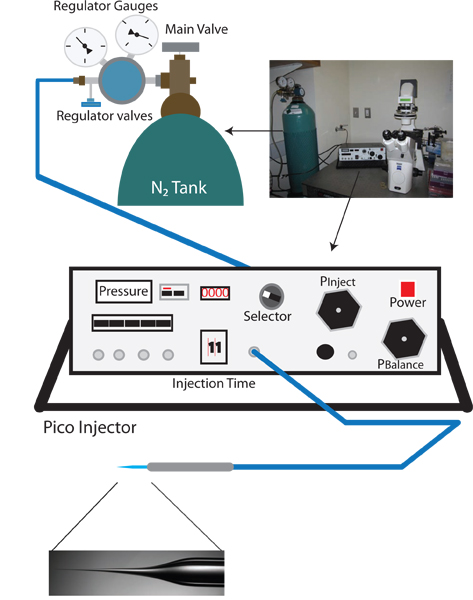
图1。吸血鬼反向注入设置。适当的设置FORA吸血鬼反向显微注射的设置是类似的一个标准 C 线虫显微注射钻机,并包括在解剖显微镜,10X和40X的目标的倒置显微镜,用于定位的一个可移动的阶段,和微操纵器与注射针保持架。此外,用于制备注射针的针牵拉也需要。独特的反向显微注射协议的一个微型注射器的平衡压力,可以更好地控制(例如华纳仪器PLI-100)是必要的。
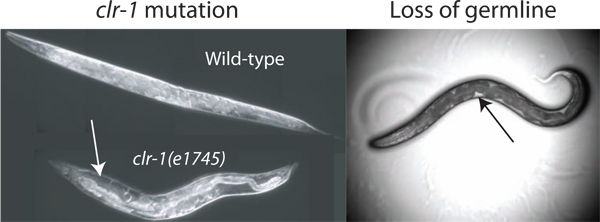
图2增强pseudocoelomic体积。可用于隔离pseudocoelomic流体的体积是不够的测定,在野生型的动物。的体积可以增加通过破坏渗透平衡的调节通过温度偏移clr进行-1(e1745)的动物,导致明显的积累的pseudocoelomic流体(白色箭头)。此外,通过激光烧蚀或GLP-1(RNAi)的损失的性腺使细胞外液(通过激光烧蚀损失示出)的访问。可用的流体是最容易观察到明确黑暗小肠和体壁(黑色箭头)之间的补丁,虽然总的可用体积远小于clr进行-1(e1745)在限制性的温度下生长的动物中发现。
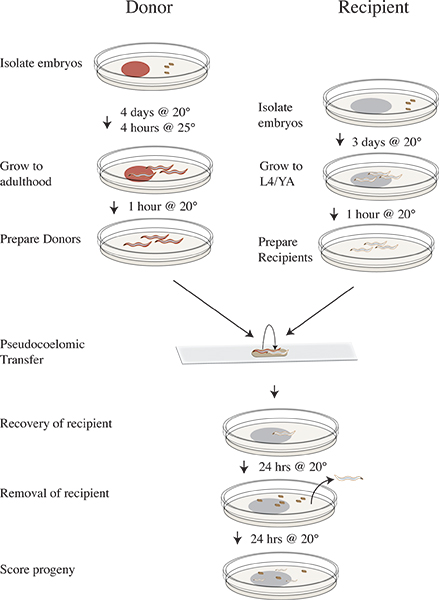
图3。吸血鬼的隔离和传输协议的时间表。前四天传输实验隔离CLR-1(e1745)平板上用RNAi食物,并培育囊胚在20°C 3天前隔离N2受体种蛋的OP50。在实验当天捐助板转移到25℃并持续4小时。删除后的捐助者25°C孵化以清洁板缺乏食物和移位20°C。将收件人的动物清洁板缺乏食品和继续孵育在20℃下在20°C进行传输实验OP50板,并培育和恢复收件人蠕虫在20℃下,24小时后取出收件人动物在20℃下孵育24小时的收件人后代分数为野生型,突变体,或未孵化的后代。
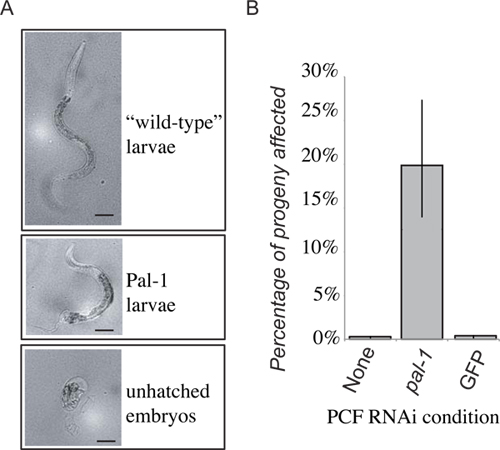
图4的代表性结果。 PAL-1的功能在收件人的损失将导致胚胎死亡,或独特的损失后的发展(A)。 PCF的传输后代的第一个24小时内提出,48小时后的得分无论是野生型幼虫,幼虫PAL-1,或者未孵化的胚胎。未孵化的胚胎和表型帕尔-1幼虫的频率相结合,得到的度量检测pal-1(RNAi)的传输引起的表型。收到的pseudocoelomic流体从动物生长PAL-1 dsRNA的食品产生了强烈的诱导相关的在控制传输受惠人士半价优惠(B)看不见的表型。
Access restricted. Please log in or start a trial to view this content.
讨论
我们已经提出了一种新的方法,使细胞外液的分离和表征从模式生物C.在这里线虫 。该技术开始与遗传或物理处理的供体虫,以增加他们的细胞外液的总体积。细胞外液,然后使用修改后的显微注射技术分离。该蠕虫安装用于显微注射举行的蠕虫病毒仍然在手术过程中使用干的琼脂糖凝胶垫。静水压力保持蠕虫的干垫垫的物理连接使用的干燥剂。这提出了一个挑战,因为一旦蠕虫安?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
我们要感谢的猎人实验室的合作性质,并感谢他们的有益的讨论和帮助,使这一技术的发展可能和乐趣。我们要感谢奈杰尔·德莱尼和秀丽隐杆线虫蠕虫病毒和细菌株的遗传学中心。这项工作是由美国国立卫生研究院GM089795拨款,以CPH。
Access restricted. Please log in or start a trial to view this content.
材料
日蠕虫准备材料准备
| Name | Company | Catalog Number | Comments |
| -7或之前 | 保持干净,吃得好 | 进行注射垫,NGM板,NGM + CARB / IPTG板,OP50 LB股票 | |
| -6 | |||
| -5 | 接种3毫升,用RNAi食物过夜 | ||
| -4 | 移动胚胎的RNAi板 | 种子RNA干扰板 | |
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | 转换蠕虫4小时至25 | 进行检测板 | |
| 移动蠕虫清洁NGM板 | |||
| 吸血鬼转移 | |||
| 恢复收件人 | |||
| +1 | 删除转接接受者 | ||
| +2 | 分数后代 |
表1。设备公司产品目录号 9 GLP-1 RNAi载体 10 PAL-1 RNAi载体 11
| 微微升的压力注射器 | 华纳仪器 | 65-0001(PLI-100) |
| 萨特仪器 | P97 | |
| Axiovert 200 | 蔡司 | |
| 试剂 | ||
| 矿物油 | EM科学 | MX1560-1 |
| 22x50 1½盖玻片 | 康宁 | |
| SeaKem LE琼脂糖 | 龙沙 | 50004 |
| 高硼硅玻璃毛细管 | 精密仪器 | 1B100F-4 |
| 次氯酸钠溶液(5%有效氯) | JT贝克 | 9416-01 |
| C.线虫和菌株 | ||
| 秀丽隐杆线虫的遗传学中心(CGC) | CB3241 | |
| 源生物科技(Ahringer进料库) | F02A9.6 | |
| pHC187 | ||
| OP50-GFP | 秀丽隐杆线虫的遗传学中心(CGC) | OP50-GFP |
| YFP E.大肠杆菌 | MC4100-YFP | |
表2。特定的试剂和设备。
参考文献
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e, Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。