É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Vampiric Isolamento de fluido extracelular a partir de
Neste Artigo
Resumo
O organismo modelo C. elegans Usa fluido pseudocoelomic como um sistema circulatório passiva. Ensaio directo desse fluido não tem sido possível anteriormente. Aqui apresentamos uma nova técnica para ensaio diretamente do espaço extracelular, e usar sinais sistêmicos silenciamento durante uma resposta RNAi como uma prova de princípio exemplo.
Resumo
O organismo geneticamente tratável modelo C. elegans tem fornecido informações em uma miríade de questões biológicas, habilitado pelo seu tempo de geração curto, facilidade de crescimento e tamanho pequeno. Este pequeno tamanho, no entanto, não permitiu um certo número de abordagens técnicas encontradas em outros sistemas de modelos. Por exemplo, as transfusões de sangue em mamíferos e técnicas de enxertia em plantas permitem fazer perguntas de composição sistema circulatório e sinalização. O sistema circulatório do worm, o pseudoceloma, até recentemente sido impossível ensaio diretamente. Para responder as questões de sinalização intercelular e sistema circulatório composição C. elegans pesquisadores têm tradicionalmente virou-se para análise genética, a célula / tecido específico de salvamento, e análise de mosaico. Estas técnicas proporcionam um meio para se inferir o que se passa entre as células, mas não são universalmente aplicáveis na identificação e caracterização de moléculas extracelulares. Apresentamos aqui uma newly técnica desenvolvida para o fluido de ensaio directamente pseudocoelomic de C. elegans. A técnica começa com qualquer manipulação genética ou física para aumentar o volume de fluido extracelular. Depois os animais são submetidos a uma técnica de micro-injecção reversa vampiric utilizando um equipamento que permite a micro-injecção de controlo de pressão fino equilíbrio. Após o isolamento do fluido extracelular, o fluido recolhido pode ser testada por transferência para outros animais, ou por via molecular. Para demonstrar a eficácia da presente técnica é apresentada uma abordagem detalhada do ensaio de um exemplo específico de moléculas de sinalização extracelulares, dsRNA longo durante uma resposta sistémica RNAi. Apesar de caracterização de RNAi sistêmica é uma prova de princípio exemplo, vemos esta técnica como sendo adaptável para atender uma variedade de questões de composição sistema circulatório e sinalização.
Protocolo
1. Preparação dos Materiais
O material necessário para vampiric microinjecção reversa é semelhante ao que é necessário para as técnicas de microinjeção padrão usados para fazer transgénico C. elegans estirpes 1. Apesar de alguns reagentes (por exemplo, placas de ensaio) são feitas no dia da transferência experimental, muitos dos materiais devem ser preparados de forma coordenada ao longo de um período de oito dias (ver quadro 1 para a tabela de tempo). Como tal, é importante planejar com cuidado ao usar esta técnica (para os reagentes e equipamentos necessários ver Tabela 2).
Almofadas de injeção:
- Fazer uma solução de 2% de agarose em H 2 O e aquecer até dissolução. Alíquota em alíquotas de 1 ml em tubos de 1,5 mL de microcentrífuga e armazenar a 4 ° C.
- Lay out 22 x 50 milímetros óculos tampa em cima da bancada com as bordas ligeiramente salientes para fora da borda de bancada para facilitar a pegá-los rapidamente.
- PokeA pequeno furo na tampa do tubo de microcentrífuga (usar um percevejo) para permitir a ventilação. Colocar o tubo num copo de 15 ml com cerca de 5 mL de água, e de microondas para derreter (aproximadamente 35 segundos).
- Utilizando uma pipeta de Pasteur e bulbo lugar uma gota (aproximadamente 35 ul) da agarose fundida sobre uma tampa de vidro e colocar imediatamente a tampa de vidro, o segundo sobre a queda de um ângulo de 90 ° em relação ao primeiro. Repita o procedimento para vários copos de capa outros.
- Após o ágar se ter solidificado, remover a tampa de vidro e permitir que a almofada de ar seco completamente durante a noite (se necessário, mais cedo, as lâminas podem ser colocadas em um forno de 50-80 ° C durante 15-30 minutos).
- Almofadas podem depois ser armazenadas numa caixa de vidro de cobertura, à temperatura ambiente por tempo indeterminado.
Placas de ensaio:
Para ensaiar a letalidade embrionária associada com pal-1 RNAi, a preparação de placas de ensaio deve ser feito no dia do experimento vampiric. O objectivo consiste em have um gramado mínimo bacteriana, enquanto não passar fome seus vermes. Um gramado muito grossa faz marcando Pal-1 larvas extremamente difícil, pois os pequenos, translúcidos animais deformados L1 pode ser facilmente perdida no alimento. Preparação da placa deve ser otimizado para marcar o fenótipo de interesse.
- Prepare OP50: 5mls semente de caldo de LB com uma colónia única OP50 cultivadas em placas de agar LB. Incubar a OP50 a 37 ° C durante a noite, com agitação, em seguida, armazenar a 4 ° C.
- Prepare 35 placas NGM milímetros de acordo com o protocolo básico (ver Nota 1).
- IL ponto 20 da cultura durante a noite OP50 (passo 1.7) em cada placa de NGM. Permitir que a LB-OP50 para secar (isso deve levar menos de 20 minutos).
Agulhas de injeção:
- Puxe agulhas de injeção de vidro borosilicato capilares usando um P97 flamejante / marrom micropipeta extrator de instrumentos Sutter (ver Figura 1 para a forma de agulha representante).
- Injeção lojaagulhas em um suporte de agulha construído a partir de uma placa de Petri e argila de modelagem (ver 1).
2. Preparação de Worms
O volume estimado pseudocoelomic de um adulto C. elegans é hermafrodita 40-80 picolitros (pessoas com. David Hall). Para obter amostras de fluido extracelular a partir de tal um pequeno reservatório é benéfica para aumentar o total de recursos disponíveis. Nós identificámos três métodos para aumentar grandemente o fluido disponível nos vermes doadores. O nosso método primário explora o fenótipo de clr-1 (e1745) mutantes, o que pode causar um aumento de 10 vezes ou mais do volume de fluido extracelular (Figura 2). Os dois métodos alternativos de utilizar o facto de que as contas de linha germinativa para cerca de um terço do volume total do sem-fim, e a sua remoção, por GLP-1 (RNAi) ou os resultados de ablação a laser, em animais com fluido pseudocoelomic preenchendo o vazio da linha germinal (Figura 2) 2 </ Sup>.
Preparação de vermes doadores usando clr-1 (e1745)
Veja a Figura 3 para clr-1 (e1745) de fluxo de trabalho de ensaio transferência
- Streak as bactérias expressando dsRNA de colónias isoladas em placas de LB + 25μg/mL carbenicilina. Vamos usar bactérias PAL-1 produzindo dsRNA para esta demonstração. Incubar durante a noite a 37 ° C.
- De um LB + mechas 25 ug / mL de carbenicilina placa de pal-1 (RNAi) bactérias, escolher uma única colónia para inocular uma cultura de 3 ml durante a noite em LB suplementado com carbenicilina 25μg/mL.
- Pipetar 15 da cultura durante a noite em placas de 35 milímetros NGM suplementado com 25 | ig / mL de carbenicilina e IPTG 1 mM. Certifique-se de que as bactérias da placa fora do centro da placa. Deixar secar (aproximadamente 20 minutos).
- Fazer 500 mL solução de água sanitária fresco (1:1 5M KOH: NaHypochlorite).
- Pipetar 10 de solução de água sanitária na placa semeada. Seja t certezao colocar a gota de lixívia de distância da mancha bacteriana.
- Para obter uma pequena população, limpa sincronizada de clr-1 (e1745) animais para microinjeção inverso, pegar 2-10 adultos grávidas na gota de lixívia. Os adultos dissolver, deixando limpo, parcialmente encenadas developmentally embriões. Estes embriões eclodem e, em seguida, a larva irá rastrear para a comida.
- Incubar durante quatro dias a 20 ° C.
- Deslocar as placas a 25 ° C durante quatro horas para induzir o inchaço.
- Escolha vermes a uma placa NGM unseeded e dar tempo para limpar as bactérias da cutícula. (Etapa opcional) Lavar worms em M9 durante a transferência para placas NGM.
- Mova Adultos L4/Young worms (YA) destinatário a uma placa de placa NGM unseeded e dar tempo para limpar as bactérias da cutícula. (Etapa opcional) Lavar worms em M9 durante a transferência para placas NGM.
A2) Preparação alternativa de vermes dadores utilizando o GLP-1 (RNAi)
- A partir de uma placa riscadade LB + 25 ^ g / mL de carbenicilina inocular uma cultura durante a noite de 3 mL LB suplementado com carbenicilina com uma única colónia de GLP-1 (RNAi) bactérias. Incubar a 37 ° C durante a noite.
- Pipetar 15 ul de GLP-1 (RNAi) cultura durante a noite numa placa de 35 milímetros NGM suplementado com 25 | ig / mL de carbenicilina e IPTG 1 mM. Incubar à temperatura ambiente durante a noite.
- Transferir L3/L4 cinco animais para os GLP-1 (RNAi) placas. Incubar durante dois dias a 20 ° C. O RNAi alvo de GLP-1 resulta em uma progênie com defeitos proliferação germinativas. A incapacidade de se desenvolver completamente os resultados da linha germinativa no espaço não ocupado que se enche de líquido extracelular. Otimização dos alimentos RNAi para gerar descendência que o progresso para a idade adulta sem germlines proliferativas podem ser necessárias, dependendo.
- Preparamos pal-l (RNAi) placas como nas etapas 2,1-2,3 do protocolo de preparação clr-1 (e1745) verme acima.
- Faça uma solução de lixívia frescação (1:1 5M de KOH: NaHypochlorite).
- Pipetar 10 de solução de água sanitária no pal-1 semeado placa (RNAi). Certifique-se de colocar a gota de água sanitária para longe da mancha bacteriana.
- Transferência de embriões, escolhendo 2-10 grávidas GLP-1 (RNAi) em adultos a gota de água sanitária.
- Incubar durante quatro dias a 20 ° C.
- Escolha vermes a uma placa NGM unseeded 60mm e dar tempo para limpar as bactérias da cutícula. (Etapa opcional) Lavar worms em M9 durante a transferência para placas NGM.
B2) Alternativa preparação de vermes doadores usando ablação a laser germinativa
- Streak as bactérias expressando dsRNA para colônias de solteiro no LB + 25 mg / ml de carbenicilina placas. Vamos usar bactérias PAL-1 produzindo dsRNA para esta demonstração. Incubar durante a noite a 37 ° C.
- A partir de uma placa com carbenicilina inocular uma cultura de 3 ml durante a noite em LB suplementado com 25 | ig / mL de carbenicilina.
- Pipetar 15 de the cultura durante a noite de pal-1-expressando dsRNA bactérias em placas de 35 milímetros NGM suplementado com 25 | ig / mL de carbenicilina e IPTG 1 mM. Deixa-se secar durante a noite.
- Isolar os animais a partir de L1 padrão OP50 placas ablação a laser e o precursor da linha germinal As células somáticas Z1 e Z4 utilizando um protocolo padrão 3.
- Recuperar vermes a laser extirpadas as placas mencionadas PAL-1 RNAi.
- Incubar 3 dias a 20 ° C.
- Escolha vermes para uma placa NGM limpo e dar tempo para limpar as bactérias da cutícula. (Etapa opcional) Lavar worms em M9 durante a transferência para placas NGM.
Preparação de vermes receptoras
- Expelido OP50 para colónias isoladas em placas LB. Incubar durante a noite a 37 ° C.
- A partir da placa de LB inocular uma cultura de 3 ml durante a noite em LB.
- Pipetar 15 da cultura durante a noite em placas de 35 NGM mm. Certifique-se de que as bactérias da placa fora do centro da placa. Deixar secar (cerca de 20 minutos).
- Faça uma solução de água sanitária fresco (1:1 5M KOH: NaHypochlorite).
- Pipetar 10 de solução de água sanitária na placa semeada. Certifique-se de colocar a gota de água sanitária para longe da mancha bacteriana.
- Transferir embriões escolhendo 2-10 adultos grávidos em N2 a gota de lixívia.
- Incubar durante três dias a 20 ° C.
- Mover vermes para uma placa limpa NGM, unseeded e incubar a 20 ° C durante pelo menos 30 minutos.
3. Vampiric Isolamento de fluido extracelular
O protocolo seguinte é específico de um conjunto de micro-injecção, composto por um pli-100 pico-injector, uma agulha fixa realizada em um micromanipulador e um estágio de flutuação em que o sem-fim pode ser deslizado para dentro da agulha. No entanto, a técnica é generalizada para inserir uma agulha de microinjecção vazio em um animal dador, enquanto se mantém uma pressão suficiente para impedir o fluxo de capilar em óleo mineral antes da entrada e celular material enquanto penetrar no tecido do corpo de parede. Enquanto a agulha está no interior de um animal doador pressão é reduzida para permitir o enchimento capilar da agulha de fluido extracelular, que pode então ser movido dentro da agulha para um sem-fim de destinatário e expelido através do aumento da pressão de modo suficiente. A remoção do fluido por acção capilar também pode ser assistido por meio do enchimento, ou a função de aspiração, do pico-injector. Esta técnica generalizada deve ser facilmente adaptável a outros sistemas de micro-injecção, que permitem o controlo da pressão de equilíbrio.
- Ligue o microscópio invertido, o microscópio de dissecação, e pico-injector (Ver Figura 1).
- Gire o botão seletor do Pico injetor para P claro, e verificar que a medição atual está em psi. Esta leitura, a pressão evidente, é que a pressão de entrada e deve ser de aproximadamente 0 psi.
- Verifique a válvula primária no tanque regulador de azoto para se certificar de que a saída está fechada (virar counterclockwise até botão está solto).
- Abra a válvula do tanque principal de nitrogênio. O medidor regulador mais próxima do tanque N2 agora deve ser a pressão interna do tanque.
- Aumentar lentamente a pressão para fora, girando a válvula principal regulador no sentido horário. Monitorar a pressão crescente sobre a pico-injetor (esta é mais preciso do que a leitura da pressão de saída no indicador regulador). Aumentar lentamente a pressão de 100 psi. Não permitir a exceder 105 psi.
- Quando 100 psi é atingido mudar o seletor para P injetar e definir a pressão de injeção para 30 psi usando o botão Pinject.
- Mude o selector de equilíbrio P.
- Coloque uma gota de 15 mL de óleo mineral em seu doador limpo e placas de beneficiários.
- Cubra o seu bloco de injeção de agarose 2% em óleo mineral.
- Carregue o seu agulha micropipeta puxado no suporte e alinhar.
- Usando um microscópio de dissecação, montar um doador e um receptor verme próximos uns dos outros sobre o p agaroseanúncio.
- Vermes posição utilizando baixa ampliação e trazer a agulha para dentro do óleo mineral perto do doador.
- Mover para alta potência e posição da agulha perto de uma cavidade pseudocoelomic.
- Aumente a pressão de equilíbrio para aproximadamente 10 psi. Observe um bujão de óleo mineral, na ponta da agulha.
- Empurrar o verme dentro da agulha para a posição da ponta da agulha no interior da cavidade pseudocoelomic movendo o palco.
- Observe um salto na posição do óleo mineral na ponta da agulha.
- Reduzir a pressão de equilíbrio para permitir a acção capilar para encher a agulha. (Pode-se também utilizar a função de preenchimento para acelerar o processo).
- Depois de recolher o fluido de slides verme longe da agulha.
- Mudar para a ampliação de baixa potência e posição da agulha pelo worm destinatário (não deixar a ponta da agulha para deixar o óleo mineral). [Alternativamente, o suporte de agulha pode ser removida e transferida para o fluido de uma gotícula num tubo de microcentrífuga.]
- Volte para oalta ampliação e mover a agulha para dentro do recipiente sem-fim, deslizando a platina do microscópio.
- Uma vez posicionado no verme destinatário utilizar a injecção (fixada em 35 psi) a função de injectar o fluido pseudocoelomic recolhido do dador.
- Remover a agulha do verme destinatário, deslizando a platina do microscópio na direcção oposta tal como utilizado para introduzir o destinatário.
- Com a agulha para fora do worm, levantar a agulha para longe do bloco de injeção.
- Remova a almofada de injeção e coloque uma gota de M9 sobre os vermes para se recuperar.
- Colocar uma gota de 10 ul M9 em uma placa de ensaio.
- Escolher o verme destinatário no M9 sobre a placa de ensaio.
4. Ensaio RNAi Transferência fenotípica
- Permitir vermes recuperados a crescer durante 24 horas a 20 ° C.
- Remover adultos receptoras, deixando os embriões e os descendentes incubados na placa. Incubar a placa durante mais 24 horas a 20 ° C.
- Progênie pontuação comonão tendo chocado, chocado, mas sendo fenotipicamente mutante, ou ser do tipo selvagem larvas.
Notas
- NGM media é feita em lotes de 1 litro através da adição de 18 g de agar, 2,5 g de bactopeptona, 3 g de cloreto de sódio e H 2 O. Adicionar barra de agitação e autoclave. Após autoclavagem colocar o balão numa placa de agitação e permitir que os meios de comunicação a arrefecer até 60 ° C enquanto se agitava. Depois de os meios de comunicação tiver arrefecido, adicionando 1 ml de colesterol (5 mg / ml em etanol), 1 mL de 1 M de CaCl2, 1 mL de MgSO4 1M, 25 mL de solução tampão de fosfato de potássio (pH 6,0). Se as placas são para ser utilizados para o RNAi NGM é suplementado com 1 mL de IPTG 1 M e 1 mL de 25 mg / mL de carbenicilina, após arrefecimento a 60 ° C. As placas são derramadas em qualquer de 35 mm (3,5 mL de NGM) ou 60 mm (8,5 ml de NGM) placas de Petri.
- Agarose a 2% em água feito. Guarde na geladeira. Fundir e fazer almofadas bem antes do dia do isolamento fluido pseudocoelomic. A secura da almofada faz com que o sem-fim de aderir a almofada,e um mínimo de um dia de secagem ao ar é necessário para as almofadas estar suficientemente seco. Se as almofadas de injeções são muito seco e vermes seus doadores estão ressecando mais rápido do que você pode manipulá-los, você pode adicionar a umidade adicional para almofadas de injeção respirando na almofada antes da adição de óleo mineral. Independentemente da capacidade de trabalhar com rapidez para isolar fluido pseudocoelomic antes de a seca de verme é absolutamente necessário.
- Usamos carbenicilina a todos os passos de preparação de alimentos nossa RNAi para seleccionar para o marcador de resistência à ampicilina. Carbenicilina é um análogo de ampicilina, que é mais estável e resulta em menos colónias satélites do que a ampicilina.
- Usamos as placas que são RNAi NGM suplementado com 1 mM de IPTG e 25 ug / mL de carbenicilina. Os vectores de alimentação de RNAi são na E. HT115 coli que é deficiente para um determinado ARNcd nuclease.
- (Etapa opcional) Nós achamos que, dada uma hora em unseeded doador placas NGM e vermes destinatário fazer um trabalho adequado perder cutículabactérias acoplados que são transportadas a partir das placas de alimentação. Isto não é verdade ainda que em casos em que o alvo RNAi no animal dador interfere com a mobilidade (por exemplo, unc-22 (RNAi)). Por conseguinte, torna-se necessário para ajudar no processo. Para fazer isso, usamos um slide a depressão, com aproximadamente 50 mL de M9. Escolhendo vermes no M9 a partir das placas de alimentação de RNAi, em seguida, sob agitação, com uma palheta padrão de platina verme é suficiente para remover a maioria das bactérias aderentes.
5. Resultados representativos
Apresentados são resultados representativos para a transferência experimental para o fluido extracelular de clr-1 (e1745) vermes cultivados em bactérias expressando dsRNA alvo pal-1. A descendência dos animais doadores morreram e / ou exibidos defeitos padronização posteriores. Em seguida, transferido do fluido extracelulara partir destes animais ao pseudoceloma de RNAi virgens do tipo selvagem vermes. Uma parte da progenia subsequente do animal receptor, em seguida, apresentado os fenótipos esperados pal-1 mutantes (Figura 4). Isto está em contraste com a descendência de animais receptores que receberam fluido extracelular a partir de animais dadores cultivadas em qualquer alimento ou bactérias bacteriano padrão de controlo de RNAi vector que exibidos apenas os níveis de fundo de letalidade (Figura 4). Enquanto a descendência de receptores de fluido extracelular a partir de animais dadores submetidos RNAi mostram um aumento significativo na frequência de fenótipos dsRNA induzidas, a penetrância não é tão forte como a descendência dos animais dadores, em que quase 100% de die progénie como embriões não eclodidos, e apenas raras, animais gravemente deformados eclodir.
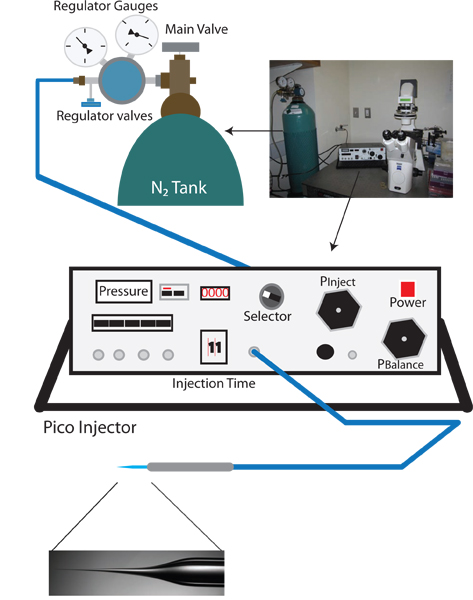
Figura 1. Vampiric configuração de injecção reversa. O fo configuração apropriadara vampiric microinjecção configuração inversa é semelhante a um padrão de C. elegans rig microinjecção, e inclui um microscópio de dissecação, um microscópio invertido com os objectivos de 10X e 40X, de uma fase móvel para o posicionamento, e um micromanipulador com o suporte de agulha de injecção. Além disso, um puxador de agulha para a preparação de agulhas de injeção também é necessário. Exclusivo para o protocolo de microinjeção reversa de um pico-injector que permite o controle preciso da pressão de equilíbrio (por exemplo, Warner Instruments PLI-100) é necessário.
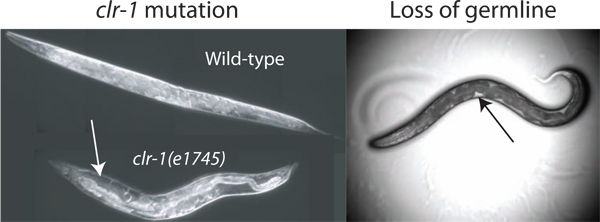
Figura 2. Melhoramento do volume pseudocoelomic. O volume de fluido disponível para pseudocoelomic isolada é insuficiente para o ensaio do tipo selvagem em animais. O volume pode ser aumentado por perturbar a regulação do equilíbrio osmótico através de mudança da temperatura de clr-1 (e1745) animais, resultando na acumulação de líquido evidente pseudocoelomic (seta branca). Além disso a perda da gónada por ablação a laser ou de GLP-1 (RNAi), permite o acesso ao fluido extracelular (perda por ablação a laser é mostrado). O fluido é mais prontamente disponível observados como manchas claras entre o intestino e escuro a parede do corpo (seta preta), embora o volume total disponível é muito menor do que a encontrada em clr-1 (e1745) animais cultivadas na temperatura restritiva.
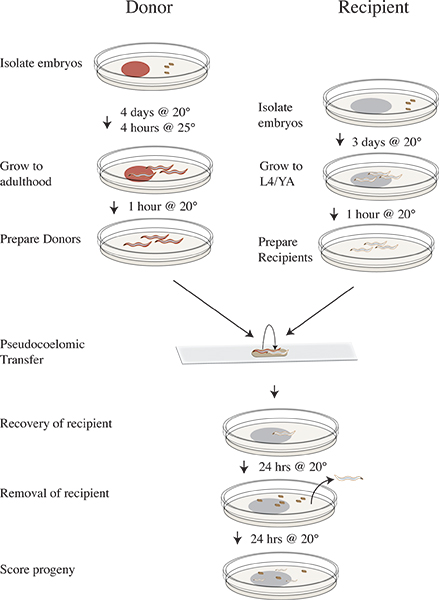
Figura 3. Isolamento Vampiric e cronograma protocolo de transferência. Quatro dias antes da transferência experimento isolar clr-1 (e1745) os embriões em placas com RNAi comida e incubar a 20 ° C. Três dias antes isolar embriões receptores N2 em OP50. No dia da experiência deslocar as placas de dadores a 25 ° C durante quatro horas. Remover os dadores após a incubação a 25 ° C para placas limpas falta de alimentos e mudança de 20 ° C. Mova os animais receptores para limpar placasfalta de alimentos e continuar a incubação a 20 ° C. Executar experimento de transferência e recuperar vermes receptoras no OP50 placas e incubar a 20 ° C. Remover os animais receptores, após 24 horas a 20 ° C. Incubar descendência destinatário durante 24 horas a 20 ° C. Progênie pontuação como do tipo selvagem, mutante, ou unhatched.
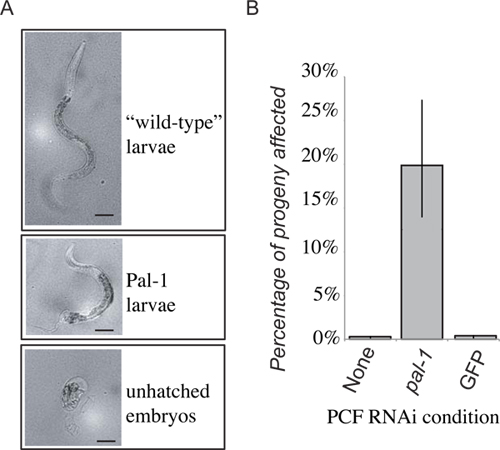
Figura 4. Resultados representativos. A perda da função de PAL-1 do receptor, vai resultar em letalidade embrionária, ou perda distintivo de desenvolvimento posterior (A). 48 horas após a transferência PCF descendência colocado dentro das primeiras 24 horas são pontuados como larvas ou de tipo selvagem, Pal-1, larvas ou embriões não eclodidos. A frequência de embriões não eclodidos e fenotipicamente Pal-1 larvas são combinados para dar uma medida de pal-1 (RNAi) fenótipos de transferência induzidas. A recepção de fluido pseudocoelomic de animais cultivadas em PAL-1 dsRNA alimentos produz uma indução forte de associadofenótipos invisíveis em receptores de controlo de transferência (B).
Discussão
Nós apresentamos aqui um novo método que permite o isolamento e caracterização de fluido extracelular a partir do modelo de organismo C. elegans. A técnica começa com a manipulação genética ou física de vermes dos doadores para aumentar o seu volume total de fluido extracelular. Fluido extracelular é então isolado utilizando uma técnica de micro-injecção modificada. Os sem-fins são montados por microinjecção utilizando almofadas de agarose secos para manter os vermes ainda durante o procedimen...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Gostaríamos de reconhecer a natureza colaborativa do laboratório de Hunter, e agradecê-los para a discussão útil e assistência que fez do desenvolvimento desta técnica possível e divertido. Gostaríamos de agradecer a Nigel Delaney eo Caenorhabditis Genética Centro de verme e cepas bacterianas. Este trabalho foi financiado pelo National Institutes of Health GM089795 subvenção para CPH.
Materiais
Dia Prep Worm Prep material
| Name | Company | Catalog Number | Comments |
| -7 Ou antes | Manter limpo, bem alimentado Clr-1 (e1745) E N2 vermes | Faça tapetes de injeção, placas NGM, NGM + Carb / placas de IPTG, OP50 ações LB | |
| -6 | Streak fora RNAi comida na LB + Carb | ||
| -5 | Inocular 3 ml durante a noite com RNAi alimentos | ||
| -4 | Mover embriões para RNAi placa | Semente RNAi placa | |
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | Mudança vermes para 25 por 4 horas | Faça placas de ensaio | |
| Mover vermes para limpar as placas NGM | |||
| Vampiric transferência | |||
| Recuperar destinatário | |||
| 1 | Remover destinatário da transferência | ||
| 2 | Progênie Pontuação |
Quadro 1. Cronograma de preparação do material.
Equipamentos Empresa Número de catálogo Clr-1 (e1745) II 9 GLP-1 RNAi vetor 10 PAL-1 RNAi vetor 11| Pressão picolitros Injector | Warner Instruments | 65-0001 (PLI-100) |
| Flaming / Brown micropipeta Puller | Sutter Instruments | P97 |
| Axiovert 200 | Zeiss | |
| Reagentes | ||
| Óleo Mineral | EM Science | MX1560-1 |
| 22x50 no 1 ½ tampa de vidro | Corning | |
| SeaKem LE Agarose | Lonza | 50004 |
| Vidro borosilicato Capilares | Mundo Precisões Instruments | 1B100F-4 |
| Solução de hipoclorito de sódio (5% de cloro disponível) | JT Baker | 9416-01 |
| C. elegans E cepas bacterianas | ||
| O Centro de Genética Caenorhabditis (CGC) | CB3241 | |
| Fonte de Biociências (Ahringer Biblioteca Alimentação) | F02A9.6 | |
| PHC187 | ||
| OP50-GFP 5 | O Centro de Genética Caenorhabditis (CGC) | OP50-GFP |
| YFP E. coli 4 | MC4100-YFP | |
Tabela 2. Reagentes e equipamentos específicos.
Referências
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e., Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados