Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolation vampirique de fluide extracellulaire d'
Dans cet article
Résumé
L'organisme modèle C. elegans Utilise un fluide pseudocoelomic comme un système circulatoire passive. Dosage direct de ce fluide n'a pas été possible auparavant. Ici, nous présentons une nouvelle technique pour analyse directement l'espace extracellulaire, et utiliser les signaux silencieux systémiques lors d'une réponse ARNi comme une preuve de principe par exemple.
Résumé
Le maïs génétiquement docile organisme modèle C. elegans a fourni des indications sur une multitude de questions biologiques, a permis par son temps de génération court, la facilité de croissance et de petite taille. Cette petite taille, cependant, a refusé un certain nombre d'approches techniques trouvées dans des systèmes modèles d'autres. Par exemple, les transfusions sanguines dans les systèmes mammaliens et des techniques de greffage dans les plantes permettent de poser des questions de composition du système circulatoire et de signalisation. Le système circulatoire du ver, le pseudocoelom, a été jusqu'à récemment impossible de doser directement. Pour répondre aux questions de signalisation intercellulaire et le système circulatoire composition C. chercheurs elegans ont traditionnellement recours à l'analyse génétique, cellulaire / tissulaire spécifique de sauvetage, et l'analyse de la mosaïque. Ces techniques fournissent un moyen pour déduire ce qui se passe entre les cellules, mais ne sont pas universellement applicable dans l'identification et la caractérisation des molécules extracellulaires. Nous présentons ici un newly technique mis au point pour doser le fluide directement pseudocoelomic de C. elegans. La technique commence soit par manipulation génétique ou physique pour augmenter le volume de fluide extracellulaire. Ensuite, les animaux sont soumis à une technique de micro-injection vampirique inverse en utilisant une plate-forme de micro-injection qui permet bien de commande de pression d'équilibre. Après isolement du liquide extracellulaire, le liquide recueilli peut être analysée par transfert dans d'autres animaux ou par des moyens moléculaires. Pour démontrer l'efficacité de cette technique, nous présentons une approche détaillée pour doser un exemple spécifique de molécules de signalisation extracellulaire, à long ARN double brin lors d'une réponse systémique ARNi. Bien que la caractérisation de RNAi systémique est une preuve de principe par exemple, nous voyons cette technique comme étant adaptable pour répondre à une variété de questions de la composition du système circulatoire et la signalisation.
Protocole
1. Préparation des matériaux
Le matériel nécessaire pour la microinjection inverse vampirique est similaire à celle requise pour les techniques de micro-injection standard utilisés pour faire transgénique C. elegans souches 1. Bien que certains réactifs (plaques de dosage, par exemple) sont faites le jour du transfert expérimental, la plupart des matériaux doit être préparée de façon coordonnée sur une période de 8 jours (voir le tableau 1 pour une table de temps). En tant que tel, il est important de planifier soigneusement en utilisant cette technique (pour les réactifs et le matériel nécessaires cf. tableau 2).
Coussinets d'injection:
- Faire une solution à 2% d'agarose dans H 2 O et de la chaleur jusqu'à dissolution. Aliquote en fractions aliquotes de 1 ml dans des tubes de 1,5 ml à centrifuger et conserver à 4 ° C.
- Étalez 22 x 50 mm lamelles sur une paillasse avec leurs bords légèrement en saillie du bord de paillasse pour faciliter les ramasser rapidement.
- Pokch petit trou dans le couvercle du microtube (utiliser une punaise) pour permettre la ventilation. Placer le tube dans un bécher de 15 ml à environ 5 ml d'eau, et à micro-ondes pour faire fondre (environ 35 secondes).
- À l'aide d'une pipette Pasteur et le lieu ampoule une goutte (environ 35 ul) de la partie fondue d'agarose sur une vitre de protection et de placer immédiatement une deuxième lamelle sur la goutte à un angle de 90 ° par rapport à la première. Répétez l'opération pour plusieurs lamelles autres.
- Après la solidification de l'agarose, enlever le verre de protection et permettre le tampon sécher à l'air pendant une nuit totalement (si nécessaire plus tôt, les lames peuvent être placés dans un four à 50-80 ° C pendant 15-30 minutes).
- Pads peuvent ensuite être stockés dans une boîte en verre couvercle à la température ambiante indéfiniment.
Les plaques d'essai:
Pour le dosage de la létalité embryonnaire associée à pal-1 ARNi, la préparation des plaques d'essai doit être effectué le jour de l'expérience vampirique. L'objectif est d'have une pelouse minimale bactérienne tout en n'étant pas mourir de faim vos vers de terre. Une pelouse trop épais fait marquant Pal-1 larve extrêmement difficile car les petits animaux translucides L1 déformés peuvent facilement être perdus dans les aliments. La préparation des plaques doit être optimisé pour marquer le phénotype d'intérêt.
- Préparer OP50: 5 ml de graines de bouillon LB avec une seule colonie OP50 cultivées sur des plaques de gélose LB. Incuber la OP50 à 37 ° C pendant la nuit tout en agitant, puis stocker à 4 ° C.
- Préparer 35 planches NGM mm selon le protocole de base (voir note 1).
- Spot de 20 ul de la nuit OP50 culture (étape 1.7) sur chaque plaque NGM. Laissez le LB-OP50 à sécher (cela devrait prendre moins de 20 minutes).
Aiguilles d'injection:
- Tirer aiguilles d'injection du verre borosilicate capillaires à l'aide d'une flamme P97 / brun micropipette extracteur d'instruments Sutter (voir la figure 1 pour une forme d'aiguille représentant).
- Injection magasinaiguilles dans un porte-aiguille construit à partir d'une boîte de Petri et la pâte à modeler (voir 1).
2. Préparation de Worms
Le volume estimé pseudocoelomic d'un adulte C. elegans hermaphrodite est de 40-80 picolitres (communication personnelle. David Hall). Pour obtenir des échantillons de fluide extracellulaire d'un tel petit réservoir, il est avantageux d'augmenter la ressource totale disponible. Nous avons identifié trois méthodes pour augmenter considérablement le fluide disponible dans les vers des bailleurs de fonds. Notre principale méthode exploite le phénotype des clr-1 (e1745) des mutants, ce qui peut provoquer une augmentation de 10 fois ou plus du volume de liquide extracellulaire (figure 2). Les deux méthodes utilisent le fait que les comptes germinales pour près d'un tiers du volume total du ver et sa suppression par glp-1 (ARNi) ou les résultats d'ablation au laser chez les animaux avec du liquide pseudocoelomic combler le vide lignée germinale (figure 2) 2 </ Sup>.
Préparation des donateurs vers l'aide clr-1 (e1745)
Voir la figure 3 pour clr-1 (e1745) flux essai de transfert
- Streak les bactéries exprimant ARNdb pour des colonies isolées sur des plaques LB + 25μg/mL carbénicilline. Nous allons utiliser pal-1 des bactéries productrices d'ARNdb pour cette démonstration. Incuber une nuit à 37 ° C.
- D'un LB strié + 25 pg / ml de carbénicilline plaque de pal-1 (ARNi), les bactéries, choisissez une seule colonie pour inoculer une culture de 3 mL nuit dans LB supplémenté avec 25μg/mL carbénicilline.
- Pipette 15 ul de culture d'une nuit sur des plaques NGM 35mm additionné de 25 pg / ml de carbénicilline et 1 mM d'IPTG. Assurez-vous que la plaque des bactéries hors centre de la plaque. Laisser sécher (environ 20 minutes).
- Assurez-500 Solution ul eau de Javel fraîche (1:1 5M KOH: NaHypochlorite).
- Pipeter 10 ul d'eau de Javel sur la plaque ensemencée. Soyez sûr que to placer la gouttelette eau de Javel loin de la tache bactérienne.
- Pour obtenir un petit, propre, la population synchronisée des clr-1 (e1745) pour les animaux microinjection inverse, choisir 2-10 adultes gravides dans la goutte l'eau de Javel. Les adultes se dissolvent, laissant propre, partiellement mise en scène du développement des embryons. Ces embryons éclosent et les larves rampent à la nourriture.
- Incuber pendant quatre jours à 20 ° C.
- Déplacer les plaques à 25 ° C pendant quatre heures pour induire un gonflement.
- Choisissez des vers sur une plaque non ensemencée NGM et laisser le temps de déguerpir les bactéries de la cuticule. (ÉTAPE FACULTATIVE) Rincer les vers à M9 pendant le transfert des plaques NGM.
- Déplacez L4/Young vers adultes bénéficiaires (YA) sur une plaque non ensemencée NGM plaque et laisser le temps de déguerpir les bactéries de la cuticule. (ÉTAPE FACULTATIVE) Rincer les vers à M9 pendant le transfert des plaques NGM.
A2) Autre préparation de vers à l'aide des bailleurs de fonds GLP-1 (ARNi)
- Partir d'une plaque striéede LB + 25 pg / ml de carbénicilline inoculer une culture de nuit de 3 ml LB supplémenté avec de la carbénicilline avec une seule colonie de GLP-1 (ARNi) des bactéries. Incuber à 37 ° C pendant la nuit.
- Pipette 15 ul de GLP-1 (ARNi) culture d'une nuit sur une plaque NGM 35 mm additionné de 25 pg / ml et 1 mM IPTG carbénicilline. Incuber à température ambiante pendant une nuit.
- Transfert de cinq L3/L4 animaux aux GLP-1 (ARNi) plaques. Incuber pendant deux jours à 20 ° C. L'ARNi ciblant le GLP-1 dans la descendance des résultats avec des défauts de prolifération des lignées germinales. L'incapacité de développer pleinement les résultats germinales dans l'espace inoccupé qui se remplit de liquide extracellulaire. Optimisation de la nourriture ARNi afin de générer une descendance à l'âge adulte sans progrès lignées germinales prolifération peut être nécessaire en fonction.
- Ont préparé pal-l (ARNi) plaques comme dans les étapes 2.1 à 2.3 du protocole clr-1 (e1745) préparation ver-dessus.
- Faire un solution fraîche eau de Javeltion (1:1 KOH 5M: NaHypochlorite).
- Pipeter 10 ul d'eau de Javel sur la tête de série pal-1 (ARNi) plaque. Assurez-vous de placer la gouttelette eau de Javel loin de la tache bactérienne.
- Transfert d'embryons en choisissant 2-10 gravides GLP-1 (ARNi) adultes dans la gouttelette eau de Javel.
- Incuber pendant quatre jours à 20 ° C.
- Choisissez des vers sur une plaque non ensemencée NGM 60mm et laisser le temps de déguerpir les bactéries de la cuticule. (ÉTAPE FACULTATIVE) Rincer les vers à M9 pendant le transfert des plaques NGM.
B2) Alternative préparation des bailleurs de fonds vers l'aide de l'ablation laser lignée germinale
- Streak les bactéries exprimant ARNdb pour des colonies isolées sur LB + 25 pg / ml de carbénicilline plaques. Nous allons utiliser pal-1 des bactéries productrices d'ARNdb pour cette démonstration. Incuber une nuit à 37 ° C.
- Partir d'une plaque avec de la carbénicilline inoculer une culture mL 3 nuit dans du milieu LB additionné de 25 pg / ml de carbénicilline.
- Pipette 15 ul d'ee culture de nuit de pal-1 ARNdb exprimer bactéries sur 35 planches NGM mm additionné de 25 pg / ml et 1 mM IPTG carbénicilline. Laisser sécher une nuit.
- Isoler les animaux L1 à partir de standards OP50 plaques et laser ablation de la lignée germinale somatique précurseur de cellules Z1 et Z4 en utilisant un protocole standard 3.
- Récupérer les vers ablation laser sur les plaques mentionnées ci-dessus ARNi pal-1.
- Incuber pendant 3 jours à 20 ° C.
- Choisissez des vers sur une plaque de NGM propre et laisser du temps pour effacer les bactéries de la cuticule. (ÉTAPE FACULTATIVE) Rincer les vers à M9 pendant le transfert des plaques NGM.
Préparation des bénéficiaires vers
- Strie sur OP50 pour des colonies isolées sur des plaques LB. Incuber une nuit à 37 ° C.
- De la plaque LB inoculer une culture de 3 mL nuit dans du milieu LB.
- Pipette 15 ul de la culture d'une nuit sur 35 planches NGM mm. Assurez-vous que la plaque des bactéries hors centre de la plaque. Laisser sécher (environ 20 minutes).
- Préparer une solution fraîche eau de Javel (1:1 5M KOH: NaHypochlorite).
- Pipeter 10 ul d'eau de Javel sur la plaque ensemencée. Assurez-vous de placer la gouttelette eau de Javel loin de la tache bactérienne.
- Transfert d'embryons en choisissant 2-10 adultes gravides N2 dans la gouttelette eau de Javel.
- Incuber pendant trois jours à 20 ° C.
- Déplacer vers un propre, plaque non ensemencée NGM et incuber à 20 ° C pendant au moins 30 minutes.
3. Isolation vampirique du liquide extracellulaire
Le protocole suivant est spécifique à une micro-injection mise en place d'un pli constitué-100 pico-injecteur, une aiguille fixe maintenu dans un micromanipulateur et une phase variable dans lequel la vis sans fin peut coulisser dans l'aiguille. Cependant, la technique généralisée consiste à insérer une aiguille dans une micro-injection vide animal donneur, tout en maintenant une pression suffisante pour empêcher capillaire en flux de l'huile minérale avant l'entrée cellulaire et maTÉRIAU en pénétrant le tissu corporel de paroi. Tandis que l'aiguille se trouve à une pression animal donneur est réduite pour permettre un remplissage capillaire de l'aiguille avec le liquide extracellulaire, qui peut alors être déplacé dans l'aiguille à une vis sans fin destinataire et expulsé par augmentation de la pression suffisamment. L'enlèvement du fluide par action capillaire peut également être assistée par l'aide du remplissage, ou d'aspiration, en fonction de la pico-injecteur. Cette technique devrait être généralisée facilement adaptable à d'autres systèmes de micro-injection qui permettent le contrôle de la pression d'équilibre.
- Allumez le microscope inversé, le microscope de dissection, et pico-injecteur (voir la figure 1).
- Tournez le bouton de sélection de l'injecteur Pico à P claire, et vérifier que la mesure de courant est en psi. Cette lecture, la pression clair, c'est la pression d'entrée et doit être d'environ 0 psi.
- Vérifier la vanne principale sur le régulateur du réservoir d'azote pour faire en sorte que la sortie est fermée (tournez counterclockwise jusqu'à ce que le bouton est relâché).
- Ouvrez la vanne d'azote du réservoir principal. La jauge de régulateur plus proche du réservoir N2 doit maintenant lire la pression interne du réservoir.
- Augmenter lentement la pression en tournant la valve de régulation principale aiguilles d'une montre. Surveiller la pression croissante sur les pico-injecteur (ce qui est plus précise que la lecture de la pression de sortie sur le manomètre du régulateur). Augmenter lentement la pression à 100 psi. NE LAISSEZ PAS dépasser 105 psi.
- Lorsque 100 psi est atteint positionner le sélecteur sur P injecter et régler la pression d'injection à 30 psi en utilisant le bouton Pinject.
- Mettez le sélecteur sur l'équilibre P.
- Placez une goutte de 15 ul d'huile minérale sur votre propre donateurs et bénéficiaires plaques.
- Couvrez votre pad 2% d'agarose injection dans l'huile minérale.
- Chargez votre aiguille micropipette tiré dans la porte et l'aligner.
- À l'aide d'un microscope à dissection, monter 1 donneur et receveur vis sans fin 1 près de l'autre sur la p agaroseannonce.
- Vers la position en utilisant un faible grossissement et amener l'aiguille dans l'huile minérale à proximité du donneur.
- Aller à haute puissance et position de l'aiguille à proximité d'une cavité pseudocoelomic.
- Augmenter la pression d'équilibre à environ 10 psi. Noter un bouchon d'huile minérale à la pointe de l'aiguille.
- Pousser la vis sans fin dans l'aiguille afin de positionner la pointe de l'aiguille dans la cavité pseudocoelomic par déplacement de la platine.
- Noter un saut dans la position de l'huile minérale dans la pointe de l'aiguille.
- Réduire la pression d'équilibre pour permettre une action capillaire pour remplir l'aiguille. (On peut aussi utiliser la fonction de remplissage pour accélérer le processus).
- Après la collecte de la vis sans fin coulisseau de fluide de l'aiguille.
- Mettez à faible grossissement et la position de l'aiguille par le ver destinataire (NE LAISSEZ PAS LA POINTE AIGUILLE DE QUITTER L'huile minérale). [Variante, le porte-aiguille peut être retiré et le fluide transféré à une gouttelette dans un tube de microcentrifugation.]
- Revenez àgrossissement élevé et déplacer l'aiguille dans la vis sans fin en faisant glisser le destinataire platine du microscope.
- Une fois positionné dans le ver destinataire utilisent l'injection (fixée à 35 psi) fonction pour injecter le fluide pseudocoelomic prélevées chez le donneur.
- Retirez l'aiguille du ver destinataire en faisant glisser la platine du microscope dans le sens opposé à celui utilisé pour entrer le destinataire.
- Avec l'aiguille sur du ver, relevez l'aiguille loin de la plaquette d'injection.
- Retirez le tampon d'injection et déposer une goutte de M9 sur les vers à récupérer.
- Placez une goutte de 10 ul de M9 sur une plaque d'essai.
- Choisissez le ver destinataire dans le M9 sur la plaque d'essai.
4. Le dosage de l'ARNi transfert phénotypique
- Laissez les vers récupérées à croître pendant 24 heures à 20 ° C.
- Retirez les adultes bénéficiaires, laissant les embryons et les descendants éclos sur la plaque. Incuber la plaque pendant 24 heures à 20 ° C.
- Note que la descendancen'ayant pas éclos, éclos, mais étant phénotypiquement mutant ou de type sauvage étant larves.
Remarques
- NGM support est faite en 1-litre lots en ajoutant 18 g d'agar-agar, 2,5 g de bactopeptone, 3 g de chlorure de sodium et H 2 O. Ajouter un barreau d'agitation et en autoclave. Après l'autoclavage, mettre le ballon sur une plaque d'agitation et de permettre aux médias de refroidir à 60 ° C sous agitation. Une fois le support est refroidi, ajouter 1 ml de cholestérol (5 mg / ml dans l'éthanol), 1 ml de CaCl2 1 M, 1 ml de 1M MgSO 4, 25 ml de tampon phosphate de potassium (pH 6,0). Si les plaques sont à utiliser pour l'ARNi NGM est complété avec 1 ml d'IPTG 1M et 1 ml de 25 mg / ml de carbénicilline après refroidissement à 60 ° C. Les plaques sont déversés dans les deux 35 mm (3,5 ml de NGM) ou 60 mm (8,5 ml de NGM) boîtes de Pétri.
- 2% d'agarose en fait de l'eau. Stocker dans le réfrigérateur. Faire fondre et faire des blocs bien avant le jour de l'isolement fluide pseudocoelomic. La sécheresse de la plaquette fait le ver se conformer à la plage,et un minimum d'une journée de séchage à l'air est nécessaire pour les pads pour être suffisamment sec. Si les plaquettes injections sont trop sèches et vos vers de terre donateurs dessiccation plus rapide que vous pouvez les manipuler, vous pouvez ajouter de l'humidité supplémentaire aux plots d'injection en respirant sur le pavé avant d'ajouter de l'huile minérale. Quelle que soit la capacité de travailler rapidement pour isoler fluide pseudocoelomic avant le séchage à vis sans fin est absolument nécessaire.
- Nous utilisons carbénicilline à toutes les étapes de notre préparation de la nourriture RNAi pour sélectionner le marqueur de résistance à l'ampicilline. Carbénicilline est un analogue de l'ampicilline qui est plus stable et les résultats dans les colonies satellites de moins que l'ampicilline.
- Nous utilisons des plaques ARNi qui sont NGM complétées par 1 mM d'IPTG et 25 pg / ml de carbénicilline. Les vecteurs d'alimentation ARNi sont en E. HT115 coli souche qui est déficiente pour une nucléase spécifique d'ARNdb.
- (Facultatif) Nous trouvons que, compte tenu d'une heure sur les plaques NGM donateurs et bénéficiaires non ensemencée vers faire un travail adéquat perdre cuticulebactéries liées qui se déroule sur des plaques d'alimentation. Ce n'est pas vrai que dans le cas où la cible ARNi chez l'animal donneur interfère avec la mobilité (par exemple unc-22 (ARNi)). Il devient donc nécessaire d'aider dans le processus. Pour ce faire, nous utilisons une lame de dépression avec environ 50 ul de M9. Reprenant les vers dans le M9 à partir des plaques d'alimentation ARNi, puis en agitant avec un pic ver platine standard est suffisant pour éliminer la plupart des bactéries adhérentes.
5. Les résultats représentatifs
Présenté résultats sont représentatifs pour le transfert expérimental de fluide extracellulaire d'clr-1 (e1745) vers cultivées sur des bactéries exprimant ARNdb ciblant pal-1. La descendance des animaux donneurs décédés et / ou présentaient des défauts de structuration postérieures. Nous avons ensuite transféré liquide extracellulairede ces animaux à l'pseudocoelom d'ARNi naïfs de type sauvage vers. Une partie de la descendance ultérieure de l'animal receveur alors affiché les phénotypes attendus pal-1 mutant (Figure 4). Ceci est en contraste à la descendance des animaux receveurs ayant reçu du liquide extracellulaire d'animaux donneurs cultivées soit sur la nourriture bactérienne standard ou ARNi contrôle des bactéries vecteurs qui manifestaient des niveaux de fond que de la létalité (figure 4). Alors que la descendance des bénéficiaires de liquide extracellulaire provenant d'animaux soumis à des bailleurs de fonds ARNi montrent une augmentation significative de la fréquence des phénotypes induits ARNdb, la pénétrance n'est pas aussi forte que dans la descendance des animaux donneurs », où près de 100% de la descendance meurent comme des embryons non éclos, et que rares, les animaux sont gravement déformés éclore.
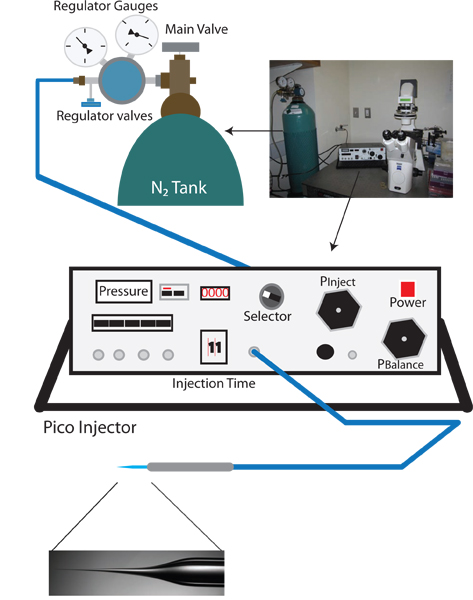
Figure 1. Configuration vampirique rétro-injection. La fo configuration appropriéera vampirique configuration microinjection inverse est semblable à un standard C. elegans gréement microinjection, et comprend un microscope à dissection, d'un microscope inversé avec des objectifs 10x et 40x, un étage déplaçable pour le positionnement, et un micromanipulateur avec porte-aiguille d'injection. En outre, un extracteur d'aiguilles pour la préparation d'aiguilles d'injection est également nécessaire. Unique au protocole de micro-injection inverse d'un pico-injecteur qui permet un contrôle précis de la pression d'équilibre (par exemple Warner Instruments PLI-100) est nécessaire.
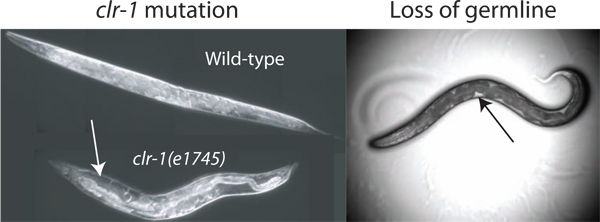
Figure 2. Amélioration du volume pseudocoelomic. Le volume de fluide pseudocoelomic disponibles pour l'isolement est insuffisant pour le dosage de type sauvage animaux. Le volume peut être augmenté en perturbant la régulation de l'équilibre osmotique à travers décalage de la température de la clr-1 (e1745) les animaux, provoquant une accumulation de liquide clair pseudocoelomic (flèche blanche). En outre, la perte de la gonade par ablation laser ou GLP-1 (ARNi) permet l'accès à un fluide extracellulaire (perte par ablation au laser est représenté). Le fluide disponible est plus facilement observable sous forme de taches claires entre l'intestin sombre et la paroi du corps (flèche noire), bien que le volume total disponible est bien inférieure à celle trouvée dans clr-1 (e1745) les animaux adultes à la température restrictive.
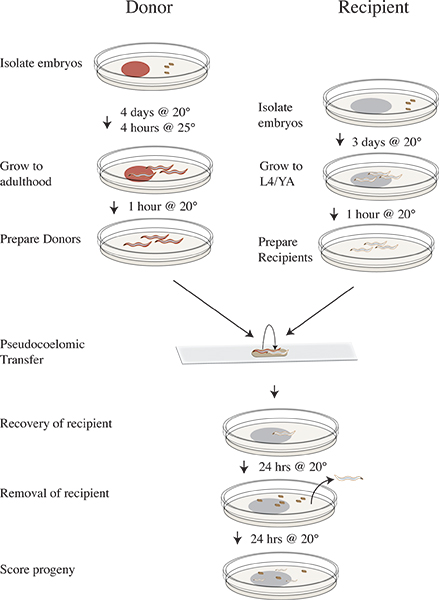
Figure 3. Vampirique isolement et le calendrier protocole de transfert. Quatre jours avant le transfert expérimentation isoler clr-1 (e1745) embryons donateurs sur des plaques avec des ARNi alimentaire et incuber à 20 ° C. Trois jours avant d'isoler des embryons receveurs N2 sur OP50. Le jour de l'expérience de déplacer les plaques donateurs à 25 ° C pendant quatre heures. Retirez les bailleurs de fonds après le 25 ° C d'incubation des plaques blanches qui n'ont pas la nourriture et le passage à 20 ° C. Déplacer les animaux receveurs pour nettoyer les plaquesmanquent de nourriture et de poursuivre l'incubation à 20 ° C. Faire un essai de transfert et de récupérer des vers sur les bénéficiaires OP50 plaques et incuber à 20 ° C. Retirer les animaux receveurs après 24 heures à 20 ° C. Incuber descendance destinataire pendant 24 heures à 20 ° C. Score descendance de type sauvage, mutant ou non éclos.
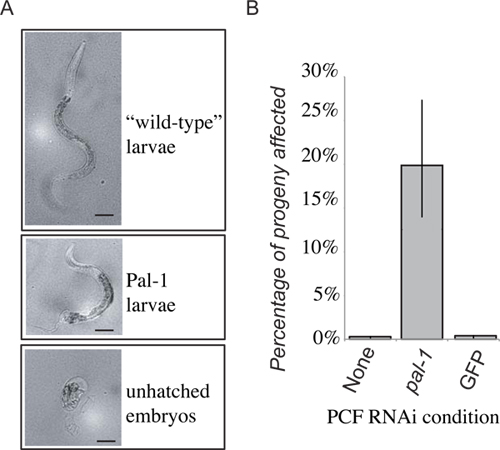
Figure 4. Résultats représentatifs. La perte de fonction PAL-1 dans le récipient entraîne une létalité embryonnaire, ou la perte de caractère distinctif de développement postérieur (A). 48 heures après le transfert de la descendance PCF déposée dans les 24 premières heures sont notées comme étant des larves de type sauvage, Pal-1 larves ou des embryons non éclos. La fréquence des embryons non éclos et phénotypiquement Pal-1 larves sont combinés pour donner une mesure de pal-1 (ARNi) phénotypes induits par le transfert. Réception d'un fluide pseudocoelomic des animaux cultivés sur PAL-1 ARNdb produit alimentaire une forte induction de l'associéphénotypes invisibles chez les receveurs de transfert de contrôle (B).
Discussion
Nous avons présenté ici une nouvelle méthode qui permet l'isolement et la caractérisation des liquides extracellulaires de l'organisme modèle C. elegans. La technique commence par la manipulation génétique ou physique de vers donateurs à accroître leur volume total du liquide extracellulaire. Fluide extracellulaire est ensuite isolé en utilisant une technique de micro-injection modifiée. Les vers sont montés pour la micro-injection à l'aide d'agarose tampons secs pour emprisonner le...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous tenons à souligner la nature collaborative du laboratoire de Hunter, et les remercier pour le débat utile et d'assistance qui fait du développement de cette technique possible et amusant. Nous tenons à remercier Nigel Delaney et le Caenorhabditis Genetics Center for ver et souches bactériennes. Ce travail a été soutenu par les Instituts nationaux de la santé GM089795 subvention à CPH.
matériels
Journée ARNi sur la nourriture sur LB + Carb
| Name | Company | Catalog Number | Comments |
| -7 Avant ou | Maintenir propres, bien nourris Clr-1 (e1745) N2 et les vers | Assurez-tampons d'injection, plaques NGM, NGM + Carb / plaques IPTG, OP50 actions LB | |
| -6 | |||
| -5 | Inoculer 3 mL nuit avec ARNi alimentaire | ||
| -4 | Déplacez embryons à l'ARNi plaque | Graines ARNi plaque | |
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | Déplacer vers à 25 pendant 4 heures | Faire des plaques d'essai | |
| Déplacer vers pour nettoyer les plaques NGM | |||
| Vampirique transfert | |||
| Récupérer destinataire | |||
| +1 | Retirer destinataire du transfert | ||
| +2 |
Tableau 1. Calendrier Préparation du matériel.
Matériel Société Clr-1 (e1745) II 9 Glp-1 ARNi vecteur 10 Pal-1 ARNi vecteur 11| Pression picolitres injecteur | Warner Instruments | 65-0001 (PLI-100) |
| Flaming / Brown micropipette extracteur | Sutter Instruments | P97 |
| Axiovert 200 | Zeiss | |
| Réactifs | ||
| EM Science | MX1560-1 | |
| 22x50 n ° 1 ½ verre Couvercle | Corning | |
| SeaKem LE Agarose | Lonza | 50004 |
| Borosilicate Glass capillaires | Précisions du monde Instruments | 1B100F-4 |
| Solution d'hypochlorite de sodium (5% de chlore disponible) | JT Baker | 9416-01 |
| C. elegans Souches bactériennes et | ||
| Le Caenorhabditis Genetics Center (CGC) | CB3241 | |
| Source Bioscience (Bibliothèque alimentation Ahringer) | F02A9.6 | |
| PHC187 | ||
| OP50-GFP 5 | Le Caenorhabditis Genetics Center (CGC) | OP50-GFP |
| YFP E. coli 4 | MC4100-YFP | |
Tableau 2. Réactifs et équipements spécifiques.
Références
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e., Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon