A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד ערפדים של נוזלים מתאיים
In This Article
Summary
אורגניזם המודל ג elegans משתמש בנוזל pseudocoelomic כמערכת דם פסיבית. בדיקה ישירה של הנוזל הזה לא הייתה אפשרית בעבר. כאן אנו מציגים שיטה חדשנית לבדיקה ישירות חלל החוץ התאי, ולהשתמש באותות השתקה מערכתיים בתגובת RNAi כהוכחה לדוגמא עיקרון.
Abstract
המודל גנטי הצייתן האורגניזם ג elegans ספק תובנה לתוך מספר עצום של שאלות ביולוגיות, מופעל על ידי זמן הדור הקצר שלו, קלויות גידול וגודל קטן. גודל קטן זה, אם כי, לא מרשה מספר גישות טכניות שנמצאו במערכות מודל אחרות. לדוגמה, עירויי דם במערכות יונקים וטכניקות השתלה בצמחים מאפשרים לשאול שאלות של הרכב דם ומערכת איתות. מערכת הדם של התולעת, pseudocoelom, יש לו עד לאחרונה היה בלתי אפשרי לבדיקה באופן ישיר. כדי לענות על שאלות של איתות אינטר ומערכת דם ההרכב ג חוקרי elegans הפכו באופן מסורתי לניתוח גנטי, הצלה ספציפית תא / רקמה, וניתוח פסיפס. טכניקות אלה מספקות אמצעים להסיק מה שקורה בין תאים, אך אינן ישימים באופן אוניברסלי בזיהוי ואפיון של מולקולות תאיות. כאן אנו מציגים neטכניקה שפותחה wly ישירות assay נוזל pseudocoelomic של ג elegans. הטכניקה מתחילה עם או מניפולציה גנטית או פיזית כדי להגדיל את נפח נוזל חוץ תאי. אחר כך את בעלי חי נתונים לטכניקת microinjection הפוך ערפדים באמצעות אסדת microinjection המאפשרת שליטה בלחץ איזון עדינה. לאחר הבידוד של נוזל חוץ תאי, הנוזל נאסף ניתן assayed על ידי העביר לבעלי חיים אחרים או באמצעים מולקולריים. כדי להדגים את היעילות של טכניקה זו אנו מציגים גישה מפורטת לassay דוגמה ספציפית של מולקולות איתות תאיות, dsRNA הארוך במהלך תגובת RNAi מערכתית. למרות אפיון של RNAi המערכתי הוא הוכחה לדוגמא עיקרון, אנו רואים בטכניקה זו כישים לענות על מגוון שאלות של קומפוזיציה ואיתות מערכת דם.
Protocol
1. הכנה של חומרים
המהותי הנחוצה לmicroinjection הפוך ערפדים דומה לזו הנדרשת לטכניקות microinjection סטנדרטיות המשמשות לייצור המהונדס ג elegans זני 1. למרות שחלק ממגיבים (למשל צלחות assay) נעשים ביום ההעברה ניסיונית, רב של החומרים חייבים להיות מוכן מתואם על פני תקופת 8 יום (ראה טבלה 1 לטבלת זמן). ככזה, חשוב לתכנן מראש בזהירות בשימוש בטכניקה זו (לריאגנטים וציוד דרושים ראה טבלה 2).
רפידות הזרקה:
- הפוך 2% בפתרון agarose H 2 O וחום עד להמסה. Aliquot בaliquots 1ml ב1.5 צינורות וחנויות microcentrifuge מ"ל ב 4 ° C.
- פריסה 22 50 כוסות כיסוי מ"מ x על גבי ספסל עם קצותיהם בולטים מעט מעל הקצה העליון הספסל כדי להקל לאסוף אותם במהירות.
- Pokחור קטן ea במכסה של צינור microcentrifuge (שימוש נעץ) כדי לאפשר אוורור. הנח את הצינור בכוס מ"ל 15 עם כ 5 מ"ל של מים, ומיקרוגל כדי להמס (כ 35 שניות).
- באמצעות פיפטה פסטר ומקום נורת ירידה (כ 35 μL) של agarose נמס על מכסה זכוכית והנח את מכסה זכוכית 2 מייד על הירידה בזווית של 90 מעלות לראשונות. חזור על פעולה עבור כמה כוסות כיסוי אחרות.
- לאחר agarose בסס, הסר את מכסה הזכוכית ומאפשר המשטח לייבוש באוויר לחלוטין הלילה (אם יש צורך במוקדם, שקופיות יכולות להיות ממוקמות ב50-80 ° C תנור במשך 15-30 דקות).
- רפידות אז ניתן לאחסן בתיבת מכסה זכוכית בטמפרטורת חדר ללא הגבלת זמן.
צלחות assay:
לassaying הקטלניות העובריות קשורות RNAi PAL-1, הכנת לוחות assay צריכים להיעשות ביום ניסוי הערפדים. המטרה היא חהve דשא חיידקים מינימאלי ואילו לא רעב התולעים שלך. דשא עבה מדי עושה בקיע פאל-1 זחלים קשים מאוד בקלות יכולות ללכת לאיבוד בחיות הקטנות, השקופות המעוותות L1 במזון. הכנת צלחת צריכה להיות מותאמת עבור בקיע הפנוטיפ של עניין.
- הכן OP50: 5mLs הזרע של מרק LB עם OP50 מושבה יחידה גדלה על צלחות אגרו LB. דגירת OP50 על 37 מעלות צלזיוס למשך הלילה בזמן רועד, ואז לאחסן ב 4 ° C.
- הכן את צלחות NGM 35 מ"מ על פי פרוטוקול בסיסי (ראה הערה 1).
- 20 μL ספוט של OP50 תרבות הלילה (שלב 1.7) על כל צלחת NGM. אפשר OP50-LB לייבוש (זה צריך לקחת פחות מ 20 דקות).
מחטי הזרקה:
- משוך מחטי הזרקה מורוסיליקט זכוכית נימים באמצעות P97 בוער / חום micropipette חולץ ממכשירי סאטר (ראה איור 1 עבור צורה של מחט נציג).
- הזרקת חנותמחטים במחזיק מחט בנויה מצלחת פטרי ופלסטלינה (ראה 1).
2. הכנה של תולעים
נפח pseudocoelomic המשוער של המבוגר ג elegans אנדרוגינוס הוא 40-80 picoliters (מצו com. דוד הול). כדי להשיג דגימות של נוזל חוץ תאי ממאגר כזה קטן זה מועיל כדי להגדיל את המשאבים הזמינים הכוללים. אנו זיהינו שלוש שיטות כדי להגדיל את הנוזל הזמין מאוד בתולעים התורמים. השיטה העיקרית שלנו מנצלת את הפנוטיפ של CLR-1 (e1745) מוטציות, אשר יכול לגרום לעלייה של 10 מתקפלת או גדולה יותר בנפח נוזל חוץ תאי (איור 2). שתי השיטות החלופיות לנצל את העובדה שחשבונות germline לכמעט שליש מהנפח הכולל של התולעת, והסרתו על ידי GLP-1 (RNAi) או תוצאות אבלציה ליזר בחיות עם נוזל pseudocoelomic ממלאים את החלל בתאי המין (איור 2) 2 </ Sup>.
הכנה של תולעים תורמים באמצעות CLR-1 (e1745)
ראה איור 3 לCLR-1 (e1745) עבודת assay העברה
- Streak את החיידקים המבטאים dsRNA למושבות בודדות בLB + צלחות 25μg/mL carbenicillin. אנו נשתמש dsRNA חיידקי חבר-1 מייצר להפגנה זו. דגירת הלילה בשעת 37 ° C.
- מLB מפוספס + 25 מיקרוגרם / מיליליטר צלחת carbenicillin של PAL-1 חיידקים (RNAi), לאסוף מושבה יחידה לחסן תרבות לילה 3 מ"ל בLB בתוספת 25μg/mL carbenicillin.
- 15 μL פיפטה של תרבות הלילה על צלחות 35mm NGM בתוספת 25 מיקרוגרם / המ"ל carbenicillin וIPTG 1 מ"מ. ודא לצלחת את החיידקים מחוץ למרכז הצלחת. לייבוש (כ 20 דקות).
- הפוך פתרון 500 μL טרי אקונומיקה (1:1 5M KOH: NaHypochlorite).
- 10 μL פיפטה של תמיסת כלור על צלחת הזרועה. להיות לא בטוחo למקם את טיפת האקונומיקה בלבד מנקודת החיידקים.
- כדי להשיג אוכלוסייה קטנה, נקיה ומסונכרנת של CLR-1 (e1745) בעלי החיים לmicroinjection ההפוך, לקחת 2-10 מבוגרים הרה לטיפת האקונומיקה. המבוגרים מתמוססים, משאירים נקי, באופן חלקי התפתחותית מבוים עוברים. עוברים אלה לאחר מכן בוקעים זחלים ויזחלו למזון.
- דגירה במשך ארבעה ימים בטמפרטורה של 20 מעלות צלזיוס
- לוחות זזים 25 מעלות צלזיוס במשך ארבע שעות כדי לגרום לנפיחות.
- פיק תולעים לצלחת NGM unseeded ולאפשר זמן כדי לנקות את החיידקים מהציפורן. (שלב אופציונלי) שטפו תולעים בM9 בעת העברה לצלחות NGM.
- העבר (י.א.) תולעי נמען מבוגרי L4/Young לצלחת NGM צלחת unseeded ולאפשר זמן כדי לנקות את החיידקים מהציפורן. (שלב אופציונלי) שטפו תולעים בM9 בעת העברה לצלחות NGM.
A2) הכנה אלטרנטיבית של תולעים תורמים באמצעות GLP-1 (RNAi)
- מצלחת מפוספסתשל LB + 25 מיקרוגרם / המ"ל carbenicillin לחסן תרבות לילה 3 מ"ל של LB בתוספת carbenicillin עם מושבה יחידה של GLP-1 חיידקים (RNAi). לדגור על 37 מעלות צלזיוס למשך הלילה.
- פיפטה 15 μL של GLP-1 (RNAi) תרבות לילה על גבי צלחת NGM 35 מ"מ בתוספת 25 מיקרוגרם / המ"ל carbenicillin ו1mm IPTG. דגירה בטמפרטורת חדר למשך הלילה.
- העברת 5 L3/L4 חיות לצלחות GLP-1 (RNAi). דגירה במשך ימים בשעת 20 ° C. RNAi מיקוד GLP-1 תוצאות בצאצאים עם מומי הפצת germline. חוסר היכולת לפתח באופן מלא את תוצאות germline בחלל ריק שמתמלא בנוזל חוץ תאי. אופטימיזציה של מזון RNAi לייצר צאצאים שהתקדמות לבגרות בלי germlines שגשוג עשויה להיות נחוצה בהתאם.
- הכין PAL-l צלחות (RNAi) כמו בשלבים של 2.1-2.3 פרוטוקול הכנת תולעת CLR-1 (e1745) לעיל.
- הפוך solu אקונומיקה טריהtion (1:1 5M KOH: NaHypochlorite).
- 10 μL פיפטה של תמיסת כלור בחבר-1 הצלחת הזורעת (RNAi). הקפד למקם את טיפת האקונומיקה בלבד מנקודת החיידקים.
- העברת עוברים על ידי הרמת 2-10 הרה GLP-1 מבוגרים (RNAi) לטיפת אקונומיקה.
- דגירה במשך ארבעה ימים בטמפרטורה של 20 מעלות צלזיוס
- פיק תולעים לצלחת NGM 60mm unseeded ולאפשר זמן כדי לנקות את החיידקים מהציפורן. (שלב אופציונלי) שטפו תולעים בM9 בעת העברה לצלחות NGM.
הכנת B2) אלטרנטיבית של תולעים תורמים באמצעות אבלציה הליזר germline
- Streak את החיידקים המבטאים dsRNA למושבות בודדות בLB + 25 מיקרוגרם / מיליליטר carbenicillin צלחות. אנו נשתמש dsRNA חיידקי חבר-1 מייצר להפגנה זו. דגירת הלילה בשעת 37 ° C.
- מצלחת עם carbenicillin לחסן תרבות 3 מיליליטר לילה בLB בתוספת 25 מיקרוגרם / המ"ל carbenicillin.
- 15 μL פיפטה של הדואר תרבות הלילה של החבר-1-dsRNA להביע חיידקים על 35 צלחות NGM מ"מ בתוספת 25 מיקרוגרם / המ"ל carbenicillin ו1mm IPTG. לאפשר לו להתייבש במשך הלילה.
- מבודד חי L1 מOP50 צלחות סטנדרטיות והליזר קטוע סומטי germline מבשר תאי Z1 וZ4 באמצעות 3 פרוטוקול סטנדרטי.
- שחזר תולעי ליזר ablated על החבר-1 צלחות RNAi הנ"ל.
- דגירה במשך 3 ימים בטמפרטורה של 20 מעלות צלזיוס
- פיק תולעים לצלחת NGM נקיה ולאפשר זמן כדי לנקות את החיידקים מהציפורן. (שלב אופציונלי) שטפו תולעים בM9 בעת העברה לצלחות NGM.
הכנה של תולעי נמען
- פס החוצה OP50 למושבות בודדות על צלחות LB. דגירת הלילה בשעת 37 ° C.
- מצלחת LB לחסן תרבות לילה 3 מ"ל בLB.
- 15 μL פיפטה של תרבות הלילה על 35 צלחות NGM מ"מ. ודא לצלחת את החיידקים מחוץ למרכז הצלחת. לאפשר לו להתייבש (כ 20 דקות).
- הפוך פתרון אקונומיקה טריה (1:1 5M KOH: NaHypochlorite).
- 10 μL פיפטה של תמיסת כלור על צלחת הזרועה. הקפד למקם את טיפת האקונומיקה בלבד מנקודת החיידקים.
- העברת עוברים על ידי הרמת 2-10 מבוגרי N2 הרה לטיפת אקונומיקה.
- דגירה במשך שלושה ימים בטמפרטורה של 20 מעלות צלזיוס
- העבר תולעים לצלחת נקיה, unseeded NGM ולדגור על 20 מעלות צלזיוס במשך 30 דקות לפחות.
3. בידוד ערפדים של נוזל תאי
הפרוטוקול הבא הוא ספציפי לmicroinjection הגדרה המורכבת של PLI-100 פיקו מזרק, מחט נייחת נערכה בmicromanipulator, ושלב שבו צף ניתן החליק לתוך תולעת המחט. עם זאת, הטכניקה הכללית היא להכניס מחט microinjection ריקה לחיה תורמת, תוך שמירה על לחץ מספיק כדי למנוע נימים בזרימה של שמן מינרלים לפני הכניסה והסלולרי material תוך חדירה לרקמות גוף הקיר. בזמן שהמחט נמצאת בלחץ חית תורם מופחת כדי לאפשר מילוי נימים של המחט בנוזל חוץ תאי, אשר לאחר מכן ניתן להעביר את המחט לתולעת נמען וגורש על ידי הגדלת הלחץ במידה מספקת. הסרת הנוזל על ידי פעולת נימים יכולה גם להיעזר באמצעות המילוי, או יניקה, פונקציה של פיקו המזרק. טכניקה כללית זה צריכה להיות להתאמה בקלות למערכות הזרקת המייקר אחרות, המאפשרות שליטה בלחץ איזון.
- הפעל מיקרוסקופ ההפוך, את המיקרוסקופ לנתיחה, ופיקו מזרק (ראה תרשים 1).
- סובב את כפתור הבורר של פיקו המזרק לP ברור, ולבדוק שהמדידה השוטפת היא בpsi. קריאה זו, לחץ הברור, היא קלט והלחץ צריך להיות כ 0 psi.
- בדקו את השסתום הראשי ברגולטור מכל החנקן על מנת לוודא שהפלט סגור (פונה counterclockwise עד הכפתור רופף).
- פתח את שסתום מכל החנקן הראשי. מד הרגולטור קרוב טנק N2 צריך עכשיו לקרוא את הלחץ הפנימי של הטנק.
- לאט לאט להגביר את הלחץ על ידי סיבוב שסתום הוויסות הראשונית בכיוון שעון. לפקח על לחץ ההולך וגובר על פיק ההזרקה (זה מדויק יותר מקריאת לחץ הפלט במד הרגולטור). לאט לאט להגביר את הלחץ עד 100 אטמוספרות. אינו מתירים תעלה על 105 psi.
- כאשר 100 psi מגיע לעבור את הבורר לP להזריק ולהגדיר את לחץ ההזרקה עד 30 psi באמצעות ידית Pinject.
- כבה את הכפתור הבורר לאיזון P.
- הנח טיפת 15 μL של שמן מינרלים בתורם הנקי שלך וצלחות נמענים.
- לכסות 2% משטח הזריקה שלך agarose בשמן מינרלים.
- טען מחט micropipette משך בבעל וליישר.
- באמצעות מיקרוסקופ לנתיחה, הר התורם 1 ותולעת נמען 1 אחד ליד שני בagarose עממודעה.
- תולעי מיקום באמצעות הגדלה ונמוכה להביא מחט לתוך שמן המינרלים ליד התורם.
- מעבר למתח גבוה ומחט עמדה ליד חלל pseudocoelomic.
- להגביר את הלחץ לאיזון כ 10 psi. שים לב תוסף שמן מינרלים בקצה של המחט.
- דחף את התולעת בתוך המחט כדי למקם את קצה המחט בחלל pseudocoelomic ידי הזזת הבמה.
- שים לב לזינוק בעמדתו של שמן המינרלים בקצה המחט.
- הפחת את לחץ האיזון כדי לאפשר פעולת נימים למלא את המחט. (אפשר גם להשתמש בפונקצית המילוי כדי להאיץ את התהליך).
- לאחר איסוף שקופית נוזל התולעת מהמחט.
- מעבר להגדלת צריכת חשמל נמוך ומיקום המחט על ידי תולעת הנמען (אינו מתיר קצה המחט לעזוב שמן מינרלים). [לחלופין, בעל המחט ניתן להסיר והנוזל הועבר לאגל בצינור microcentrifuge.]
- עבור חזרההגדלה גבוהה ולהזיז את המחט לתוך תולעת הנמען באמצעות החלקת במת מיקרוסקופ.
- לאחר שהתמקם בתולעת הנמען משתמש בהזרקה (נקבע על 35 psi) הפונקציה להזריק נוזל pseudocoelomic נאסף מהתורם.
- להוציא את המחט מתולעת הנמען באמצעות החלקת במת מיקרוסקופ בכיוון ההפוך כמשמש להזנת הנמען.
- עם את המחט של התולעת, להעלות את המחט ממשטח הזריקה.
- הסר את משטח ההזרקה והנח טיפה של M9 על התולעים כדי להתאושש.
- הנח טיפת μL 10 מתוך M9 על צלחת assay.
- בחר את התולעת לנמען M9 על צלחת assay.
4. Assaying העברה פנוטיפי RNAi
- אפשר תולעים התאוששו לגדול במשך 24 שעות בטמפרטורה של 20 מעלות צלזיוס
- הסר מבוגרי נמענים, עוזב עוברים וצאצאים שבקעו על הצלחת. דגירת צלחת לתקופה של 24 שעות נוספות בשעת 20 ° C.
- צאצאי ציון כמולאחר שלא בקע, בקע אבל להיות phenotypically מוטציה, או להיות זחלים פראיים מסוג.
הערות
- NGM תקשורת נעשית בקבוצות 1-ליטר על ידי הוספת 18 גרם של אגר, 2.5 גר 'bactopeptone, 3 גרם נתרן כלורי וH 2 O. הוסף מערבבי בר וחיטוי. לאחר מעוקר לשים את הבקבוק על צלחת מערבבים ולאפשר התקשורת להתקרר עד 60 ° C תוך ערבוב. אחרי התקשורת התקררה מוסיף 1 מ"ל של כולסטרול (5 מ"ג / מ"ל באתנול), 1 מ"ל של 1M CaCl 2, 1 מ"ל של 1M MgSO 4, 25 מ"ל של חיץ פוספט אשלגן (pH6.0). אם צלחות הן לשמש לRNAi NGM הוא השלים עם 1 מ"ל של IPTG 1M ו1 מ"ל של 25 מ"ג / המ"ל carbenicillin לאחר הקירור עד 60 ° C. צלחות שפכו באו 35 מ"מ (3.5 מ"ל של NGM) או 60 מ"מ (8.5 מ"ל של NGM) צלחות פטרי.
- 2% agarose עשו במים. אחסן במקרר. ממס ולעשות רפידות היטב מראש של היום של בידוד הנוזל pseudocoelomic. היובש של המשטח הופך את התולעת לדבוק בפנקס,ולפחות יום אחד של ייבוש אוויר הוא הכרחי לרפידות להיות יבשות מספיק. אם רפידות הזריקות יבשות מדי והתולעים התורמים שלך desiccating מהר יותר מאשר אתה יכול לתפעל אותם אתה יכול להוסיף לחות נוספת לרפידות הזרקה על ידי נשימה על הכרית לפני הוספת שמן מינרלים. ללא קשר ליכולת לעבוד במהירות כדי לבודד נוזל pseudocoelomic לפני מתייבש התולעת היא הכרחית.
- אנו משתמשים carbenicillin בכל השלבים של הכנת מזון RNAi לבחור עבור סמן התנגדות אמפיצילין. Carbenicillin הוא אנלוגי אמפיצילין שהוא יציב יותר ותוצאות במושבות לווין פחות מאשר אמפיצילין.
- אנו משתמשים בצלחות RNAi שהם השלימו עם NGM 1mm IPTG ו25 מיקרוגרם / המ"ל carbenicillin. וקטורי האכלת RNAi הם בHT115 E. זן חיידק שהוא לקוי לdsRNA ספציפי nuclease.
- (שלב אופציונלי) אנו מוצאים שמקבלים שעה בתורם unseeded NGM צלחות ותולעי נמען לעשות עבודה טובה לאבד את הציפורןחיידקים כפותים שמועברים מצלחות ההאכלה. זה לא נכון, כי במקרים בם יעד RNAi בבעלי חי התורם מפריע לניידות (למשל UNC-22 (RNAi)). לכן הופך להיות נחוץ כדי לסייע בתהליך. לשם כך, אנו משתמשים בשקופית דיכאון עם כ 50 μL של M9. בחירת תולעים לM9 מצלחות האכלת RNAi, אז לערבב עם מכוש תולעת פלטינה סטנדרטי הוא מספיק כדי להסיר חיידקים חסידים ביותר.
5. נציג תוצאות
פירוט תוצאות יציגות להעברה ניסיונית עבור נוזל חוץ תאי מCLR-1 (e1745) תולעים גודלו על חיידקים המבטאים dsRNA מיקוד PAL-1. צאצאיהם של בעלי החיים מתו התורמים ו / או פגמים הציגו דפוסים אחוריים. אז העברנו נוזל חוץ תאימבעלי החיים אלה לpseudocoelom של תולעים נאיביים RNAi סוג פראי. חלק מצאצאיו של בעל החיים שלאחר מכן הנמען אז מוצג פנוטיפים PAL-1 המוטציה הצפויים (איור 4). זאת בניגוד לצאצאים של בעלי חיים מושתלים שקבלו נוזל חוץ תאי מבעלי חיים שגודלו תורמים משני חיידקי וקטור RNAi שליטה שהפגינו רק רמות רקע של הקטלניות (איור 4) מזון או חיידקים רגילים. אמנם צאצאיהם של מקבלי נוזל חוץ תאי מחיות תורמות העוברים RNAi מצביע על עלייה משמעותית בתדירות של פנוטיפים dsRNA מושרים, חדירנות הם לא חזק כמו בצאצאיהם של בעלי החיים התורמים, שבו כמעט 100% מצאצאים למות כעוברים שעדיין לא בקעו, ו רק בעלי חיים נדירים, מעוותים קשה לבקוע.
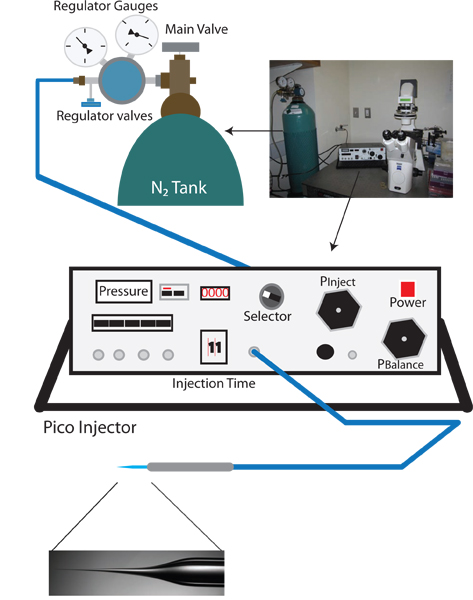
איור 1. התקנת הזרקה הפוכה ערפד. Fo ההתקנה המתאימההתקנת microinjection הפוכה ra ערפדים דומה לסטנדרט ג elegans תלבושת microinjection, והיא כוללת דיסקציה מיקרוסקופ, מיקרוסקופ הפוך עם יעדי 10X ו40X, שלב נייד למיצוב, וmicromanipulator עם בעל מחט זריקה. בנוסף, חולץ מחט להכנה של מחטי הזרקה הוא גם צורך. ייחודי לפרוטוקול microinjection ההפוך pico-מזרק המאפשר בקרה טובה של לחץ איזון (למשל ורנר מכשירי PLI-100) הוא זקוקים.
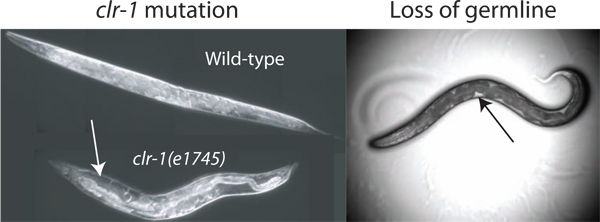
איור 2. שיפור של נפח pseudocoelomic. נפחיו של נוזל pseudocoelomic זמין לבידוד אינו מספיקים לבדיקה בחיות פראיות מסוג. הנפח ניתן להגדיל ע"י שיבוש הרגולציה של איזון האוסמוטי באמצעות שינוי הטמפרטורה של CLR-1 (e1745) בעלי חיים, וכתוצאה מכך ההצטברות של הנוזל ברורה pseudocoelomic (חץ לבן). בנוסף לאובדן האשך ידי אבלציה ליזר או GLP-1 (RNAi) מאפשר גישה לנוזל חוץ תאי (הפסד של אבלציה ליזר מוצג). הנוזל הזמין ביותר שנצפה בקלות ככתמים ברורים בין המעי הכהה וקיר הגוף (חץ שחור), למרות שהנפח הכולל הזמין הוא הרבה פחות מזה שנמצא בCLR-1 (e1745) חיות שגודלו בטמפרטורה המגבילה.
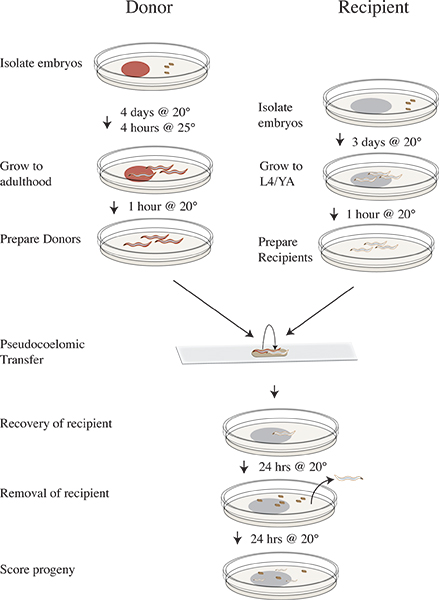
איור 3. בידוד ערפד וציר זמן פרוטוקול העברה. ארבעה ימים לפני העברת ניסוי לבודד CLR-1 (e1745) עוברים תורמים בצלחות שRNAi מזון ולדגור על 20 ° C. שלושה ימים לפני לבודד עוברי נמען N2 בOP50. ביום של הניסוי מזיז את הצלחות התורמות עד 25 מעלות צלזיוס במשך ארבע שעות. הסר את התורמים לאחר הדגירה של 25 ° C לצלחות נקיות חסרות מזון ושינוי עד 20 ° C. להעביר את בעלי חיים המושתלים לנקות צלחותחסר מזון ולהמשיך דוגרים על 20 ° C. בצע ניסוי העברה ולהתאושש תולעי נמען על OP50 צלחות ולדגור על 20 ° C. הסר את בעלי החיים המושתלים לאחר 24 שעות בטמפרטורה של 20 מעלות צלזיוס דגירת צאצאי נמען במשך 24 שעות בטמפרטורה של 20 מעלות צלזיוס צאצאי ציון כפראי, סוג, מוטציה, או נתבקעה.
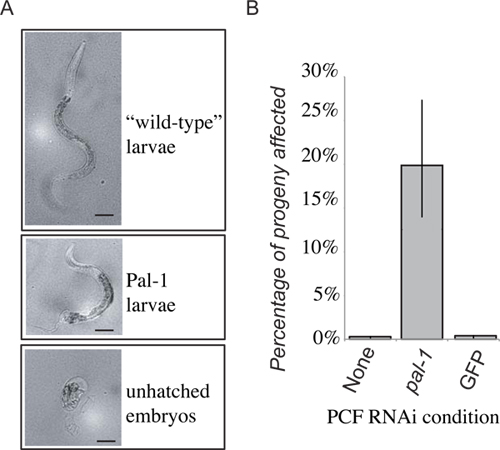
איור 4. נציג תוצאות. אובדן תפקוד PAL-1 בנמען יגרום הקטלניות עובריות, או אובדן ייחודי של פיתוח אחורי (). 48 שעות לאחר העברת צאצאי PCF הניחו בתוך 24 השעות הראשונות הם קלעו כמו גם זחלים פרועי סוג, זחלי פאל-1, או עוברים שעדיין לא בקעו. התדירות של עוברים שעדיין לא בקעו וphenotypically פאל-1 זחלים משולבות לתת מידה של חבר-1 (RNAi) פנוטיפים העברה מושרים. קבלת נוזל pseudocoelomic מבעלי חיים שגודלו על PAL-1 dsRNA מזון מייצרת אינדוקציה חזקה של משויךפנוטיפים בלתי נראים במקבלי העברת שליטה (ב).
Access restricted. Please log in or start a trial to view this content.
Discussion
יש לנו הצגנו שיטה חדשה המאפשרת בידוד והאפיון של נוזל חוץ תאי ממודל אורגניזם ג כאן elegans. הטכניקה מתחילה במניפולציה הגנטית או פיזית של תולעים תורמים להגדלת הנפח הכולל של נוזל חוץ התאי שלהם. אז נוזל חוץ תאי הוא מבודד בטכניקת microinjection שונה. התולעים הם רכובים על micr...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
ברצוננו להכיר את האופי השיתופי של האנטר המעבדה, ומודה להם על דיון וסיוע המועיל שעשה פיתוח של טכניקה זו אפשרית ומהנה. ברצוננו להודות לנייג'ל דילייני וCaenorhabditis גנטיקת המרכז לתולעת וזני חיידקים. עבודה זו נתמכה על ידי המכון הלאומי לבריאות GM089795 מענק לCPH.
Access restricted. Please log in or start a trial to view this content.
Materials
יום הכנת תולעת הכנת חומר
| Name | Company | Catalog Number | Comments |
| -7 או לפני | שמור על ניקיון, נזון היטב CLR-1 (e1745) ותולעי N2 | הפוך רפידות הזרקה, צלחות NGM, NGM + פחמימות / צלחות IPTG, מניות LB OP50 | |
| -6 | רצף את RNAi אוכל על LB + פחמימות | ||
| -5 | לחסן 3 מיליליטר לילה עם RNAi מזון | ||
| -4 | זרעי RNAi צלחת | ||
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | Shift תולעים עד 25 במשך 4 שעות | הפוך צלחות assay | |
| ערפד העברה | |||
| שחזור נמען | |||
| +1 | הסרת נמען העברה | ||
| 2 | צאצאי ציון |
טבלה 1. ציר זמן הכנת חומר.
ציוד חברה מספר קטלוג CLR-1 (e1745) השני 9 GLP-1 RNAi וקטור 10 חבר-1 RNAi וקטור 11| Picoliter לחץ Injector | וורנר מכשירים | 65-0001 (PLI-100) |
| Flaming / בראון micropipette פולר | סאטר מכשירים | P97 |
| Axiovert 200 | Zeiss | |
| ריאגנטים | ||
| שמן מינרלים | EM מדע | MX1560-1 |
| 22x50 שום ½ 1 מכסה זכוכית | קורנינג | |
| SeaKem LE agarose | Lonza | 50004 |
| ורוסיליקט זכוכית נימים | Precisions מכשירי העולם | 1B100F-4 |
| פתרון Hypochlorite נתרן (5% כלור זמין) | JT ייקר | 9416-01 |
| ג elegans וזני חיידקים | ||
| Caenorhabditis גנטיקת המרכז (CGC) | CB3241 | |
| מקור Bioscience (ספריית האכלת Ahringer) | F02A9.6 | |
| PHC187 | ||
| OP50-GFP 5 | Caenorhabditis גנטיקת המרכז (CGC) | OP50-GFP |
| YFP א coli 4 | MC4100-YFP | |
טבלה 2. ריאגנטים וציוד ספציפיים.
References
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e, Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved