Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Vampiric Aislamiento de líquido extracelular de
En este artículo
Resumen
El organismo modelo C. elegans Utiliza fluido pseudocoelomic como un sistema circulatorio pasiva. Ensayo directo de este fluido no ha sido posible anteriormente. Aquí se presenta una técnica novedosa de ensayo directamente en el espacio extracelular, y utilizar las señales sistémicas silenciamiento durante una respuesta de RNAi como una prueba de principio ejemplo.
Resumen
El organismo genéticamente tractable modelo C. elegans ha ayudado a comprender un gran número de cuestiones biológicas, habilitado por su corto tiempo de generación, facilidad de crecimiento y el tamaño pequeño. Este pequeño tamaño, sin embargo, ha rechazado un número de enfoques técnicos encontrados en otros sistemas modelo. Por ejemplo, las transfusiones de sangre en los sistemas de mamíferos y las técnicas de injerto en plantas permiten hacer preguntas de composición del sistema circulatorio y señalización. El sistema circulatorio de la lombriz, el pseudoceloma, ha sido hasta hace poco imposible de ensayo directamente. Para responder a las preguntas de la señalización intercelular y el sistema circulatorio composición C. investigadores elegans tradicionalmente han convertido a un análisis genético, de célula / tejido de rescate específico, y el análisis de mosaico. Estas técnicas proporcionan un medio para inferir lo que está pasando entre las células, pero no son universalmente aplicables en la identificación y caracterización de moléculas extracelulares. Aquí les presentamos una neWLY técnica desarrollada a ensayo directamente el fluido pseudocoelomic de C. elegans. La técnica comienza con cualquiera de manipulación genética o física para aumentar el volumen de fluido extracelular. Después, los animales se someten a una técnica de microinyección vampírica inversa usando una plataforma de microinyección que permite un control fino balance de la presión. Después del aislamiento de fluido extracelular, el líquido recogido puede ensayarse por transferencia a otros animales o por medios moleculares. Para demostrar la eficacia de esta técnica se presenta un enfoque detallado para el ensayo de un ejemplo específico de moléculas de señalización extracelular, durante un largo dsRNA de respuesta RNAi. Aunque la caracterización de RNAi sistémico es una prueba de principio ejemplo, vemos esta técnica como ser adaptable para responder una variedad de preguntas de la composición del sistema circulatorio y de señalización.
Protocolo
1. Preparación de los materiales
El material necesario para la microinyección vampírica inversa es similar a la requerida para las técnicas de microinyección estándar utilizados para hacer transgénico C. elegans cepas 1. Aunque algunos reactivos (por ejemplo, placas de ensayo) se hizo el día de la transferencia experimental, muchos de los materiales debe ser coordinada preparado durante un periodo de 8 días (véase la Tabla 1 para una mesa de tiempo). Como tal, es importante planificar de antemano con cuidado al usar esta técnica (para los reactivos y equipos necesarios ver Tabla 2).
Almohadillas de inyección:
- Haga una solución al 2% de agarosa en H 2 O y el calor hasta que se disuelva. Dividir en partes alícuotas de 1 ml en alícuotas en tubos de 1,5 mL microcentrífuga y se almacena a 4 º C.
- Coloque 22 x 50 mm cubreobjetos sobre una mesa de trabajo con los bordes ligeramente sobresalientes del borde de sobremesa para facilitar recogerlos rápidamente.
- Pokea agujero pequeño en la tapa del tubo de microcentrífuga (utilizar una chincheta) para permitir la ventilación. Colocar el tubo en un vaso de precipitados de 15 ml con aproximadamente 5 ml de agua, y de microondas para fundir (aproximadamente 35 segundos).
- Utilizando una pipeta Pasteur y lugar bulbo una gota (aproximadamente 35 l) de la agarosa fundida en una cubierta de vidrio e inmediatamente colocar un cubreobjetos sobre la gota segundo en un ángulo de 90 ° respecto a la primera. Repita el procedimiento para varios cubreobjetos otros.
- Después de que la agarosa se ha solidificado, retire la cubierta de vidrio y permitir que la almohadilla de secar completamente al aire durante la noche (si es necesario antes, las diapositivas se pueden colocar en un horno de 50-80 ° C durante 15-30 minutos).
- Almohadillas se pueden almacenar en una caja de vidrio de cubierta a temperatura ambiente indefinidamente.
Las placas de ensayo:
Para el ensayo de la letalidad embrionaria asociada con PAL-1 RNAi, la preparación de placas de ensayo se debe hacer en el día del experimento vampírica. El objetivo es HÃVe un césped bacteriano mínimo mientras no mueren de hambre a los gusanos. Un césped demasiado gruesa hace que anotar Pal-1 larvas extremadamente difícil, ya que las pequeñas y traslúcidas animales deformes L1 puede perderse fácilmente en la comida. Preparación de placas se debe optimizar para anotar el fenotipo de interés.
- Preparar OP50: 5 ml de siembra de caldo LB con una sola colonia OP50 crecer en placas de agar LB. Incubar el OP50 a 37 ° C durante la noche con agitación, a continuación, almacenar a 4 ° C.
- Preparar placas de 35 mm NGM, según el protocolo básico (ver Nota 1).
- Punto 20 l de la noche a la mañana OP50 cultura (paso 1,7) en cada plato NGM. Deje que el LB-OP50 se seque (esto debería tomar menos de 20 minutos).
Agujas de inyección:
- Tire de agujas de inyección de capilares de vidrio de borosilicato usando un P97 Flaming / Brown micropipeta extractor de instrumentos Sutter (véase la Figura 1 para la forma representativa de aguja).
- Tienda inyecciónagujas en un soporte de aguja construido a partir de una placa de Petri y plastilina (ver 1).
2. Preparación de Worms
El volumen estimado pseudocoelomic de un adulto C. elegans es hermafrodita picolitros (40-80 pers com. David Hall). Para obtener muestras de fluido extracelular de un pequeño depósito que es beneficioso para aumentar el recurso total disponible. Se han identificado tres métodos para aumentar en gran medida el fluido disponible en los gusanos donantes. Nuestro método principal explota el fenotipo de clr-1 (e1745) mutantes, que puede causar un aumento de 10-veces o más en volumen de fluido extracelular (Figura 2). Los dos métodos alternativos utilizar el hecho de que las cuentas de línea germinal para casi un tercio del volumen total del gusano, y su eliminación por el GLP-1 (RNAi) o resultados de ablación por láser en animales con fluido pseudocoelomic llenar el vacío de línea germinal (Figura 2) 2 </ Sup>.
Preparación de gusanos donantes utilizando clr-1 (e1745)
Vea la Figura 3 para clr-1 (e1745) flujo de trabajo de transferencia ensayo
- Seguidos por las bacterias que expresan dsRNA para las colonias individuales en placas de LB + 25μg/mL carbenicilina. Haremos uso de pal-1 dsRNA bacterias que producen para esta demostración. Incubar durante una noche a 37 ° C.
- Desde el LB rayado + 25 mg / ml de carbenicilina placa de PAL-1 (RNAi) las bacterias, elegir una sola colonia para inocular un cultivo de 3 ml durante la noche en LB suplementado con 25μg/mL carbenicilina.
- Pipetear 15 l de cultivo de una noche en placas de 35 mm NGM complementado con 25 ug / ml de carbenicilina y 1 mM IPTG. Asegúrese de que la placa de las bacterias fuera del centro de la placa. Dejar secar (aproximadamente 20 minutos).
- Haga solución 500 l lejía fresca (1:1 5M KOH: NaHypochlorite).
- Pipetear 10 l de solución de cloro en la placa de semillas. Sea t seguroo colocar la gota de lejía lejos de la mancha bacteriana.
- Para obtener una pequeña población limpia y sincronizada de clr-1 (e1745) los animales para la microinyección inversa, escoger 2-10 adultos grávidas en la gota de blanqueador. Los adultos se disuelven, dejando limpia, parcialmente por etapas de desarrollo de embriones. Estos embriones luego eclosionan y las larvas se arrastran a la comida.
- Incubar durante cuatro días a 20 ° C.
- Desplazar las placas a 25 ° C durante cuatro horas para inducir la inflamación.
- Elige gusanos a una placa de NGM cabeza de serie y dar tiempo para limpiar las bacterias de la cutícula. (PASO OPCIONAL) Enjuague gusanos en M9 mientras se transfieren a placas de NGM.
- Mueva L4/Young Adultos (YA) gusanos receptores a una placa de placa NGM cabeza de serie y permitir de eliminar las bacterias de la cutícula. (PASO OPCIONAL) Enjuague gusanos en M9 mientras se transfieren a placas de NGM.
A2) Preparación alternativa de gusanos donantes utilizando GLP-1 (RNAi)
- De una placa de rayadode LB + 25 ug / ml de carbenicilina inocular un cultivo de 3 ml durante la noche de LB complementado con carbenicilina con una única colonia de GLP-1 (RNAi) bacterias. Incubar a 37 ° C durante la noche.
- Pipetear 15 l de GLP-1 (RNAi) cultivo de una noche sobre una placa de 35 mm NGM complementado con 25 ug / ml de carbenicilina e IPTG 1 mM. Incubar a temperatura ambiente durante la noche.
- Transferir cinco L3/L4 animales a los GLP-1 (RNAi) placas. Incubar durante dos días a 20 ° C. El RNAi dirigido GLP-1 resulta en una progenie con defectos proliferación línea germinal. La incapacidad de desarrollar plenamente los resultados de línea germinal en un espacio no ocupado que se llena con el líquido extracelular. Optimización de la comida RNAi para generar progenie que el progreso hacia la edad adulta sin germlines proliferativas pueden ser necesarios dependiendo.
- Ha preparado pal-l (RNAi) placas como en los pasos 2.1-2.3 del protocolo de preparación clr-1 (e1745) gusano anteriormente.
- Haga una solución blanqueadorción (1:1 5M KOH: NaHypochlorite).
- Pipetear 10 l de solución de lejía en la cabeza de serie pal-1 (RNAi) plato. Asegúrese de colocar la gota de lejía lejos de la mancha bacteriana.
- Transferencia de embriones al recoger 2-10 grávidas GLP-1 (RNAi), los adultos en la gota de lejía.
- Incubar durante cuatro días a 20 ° C.
- Elige gusanos a una placa de NGM 60mm cabeza de serie y dar tiempo para limpiar las bacterias de la cutícula. (PASO OPCIONAL) Enjuague gusanos en M9 mientras se transfieren a placas de NGM.
B2) Preparación alternativa de gusanos donantes utilizando ablación láser de línea germinal
- Seguidos por las bacterias que expresan dsRNA para las colonias individuales en LB + 25 mg / ml de carbenicilina placas. Haremos uso de pal-1 dsRNA bacterias que producen para esta demostración. Incubar durante una noche a 37 ° C.
- Desde una placa con carbenicilina inocular un cultivo de 3 ml durante la noche en LB suplementado con 25 g / ml de carbenicilina.
- Pipetear 15 l de thcultura e durante la noche de PAL-1 dsRNA-expresando bacterias sobre placas de NGM 35 mM suplementado con 25 g / ml de carbenicilina e IPTG 1 mM. Deje que se seque durante la noche.
- Aislar los animales de L1 estándar OP50 placas y láser ablación de la línea germinal precursor células somáticas Z1 y Z4 utilizando un protocolo estándar 3.
- Recuperar gusanos ablación láser sobre las citadas placas pal-1 RNAi.
- Incubar durante 3 días a 20 ° C.
- Elige gusanos a una placa de NGM limpia y dejar tiempo para limpiar las bacterias de la cutícula. (PASO OPCIONAL) Enjuague gusanos en M9 mientras se transfieren a placas de NGM.
Preparación de gusanos receptores
- Streak fuera OP50 para las colonias individuales en placas de LB. Incubar durante una noche a 37 ° C.
- De la placa de LB inocular un cultivo de 3 ml durante la noche en LB.
- Pipetear 15 l de cultivo de una noche en placas de 35 mm NGM. Asegúrese de que la placa de las bacterias fuera del centro de la placa. Deje que se seque (aproximadamente 20 minutos).
- Prepare una solución de blanqueador (1:1 5M KOH: NaHypochlorite).
- Pipetear 10 l de solución de cloro en la placa de semillas. Asegúrese de colocar la gota de lejía lejos de la mancha bacteriana.
- Transferencia de embriones eligiendo los adultos 2-10 N2 grávidas en la gota de lejía.
- Incubar durante tres días a 20 ° C.
- Mover los gusanos a un plato limpio, NGM no sembrado y se incuba a 20 ° C durante al menos 30 minutos.
3. Vampiric Aislamiento de líquido extracelular
El siguiente protocolo es específico de una microinyección de configuración que consta de un pli-100 pico-inyector, una aguja estacionaria a cabo en un micromanipulador, y un escenario flotante en el que puede ser el gusano se deslizó en la aguja. Sin embargo, la técnica generalizada consiste en insertar una aguja de microinyección vacío en un animal donante, mientras que se mantiene la presión suficiente para evitar capilar en el flujo de aceite mineral antes de la entrada y ma celularterial mientras penetra el tejido del cuerpo de pared. Mientras que la aguja está dentro de un animal donante presión se reduce para permitir el llenado capilar de la aguja con el líquido extracelular, que puede entonces ser movido en la aguja a un gusano destinatario y expulsado por el aumento de la presión suficientemente. La extracción del líquido por acción capilar también puede verse facilitada utilizando el relleno, o de succión, la función de la pico-inyector. Esta técnica generalizada debería ser fácilmente adaptable a otros sistemas de micro-inyección que permiten el control de la presión de equilibrio.
- Encender el microscopio invertido, el microscopio de disección, y pico-inyector (Ver Figura 1).
- Gire la perilla selectora del Pico inyector P claro, y verificar que la medida actual está en psi. Esta lectura, la presión claro, es la presión de entrada y debe ser de aproximadamente 0 psi.
- Comprobar la válvula principal en el regulador del tanque de nitrógeno para asegurarse de que la salida está cerrada (a la counterclockwise hasta que el botón está suelto).
- Abra la válvula de nitrógeno tanque principal. El indicador del regulador del depósito más cercano N2 debería leer ahora la presión interna del tanque.
- Aumente lentamente la presión hacia fuera, girando la válvula principal regulador hacia la derecha. Vigilar la presión cada vez mayor sobre el pico-inyector (esta es más precisa que la lectura de la presión de salida en el indicador del regulador). Aumente lentamente la presión a 100 psi. NO DEJE QUE SE superar los 105 psi.
- Cuando se llega a 100 psi cambiar el selector a P inyectar y ajustar la presión de inyección de hasta 30 psi utilizando el botón Pinject.
- Cambie el selector de equilibrio P.
- Coloque una gota de 15 l de aceite mineral en su donante limpio y placas receptoras.
- Cúbrase la almohadilla 2% de agarosa en inyección de aceite mineral.
- Cargue la aguja tiró micropipeta en el soporte y alinear.
- Usando un microscopio de disección, montar 1 donante y receptor 1 gusano cerca unos de otros en la p agarosaanuncio.
- Gusanos posición utilizando pocos aumentos y poner la aguja en el aceite mineral cerca de la donante.
- Mover a la alta potencia y posición de la aguja cerca de una cavidad pseudocoelomic.
- Aumentar la presión de equilibrio a aproximadamente 10 psi. Tenga en cuenta un tapón de aceite mineral en la punta de la aguja.
- Empuje el gusano dentro de la aguja a la posición de la punta de la aguja en la cavidad pseudocoelomic moviendo el escenario.
- Tenga en cuenta un salto en la posición del aceite mineral en la punta de la aguja.
- Reducir la presión de equilibrio para permitir que la acción capilar para llenar la aguja. (También se puede usar la función de llenado para acelerar el proceso).
- Después de recoger el gusano diapositiva fluido fuera de la aguja.
- Cambie a la ampliación de baja potencia y la posición de la aguja por el gusano destinatario (NO PERMITEN LA PUNTA AGUJA DE ABANDONAR EL ACEITE MINERAL). [Alternativamente, el soporte de la aguja puede ser eliminado y el fluido transferido a una gotita en un tubo de microcentrífuga.]
- Cambie de nuevo aalta ampliación y mover la aguja en el gusano destinatario deslizando la platina del microscopio.
- Una vez posicionado en el gusano receptor utilizan la inyección (ajustado a 35 psi) para inyectar el fluido pseudocoelomic recolectan de un donante.
- Retire la aguja de la gusano receptor deslizando la platina del microscopio en la dirección opuesta tal como se utiliza para introducir el destinatario.
- Con la aguja fuera del gusano, subir la aguja fuera de la plataforma de inyección.
- Retire la almohadilla de inyección y colocar una gota de M9 sobre los gusanos en recuperarse.
- Coloque una gota de 10 l de M9 en una placa de ensayo.
- Elija el gusano destinatario en la M9 en la placa de ensayo.
4. Ensayo de transferencia de RNAi fenotípica
- Permitir gusanos recuperados de crecer durante 24 horas a 20 ° C.
- Eliminar los adultos receptores, dejando embriones y progenie rayada en la placa. Incubar la placa durante 24 horas a 20 ° C.
- Puntuación progenie comoal no haber tramado, tramado pero siendo fenotípicamente mutante, o ser de tipo salvaje larvas.
Notas
- NGM medios de comunicación se realiza en lotes de 1-litro mediante la adición de 18 g de agar, 2,5 g de bactopeptona, 3 g de cloruro de sodio y H 2 O. Agregar una barra de agitación y autoclave. Después del autoclavado poner el matraz en una placa de agitación y permitir que los medios para enfriar a 60 ° C mientras se agitaba. Cuando el material se ha enfriado, añadir 1 ml de colesterol (5 mg / ml en etanol), 1 ml de 1 M CaCl 2, 1 ml de 1M MgSO 4, 25 ml de tampón de fosfato de potasio (pH 6,0). Si las placas se van a utilizar para la RNAi NGM está suplementado con 1 ml de IPTG 1M y 1 ml de 25 mg / ml de carbenicilina después de enfriar a 60 ° C. Las placas se vertió en cualquiera de 35 mm (3,5 ml de NGM) o 60 mm (8,5 ml de NGM) placas de Petri.
- 2% de agarosa hizo en agua. Conservar en nevera. Fundir y hacer almohadillas bien antes de la días de aislamiento fluido pseudocoelomic. La sequedad de la plataforma hace que el gusano se adhieren a la plataforma,y un mínimo de un día de secado de aire es necesario para que las pastillas a ser lo suficientemente seco. Si las pastillas inyecciones son demasiado secas y sus gusanos donantes desecar más rápidamente que usted puede manipularlos puede agregar humedad adicional a las almohadillas de inyección al respirar en la almohadilla antes de añadir aceite mineral. Sin la capacidad de trabajar con rapidez para aislar el fluido pseudocoelomic antes de que se seque el gusano es absolutamente necesario.
- Usamos carbenicilina a todos los pasos de nuestra preparación de alimentos RNAi para seleccionar el marcador de resistencia a la ampicilina. Carbenicilina es un análogo a la ampicilina que es más estable y da como resultado un menor número de colonias satélite que la ampicilina.
- Usamos placas RNAi que se NGM complementado con 1 mM de IPTG y 25 ug / ml de carbenicilina. Los vectores de alimentación RNAi son en la E. HT115 coli cepa que es deficiente para una nucleasa específica de dsRNA.
- (Paso opcional) Encontramos que, dada una hora en NGM placas unseeded donante y receptor gusanos hacen un trabajo adecuado perder cutículabacterias unidas que se realiza a través de las placas de alimentación. Esto no es cierto, aunque en los casos en que el objetivo de RNAi en el animal donante interfiere con la movilidad (por ejemplo, unc-22 (RNAi)). Por lo tanto, se hace necesaria para ayudar en el proceso. Para ello, se utiliza un portaobjetos de depresión con aproximadamente 50 l de M9. Recogiendo los gusanos en la M9 de las placas de alimentación RNAi, luego se agita con un pico de platino gusano estándar es suficiente para eliminar las bacterias más adherentes.
5. Los resultados representativos
Se presentan resultados representativos para la transferencia experimental para el líquido extracelular de clr-1 (e1745) gusanos que crecen en las bacterias que expresan la orientación dsRNA pal-1. La progenie de los animales donantes murieron y / o defectos posteriores mostraron patrones. A continuación, transfiere el líquido extracelularde estos animales a la pseudoceloma de RNAi ingenuos gusanos de tipo salvaje. Una parte de la progenie posterior del animal receptor continuación, se muestra los fenotipos esperados PAL-1 mutante (Figura 4). Esto es en contraste a la progenie de los animales receptores que recibieron fluido extracelular de animales donantes cultivadas en cualquiera de los dos alimentos estándar bacteriana o de control de RNAi bacterias vector que muestran sólo niveles de fondo de letalidad (Figura 4). Mientras que la progenie de los receptores de líquido extracelular de animales donantes sometidos a RNAi muestran un aumento significativo en la frecuencia de dsRNA fenotipos inducidos, la penetrancia no es tan fuerte como en la progenie de los animales donantes, donde casi el 100% de troquel progenie de los embriones no eclosionados, y sólo animales raros, severamente deformados eclosionar.
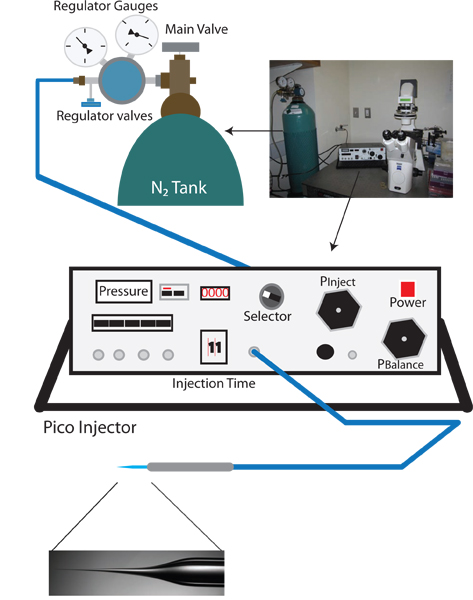
Figura 1. Inversa vampírico configuración de la inyección. El fo configuración adecuadara configuración vampírica microinyección inverso es similar a un estándar de C. elegans aparejo microinyección, e incluye un microscopio de disección, un microscopio invertido con objetivos de 10X y 40X, una etapa móvil para el posicionamiento, y un micromanipulador con soporte de aguja de inyección. Además, un extractor de aguja para la preparación de agujas de inyección también es necesaria. Único en el protocolo inverso microinyección un pico-inyector que permite un control preciso de la presión de equilibrio (por ejemplo Warner Instruments PLI-100) es necesario.
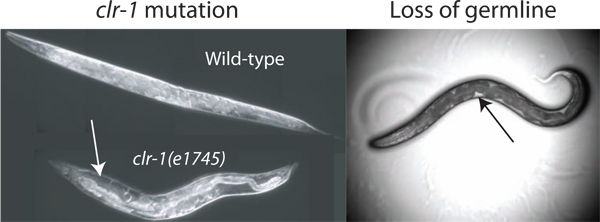
Figura 2. Mejora de volumen pseudocoelomic. El volumen de fluido pseudocoelomic disponible para el aislamiento es insuficiente para el ensayo en animales de tipo salvaje. El volumen se puede aumentar mediante la interrupción de la regulación del equilibrio osmótico a través de cambio de la temperatura de clr-1 (e1745) los animales, lo que resulta en la acumulación de fluido pseudocoelomic evidente (flecha blanca). Además de la pérdida de la gónada por ablación por láser o GLP-1 (RNAi) permite el acceso al fluido extracelular (pérdida por ablación por láser se muestra). El fluido está disponible más fácilmente observados como manchas claras entre el intestino oscuro y la pared del cuerpo (flecha negro), aunque el volumen total disponible es mucho menor que la que se encuentra en clr-1 (e1745) animales cultivadas a la temperatura restrictiva.
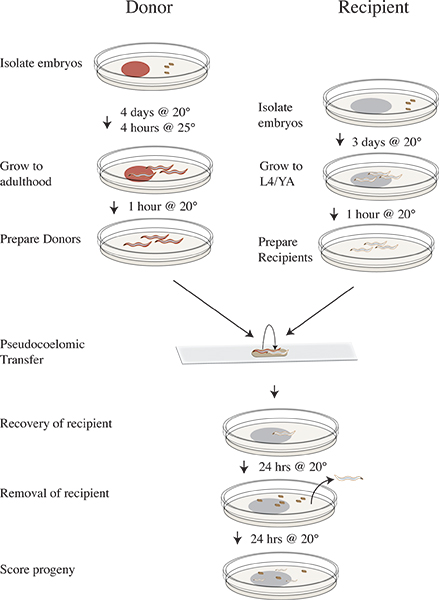
Figura 3. Vampírico aislamiento y la línea de tiempo del protocolo de transferencia. Cuatro días antes de la transferencia experimento aislar clr-1 (e1745) embriones donantes en placas con RNAi alimentos y se incuba a 20 ° C. Tres días antes de aislar embriones receptores N2 en OP50. En el día del experimento desplazar las placas de donantes a 25 ° C durante cuatro horas. Retire los donantes después de 25 ° C de incubación para platos limpios que carecen de alimentos y el cambio a 20 ° C. Mueva los animales receptores para limpiar las placasque carecen de alimentos y continuar incubando a 20 ° C. Realizar el ensayo de transferencia y recuperación de los gusanos receptores sobre OP50 placas e incubar a 20 ° C. Eliminar los animales receptores después de 24 horas a 20 ° C. Incubar progenie destinatario durante 24 horas a 20 ° C. Puntuación progenie de tipo salvaje, mutante, o unhatched.
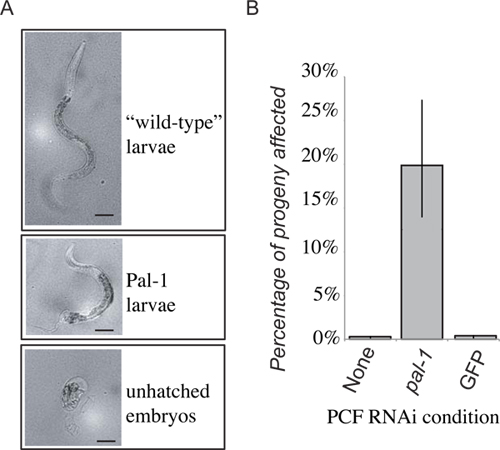
Figura 4. Los resultados representativos. La pérdida de PAL-1 función en el receptor dará lugar a letalidad embrionaria, o pérdida distintivo de desarrollo posterior (A). 48 horas después de la progenie de transferencia PCF establecido dentro de las primeras 24 horas se obtuvo como cualquiera de las larvas de tipo salvaje, las larvas Pal-1, o embriones no eclosionados. La frecuencia de los embriones no eclosionados y fenotípicamente Pal-1 larvas se combinan para dar una medida de PAL-1 (RNAi) fenotipos inducidos por transferencia. La recepción de fluido pseudocoelomic de animales cultivadas en PAL-1 dsRNA alimentos produce una fuerte inducción de la asociadafenotipos que no se ven en los receptores de la transferencia de control (B).
Discusión
Hemos presentado aquí un nuevo método que permite el aislamiento y la caracterización de líquido extracelular del organismo modelo C. elegans. La técnica comienza con la manipulación genética o física de gusanos donantes a incrementar su volumen total de fluido extracelular. Fluido extracelular se aísla a continuación usando una técnica de microinyección modificada. Los gusanos están montados para la microinyección usando almohadillas secas de agarosa para mantener los gusanos inmóvil durante el ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría reconocer la naturaleza de colaboración del laboratorio de Hunter, y darles las gracias por el debate útil y la asistencia que han hecho del desarrollo de esta técnica posible y divertido. Nos gustaría dar las gracias a Nigel Delaney y el Caenorhabditis Centro de Genética para el gusano y las cepas bacterianas. Este trabajo fue financiado por los Institutos Nacionales de Salud de subvención GM089795 a CPH.
Materiales
Día Worm Prep Material Prep
| Name | Company | Catalog Number | Comments |
| -7 O antes | Mantener limpio y bien alimentados Clr-1 (e1745) N2 y gusanos | Hacer almohadillas de inyección, placas de NGM, NGM + Carb / placas de IPTG, OP50 acciones LB | |
| -6 | Streak por RNAi comida en LB + Carb | ||
| -5 | Inocular 3 ml durante la noche con comida RNAi | ||
| -4 | Mover embriones para RNAi placa | Semilla RNAi placa | |
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | Cambie los gusanos a 25 durante 4 horas | Hacer las placas de ensayo | |
| Mover gusanos para limpiar las placas de NGM | |||
| Vampírico transferencia | |||
| Recuperar destinatario | |||
| +1 | Eliminar destinatario de la transferencia | ||
| +2 | Resultado Progenie |
Tabla 1. Timeline preparación de materiales.
Equipos Empresa Número de catálogo Clr-1 (e1745) II 9 GLP-1 RNAi vector 10 Pal-1 RNAi vector 11| Presión del inyector picolitros | Warner Instruments | 65-0001 (PLI-100) |
| Flaming / Brown micropipeta Puller | Sutter Instruments | P97 |
| Axiovert 200 | Zeiss | |
| Reactivos | ||
| Aceite Mineral | EM Science | MX1560-1 |
| 22x50 n º 1 ½ cubierta de cristal | Corning | |
| SeaKem LE agarosa | Lonza | 50004 |
| Vidrio borosilicato capilares | Mundo Precisiones Instrumentos | 1B100F-4 |
| Solución de hipoclorito de sodio (5% de cloro disponible) | JT Baker | 9416-01 |
| C. elegans Y Cepas bacterianas | ||
| El Centro de Genética Caenorhabditis (CGC) | CB3241 | |
| Fuente Bioscience (Biblioteca Ahringer Alimentación) | F02A9.6 | |
| PHC187 | ||
| OP50-GFP 5 | El Centro de Genética Caenorhabditis (CGC) | OP50-GFP |
| YFP E. coli 4 | MC4100-YFP | |
Tabla 2. Reactivos y equipos específicos.
Referencias
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e., Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados