Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vampiric Isolation der extrazellulären Flüssigkeit aus
In diesem Artikel
Zusammenfassung
Die Modell-Organismus C. elegans Verwendet pseudocoelomic Fluid als passives Kreislaufsystems. Direkter Assay dieser Flüssigkeit wurde zuvor nicht möglich. Hier präsentieren wir eine neuartige Technik direkt Assay den extrazellulären Raum, und verwenden systemischen Silencing-Signale während einer RNAi-Antwort als proof of principle Beispiel.
Zusammenfassung
Die genetisch gefügig Modellorganismus C. elegans hat Einblicke in eine Vielzahl von biologischen Fragestellungen vorgesehen, aktiviert durch seine kurze Generationszeit, einfache Wachstum und geringe Größe. Diese geringe Größe, aber hat lehnten eine Reihe von technischen Ansätzen in anderen Modellsystemen gefunden. Zum Beispiel ermöglichen Bluttransfusionen in Säugetier-Systemen und Transplantation Techniken in Anlagen Fragen des Kreislaufsystems Zusammensetzung und Signalisierung. Das Kreislaufsystem der Schnecke, der pseudocoelom, war bis vor kurzem nicht möglich direkt Assay. Um Fragen der interzellulären Signaltransduktion und Kreislaufsystem Zusammensetzung C. beantworten elegans Forscher haben traditionell genetische Analyse, Zelle / Gewebe-spezifische Rettung und Mosaik-Analyse eingeschaltet. Diese Techniken stellen ein Mittel zu folgern, was zwischen Zellen geschieht, sind jedoch nicht universell in Identifizierung und Charakterisierung von extrazellulären Moleküle. Hier präsentieren wir eine neWLY entwickelten Technik direkt Assay die pseudocoelomic Flüssigkeit C. elegans. Die Technik beginnt entweder genetisch oder physikalische Manipulation um das Volumen des extrazellulären Fluids zu erhöhen. Danach werden die Tiere mit einem vampirischen umgekehrter Mikroinjektionstechnik mit einer Mikroinjektion rig, die feine Balance Druckregelung ermöglicht unterzogen. Nach Isolierung der extrazellulären Flüssigkeit, kann die aufgefangene Flüssigkeit durch Überführung in anderen Tieren oder durch molekulare Methoden untersucht werden. Um die Wirksamkeit dieser Technik zu demonstrieren wir eine detaillierte Konzept für Assay ein spezifisches Beispiel der extrazellulären Signalmolekülen, lange dsRNA während einer systemischen RNAi-Antwort. Obwohl Charakterisierung der systemischen RNAi ist ein proof of principle Beispiel sehen wir diese Technik als anpassungsfähig an eine Vielzahl von Fragen des Kreislaufsystems Zusammensetzung und Signalisierung beantworten.
Protokoll
Ein. Herstellung von Materialien
Das Material notwendig vampirischen umgekehrter Mikroinjektion ist ähnlich dem für Standard Mikroinjektion Techniken verwendet, um transgene C. machen erforderlich elegans-Stämme ein. Obwohl einige Reagenzien (z. B. Assay-Platten) hergestellt werden der Tag der experimentellen Übertragung muss viele der Materialien koordinativ über einen 8 Tagen (siehe Tabelle 1 für eine Zeit-Tabelle) hergestellt werden. Als solches ist es wichtig, nach vorne sorgfältig geplant, wenn unter Verwendung dieser Technik (z. notwendigen Reagenzien und Ausrüstung siehe Tabelle 2).
Injection Pads:
- Machen Sie einen 2% igen Lösung in H 2 O und Wärme, bis sie gelöst. Aliquot in 1ml Aliquots in 1,5 ml Reaktionsgefäße und bei 4 ° C.
- Legen Sie 22 x 50 mm Deckgläser auf einer Werkbank mit ihren Rändern leicht vorstehende von der Bank oberen Rand zu erleichtern abholen schnell.
- Pokea kleines Loch in den Deckel des Mikrozentrifugenröhrchen (verwenden Sie eine Reißzwecke), damit Entlüftung. Das Röhrchen wird in einem 15 ml-Becherglas mit etwa 5 ml Wasser und Mikrowellen zu schmelzen (etwa 35 Sekunden).
- Mit einer Pasteurpipette und Birne Ort ein Tropfen (etwa 35 ul) des geschmolzenen Agarose auf einem Deckglas und sofort einen zweiten Deckglas über das Drop in einem 90 ° Winkel zu dem ersten. Wiederholen Sie dies für einige andere Deckgläser.
- Nach Erstarren der Agarose, entfernen Sie das Deckglas und lassen Sie das Pad an der Luft vollständig trocknen über Nacht (bei Bedarf früher, Folien können in einer 50-80 ° C Ofen für 15-30 Minuten gesetzt werden).
- Pads können dann in einem Deckglas box bei Raumtemperatur unbegrenzt lagerfähig.
Assay-Platten:
Zur Untersuchung der embryonalen Letalität mit PAL-1 RNAi, die Vorbereitung von Assay-Platten verbunden sind, sollten am Tag der vampirischen Experiment durchgeführt werden. Das Ziel ist, have eine minimale Bakterienrasen zwar nicht hungern Ihre Würmer. Eine zu dicke Rasen macht erziehlt Pal-1 Larven äußerst schwierig, da die kleinen, durchscheinenden verformt L1 Tieren kann leicht in der Lebensmittel verloren. Platte Zubereitung sollte zum Ritzen der Phänotyp von Interesse optimiert werden.
- Planen OP50: Seed 5mLs von LB-Medium mit einer einzelnen Kolonie OP50 auf LB-Agar-Platten gezüchtet. Inkubieren OP50 bei 37 ° C über Nacht unter Schütteln bei 4 ° C lagern
- Bereiten 35 mm NGM-Platten nach grundlegenden Protokoll (siehe Anmerkung 1).
- Spot 20 ul der Nacht OP50 Kultur (Schritt 1,7) auf jede NGM Platte. Erlauben der LB-OP50 zu trocknen (dies sollte weniger als 20 Minuten).
Injektionsnadeln:
- Ziehen Sie Injektionsnadeln aus Borosilikatglas Kapillaren mit einem P97 flammenden / braun Feinpipettenziehvorrichtung von Sutter Instrumente (siehe Abbildung 1 für repräsentative Nadelform).
- Shop InjektionNadeln in einem Nadelhalter aus einer Petrischale und Knetmasse (siehe 1) konstruiert.
2. Vorbereitung von Worms
Die geschätzte pseudocoelomic Volumen eines erwachsenen C. elegans Hermaphrodit ist 40-80 Picoliter (pers. com. David Hall). Um Proben von extrazellulärem Fluid von einem so kleinen Vorratsbehälter zu erhalten ist es vorteilhaft, das insgesamt zur Verfügung stehende Ressource zu erhöhen. Wir haben drei Methoden identifiziert stark erhöhen die verfügbaren Flüssigkeit in den Spender Würmer. Unsere primäre Methode nutzt den Phänotyp clr-1 (e1745) Mutanten, die eine 10-fache oder mehr im extrazellulären Flüssigkeitsvolumen (Abbildung 2) verursachen können. Die beiden alternativen Methoden nutzen die Tatsache, dass die Keimbahn macht fast ein Drittel des Gesamtvolumens der Wurm und seine Entfernung durch GLP-1 (RNAi) oder Laserablation Ergebnisse bei Tieren mit pseudocoelomic Fluid die Keimbahn Lücke füllen (Abbildung 2) 2 </ Sup>.
Vorbereitung von Spender-Würmer mit clr-1 (e1745)
Siehe Abbildung 3 für clr-1 (e1745)-Assay-Workflow
- Streak von Bakterien, die dsRNA für einzelne Kolonien auf LB + 25μg/mL Carbenicillin Platten. Wir werden pal-1 dsRNA produzierenden Bakterien für diese Demonstration zu verwenden. Inkubieren über Nacht bei 37 ° C.
- Von einem gestreiften LB + 25 ug / ml Carbenicillin Platte von pal-1 (RNAi)-Bakterien, wählen Sie eine einzelne Kolonie eine 3 mL Übernachtkultur in LB mit 25μg/mL Carbenicillin ergänzt impfen.
- Pipette 15 ul Übernachtkultur auf 35mm NGM-Platten mit 25 ug / ml Carbenicillin und 1 mM IPTG ergänzt. Achten Sie darauf, auf die Platte, die Bakterien aus der Mitte der Platte. Trocknen lassen (ca. 20 Minuten).
- Stellen Sie 500 ul frischem Bleichlösung (1:1 5M KOH: NaHypochlorite).
- Je 10 ul von Bleichmittel Lösung auf dem seeded Platte. Achten Sie darauf, to Stellen Sie das Bleichmittel Tropfen weg von der bakteriellen Fleck.
- Um einen kleinen, sauberen, synchronisiert Bevölkerung clr-1 (e1745) Tiere für Reverse Mikroinjektion zu erhalten, wählen Sie 2-10 gravid Erwachsenen in der Bleiche Tropfen. Die Erwachsenen aufzulösen, so dass saubere, teilweise entwicklungspolitisch inszeniert Embryonen. Diese Embryonen werden dann schlüpfen und die Larven werden die Lebensmittel kriechen.
- Inkubieren für vier Tage bei 20 ° C.
- Verlagern Platten bis 25 ° C für vier Stunden zu induzieren Schwellung.
- Pick-Würmern zu einem ungesetzte NGM Platte und genügend Zeit, um klar aus Bakterien aus der Nagelhaut. (Optionaler Schritt) Spülen Würmer in M9 während der Übertragung auf NGM-Platten.
- Bewegen L4/Young Erwachsene (YA) Empfänger Würmern zu einem ungesetzte Platte NGM Platte und genügend Zeit, um klar aus Bakterien aus der Nagelhaut. (Optionaler Schritt) Spülen Würmer in M9 während der Übertragung auf NGM-Platten.
A2) Alternative Herstellung von Würmern Donor mit GLP-1 (RNAi)
- Von einem gestreiften PlatteLB + 25 ug / mL Carbenicillin inokulieren eine 3 ml Übernachtkultur von LB mit Carbenicillin mit einer einzelnen Kolonie von GLP-1 (RNAi) Bakterien ergänzt. Bei 37 ° C über Nacht.
- Pipette 15 ul GLP-1 (RNAi)-Nacht-Kultur auf einer 35 mm NGM Platte mit 25 ug / mL Carbenicillin und 1mM IPTG ergänzt. Inkubation bei Raumtemperatur über Nacht.
- Übertragen fünf L3/L4 Tiere zu den GLP-1 (RNAi)-Platten. Inkubieren für zwei Tage bei 20 ° C. Die RNAi-Targeting GLP-1 führt zu Nachkommen mit Keimbahn Verbreitung Mängel. Die Unfähigkeit zur vollen Entfaltung der Keimbahn Ergebnisse im unbesetzten Raum, der mit extrazellulären Flüssigkeit füllt. Optimierung der RNAi Lebensmittel Nachkommen, dass die Fortschritte bis zum Erwachsenenalter, ohne proliferative Keimbahnen kann notwendig sein, je zu generieren.
- Vorbereitet pal-l (RNAi)-Platten, wie in Schritten von 2,1 bis 2,3 des clr-1 (e1745) worm Vorbereitung Protokoll oberhalb haben.
- Machen Sie eine frische Bleiche Lösungention (1:1 5M KOH: NaHypochlorite).
- Je 10 ul von Bleichmittel Lösung auf dem seeded pal-1 (RNAi) Platte. Achten Sie darauf, dass das Bleichmittel Tropfen weg legen aus dem bakteriellen Fleck.
- Übertragen Embryonen durch Kommissionierung 2-10 gravid GLP-1 (RNAi) Erwachsene in der Bleiche Tropfen.
- Inkubieren für vier Tage bei 20 ° C.
- Pick-Würmern zu einem ungesetzte 60mm NGM Platte und genügend Zeit, um klar aus Bakterien aus der Nagelhaut. (Optionaler Schritt) Spülen Würmer in M9 während der Übertragung auf NGM-Platten.
B2) Alternative Herstellung von Spender-Würmer mit Keimbahn Laserablation
- Streak von Bakterien, die dsRNA für einzelne Kolonien auf LB + 25 ug / ml Carbenicillin Platten. Wir werden pal-1 dsRNA produzierenden Bakterien für diese Demonstration zu verwenden. Inkubieren über Nacht bei 37 ° C.
- Von einem Teller mit Carbenicillin impfen eine 3 mL Übernacht-Kultur in LB mit 25 ug / mL Carbenicillin ergänzt.
- Pipette 15 ul the Übernachtkultur von pal-1 dsRNA-exprimierenden Bakterien auf 35 mm NGM-Platten mit 25 ug / ml Carbenicillin und 1mM IPTG ergänzt. Lassen Sie über Nacht trocknen.
- Isolieren L1 Tiere aus Standard-OP50 Platten-und Laser-Ablation die somatische Keimbahn-Vorläuferzellen Z1 und Z4 über ein standardisiertes Protokoll 3.
- Recover Laser abgetragen Würmer auf den genannten PAL-1 RNAi Platten.
- Einer Inkubationszeit von 3 Tagen bei 20 ° C.
- Pick-Würmern zu einer sauberen NGM Platte und genügend Zeit, um klar aus Bakterien aus der Nagelhaut. (Optionaler Schritt) Spülen Würmer in M9 während der Übertragung auf NGM-Platten.
Vorbereitung des Empfängers Würmern
- Streak von OP50 einzelne Kolonien auf LB-Platten. Inkubieren über Nacht bei 37 ° C.
- Von der LB-Platte beimpft eine 3 mL Übernachtkultur in LB.
- Pipette 15 ul der Übernachtkultur auf 35 mm NGM-Platten. Achten Sie darauf, auf die Platte, die Bakterien aus der Mitte der Platte. Trocknen lassen (ca. 20 Minuten).
- Machen Sie eine frische Bleichlösung (1:1 5M KOH: NaHypochlorite).
- Je 10 ul von Bleichmittel Lösung auf dem seeded Platte. Achten Sie darauf, dass das Bleichmittel Tropfen weg legen aus dem bakteriellen Fleck.
- Übertragen Embryonen durch Kommissionierung 2-10 gravid N2 Erwachsenen in der Bleiche Tropfen.
- Inkubieren für drei Tage bei 20 ° C.
- Bewegen Sie Würmer auf eine saubere, ungesetzte NGM Platte und inkubieren bei 20 ° C für mindestens 30 Minuten.
3. Vampiric Isolation der extrazellulären Flüssigkeit
Das folgende Protokoll ist spezifisch für eine Mikroinjektion Set-up, bestehend aus einem pli-100 Pico-Injektor, eine stationäre Nadel im Mikromanipulator gehalten, und einem schwimmenden Stadium in dem die Schnecke in die Nadel geschoben werden kann. Jedoch ist die allgemeine Technik, um eine leere Nadel in eine Mikroinjektion Spendertier einzufügen, während ein ausreichender Druck zur Verhinderung Kapillare in Strömungsrichtung an Mineralöl vor dem Eintritt und zellulären material während Eindringen in den Körper Wandgewebes. Während sich die Nadel in einem Donortier Druck reduziert wird, um kapillare Befüllung der Nadel mit extrazellulären Flüssigkeit, die dann in der Nadel kann an einen Empfänger Schnecke bewegt werden und vertrieben durch Erhöhung des Druckes ausreichend ermöglichen. Entfernen der Flüssigkeit durch Kapillarwirkung kann auch durch Verwendung der Füllung unterstützt, oder Absaugen, Funktion des Pico-Injektors. Diese verallgemeinerte Technik sollte einfach an andere Mikro-Einspritzsysteme, die Kontrolle von Balance Druck zu ermöglichen.
- Schalten Sie die inverse Mikroskop der Dissektionsmikroskop und pico-Injektor (siehe Abbildung 1).
- Drehen Sie den Knopf des Pico Injektor P klar, und prüfen Sie, ob die aktuelle Messung in psi ist. Diese Lesart, die klare Druck ist der Eingangsdruck und sollte etwa 0 psi sein.
- Überprüfen das Hauptventilorgan am Stickstoff Tankregler um sicherzustellen, dass der Ausgang geschlossen ist (wiederum counterclockwise bis Knopf ist lose).
- Öffnen Sie das Stickstoff-Tank Ventil. Der Regler Manometer am nächsten der N2 Tank sollte nun den Innendruck des Tanks.
- Steigern Sie langsam die aus Druck durch Drehen des primären Regulierventil im Uhrzeigersinn. Überwachen Sie den zunehmenden Druck auf die pico-Injektor (dies ist genauer als der Ausgangsdruck Lesung am Regler gauge). Langsam erhöhen den Druck auf 100 psi. Nicht in die 105 psi ÜBERSTEIGEN.
- Wenn 100 psi erreicht stellen Sie den Schalter zu injizieren und den Einspritzdruck auf 30 psi unter Verwendung des Pinject Regler P.
- Schalten Sie den Drehknopf, um P Gleichgewicht.
- Legen Sie eine 15 ul Tropfen Mineralöl auf Ihre saubere Spender und Empfänger Platten.
- Bedecken Sie 2% igen Injektion Pad in Mineralöl.
- Legen Sie zog Mikropipette Nadel in die Halterung und ausrichten.
- Verwendung einer Dissektionsmikroskop Montieren ein Donor-und ein Empfänger Schnecke in der Nähe zueinander auf dem Agarose pad.
- Position Würmer mit geringer Vergrößerung und bringen Nadel in der Mineralölindustrie in der Nähe des Spenders.
- Zu bewegen, um hohe Leistung und Position Nadel in der Nähe einer pseudocoelomic Hohlraum.
- Erhöhen Sie die Balance Druck auf etwa 10 psi. Beachten ein Mineralöl Stecker an der Spitze der Nadel.
- Schieben Sie den Wurm in die Nadel, um die Nadelspitze in der pseudocoelomic Hohlraum durch Bewegen der Bühne zu positionieren.
- Beachten einen Sprung in der Position des Mineralöls in der Spitze der Nadel.
- Verringerung des Drucks auf Gleichgewicht Kapillarwirkung zu ermöglichen, um die Nadel zu füllen. (Man kann auch die Füllung Funktion, um den Prozess zu beschleunigen).
- Nach dem Sammeln Flüssigfolie der Wurm von der Nadel weg.
- Wechseln Sie zu geringer Leistung Vergrößerung und Position der Nadel durch den Empfänger Wurm (NICHT ERLAUBT Die Nadelspitze, das Mineralöl zu verlassen). [Alternativ kann der Nadelhalter entfernt und die Flüssigkeit eines Tropfens in einem Mikrozentrifugenröhrchen übertragen.]
- Wechseln Sie wieder zuhoher Vergrößerung und bewegen Sie die Nadel in den Empfänger-Wurm, indem Sie den Mikroskoptisch.
- Einmal in den Empfänger-Wurm positioniert verwenden die Injektion (eingestellt auf 35 psi) Funktion, um die pseudocoelomic Flüssigkeit aus dem Spender entnommen injizieren.
- Entfernen der Nadel aus dem Empfänger Wurm durch Verschieben der Mikroskoptisch in der entgegengesetzten Richtung wie verwendet, um die Empfänger einzugeben.
- Mit der Nadel aus der Wurm, heben Sie die Nadel von der Injektion Pad.
- Entfernen Sie die Injektion Pad und platzieren Sie einen Tropfen M9 auf den Würmern zu erholen.
- Legen Sie eine 10 ul Tropfen M9 auf einer Testplatte.
- Wählen Sie den Empfänger Wurm in der M9 auf der Testplatte.
4. Testen RNAi Phänotypische Übertragung
- Lassen Sie erholt Würmer für 24 Stunden bei 20 ° C wachsen
- Entfernen Empfänger Erwachsenen, so dass Embryonen und geschlüpften Nachkommen auf dem Teller. Inkubieren Platte für weitere 24 Stunden bei 20 ° C.
- Ergebnis Nachkommenschaftnachdem nicht schraffiert, schraffierte aber als phänotypisch Mutanten oder als Wildtyp-Larven.
Aufzeichnungen
- NGM Medien werden in 1-Liter-Chargen durch Zugabe von 18 g Agar, 2,5 g Bactopepton, 3 g Natriumchlorid und H 2 O aus Fügen Rührstab und Autoklaven. Nach dem Autoklavieren legte die Flasche auf einer Rührplatte und lassen Sie die Medien auf 60 ° C abkühlen unter Rühren. Nachdem das Medium abgekühlt ist, fügt man 1 ml Cholesterin (5 mg / ml in Ethanol), 1 ml 1 M CaCl2, 1 ml 1 M MgSO 4, 25 ml Kaliumphosphatpuffer (pH 6,0). Wenn Platten für RNAi Gebrauch sind die NGM wird mit 1 ml 1 M IPTG und 1 ml 25 mg / ml Carbenicillin nach Abkühlen auf 60 ° C ergänzt Die Platten werden in entweder 35 mm (3,5 ml der NGM) oder 60 mm (8,5 mL NGM) Petrischalen gegossen.
- 2% Agarose in Wasser. Im Kühlschrank aufbewahren. Schmelzen und Pads im Vorfeld des Tages der pseudocoelomic Flüssigkeit Isolation. Die Trockenheit des Polsters ermöglicht die Schnecke mit dem Kissen anhaften,und mindestens einen Tag Lufttrocknung ist notwendig für den Pads trocken genug sein. Wenn die Injektionen Pads sind zu trocken und Ihre Spender Würmer schneller Austrocknung, als man sie zu manipulieren können zusätzliche Feuchtigkeit der Injektion Pads hinzuzufügen durch die Atmung auf das Pad vor Zugabe von Mineralöl. Unabhängig von der Fähigkeit, schnell zu arbeiten, um pseudocoelomic Flüssigkeit vor der Wurm trocknet zu isolieren ist absolut notwendig.
- Wir verwenden Carbenicillin auf allen Stufen unserer RNAi Zubereitung von Speisen für die Ampicillin-Resistenz-Marker auszuwählen. Carbenicillin ist ein Ampicillin-Analogon, das stabiler und führt zu weniger Satelliten Kolonien als Ampicillin ist.
- Wir verwenden RNAi Platten, die NGM mit 1 mM IPTG und 25 ug / mL Carbenicillin ergänzt werden. Die RNAi Fütterung Vektoren sind in der HT115 E. coli-Stamm, der defizient für eine dsRNA spezifischen Nuklease.
- (Optional Step) Wir finden, dass angesichts einer Stunde auf ungesetzte NGM-Platten Spender und Empfänger Würmern zu tun eine angemessene Arbeit zu verlieren Schuppenschichtgebundenen Bakterien, die über von den Fütterung Platten durchgeführt. Das stimmt nicht aber in Fällen, in denen das RNAi-Ziel im Donortier stört Mobilität (zB unc-22 (RNAi)). Es wird daher notwendig, in den Prozess zu unterstützen. Um dies zu tun, verwenden wir eine Depression Schlitten mit etwa 50 ml M9. Picking Würmer in der M9 von den RNAi Fütterung Platten, dann unter Rühren mit einem Standard-Platin-Wurm Pick ist ausreichend, um die meisten adhärenten Bakterien zu entfernen.
5. Repräsentative Ergebnisse
Präsentiert werden repräsentative Ergebnisse für die experimentelle Übertragung für extrazelluläre Flüssigkeit aus clr-1 (e1745) Würmer auf Bakterien, die dsRNA Targeting pal-1 gewachsen. Die Nachkommen der Spendertiere starb und / oder ausgestellt posterior Musterbildung Mängel. Wir haben dann übertragen extrazellulären Flüssigkeitaus diesen Tieren die pseudocoelom der RNAi naiv Wildtyp-Würmer. Ein Teil des nachfolgenden Nachkommenschaft der Empfängertier dann die erwarteten pal-1 Mutantenphänotypen (Abbildung 4) angezeigt. Dies steht im Gegensatz zu den Nachkommen der Empfängertiere, der extrazellulären Flüssigkeit von Spendertieren auf beiden Standard oder Kontrolle bakterieller Lebensmittel RNAi Vektor Bakterien, die nur Hintergrundwerte von Letalität (Abbildung 4) angezeigt gezüchtet übermittelt. Während Nachkommen der Empfänger von extrazellulären Flüssigkeit von Spendertieren unterziehen RNAi zeigen einen signifikanten Anstieg in der Häufigkeit von dsRNA induzierten Phänotypen, ist die Penetranz nicht so stark wie in den Spendertieren 'Nachkommen, wo fast 100% der Nachkommen sterben unhatched Embryonen und Nur selten, stark verformte Tiere schlüpfen.
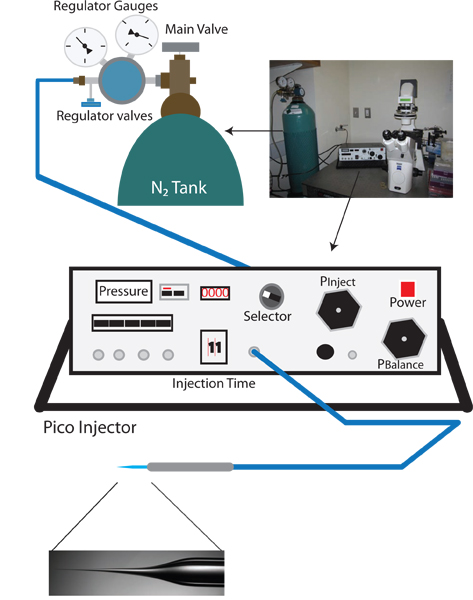
Abbildung 1. Vampiric reverse Injektion Setup. Der entsprechende Setup-fora vampirischen umgekehrter Mikroinjektion Setup ist ähnlich wie bei einem Standard-C elegans Mikroinjektion rig und umfasst einen Dissektionsmikroskop, einem inversen Mikroskop mit 10X und 40X Ziele, einen beweglichen Tisch zum Positionieren, und einen Mikromanipulator mit Injektionsnadelhalter. Zusätzlich wird eine Nadel Ziehvorrichtung zur Herstellung von Injektionsnadeln ebenfalls benötigt. Einzigartig an der Rückseite Mikroinjektion Protokoll ein pico-Injektor, der feine Steuerung der Balance Druck ermöglicht (zB Warner Instruments PLI-100) benötigt wird.
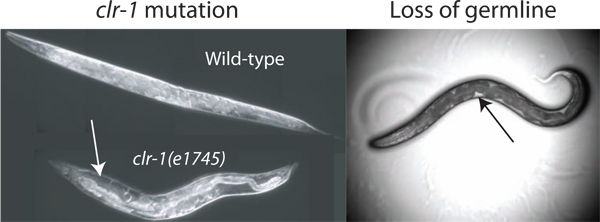
Abbildung 2. Verbesserung der pseudocoelomic Volumen. Das Volumen der Flüssigkeit sofort pseudocoelomic Isolierung unzureichend ist für einen Assay in Wildtyp-Tieren. Die Lautstärke kann durch Unterbrechung der Regelung des osmotischen Gleichgewichts durch Temperatur Verschiebung clr-1 (e1745) Tiere, die sich in der Hand Ansammlung von pseudocoelomic Flüssigkeit (weißer Pfeil) erhöht werden. Zusätzlich wird der Verlust der Gonaden durch Laserablation oder GLP-1 (RNAi) ermöglicht den Zugriff auf extrazelluläre Flüssigkeit (Verlust durch Laserablation ist gezeigt). Die verfügbare Fluid wird am leichtesten als klare Patches zwischen dem dunklen und dem Darm Körperwand (schwarzer Pfeil) beobachtet, obwohl die gesamte verfügbare Volumen ist viel geringer als der in clr-1 (e1745) Tieren bei der restriktiven Temperatur gezüchtet gefunden.
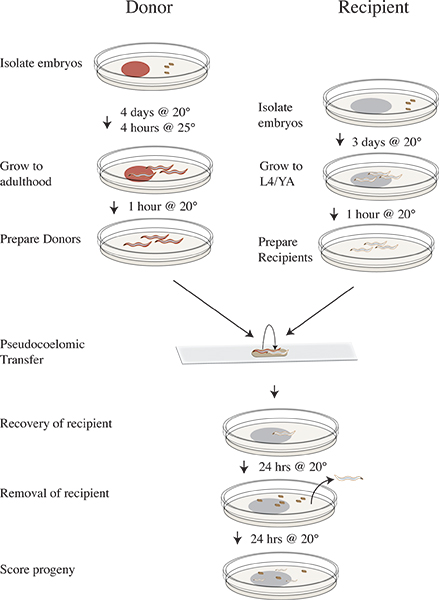
Abbildung 3. Vampiric Isolation und Transfer Protocol Timeline. Vier Tage vor dem Transfer Experiment zu isolieren clr-1 (e1745) Spenderembryonen auf Platten mit RNAi Essen und inkubieren bei 20 ° C. Drei Tage vor isolieren N2 Empfänger Embryonen auf OP50. Am Tag des Experiments verschieben die Donor Platten bis 25 ° C für vier Stunden. Entfernen Sie die Spender nach der 25 ° C Inkubation, um saubere Teller fehlen Nahrungsmittel und Verschiebung bis 20 ° C. Verschieben Sie die Empfänger-Tiere Platten reinigenfehlen Nahrungsmittel und weiterhin Inkubation bei 20 ° C. Führen Transfer Experiment und erholen Empfänger Würmer auf OP50 Platten und Inkubation bei 20 ° C. Entfernen Sie die Empfänger-Tieren nach 24 Stunden bei 20 ° C. Inkubieren Empfängers Nachkommen für 24 Stunden bei 20 ° C. Ergebnis Nachkommen als Wildtyp-Mutanten oder unhatched.
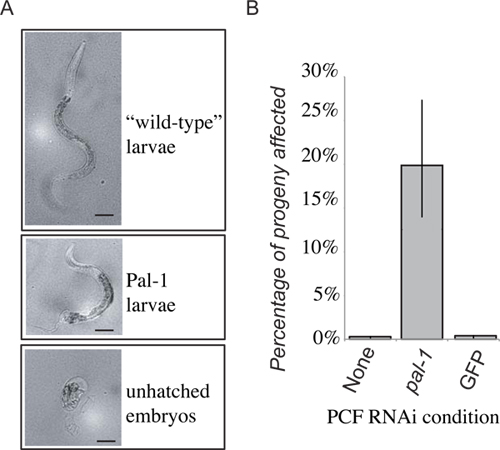
Abbildung 4. Repräsentative Ergebnisse. Der Verlust von PAL-1-Funktion in den Empfänger in der embryonalen Letalität oder markanten Verlust der hinteren Entwicklung (A) führen. 48 Stunden nach PCF Transfer Nachkommen, die innerhalb der ersten 24 Stunden verlegt werden entweder Wildtyp-Larven, Pal-1 Larven oder unhatched Embryonen erzielt. Die Häufigkeit der unhatched Embryonen und phänotypisch Pal-1 Larven werden kombiniert, um ein Maß für pal-1 (RNAi) Transfer induzierten Phänotypen ergeben. Erhalt der pseudocoelomic Flüssigkeit aus Tieren auf PAL-1 dsRNA Lebensmittel angebaut erzeugt eine starke Induktion von assoziiertenPhänotypen unsichtbaren Kontrolle Transferempfänger (B).
Diskussion
Wir haben hier ein neuartiges Verfahren, das die Isolierung und Charakterisierung der extrazellulären Flüssigkeit von der ermöglicht Modellorganismus C. vorgestellt elegans. Die Technik beginnt mit der genetischen oder physikalische Manipulation von Spender Würmer ihr Gesamtvolumen der extrazellulären Flüssigkeit zu erhöhen. Extrazellulären Flüssigkeit wird dann isoliert unter Verwendung eines modifizierten Mikroinjektionstechnik. Die Würmer sind für die Mikroinjektion mit trockener Agarose-...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir möchten den kooperativen Charakter der Hunter-Labor bestätigen, und danke ihnen für die hilfreiche Diskussionen und Unterstützung, die Entwicklung dieser Technik möglich und Spaß gemacht. Wir möchten Nigel Delaney und Caenorhabditis Genetics Center for Wurm und Bakterienstämme danken. Diese Arbeit wurde von den National Institutes of Health GM089795 Zuschuss CPH unterstützt.
Materialien
Day Worm Prep Material Prep
| Name | Company | Catalog Number | Comments |
| -7 Oder Standes | Pflegen sauber, gut gefüttert Clr-1 (e1745) N2 und Würmern | Make Injektion Pads, NGM-Platten, NGM + Carb / IPTG Platten, OP50 LB Lager | |
| -6 | Streak von RNAi Essen auf LB + Carb | ||
| -5 | Impfen 3 mL Übernachtung mit RNAi Lebensmitteln | ||
| -4 | Bewegen Embryonen RNAi Platte | Seed RNAi Platte | |
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | Umschalttaste Würmern bis 25 für 4 Stunden | Make Testplatten | |
| Bewegen Würmer NGM-Platten reinigen | |||
| Vampiric Transfer | |||
| Wiederherstellen Empfänger | |||
| +1 | Entfernen Übertragungsbehältnis | ||
| +2 | Score Progeny |
Tabelle 1. Material Vorbereitung Timeline.
Ausrüstung Unternehmen Katalog-Nummer Clr-1 (e1745) II 9 GLP-1 RNAi-Vektor 10 PAL-1 RNAi-Vektor 11| Picoliter Druck Injector | Warner Instruments | 65-0001 (PLI-100) |
| Flaming / Brown Feinpipettenziehvorrichtung | Sutter Instruments | P97 |
| Axiovert 200 | Zeiss | |
| Reagenzien | ||
| Mineral Oil | EM Science | MX1560-1 |
| 22x50 no 1 ½ Deckglas | Corning | |
| SeaKem LE Agarose | Lonza | 50004 |
| Borosilikatglas Kapillaren | World Precisions Instruments | 1B100F-4 |
| Natriumhypochlorit-Lösung (5% verfügbares Chlor) | JT Baker | 9416-01 |
| C. elegans Und Bakterienstämme | ||
| Die Caenorhabditis Genetics Center (CGC) | CB3241 | |
| Source Bioscience (Ahringer Feeding Library) | F02A9.6 | |
| PHC187 | ||
| OP50-GFP 5 | Die Caenorhabditis Genetics Center (CGC) | OP50-GFP |
| YFP E. coli 4 | MC4100-YFP | |
Tabelle 2. Spezifische Reagenzien und Geräte.
Referenzen
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e., Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten