需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
硬膜外颅内压测量中使用的光纤压力传感器的大鼠
摘要
介绍一种新的技术来记录颅骨内的压力。微创的方法是使用一个光纤压力传感系统,准确地测量不会造成重大的脑外伤颅内压(ICP)在麻醉大鼠。该技术可以用在广泛的实验模型。
摘要
升高颅内压(ICP)是一个重大的问题,在缺血性脑损伤的几种形式,包括中风,脑外伤和心脏骤停。这个海拔可能导致进一步的神经损伤,小脑幕1,2,3,4症,脑压,神经赤字或增加脑梗塞2,4的 形式。目前的治疗方法往往不足以控制在临床上设置5,6,7 ICP升高。因此,有一个准确的ICP测量方法,在动物模型中需要进一步我们的基本机制的理解和发展新的治疗方法为ICP升高。
在临床和实验设置ICP备无法估计没有直接测量。目前存在的几种方法ICP导管插入。这些脑室导管已成为临床上的“金标准”的ICP测量人类8。这种方法INVolves颅骨部分切除和导管通过脑组织的仪器。因此,脑室导管感染发生率6-11%9。出于这个原因,硬膜下和硬膜外cannulations的缺血性损伤的动物模型已成为首选方法。
各种ICP测量技术已被改编为动物模型,其中,充满液体的的遥测导管10和固态导管是最常用的11,12,13,14,15。充液系统开发行中的气泡,很容易造成假ICP备读数。固态探头避免此问题( 图1)。另外一个问题是没有根据头骨或装修成心室导管造成脑损伤,可能会改变实验结果。因此,我们已经开发出一种方法,连续硬膜外腔放置一个ICP导管,但避免了NE插入颅骨和大脑之间。
一个光纤压力导管(420LP,SAMBA传感器,瑞典),用来衡量在硬膜外位置ICP因为压力传感器(导管很尖)的位置被发现产生在这个模型中的信号高保真ICP 。有其他厂家类似的光纤技术,可与我们的方法使用的13。替代固态导管,导管尖端一侧有压力传感器,将不适合这种模式的信号将挫伤由监测螺丝的存在。
在这里,我们提出了一个相对简单和准确的方法来衡量ICP备。这种方法可用于广泛的跨ICP备相关的动物模型。
研究方案
1。头骨穿透
- 麻醉与异氟醚(5%的诱导,维护1.5-2%)在70%N2和30%O 2的老鼠。麻醉诱导后,将大鼠俯卧变暖板,老鼠的鼻子在麻醉鼻锥定位。
- 虽然维持麻醉,固定在头部立体定向框架,插入耳酒吧,直到头部稳定。确保呼吸不受损害。 ( 图2 A)。
- 头皮皮下注入持久的局部麻醉,布比卡因0.3毫升0.5%(辉瑞公司,澳大利亚),然后才作出一个1.5厘米的皮肤中线头部切口。 (无菌文书和手套,应使用)。
- 钝性解剖的软组织及周围的肌肉,清楚地定位Lambda和前囟门。收回的皮肤和结缔组织。
- 暴露颅骨施加压力,制止任何出血。颅骨出血过多可能被烧灼。
- 使用牙科DRILL与1毫米尖端的毛刺,毛刺一个洞2毫米宽的右顶骨。伯尔孔横向和2毫米,2毫米前囟门后,以避免上矢状窦,确保安置的ICP传感器是在缺血的领土,中风的研究。替代的位置,也同样适用于其他应用程序。伯尔孔深度其中硬脑膜以上的头骨变为半透明。 ( 图2-B的 )。
- 更换0.5毫米尖毛刺毛刺去除颅骨洞基地。
- 当头骨开始开裂,使用45°钳清除所有剩余的头骨,清除杂物,确保孔的基础。 ( 图3)。
2。螺杆修改和插入
- 通过六角头螺丝,使用一台车床和0.7毫米的钻头钻一个0.7毫米的孔。
- 监测螺丝插入孔内转动约1.5圈(使用的最低金额原来需要,以确保在颅骨螺钉,以免损害底层组织)。 ( 图2-C和图4)。
- 伯尔第二洞一个在左顶骨锚定螺钉,外侧2毫米和2毫米,前囟门后。这个洞并不需要完整的头骨渗透,因此,1毫米尖端毛刺用于薄螺丝插入头骨。
- 插入第二个孔,2×4毫米六角头螺钉。此螺钉固定的牙科水泥,因此监测螺丝头骨。
- 使用移液管混合,适用于牙科水泥单体及聚合物,螺丝头的基础。
- 允许牙科水泥干燥至少10分钟。
3。颅内压力传感器插入
- 用白色涂改液,标志着尖端的光纤传感器从4毫米。
- 填补了用无菌生理盐水(0.9%)的监测螺丝孔,确保没有气泡内螺纹。
- 插入ICP探头4毫米到螺钉,使探头尖端是螺杆年底的水平。确保针尖不会刺破硬脊膜。
- 调整螺钉内探针的尖端,可以观察到,直到ICP跟踪反映通风和血压脉冲波。 ( 图5)。
4。形成一个密闭的密封
- 一个密封的密封是必须准确的ICP阅读。混合一种粘稠的生物相容性嵌缝材料中的比例为1:1的单体和聚合物。因为压力传感器探头的尖端,这是的挖空螺丝内,嵌缝材料的应用,以光纤探针轴有没有压力传感器灵敏度的影响。
- 应用探头周围的一层薄薄的监测螺丝头。避免取代ICP探头。
- 允许设置为5分钟。
- 申请第二次裁员呃,整个监测螺钉和探头周围的嵌缝材料。从任何裂隙在嵌缝材料,确保没有液体泄漏。 ( 图的2-D)。
- 卸下耳朵酒吧。
- 老鼠可能会保持在俯卧位,或小心地将在ICP监测仰卧位旋转。
- 完成过程的示意图所示( 图6)。
5。颅内压传感器的拆卸和重新安置
- 在完成ICP监测,ICP传感器可能会被轻轻拉螺杆和嵌缝材料导管。
- 桑巴传感器应立即放入1%Terg-A酶的解决方案,以防止尖端腐蚀。
- 孔留在嵌缝材料应包括与嵌缝材料的附加层。 (大鼠,在这个阶段可能会被唤醒)。
- 重新插入额外的监测桑巴导管,切嵌缝材料在螺丝头的水平。
- 重复步骤3.2 - 5.3。
6。代表结果
图5是ICP的读数超过十秒钟的代表性。在基线,在大鼠的平均ICP是6毫米汞柱。在图5所示的短周期事件反映血压脉冲波。周期较长的事件表明通风事件。请注意,SAMBA传感器反映了通风幅度为3-4毫米汞柱,脉搏振幅1-2毫米汞柱。
在每次实验来验证的桑巴传感器的位置,ICP的痕迹,应进行腹部按压和呼吸活动,如呼吸暂停期间,为响应。 图7描述了一个腹部的压缩。
在大多数实验invo观察期间的呼吸暂停( 如图8所示) lving自发呼吸的动物。呼吸上呼吸道(膈肌传感器)和动脉压的痕迹变形的情况下,这些事件被认定生理记录。相当于改变在ICP跟踪验证ICP探头定位。
图9描述了一个典型的ICP跟踪后去除耳酒吧(步骤4.6)。插入耳酒吧轻微的头骨和在颅内量随之中断,在压缩的步骤1.2结果,从而增加ICP。如果传感器被正确定位,ICP将下降至少4 - 5毫米汞柱,去除耳酒吧。
可用于组织学分析,以检查皮质区立即下的压力传感器和螺杆造成任何损害。创伤性和非创伤性的螺丝插入的一个例子如图4所示。
_upload/3689/3689fig1.jpg“/>
图1。充满液体VS桑巴ICP备痕迹。ICP是通过Samba的光纤导管( 顶部 )和一个充满液体的导管( 底部 ),同时记录。平均ICP值相似,在这两个痕迹,但充满流体的导管信号,特别是打击较清晰的呼吸和动脉血压波形与光纤导管。
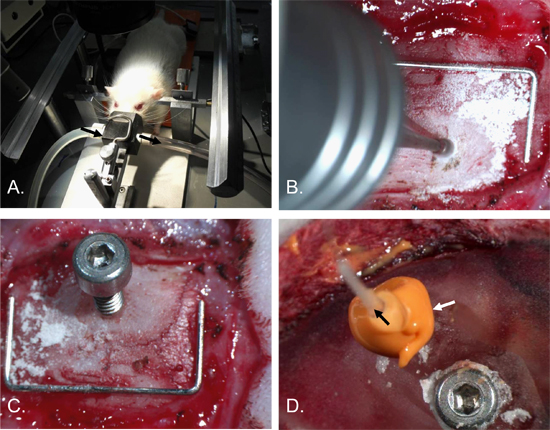
图2。颅内压导管插入程序。大鼠的头部被固定在一个立体框架耳酒吧和麻醉鼻锥的研究[A]。是钻了一个洞,直径约2毫米,成右顶骨[A]。 2×4毫米0.7毫米的孔与轴螺丝插入[J]。锚固螺杆插入左顶骨和头骨和牙科水泥覆盖的手术部位。 ICP备cathetER( 黑色箭头 ),然后插入螺丝孔和一个密封的密封嵌缝材料( 白色箭头 )研究[D]。主食(规模)= 12毫米x 5毫米。
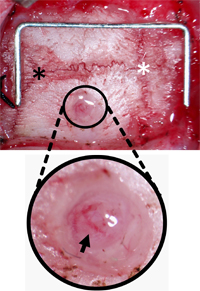
图3。监测毛刺螺丝孔定位 。头骨被清除结缔组织找到拉姆达( 黑色星号 )和前囟门( 白星号 )和孔钻外侧2毫米和2毫米,前囟门后。孔离开硬脑膜和软脑膜血管( 黑色箭头 )完整的碎片被清除。主食(规模)= 12毫米x 5毫米。
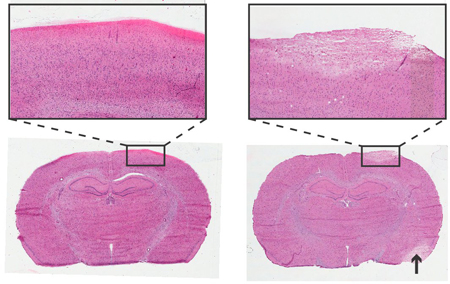
图4。 ICP监测螺杆仪表24小时后大鼠脑组织学。Haemotoxylin和曙红染色,6微米的冠状切片。左:非创伤性的螺丝插入。右:创伤螺丝插入,苍白面积描述中风受损的区域( 箭头 )具有相似的细胞形态受损的组织。插入4X目标。

图5。典型ICP备微量脉冲压力波幅度较小(*)的事件描述。通风反映较长的周期(#)的事件。
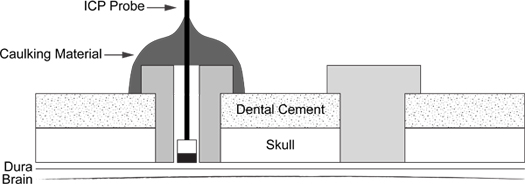
图6。 ICP探针插入示意图 。图表说明支持螺丝( 右 )和嵌缝材料涂层ICP探入螺丝( 左 )的位置。
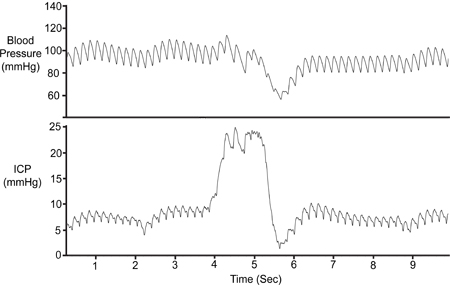
图7。腹部的压缩,腹部被暂时压缩(约1秒),以验证ICP信号的可行性。压缩结果在脑静脉回流减少,增加颅内量,从而增加ICP备。动脉压(Pa)仅下降后初始ICP崛起。
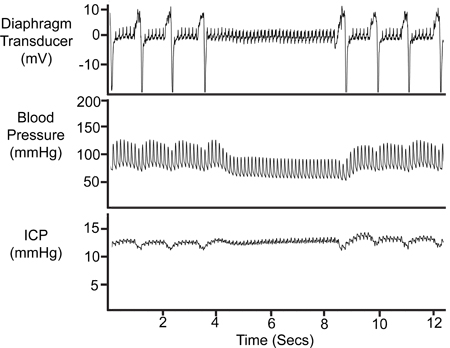
图8。呼吸暂停期间,暂时停止呼吸,在反映膈肌传感器跟踪,动脉压(Pa)微量元素的ICP跟踪。
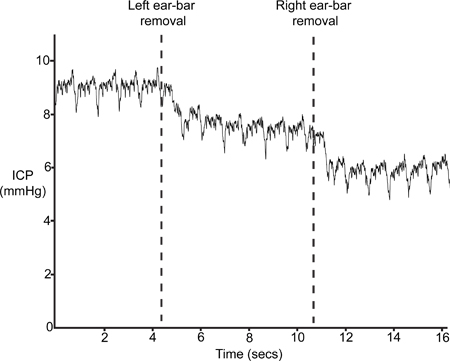
图9。耳酒吧去除。ICP应该放弃拆除的立体框架耳酒吧。
讨论
这里介绍的过程,使颅内压非常灵敏,准确的记录。这种微创技术,避免了显着的脑外伤,定位在硬膜外腔压力传感器和脑组织或心室。
的关键步骤包括:1)通过头骨钻 - 护理必须采取不刺破硬脊膜或损害脑组织的基本; 2)确保紧的密封嵌缝材料 - 如果有任何泄漏,ICP跟踪将不会可靠。当适当的位置,ICP传感器读数将不仅ICP备准确跟踪,但呼吸和心率。与灵感,更负面的胸?...
披露声明
我们什么都没有透露。
致谢
这个项目是由国家中风基金会,亨特医学研究所(HMRI)和国家健康与医学研究理事会(NH&MRC的),澳大利亚。特别感谢卫生车间员工在纽卡斯尔大学的教师,他们的技术专长。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 牙科水泥单体 | 亨利施恩 | VX-SC500MLL | |
| 牙科水泥聚合物 | 亨利施恩 | VX-SC1000GCL4 | |
| 牙钻毛刺大小12 | gunz牙科 | EL104S001012/10 | |
| 牙钻毛刺大小6 | gunz牙科 | EL104S001006/10 | |
| 金属螺丝 | 五金店 | 2×4毫米,六角头。 (0.7毫米钻孔轴实验室修改) | |
| SAMBA的控制单元 | 哈佛仪器 | 50433102 | |
| SAMBA的传感器 | 哈佛仪器 | 50461122 | 420唱片,15厘米的裸光纤,无线电不透明涂料 |
| silagum影音单嵌缝材料 | gunz牙科 | 的RG 9152 | vinylpolysiloxanes,氢聚硅氧烷,填料,颜料,添加剂,催化剂plantinum |
| terg的一个酶 | alconox,公司 | 1304 | 活性酶洗衣粉 |
参考文献
- Ng, L. K., Nimmannitya, J. Massive cerebral infarction with severe brain swelling: a clinicopathological study. Stroke. 1, 158-163 (1970).
- Plum, F. Brain swelling and edema in cerebral vascular disease. Res. Publ. Assoc. Res. Nerv. Ment. Dis. 41, 318-348 (1966).
- Ropper, A. H., Shafran, B. Brain edema after stroke. Clinical syndrome and intracranial pressure. Arch. Neurol. 41, 26-29 (1984).
- Silver, F. L., Norris, J. W., Lewis, A. J., Hachinski, V. C. Early mortality following stroke: a prospective review. Stroke. 15, 492-496 (1984).
- Geraci, E. B., Geraci, T. A. Hyperventilation and head injury: controversies and concerns. J. Neurosci. Nurs. 28, 381-387 (1996).
- Schwab, S., Aschoff, A., Spranger, M., Albert, F., Hacke, W. The value of intracranial pressure monitoring in acute hemispheric stroke. Neurology. 47, 393-398 (1996).
- Adams, H. P. Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association. Stroke. 34, 1056-1083 (2003).
- Zhong, J. Advances in ICP monitoring techniques. Neurol. Res. 25, 339-350 (2003).
- Aucoin, P. J. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am. J. Med. 80, 369-376 (1986).
- Silasi, G., MacLellan, C. L., Colbourne, F. Use of telemetry blood pressure transmitters to measure intracranial pressure (ICP) in freely moving rats. Curr. Neurovasc. Res. 6, 62-69 (2009).
- Crutchfield, J. S., Narayan, R. K., Robertson, C. S., Michael, L. H. Evaluation of a fiberoptic intracranial pressure monitor. J. Neurosurg. 72, 482-487 (1990).
- Bolander, R., Mathie, B., Bir, C., Ritzel, D., Vandevord, P. Skull Flexure as a Contributing Factor in the Mechanism of Injury in the Rat when Exposed to a Shock Wave. Ann. Biomed. Eng. , (2011).
- Chavko, M., Koller, W. A., Prusaczyk, W. K., McCarron, R. M. Measurement of blast wave by a miniature fiber optic pressure transducer in the rat brain. J. Neurosci. Methods. 159, 277-281 (2007).
- Chavko, M. Relationship between orientation to a blast and pressure wave propagation inside the rat brain. J. Neurosci. Methods. 195, 61-66 (2011).
- Leonardi, A. D., Bir, C. A., Ritzel, D. V., VandeVord, P. J. Intracranial pressure increases during exposure to a shock wave. J. Neurotrauma. 28, 85-94 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。