A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת לחץ תוך גולגולתי אפידורל בחולדות באמצעות מתמר סיבים אופטיים לחץ
In This Article
Summary
טכניקה חדשנית להקליט את הלחצים בתוך הגולגולת מתואר. שיטה פולשנית משתמשת במערכת של סיבים אופטיים לחץ חישה כדי למדוד במדויק את לחץ תוך גולגולתי (ICP) בחולדות מורדם מבלי לגרום טראומה מוחית משמעותית. הטכניקה עשויה לשמש במגוון רחב של דגמים ניסיוניים.
Abstract
לחץ תוך גולגולתי מוגבר (ICP) הוא בעיה משמעותית במספר צורות של פגיעה מוחית איסכמי, כולל פציעה, שבץ מוח טראומטית דום לב. גובה זה עלול לגרום לפגיעה נוירולוגית נוספת, בצורה של פריצת transtentorial 1,2,3,4, דחיסה המוח התיכון, חסר נוירולוגי או גדל אוטם מוחי 2,4. הטיפולים הקיימים הם בדרך כלל לא מספיק כדי לשלוט ICP גבוה בסביבה הקלינית 5,6,7. לכן יש צורך בשיטות מדידה מדויקות של ICP בבעלי חיים כדי לקדם את הבנתנו את המנגנונים הבסיסיים כדי לפתח טיפולים חדשים ICP גבוה.
במסגרת הניסוי הקליני גם ICP לא ניתן להעריך ללא מדידה ישירה. מספר שיטות של החדרת קטטר ICP קיימות כיום. אלה קטטר תוך חדרי הפכה "תקן הזהב" של מדידת ICP קליני בבני אדם 8. שיטה זו Involves הסרה חלקית של הגולגולת ואת המכשור של צנתר דרך רקמת המוח. כתוצאה מכך, צנתרים תוך חדרי יש שיעור הדבקה של% 06-11 ספטמבר. מסיבה זו, cannulations subdural ו אפידורל הפכו את השיטות המועדפות בבעלי חיים של פגיעה איסכמית.
שיטות מדידה שונות ICP הותאמו במודלים של בעלי חיים, ואת אלה, מלאות נוזל צנתרים טלמטריה 10 צנתרים מצב מוצק הם 11,12,13,14,15 השכיח ביותר. את מלאות נוזל מערכות נוטים לפתח בועות אוויר בתוך הקו, וכתוצאה מכך קריאות שווא ICP. בדיקות של מצב מוצק להימנע מבעיה זו (איור 1). בעיה נוספת היא צנתרים הולם תחת הגולגולת או לתוך החדרים מבלי לגרום פגיעה מוחית שעשוי לשנות את תוצאות הניסוי. לכן, פיתחנו שיטה המציבה קטטר ICP רציף עם החלל האפידורלי, אך נמנע נהאד להכניס אותו בין הגולגולת למוח.
סיבים אופטיים לחץ קטטר (420LP, חיישנים סמבה, שבדיה) שימש למדידת ICP במקום אפידורל בגלל המיקום של חיישן לחץ (על קצה קצהו של קטטר) נמצא לייצר אות איכות גבוהה ICP במודל זה . ישנם יצרנים אחרים דומים טכנולוגיות סיבים אופטיים 13 כי ניתן להשתמש במתודולוגיה שלנו. חלופיות צנתרים מצב מוצק, אשר יש חיישן הלחץ נמצא בצד של קצה הצנתר, לא יהיה מתאים לדגם זה כמו האות תהיה לחה על ידי נוכחות של בורג ניטור.
כאן, אנו מציגים שיטה פשוטה יחסית ומדויק למדידת ICP. בשיטה זו ניתן להשתמש במגוון רחב של דגמים בעלי חיים ICP בנושא.
Protocol
1. גולגולת חדירה
- לטשטש את עכברוש עם (אינדוקציה 5%, תחזוקה 1.5-2%) isoflurane ב% 70 N 2 ו - 30% O 2. בעקבות אינדוקציה של הרדמה, הצב את החולדה נוטה על צלחת ההתחממות, מיקום האף של עכברוש חרוט האף הרדמה.
- תוך שמירה על הרדמה, להבטיח את הראש במסגרת stereotaxic, הכנסת לאוזן הסורגים עד שהראש הוא התייצב. ודא נשימה לא נפגעת. (איור 2).
- להזריק מתחת לעור הקרקפת עם הרדמה מקומית לאורך זמן, Bupivacaine 0.3% 0.5 מ"ל (פייזר, אוסטרליה) לפני קבלת 1.5 ס"מ קו האמצע העור חתך בראש. (מכשירי סטריליות וכפפות יש להשתמש.)
- להקהות לנתח את הרקמות הרכות ואת השרירים המקיפים בבירור לאתר למבדה ו גבחת. לחזור בו העור ורקמות החיבור.
- גזע דימום על ידי הפעלת לחץ על הגולגולת חשוף. דימום בגולגולת מוגזם ניתן צרב.
- שימוש DRI שינייםLL עם 1 מ"מ בקצה בר, בר חור 2 מ"מ רוחב לתוך העצם הקודקודית הימנית. בר חור 2 מ"מ לרוחב ו - 2 מ"מ אחורית מ גבחת להימנע סינוס sagittal מעולה להבטיח את המיקום של החיישן ICP הוא על טריטוריה איסכמית, שבץ ללימודים. מקומות חלופיים יהיה מתאים באותה מידה עבור יישומים אחרים. בר חור לעומק שבו הגולגולת מעל דורה הופך שקוף. (איור 2-B).
- להחליף את בר עם 0.5 מ"מ בקצה בר להסיר את הגולגולת בבסיס החור.
- כאשר הגולגולת מתחיל להיסדק, השתמש מלקחיים 45 מעלות כדי להסיר את כל הגולגולת הנותרים, כדי להבטיח בסיס של החור מנוקה של פסולת. (איור 3).
2. בורג שינוי והחדרת
- לקדוח חור 0.7 מ"מ באמצעות בורג משושה ראשים באמצעות מחרטה המקדח ו 0.7 מ"מ.
- הכנס את הבורג ניטור לתוך החור ידי הפיכתו כ 1.5 סיבובים (שימוש בכמות מינימלית שלפונה הצורך להבטיח בורג בגולגולת כדי לא לגרום נזק לרקמות הבסיסית). (איור 2-C, איור 4).
- בר חור 2 עבור בורג עיגון בעצם הקודקודית השמאלית, 2 מ"מ לרוחב ו - 2 מ"מ אחורית מ גבחת. חור זה אינו מחייב חדירה מלאה של הגולגולת, כך 1 מ"מ בקצה בר משמש לדלל את הגולגולת של הכנסת בורג.
- להוסיף 2 x 4 מ"מ בורג משושה בעל ראש לתוך החור 2. בורג זה עוזר לעגן מלט שיניים ולכן בורג ניטור לגולגולת.
- השתמש פיפטה העברת לערבב וליישם מונומר מלט שיניים פולימר לבסיס הראש של הברגים.
- אפשר דבק דנטלי להתייבש לפחות 10 דקות.
3. לחץ תוך גולגולתי מתמר הכנסת
- באמצעות נוזל תיקון לבן, לסמן את סיב אופטי חיישן 4 מ"מ מקצה.
- למלא את החור של בורג ניטור עם מי מלח סטרילית (0.9%) ולהבטיח לאבועות האוויר נמצאים בתוך בורג.
- הכנס את החללית ICP 4 מ"מ לתוך הבורג כך את קצה החללית היא ברמה עם סוף בורג. ודא עצה לא פירס דורה.
- כוון את קצה החללית בתוך בורג עד זכר ICP המשקף אוורור ולחץ דם גלי הדופק ניתן לצפות. (איור 5).
4. יצירת חותם אטום
- חותם אטום הכרחי לקריאה ICP מדויק. מערבבים מונומר צמיג ביולוגית חומר איטום פולימרי ביחס של 1:1. בגלל חיישן הלחץ הוא על קצה של החללית, וזאת בתוך בורג את חלול, יישום של חומר אטימה לפיר של בדיקה סיבים אופטיים אין כל השפעה על הרגישות של חיישן לחץ.
- למרוח שכבה דקה סביב החללית וראש בורג ניטור. הימנע לעקירתם בדיקה ICP.
- אפשר להגדיר במשך 5 דקות.
- החל זיון 2אה חומר אטימה סביב הבורג ניטור בדיקה כולו. ודא כי נוזל לא דולף מכל סדקים בחומר אטימה. (איור 2-D).
- הסר עגילים סורג ובריח.
- עכברוש עשויים להישאר במצב מועדים, או להיות בזהירות הסתובב למצב שכיבה במהלך ניטור ICP.
- סכמטי של הליך השלמת מתואר (איור 6).
5. לחץ תוך גולגולתי מתמר הסרת Reinsertion
- על ניטור השלמת ICP, חיישן ICP ניתן להסיר על ידי משיכתו בעדינות את הקטטר מחומר הבורג אטימה.
- חיישן SAMBA צריך להיות מיד במקום בפתרון Terg, שעיכב את האנזים הזה 1% כדי למנוע קורוזיה עצה.
- החור שנותר חומר אטימה צריך להיות מכוסה שכבה נוספת של חומר אטימה. (החולדה עשויה להתעורר בשלב זה).
- כדי והכנס קטטר SAMBA לניטור נוסף, לפרוסחומר אטימה ברמה של ראש הבורג.
- חזור על שלבים 3.2 - 5.3.
6. נציג תוצאות
איור 5 הוא ייצוג של קריאות ICP יותר מעשר שניות. בתחילת המחקר, ICP הממוצע חולדה Wistar הוא 6 מ"מ כספית. אירועי מחזוריות קצר יותר מתואר באיור 5 משקפים לחץ דם גלי הדופק. אירועי מחזוריות כבר להראות אירועים אוורור. ראוי לציין, כי חיישן SAMBA משקף משרעת אוורור של 3-4 מ"מ כספית ואת משרעת הדופק של 1-2 מ"מ כספית.
כדי לאמת את מיקום החיישן SAMBA בכל ניסוי, עקבות ICP יש לבדוק היענות לחיצות בטן ואירועים נשימתיים, כגון תקופות של דום נשימה. דחיסת בטן מתואר באיור 7.
תקופות של דום נשימה (באיור 8) נצפות ביותר ניסויים invo lving נושם באופן ספונטני בעלי חיים. אירועים אלה מזוהים על ידי פיזיולוגיים רשומות היעדרות של deflections הנשימה על הנשימה (הסרעפת מתמר) וסימני לחץ הדם. שינוי המקבילה זכר ICP מאמת את מיקום החללית ICP.
איור 9 מתאר זכר טיפוסי ICP לאחר הסרת ה-בארים אוזניים (שלב 4.6). הכניסה של ה-בארים אוזניים בשלב 1.2 תוצאות דחיסה קלה של הגולגולת הפרעה וכתוצאה מכך בהיקף תוך גולגולתי ומכאן ICP מוגבר. אם החיישן בצורה נכונה, ICP ירד לפחות 4-5 מ"מ כספית עם ההסרה של ה-בארים אוזניים.
ניתוח היסטולוגית ניתן להשתמש כדי לבדוק אם יש נזק לאזור קליפת המוח מיד תחת חיישן לחץ בורג. דוגמה הכניסה בורג טראומטי ולא טראומטי מתואר באיור 4.
_upload/3689/3689fig1.jpg "/>
באיור 1. נוזל מלא לעומת סמבה עקבות ICP. ICP נרשמה בו זמנית באמצעות קטטר SAMBA סיבים אופטיים (למעלה) ו קטטר מלא נוזל (למטה). הערכים הממוצעים ICP היו דומים בשתי עקבות, עם זאת האות נוזל קטטר מלא היה בעיקר לחה לעומת הנשימה ברורה גל לחץ הדם ראיתי עם קטטר סיבים אופטיים.
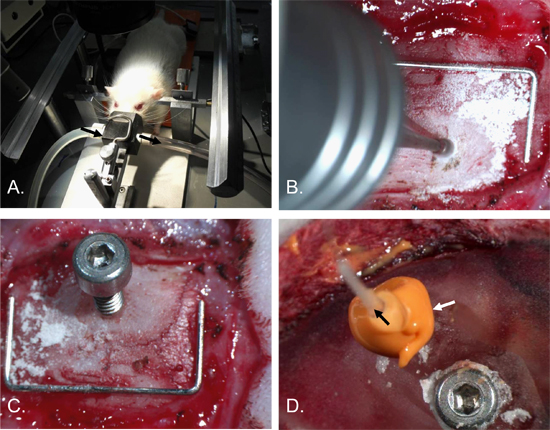
איור 2. לחץ תוך גולגולתי צנתר הכנסת נוהל. ראש של חולדה היה מאובטח במסגרת stereotaxic עם ברים אוזניים חרטומו הרדמה [א]. חור, כ -2 מ"מ קוטר, נקדחה לתוך העצם הקודקודית הימנית [B]. 2 x 4 מ"מ בורג עם חור 0.7 מ"מ בפיר הוכנס [C]. בורג עיגון הוכנס לתוך העצם הקודקודית השמאלית הגולגולת באתר כירורגית מכוסה מלט שיניים. ICP cathetER (שחור חץ) הוכנס לתוך חור הבורג ואת חותם אטום עשה עם חומר אטימה (לבן החץ) [ד]. סיכות (על סולם) = 12 מ"מ x 5 מ"מ.
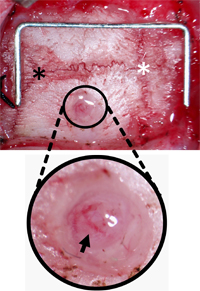
איור 3. בורג ניטור בר אוריינטציה חור. הגולגולת פונה של רקמת חיבור לאתר למבדה (כוכבית שחור) ו גבחת (כוכבית לבן) ואת חור קדח 2 מ"מ לרוחב ו 2 מ"מ אחורית מ גבחת. חור נוקה פסולת עוזב דורה וכלי pial (חץ שחור) שלמים. סיכות (על סולם) = 12 מ"מ x 5 מ"מ.
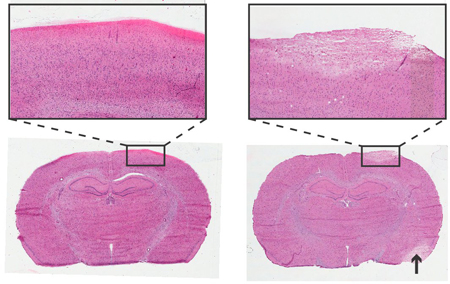
באיור 4. היסטולוגיה של מוח החולדה 24 שעות לאחר מכשור של בורג ניטור ICP. Haemotoxylin ו מכתים Eosin, 6 חלקים העטרה מיקרומטר. משמאל: ללא טראומטית הכנסת בורג. משמאל: הכנסת בורג טראומטית,שטח של חיוורון מתאר רקמות פגועות עם מורפולוגיה תאית דומה האזור הפגוע שבץ (החץ). הוספת נגד מטרה 4x.

איור 5. טיפוסי ICP עקבות. גלי דופק לחץ מתוארים על ידי אירועי משרעת קטנה יותר (*). אוורור בא לידי ביטוי על ידי אירועים של מחזוריות יותר (#).
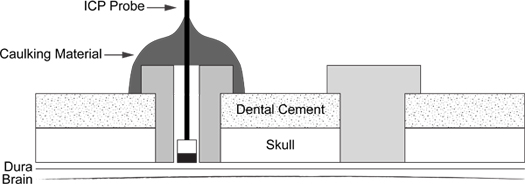
איור 6. ICP Probe סכמטי הכניסה. התרשים מדגים המיקום של בורג תמיכה (מימין) מצופה חומר אטימה ICP החללית אל בורג (משמאל).
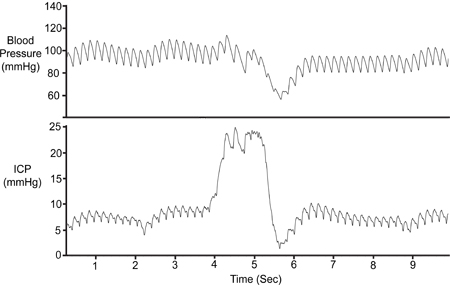
איור 7. דחיסת הבטן. הבטן היה דחוס באופן זמני (~ 1 שניות) כדי לאמת את הכדאיות של האות ICP. דחיסה תוצאות בתמורה מופחתת ורידי המוח,הגדלת נפח תוך גולגולתי, ובכך להגדיל את ICP. לחץ הדם (אבא) ירד רק לאחר עליית ICP הראשונית.
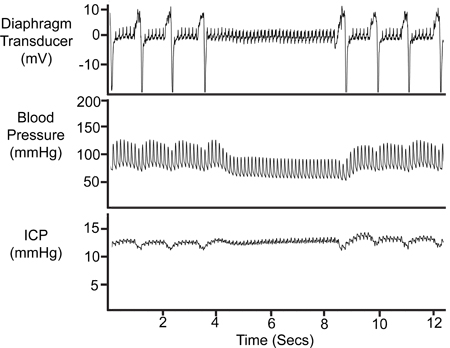
איור 8. תקופת Apnoea. הפסקה זמנית של הנשימה בא לידי ביטוי זכר מתמר הסרעפת, לחץ הדם (אבא) ואת זכר זכר ICP.
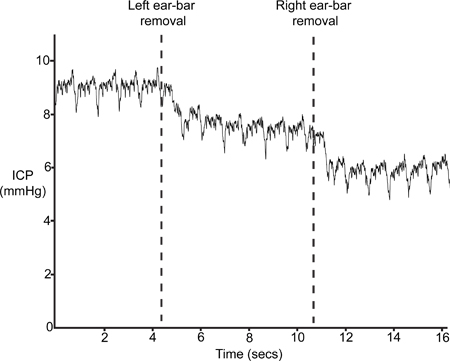
איור 9. האוזן בר הסרה. ICP צריכה לרדת עם ההסרה של stereotaxic מסגרת אוזניים למוצרי סורג ובריח.
Discussion
ההליך המוצג כאן מאפשר הקלטה מאוד רגיש ומדויק של לחץ תוך גולגולתי. זו טכניקה פולשנית מונעת טראומה מוחית משמעותית ידי הצבת חיישן לחץ בחלל האפידורלי ולא ברקמת המוח או החדרים.
השלבים הקריטיים כוללים: 1) קידוח דרך הגולגולת - יש להקפיד ל...
Disclosures
אין לנו מה למסור.
Acknowledgements
פרויקט זה מומן על ידי הקרן הלאומית שבץ, האנטר רפואי מכון המחקר (HMRI) ו לאומי, בריאות, המועצה למחקר רפואי (MRC & NH), אוסטרליה. תודה מיוחדת הפקולטה צוות סדנת הבריאות באוניברסיטת ניוקאסל עבור המומחיות הטכנית שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| דבק דנטלי מונומר | הנרי שיין | VX-SC500MLL | |
| שיניים מלט פולימר | הנרי שיין | VX-SC1000GCL4 | |
| תרגיל שיניים בר בגודל 12 | Gunz שיניים | EL104S001012/10 | |
| תרגיל שיניים בר בגודל 6 | Gunz שיניים | EL104S001006/10 | |
| מתכת בורג | חומרה Store | 2 x 4 מ"מ, ראש משושה. (מעבדה שונה על ידי חור 0.7 מ"מ קדח דרך פיר) | |
| SAMBA יחידת בקרה | הרווארד Apparatus | 50433102 | |
| SAMBA חיישן | הרווארד Apparatus | 50461122 | LP 420, סיבים חשופים 15 ס"מ, רדיו אטום ציפוי |
| Silagum AV מונו חומר אטימה | Gunz שיניים | RG 9152 | Vinylpolysiloxanes, polysiloxanes מימן, מילוי, פיגמנטים, תוספים, plantinum זרז |
| Terg, שעיכב את האנזים הזה | Alconox, Inc | 1304 | אנזימים פעילים אבקת כביסה |
References
- Ng, L. K., Nimmannitya, J. Massive cerebral infarction with severe brain swelling: a clinicopathological study. Stroke. 1, 158-163 (1970).
- Plum, F. Brain swelling and edema in cerebral vascular disease. Res. Publ. Assoc. Res. Nerv. Ment. Dis. 41, 318-348 (1966).
- Ropper, A. H., Shafran, B. Brain edema after stroke. Clinical syndrome and intracranial pressure. Arch. Neurol. 41, 26-29 (1984).
- Silver, F. L., Norris, J. W., Lewis, A. J., Hachinski, V. C. Early mortality following stroke: a prospective review. Stroke. 15, 492-496 (1984).
- Geraci, E. B., Geraci, T. A. Hyperventilation and head injury: controversies and concerns. J. Neurosci. Nurs. 28, 381-387 (1996).
- Schwab, S., Aschoff, A., Spranger, M., Albert, F., Hacke, W. The value of intracranial pressure monitoring in acute hemispheric stroke. Neurology. 47, 393-398 (1996).
- Adams, H. P. Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association. Stroke. 34, 1056-1083 (2003).
- Zhong, J. Advances in ICP monitoring techniques. Neurol. Res. 25, 339-350 (2003).
- Aucoin, P. J. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am. J. Med. 80, 369-376 (1986).
- Silasi, G., MacLellan, C. L., Colbourne, F. Use of telemetry blood pressure transmitters to measure intracranial pressure (ICP) in freely moving rats. Curr. Neurovasc. Res. 6, 62-69 (2009).
- Crutchfield, J. S., Narayan, R. K., Robertson, C. S., Michael, L. H. Evaluation of a fiberoptic intracranial pressure monitor. J. Neurosurg. 72, 482-487 (1990).
- Bolander, R., Mathie, B., Bir, C., Ritzel, D., Vandevord, P. Skull Flexure as a Contributing Factor in the Mechanism of Injury in the Rat when Exposed to a Shock Wave. Ann. Biomed. Eng. , (2011).
- Chavko, M., Koller, W. A., Prusaczyk, W. K., McCarron, R. M. Measurement of blast wave by a miniature fiber optic pressure transducer in the rat brain. J. Neurosci. Methods. 159, 277-281 (2007).
- Chavko, M. Relationship between orientation to a blast and pressure wave propagation inside the rat brain. J. Neurosci. Methods. 195, 61-66 (2011).
- Leonardi, A. D., Bir, C. A., Ritzel, D. V., VandeVord, P. J. Intracranial pressure increases during exposure to a shock wave. J. Neurotrauma. 28, 85-94 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved