É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medida da Pressão Intracraniana peridural em ratos, utilizando um transdutor de pressão de fibra óptica
Neste Artigo
Resumo
Uma nova técnica para gravar as pressões dentro do crânio é descrito. O método minimamente invasiva utiliza um sistema de pressão de fibra óptica de detecção para medir com precisão a pressão intracraniana (ICP) em ratos anestesiados, sem causar trauma cerebral significativa. A técnica pode ser utilizada em uma ampla variedade de modelos experimentais.
Resumo
Aumento da pressão intracraniana (PIC) é um problema significativo em várias formas de lesão isquêmica cerebral, incluindo acidente vascular cerebral lesão cerebral, traumática e parada cardíaca. Esta elevação pode resultar em lesão neurológica adicional, sob a forma de hérnia transtentorial 1,2,3,4, compressão mesencéfalo, déficit neurológico ou aumentada enfarte cerebral 2,4. As terapias atuais são muitas vezes insuficientes para controlar ICP elevado na prática clínica 5,6,7. Assim, há uma necessidade de métodos precisos de medição ICP em modelos animais para promover nossa compreensão dos mecanismos básicos e para desenvolver novos tratamentos para o ICP elevada.
Em ambos a definição clínica e experimental ICP não pode ser calculada sem medição direta. Vários métodos de ICP inserção do cateter existem atualmente. Destes o cateter intraventricular tornou-se o clínico "padrão ouro" da ICP medida em humanos 8. Este método involves a remoção parcial do crânio e da instrumentação do cateter através do tecido cerebral. Por conseguinte, os cateteres intraventriculares têm uma taxa de infecção de 6-11% 9. Por esta razão, canulações subdural e epidural tornaram-se os métodos preferidos em modelos animais de lesão isquémica.
Várias técnicas de medição do ICP foram adaptados para modelos animais, e destes, cateteres cheias de líquido de telemetria 10 e cateteres de estado sólido são 11,12,13,14,15 mais utilizado. Os sistemas cheios de fluido são propensas a desenvolver bolhas de ar na linha, resultando em leituras falsas ICP. Sondas de estado sólido evitar este problema (Figura 1). Um problema adicional é cateteres de montagem sob o crânio ou nos ventrículos, sem causar qualquer lesão cerebral que pode alterar os resultados experimentais. Portanto, desenvolveram um método que coloca um cateter ICP contíguo com o espaço epidural, mas evita a need para inseri-lo entre o crânio eo cérebro.
Um cateter de pressão de fibra óptica (420LP, Sensors SAMBA, Suécia) foi usado para medir o ICP no local epidural, porque a localização do sensor de pressão (na ponta do cateter muito) foi encontrada para produzir um sinal de alta fidelidade ICP neste modelo . Existem outros fabricantes de tecnologias semelhantes de fibra óptica 13 que podem ser utilizados com a nossa metodologia. Alternativos cateteres de estado sólido, que têm o sensor de pressão localizada na parte lateral da ponta do cateter, não seria apropriado para este modelo como o sinal seria humedecido pela presença do parafuso de monitorização.
Aqui, apresentamos um método relativamente simples e preciso para medir a ICP. Este método pode ser usado através de uma vasta gama de modelos animais ICP relacionados.
Protocolo
1. Penetração Crânio
- Anestesiar rato com (indução de 5%, a manutenção 1,5-2%) de isoflurano em 70% de N 2 e 30% de O 2. Após a indução da anestesia, coloque o rato propenso em uma placa de aquecimento, posicionando o nariz do rato em um cone de nariz anestésico.
- Embora mantendo a anestesia, proteger a cabeça em um quadro estereotáxico, inserir os auriculares, bares até a cabeça está estabilizado. Certifique-se a respiração não é prejudicada. (Figura 2-A).
- Injectar por via subcutânea com couro cabeludo duradoura anestesia local, Bupivacaína 0,3 ml a 0,5% (Pfizer, Austrália) antes de fazer uma incisão na pele 1,5 centímetros da cabeça na linha média. (Instrumentos estéreis e luvas devem ser usadas.)
- Blunt dissecar o tecido mole e músculos que rodeiam a localizar claramente Lambda e Bregma. Retrair a pele e tecido conjuntivo.
- Stem qualquer hemorragia, aplicando pressão para o crânio exposta. Sangramento excessivo do crânio pode ser cauterizado.
- Usando um dri dentalll com ponta de 1 mm burr, burr um orifício de 2 mm de largura no osso parietal direito. Burr o orifício 2 mm lateral e 2 mm posterior a partir de Bregma para evitar o seio sagital superior e assegurar o posicionamento do sensor de ICP é sobre o território isquémico, para estudos de acidente vascular cerebral. Localizações alternativas seria igualmente adequado para outras aplicações. Burr o buraco até uma profundidade onde o crânio acima da dura-máter torna-se transparente. (Figura 2-B).
- Substituir a rebarba com um 0,5 milímetros ponta da rebarba para remover o crânio na base do furo.
- Quando o crânio começa a rachar, use 45 ° fórceps para remover todo o crânio remanescente, assegurando a base do orifício é limpa de detritos. (Figura 3).
2. Modificação parafuso e Inserção
- Faça um furo de 0,7 milímetros por meio de um parafuso de cabeça hexagonal usando um torno e 0,7 broca mm.
- Insira o parafuso de monitoramento dentro do buraco, transformando-a cerca de 1,5 voltas (usar a quantidade mínima detorna necessária para garantir parafuso no crânio de modo a não danificar o tecido subjacente). (Figura 2-C e Figura 4).
- Burr um segundo furo para um parafuso de ancoragem no osso parietal esquerdo, 2 mm lateral e 2 mm posterior a partir de bregma. Este furo não requer a penetração completa do crânio, de modo a 1 milímetro ponta da rebarba é usado para diluir o crânio para a inserção do parafuso.
- Inserir uma 2 x 4 parafuso de cabeça hexagonal mm no segundo furo. Este parafuso ajuda a ancorar o cimento dental e, portanto, o parafuso de monitorização para o crânio.
- Usar uma pipeta de transferência para misturar e aplicar monómero cimento dental e polímero à base da cabeça dos parafusos.
- Permitir cimento dental para secar durante pelo menos 10 minutos.
3. Inclusão do transdutor de pressão intracraniana
- Usando fluido correcção branco, marcar a fibra óptica sensor de 4 mm a partir da ponta.
- Encher o furo do parafuso de monitorização com solução salina estéril (0,9%) e assegurar que nãobolhas de ar estão presentes dentro do parafuso.
- Inserir o ICP sonda 4 mm no parafuso de modo que a ponta da sonda está nivelada com a extremidade do parafuso. Assegurar a ponta não perfurar a dura-máter.
- Ajustar a ponta da sonda dentro do parafuso até um traço ICP reflectindo ventilação e as ondas de sangue de impulsos de pressão podem ser observadas. (Figura 5).
4. Formando um selo hermético
- Uma vedação hermética é imperativo uma leitura ICP preciso. Misturar um monómero material viscoso biocompatível calafetagem e polímero na proporção de 1:1. Porque o sensor de pressão está na ponta da sonda, e este está dentro do parafuso para fora oco, a aplicação do material de calafetagem para o eixo da sonda de fibra óptica tem nenhum efeito sobre a sensibilidade à pressão do sensor.
- Aplicar uma camada fina em torno da sonda e da cabeça do parafuso de monitorização. Evite deslocar a sonda ICP.
- Permitir a ser definido para 5 minutos.
- Aplique um leigo segundaer de material de calafetagem em torno do parafuso de monitoramento inteiro e sonda. Certifique-se que o líquido não está vazando de fendas do material de calafetagem. (Figura 2-D).
- Remover orelha-bares.
- O rato pode permanecer na posição prona, ou ser cuidadosamente girado para a posição supina durante monitorização da PIC.
- Um diagrama esquemático do processo completo é representado na (Figura 6).
5. Remoção do transdutor de pressão intracraniana e da Reinserção
- No controlo conclusão ICP, o sensor de ICP pode ser removido, puxando o cateter a partir do material de rosca e de calafetagem.
- O sensor SAMBA deve ser imediatamente lugar em solução a 1% TERG-A-Zyme para prevenir a corrosão de ponta.
- O furo remanescente no material de calafetagem deve ser coberta com uma camada adicional de material de calafetagem. (Rato pode ser acordado nesta fase).
- Para reinserir o cateter SAMBA para monitoramento adicional, a fatiao material de calafetagem ao nível da cabeça do parafuso.
- Repita os passos 3.2 - 5.3.
6. Os resultados representativos
A Figura 5 é uma representação de leituras ICP ao longo de dez segundos. No início do estudo, o ICP em média um rato Wistar é de 6 mmHg. Os acontecimentos de periodicidade mais curta representado na Figura 5 reflexão das ondas de pressão de pulso de sangue. Os eventos de maior periodicidade mostrar os eventos de ventilação. Note-se que o sensor de SAMBA reflecte uma amplitude de ventilação de mmHg 3-4 e amplitude de pulso de 1-2 mmHg.
Para validar a posição do sensor SAMBA em cada experimento, os traços do ICP deve ser testado para a adequação às compressões abdominais e eventos respiratórios, tais como períodos de apnéia. Uma compressão abdominal é mostrada na Figura 7.
Períodos de apneia (ilustrada na Figura 8) são observados na maioria dos experimentos INVO lving respiração espontânea animais. Estes eventos são identificados em registros fisiológicos por uma ausência de desvios respiratórios sobre respiratória (diafragma do transdutor) e traços de pressão arterial. Uma alteração equivalente no rastreamento ICP valida o posicionamento da sonda ICP.
A Figura 9 representa um traço típico ICP após a remoção das barras de orelha-(passo 4.6). A inserção da espiga de barras no passo 1.2 resulta em uma ligeira compressão do crânio e conseqüente interrupção no volume intracraniano e, consequentemente, um aumento da PIC. Se o sensor está posicionado correctamente, o ICP irá cair, pelo menos, 4-5 mmHg, com a remoção dos orelha-bares.
A análise histológica podem ser utilizados para verificar se há qualquer dano para a área cortical imediatamente sob o sensor de pressão e parafuso. Um exemplo de uma inserção do parafuso traumática e não traumática está representado na Figura 4.
_upload/3689/3689fig1.jpg "/>
Figura 1. Cheio de líquido Traces Vs SAMBA ICP. ICP foi gravado simultaneamente através do cateter de fibra óptica SAMBA (em cima) e um cateter cheio de líquido (parte inferior). Os valores médios do ICP foram semelhantes em ambos os traços, no entanto o sinal de cateter cheio de líquido, nomeadamente, foi embebido em comparação com a clara e respiratória de pressão arterial formas de onda observada com o cateter de fibra óptica.
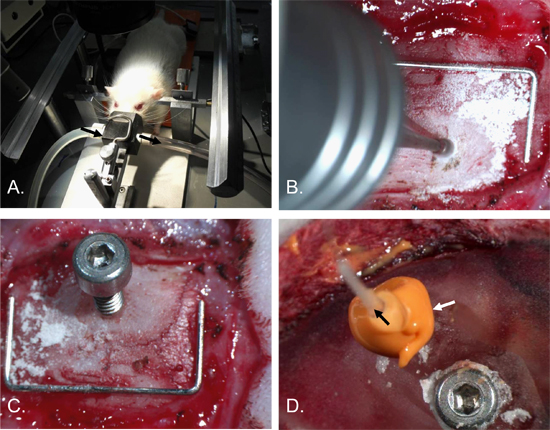
Figura 2. Pressão intracraniana procedimento de inserção do cateter. Cabeça do rato foi fixado em uma moldura estereotáxica com orelha-bares e um cone de nariz anestésico [A]. Um buraco, cerca de 2 mm de diâmetro, foi perfurado no osso parietal direito [B]. Um parafuso de 2 x 4 mm com um furo 0,7 mm no eixo foi inserido [C]. Um parafuso de ancoragem foi inserido no osso parietal esquerdo e do crânio e local cirúrgico coberto de cimento dental. O ICP catheter (seta preta) foi então inserido no furo de parafuso e uma vedação hermética feito com o material de calafetagem (seta branca) [D]. Grampo (por escala) = 12 mm x 5 mm.
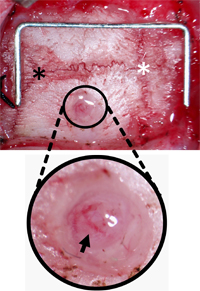
Figura 3. Monitoramento Parafuso Orientação Buraco Burr. O crânio foi limpo de tecido conectivo para localizar Lambda (asterisco preto) e Bregma (asterisco branco) e do orifício 2 milímetros lateral e 2 milímetros posterior a partir de bregma. O buraco foi inocentado de detritos deixando a dura-máter e vasos Pial (seta preta) intactas. Grampo (por escala) = 12 mm x 5 mm.
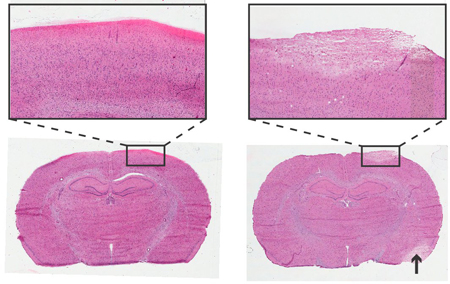
Figura 4. Histologia do cérebro de um rato 24 horas após a instrumentação do ICP Parafuso de Acompanhamento. Haemotoxylin e Eosina, 6 mM cortes coronais. Esquerda: não-traumática inserção do parafuso. Direita: a inserção do parafuso traumática,área de palidez descreve o tecido danificado com morfologia celular semelhante à área danificada acidente vascular cerebral (seta). Insere no objetivo de 4x.

Figura 5. Típicas ICP rastreamento. Ondas de pressão de pulso são representadas por eventos de menor amplitude (*). Ventilação é refletida por eventos de maior periodicidade (#).
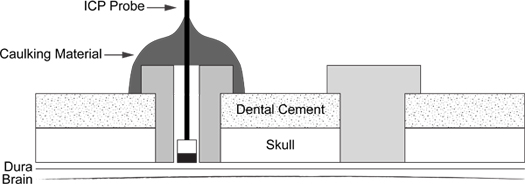
Figura 6. ICP Probe esquemática de Inclusão. Diagrama ilustra a colocação do parafuso de apoio (à direita) e calafetagem material revestido ICP sonda em parafuso (esquerda).
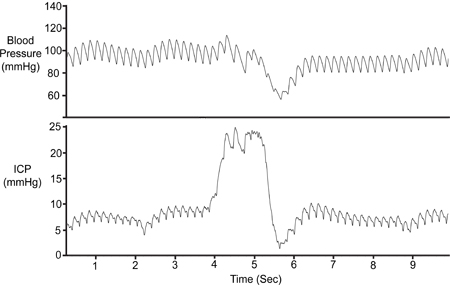
Figura 7. Compressão abdominal. O abdómen foi temporariamente comprimido (~ 1 seg) para validar a viabilidade do sinal de ICP. Compactação resulta em redução do retorno venoso cerebral,aumento do volume intracraniano e, assim, elevar a PIC. A pressão arterial (Pa) caiu apenas após o surgimento ICP inicial.
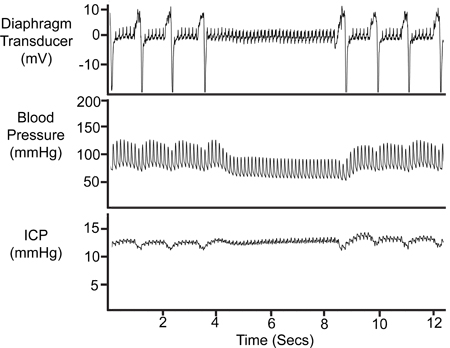
Figura 8. Período de Apneia. A cessação temporária da respiração é refletida no rastreamento transdutor de diafragma, a pressão arterial (Pa) traço eo traço ICP.
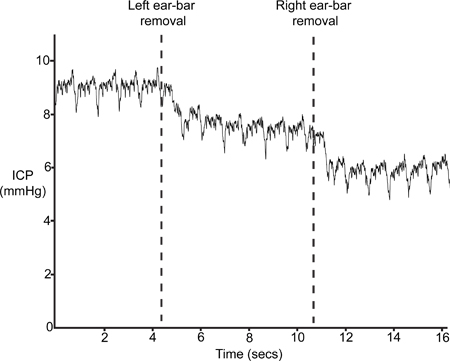
Figura 9. Ear Bar-Remoção. ICP deve cair com a retirada dos quadros estereotáxicas orelha-bares.
Discussão
O procedimento aqui apresentado permite uma gravação muito sensível e preciso da pressão intracraniana. Esta técnica minimamente invasiva evita trauma cerebral significativa, posicionando o sensor de pressão no espaço epidural e não tecido do cérebro ou ventrículos.
As etapas críticas incluem: 1) perfurar o crânio - é preciso ter cuidado para não furar a dura ou danos subjacentes do tecido cerebral; 2) assegurar uma boa vedação com o material de calafetagem - se houver vazame...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este projecto foi financiado pelo National Stroke Foundation, Medical Research Institute Hunter (HMRI) e Nacional de Saúde e Conselho de Pesquisa Médica (MRC & NH), na Austrália. Agradecimentos especiais à Faculdade de pessoal das oficinas Saúde da Universidade de Newcastle por sua experiência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Monômero Cimento Dental | Henry Schein | VX-SC500MLL | |
| Dental cimento polímero | Henry Schein | VX-SC1000GCL4 | |
| Broca de dentista rebarbas tamanho 12 | Gunz Dental | EL104S001012/10 | |
| Broca de dentista rebarbas tamanho 6 | Gunz Dental | EL104S001006/10 | |
| Parafuso metálico | Loja de Ferragens | 2 x 4 mm, de cabeça hexagonal. (Laboratório modificados de 0,7 milímetros furo perfurado através do eixo) | |
| SAMBA Unidade de Controle | Harvard Apparatus | 50433102 | |
| SAMBA Sensor | Harvard Apparatus | 50461122 | 420 LP, fibra nua 15cm, rádio-opaco revestimento |
| Silagum AV Mono material de calafetagem | Gunz Dental | RG 9152 | Vinylpolysiloxanes, polissiloxanos de hidrogênio, de enchimento, pigmentos, aditivos, plantinum catalisador |
| TERG-A-Zyme | Alconox, Inc. | 1304 | Enzyme-ativo detergente em pó |
Referências
- Ng, L. K., Nimmannitya, J. Massive cerebral infarction with severe brain swelling: a clinicopathological study. Stroke. 1, 158-163 (1970).
- Plum, F. Brain swelling and edema in cerebral vascular disease. Res. Publ. Assoc. Res. Nerv. Ment. Dis. 41, 318-348 (1966).
- Ropper, A. H., Shafran, B. Brain edema after stroke. Clinical syndrome and intracranial pressure. Arch. Neurol. 41, 26-29 (1984).
- Silver, F. L., Norris, J. W., Lewis, A. J., Hachinski, V. C. Early mortality following stroke: a prospective review. Stroke. 15, 492-496 (1984).
- Geraci, E. B., Geraci, T. A. Hyperventilation and head injury: controversies and concerns. J. Neurosci. Nurs. 28, 381-387 (1996).
- Schwab, S., Aschoff, A., Spranger, M., Albert, F., Hacke, W. The value of intracranial pressure monitoring in acute hemispheric stroke. Neurology. 47, 393-398 (1996).
- Adams, H. P. Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association. Stroke. 34, 1056-1083 (2003).
- Zhong, J. Advances in ICP monitoring techniques. Neurol. Res. 25, 339-350 (2003).
- Aucoin, P. J. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am. J. Med. 80, 369-376 (1986).
- Silasi, G., MacLellan, C. L., Colbourne, F. Use of telemetry blood pressure transmitters to measure intracranial pressure (ICP) in freely moving rats. Curr. Neurovasc. Res. 6, 62-69 (2009).
- Crutchfield, J. S., Narayan, R. K., Robertson, C. S., Michael, L. H. Evaluation of a fiberoptic intracranial pressure monitor. J. Neurosurg. 72, 482-487 (1990).
- Bolander, R., Mathie, B., Bir, C., Ritzel, D., Vandevord, P. Skull Flexure as a Contributing Factor in the Mechanism of Injury in the Rat when Exposed to a Shock Wave. Ann. Biomed. Eng. , (2011).
- Chavko, M., Koller, W. A., Prusaczyk, W. K., McCarron, R. M. Measurement of blast wave by a miniature fiber optic pressure transducer in the rat brain. J. Neurosci. Methods. 159, 277-281 (2007).
- Chavko, M. Relationship between orientation to a blast and pressure wave propagation inside the rat brain. J. Neurosci. Methods. 195, 61-66 (2011).
- Leonardi, A. D., Bir, C. A., Ritzel, D. V., VandeVord, P. J. Intracranial pressure increases during exposure to a shock wave. J. Neurotrauma. 28, 85-94 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados