È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Epidurale Misurazione della pressione intracranica in ratto utilizzando una fibra ottica trasduttore di pressione
In questo articolo
Riepilogo
Una nuova tecnica per registrare le pressioni all'interno del cranio è descritto. Il metodo minimamente invasivo utilizza una fibra ottica sistema di rilevamento della pressione per misurare accuratamente la pressione endocranica (ICP) in ratti anestetizzati senza causare traumi significativi cervello. La tecnica può essere utilizzata in un'ampia gamma di modelli sperimentali.
Abstract
L'elevata pressione intracranica (ICP) è un problema significativo in diverse forme di danno cerebrale ischemico tra cui ictus, trauma cranico e arresto cardiaco. Questo aumento può causare un ulteriore danno neurologico, in forma di ernia transtentoriale 1,2,3,4, compressione mesencefalo, deficit neurologici o infarto cerebrale è aumentato 2,4. Le attuali terapie sono spesso inadeguati per controllare elevata ICP in ambito clinico 5,6,7. Quindi vi è la necessità di metodi accurati di misura ICP in modelli animali per migliorare la nostra comprensione dei meccanismi di base e di sviluppare nuovi trattamenti per elevata ICP.
In entrambi i casi l'impostazione clinica e sperimentale ICP non può essere definita senza misurazione diretta. Diversi metodi di inserimento del catetere ICP esistono attualmente. Di questi il catetere intraventricolare è diventata la clinica 'gold standard' di misura ICP negli esseri umani 8. Questo metodo involves l'asportazione parziale del cranio e la strumentazione del catetere attraverso il tessuto cerebrale. Di conseguenza, cateteri intraventricolari hanno un tasso di infezione del 6-11% 9. Per questo motivo, cannulazioni subdurali ed epidurale sono diventati i metodi preferiti in modelli animali di danno ischemico.
Diverse tecniche di misurazione ICP sono stati adattati per i modelli animali, e di questi, piene di liquido cateteri di telemetria 10 e cateteri a stato solido sono le più frequentemente utilizzate 11,12,13,14,15. Le piene di liquido sistemi sono inclini a sviluppare bolle d'aria nella linea, con conseguente falsi letture ICP. Sonde a stato solido evitare questo problema (Figura 1). Un ulteriore problema è cateteri di montaggio sotto il cranio o nei ventricoli senza causare alcun danno cerebrale che potrebbero alterare i risultati sperimentali. Pertanto, abbiamo sviluppato un metodo che inserisce un catetere ICP contiguo con lo spazio epidurale, ma evita il NEed inserirlo tra cranio e cervello.
Una fibra ottica catetere di pressione (420LP, sensori SAMBA, Svezia) è stato usato per misurare ICP nella posizione epidurale perché la posizione del sensore di pressione (sulla punta del catetere) è stato trovato per produrre un segnale ad alta fedeltà ICP in questo modello . Ci sono altri produttori di simili tecnologie a fibre ottiche 13 che possono essere utilizzati con la metodologia. Alternative cateteri stato solido, che hanno il sensore di pressione collocato sul lato della punta del catetere, non sarebbe appropriato per questo modello come il segnale sarebbe smorzata dalla presenza della vite di monitoraggio.
Qui vi presentiamo un metodo relativamente semplice ed accurato per misurare la ICP. Questo metodo può essere utilizzato in una vasta gamma di modelli animali ICP correlati.
Protocollo
1. Skull Penetrazione
- Anestetizzare ratto con isofluorano (induzione 5%, 1,5-2% di manutenzione) in 70% N 2 e 30% O 2. Dopo l'induzione dell'anestesia, posizionare il topo prona su una piastra riscaldante, posizionando il naso del topo in un cono di naso anestetico.
- Pur mantenendo l'anestesia, fissare la testa in un frame stereotassico, inserendo le orecchie-bar fino a quando la testa si è stabilizzata. Assicurarsi che la respirazione non è compromessa. (Figura 2-A).
- Iniettare cuoio capelluto per via sottocutanea con anestetico locale a lunga durata, bupivacaina 0,3 ml 0,5% (Pfizer, Australia) prima di prendere una skin 1,5 centimetri un'incisione mediana testa. (Strumenti sterili e guanti devono essere utilizzati.)
- Smussare sezionare i tessuti molli e dei muscoli circostanti per individuare in modo chiaro e Lambda Bregma. Ritrarre la pelle e del tessuto connettivo.
- Stelo qualsiasi sanguinamento applicando pressione al cranio esposto. Cranio sanguinamento eccessivo può essere cauterizzato.
- Utilizzo di un dentale drill con una punta di 1 mm radica, radica di 2 mm ampio foro nell'osso parietale destro. Burr da 2 mm foro laterale e 2 mm posteriormente da Bregma per evitare il seno longitudinale superiore e assicurare il posizionamento del sensore ICP è sul territorio ischemico, ictus per studi. Ubicazioni alternative sia ugualmente adatta per altre applicazioni. Burr il foro ad una profondità dove il cranio sopra la dura diventa traslucida. (Figura 2-B).
- Sostituire la bava con una punta da 0,5 mm bave per rimuovere il cranio alla base del foro.
- Quando il cranio comincia a incrinarsi, usare pinze a 45 ° per rimuovere tutti i rimanenti cranio, assicurando la base del foro è liberata dai detriti. (Figura 3).
2. Vite Modifica e inserimento
- Praticare un foro di 0,7 millimetri attraverso una vite con testa esagonale usando un tornio e lo 0,7 punta mm.
- Inserire la vite di monitoraggio nel foro ruotandolo in circa 1,5 giri (usare la quantità minima didiventa necessario a garantire la vite nel cranio in modo da non danneggiare il tessuto sottostante). (Figura 2-C e Figura 4).
- Burr un secondo foro per una vite di ancoraggio nell'osso parietale sinistro, 2 mm e 2 mm laterale posteriore da Bregma. Questo foro non richiede la penetrazione completa del cranio, in modo che il mm 1 punta bava viene usato per fluidificare il cranio per l'inserimento della vite.
- Inserire un x 2 4 a testa esagonale da mm vite nel secondo foro. Questa vite aiuta ad ancorare il cemento dentale e quindi la vite di monitoraggio al cranio.
- Utilizzare una pipetta di trasferimento per mescolare e applicare monomero e polimero cemento dentale alla base della testa delle viti.
- Lasciare cemento dentale ad asciugare per almeno 10 minuti.
3. Inserimento del trasduttore di pressione intracranica
- Utilizzo di liquido bianco correzione, segnare la fibra ottica sensore 4 mm dalla punta.
- Riempire il foro della vite di monitoraggio con soluzione salina sterile (0,9%) e non garantisconobolle d'aria sono presenti all'interno della vite.
- Inserire la ICP sonda 4 mm nella vite in modo che la punta della sonda è a livello con l'estremità della vite. Assicurarsi che la punta non perforare la dura.
- Regolare la punta della sonda all'interno della vite fino a una traccia ICP riflettente ventilazione e sangue onde a impulsi di pressione può essere osservato. (Figura 5).
4. Formare una chiusura ermetica
- Una chiusura ermetica è indispensabile per una lettura accurata ICP. Mescolare un viscoso monomero biocompatibile materiale di sigillatura e polimero nel rapporto di 1:1. Poiché il sensore di pressione è sulla punta della sonda, e questo è all'interno della vite coppellate, l'applicazione di materiale di sigillatura all'albero della fibra ottica sonda ha alcun effetto sulla sensibilità del sensore di pressione.
- Applicare uno strato sottile della sonda e la testa della vite di monitoraggio. Evitare di spostare la sonda ICP.
- Lasciare riposare per 5 minuti.
- Applicare un laico secondoer del materiale di sigillatura attorno alla vite di monitoraggio intera e sonda. Assicurarsi che non vi siano perdite di liquido da eventuali crepacci nel materiale di coibentazione. (Figura 2-D).
- Rimuovere le orecchie-bar.
- Il ratto può rimanere in posizione prona, o essere attentamente ruotato nella posizione supina durante il monitoraggio ICP.
- Uno schema della procedura completata è rappresentato in (Figura 6).
5. Trasduttore di pressione intracranica rimozione e il reinserimento
- Al completamento monitoraggio ICP, il sensore ICP può essere rimosso tirando delicatamente il catetere dal materiale vite e sigillatura.
- Il sensore di SAMBA deve essere immediatamente posto in 1% TERG-A-Zyme soluzione per prevenire la corrosione della punta.
- Il foro rimanente nel materiale di sigillatura deve essere coperto con uno strato aggiuntivo di materiale di sigillatura. (Rat può essere svegliato in questa fase).
- Per reinserire il catetere SAMBA per il monitoraggio aggiuntivo, affettareil materiale di sigillatura a livello della testa della vite.
- Ripetere i passaggi 3.2 - 5.3.
6. Risultati rappresentativi
Figura 5 è una rappresentazione di letture ICP oltre dieci secondi. Al basale, l'ICP medio in un ratto Wistar è di 6 mmHg. Gli eventi di più breve periodicità illustrato nella figura 5 riflettere onde a impulso di pressione del sangue. Gli eventi di più lunga periodicità visualizzare gli eventi di ventilazione. Si noti che il sensore SAMBA riflette una ampiezza di ventilazione mmHg 3-4 e ampiezza dell'impulso di 1-2 mmHg.
Per convalidare la posizione del sensore SAMBA in ciascun esperimento, le tracce ICP devono essere testati per la reattività di compressioni addominali ed eventi respiratorie, come i periodi di apnea. Una compressione addominale è illustrato in Figura 7.
Periodi di apnea (illustrata nella figura 8) si osservano in più esperimenti Invo lving respiro spontaneo animali. Questi eventi sono identificati sulle registrazioni fisiologiche, l'assenza di deviazioni su respiratorie delle vie respiratorie (trasduttore diaframma) e tracce di pressione arteriosa. Un'alterazione equivalente nella traccia ICP convalida il posizionamento della sonda ICP.
Figura 9 illustra una tipica traccia ICP dopo la rimozione delle barre auricolari (passo 4.6). L'inserimento delle barre di auricolari in fase 1.2 risultati in una leggera compressione del cranio e la conseguente interruzione del volume intracranico e quindi un aumento della ICP. Se il sensore è posizionato correttamente, ICP scenderà almeno 4-5 mmHg con la rimozione delle barre dell'orecchio.
L'analisi istologica può essere utilizzato per verificare eventuali danni alla zona corticale immediatamente sotto il sensore di pressione e la vite. Un esempio di inserimento della vite traumatico e non-traumatica è illustrato in Figura 4.
_upload/3689/3689fig1.jpg "/>
Figura 1. Fluid Filled Vs SAMBA Tracce ICP. ICP è stato registrato contemporaneamente tramite la fibra ottica catetere SAMBA (in alto) e un catetere pieno di liquido (in basso). I valori medi PIC erano simili in entrambe le tracce, ma il segnale catetere riempito di fluido è stato notevolmente smorzato rispetto al respiratorie chiaro e pressione arteriosa forme d'onda visto con la fibra ottica catetere.
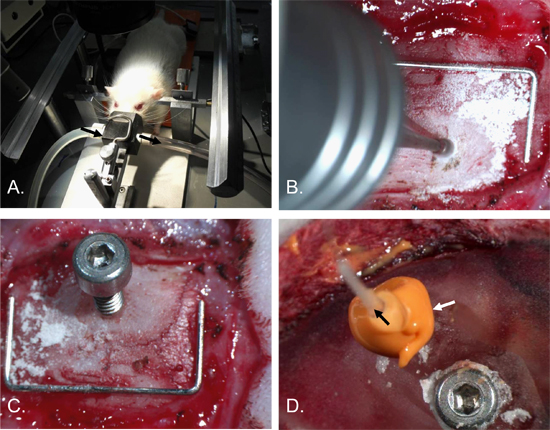
Figura 2. Intracranica catetere Procedure pressione di inserimento. La testa del topo è stato fissato ad un telaio stereotassico con orecchio-bar e un cono il naso anestetico [A]. Un foro, di circa 2 mm di diametro, è stato perforato nella parietale destro [B]. A x 2 4 vite mm con un foro di 0,7 mm è stato inserito l'albero [C]. Una vite di fissaggio è stato inserito nell'osso parietale sinistro e il cranio e sito chirurgico rivestito in cemento dentale. La ICP catheter (freccia nera) è stato quindi inserito nel foro a vite e una chiusura ermetica realizzato con il materiale di sigillatura (freccia bianca) [D]. Staple (per scala) = 12 mm x 5 mm.
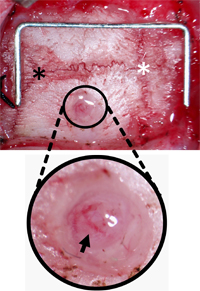
Figura 3. Monitoraggio vite Burr Hole Orientamento. Il cranio è stato scagionato da tessuto connettivo per individuare Lambda (asterisco nero) e Bregma (asterisco bianco) e il foro 2 millimetri laterali e 2 mm posteriormente dal bregma. Il foro è stata liberata dai detriti lasciando la durata e le navi piale (freccia nera) intatti. Staple (per scala) = 12 mm x 5 mm.
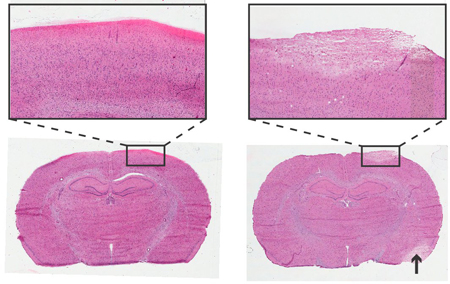
Figura 4. Istologia di cervello di ratto 24 ore dopo Strumentazione di vite monitoraggio della pressione intracranica. Haemotoxylin e colorazione eosina, 6 micron sezioni coronali. A sinistra: non traumatico inserimento della vite. A destra: inserimento della vite traumatica,area di pallore raffigura tessuto danneggiato con simile morfologia cellulare per ictus zona danneggiata (freccia). Inserti a obiettivo 4x.

Figura 5. Tipici ICP traccia. Onde di pressione di impulsi sono rappresentati da eventi di minore ampiezza (*). La ventilazione è riflessa da eventi di più periodicità (#).
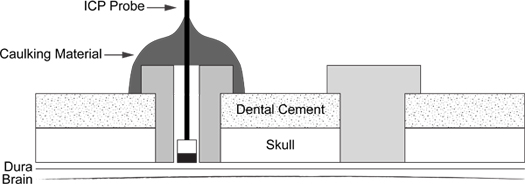
Figura 6. ICP di inserimento della sonda schematica. Diagramma illustra il posizionamento della vite di supporto (a destra) e coibentazione materiale rivestito ICP sonda nella vite (a sinistra).
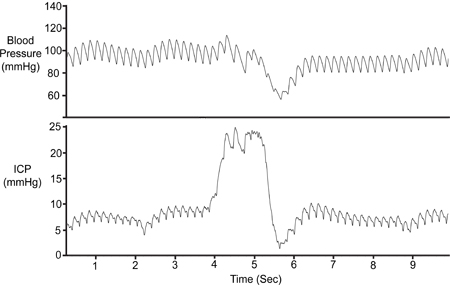
Figura 7. Compressione addominale. L'addome è stato temporaneamente compresso (~ 1 sec) per convalidare la fattibilità del segnale ICP. La compressione risulta in riduzione ritorno venoso cerebrale,l'aumento del volume cerebrale e aumentando così la ICP. La pressione arteriosa (Pa) è sceso solo dopo l'ascesa iniziale ICP.
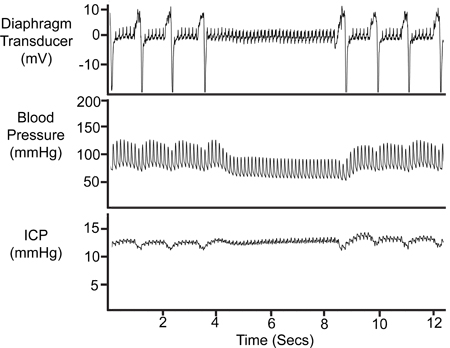
Figura 8. Periodo di Apnea. La temporanea cessazione della respirazione si riflette nella traccia trasduttore a membrana, la pressione arteriosa (Pa) traccia e la traccia ICP.
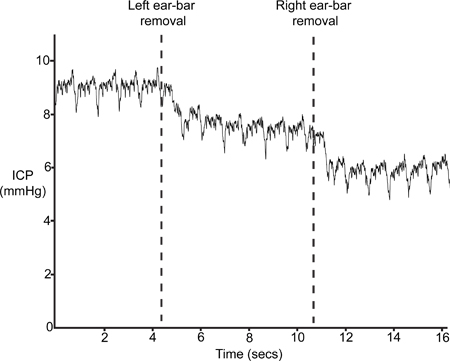
Figura 9. Ear-Bar rimozione. ICP dovrebbe cadere con la rimozione dei stereotassiche telaio ear-bar.
Discussione
La procedura qui presentata consente una registrazione molto sensibile e preciso della pressione intracranica. Questa tecnica minimamente invasiva evita traumi significativi cervello posizionando il sensore di pressione nello spazio epidurale e non il tessuto cerebrale o ventricoli.
I passaggi critici sono: 1) di perforazione attraverso il cranio - bisogna fare attenzione a non forare la durata o danno sotteso tessuto cerebrale, 2) garantire una tenuta perfetta con il materiale di sigillatur...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo progetto è stato finanziato dalla National Stroke Foundation, Hunter Medical Research Institute (HMRI) e National Health and Medical Research Council (NH & MRC), Australia. Un ringraziamento speciale alla Facoltà della Salute Workshop presso l'Università di Newcastle per la loro competenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Cemento Monomer Dental | Henry Schein | VX-SC500MLL | |
| Dental cemento polimerico | Henry Schein | VX-SC1000GCL4 | |
| Drill Dental Burr-taglia 12 | Gunz Dental | EL104S001012/10 | |
| Drill Dental Burr-size 6 | Gunz Dental | EL104S001006/10 | |
| In metallo a vite | Ferramenta | 2 x 4 mm, testa esagonale. (Laboratorio modificato da 0,7 mm forata foro passante) | |
| SAMBA Control Unit | Harvard Apparatus | 50433102 | |
| SAMBA Sensor | Harvard Apparatus | 50461122 | 420 LP, 15cm in fibra nuda, radio-opaco rivestimento |
| Silagum AV Mono materiale di sigillatura | Gunz Dental | RG 9152 | Vinylpolysiloxanes, polisilossani idrogeno, filler, pigmenti, additivi, catalizzatori plantinum |
| TERG-A-Zyme | Alconox, Inc. | 1304 | Enzyme-active detersivo in polvere |
Riferimenti
- Ng, L. K., Nimmannitya, J. Massive cerebral infarction with severe brain swelling: a clinicopathological study. Stroke. 1, 158-163 (1970).
- Plum, F. Brain swelling and edema in cerebral vascular disease. Res. Publ. Assoc. Res. Nerv. Ment. Dis. 41, 318-348 (1966).
- Ropper, A. H., Shafran, B. Brain edema after stroke. Clinical syndrome and intracranial pressure. Arch. Neurol. 41, 26-29 (1984).
- Silver, F. L., Norris, J. W., Lewis, A. J., Hachinski, V. C. Early mortality following stroke: a prospective review. Stroke. 15, 492-496 (1984).
- Geraci, E. B., Geraci, T. A. Hyperventilation and head injury: controversies and concerns. J. Neurosci. Nurs. 28, 381-387 (1996).
- Schwab, S., Aschoff, A., Spranger, M., Albert, F., Hacke, W. The value of intracranial pressure monitoring in acute hemispheric stroke. Neurology. 47, 393-398 (1996).
- Adams, H. P. Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association. Stroke. 34, 1056-1083 (2003).
- Zhong, J. Advances in ICP monitoring techniques. Neurol. Res. 25, 339-350 (2003).
- Aucoin, P. J. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am. J. Med. 80, 369-376 (1986).
- Silasi, G., MacLellan, C. L., Colbourne, F. Use of telemetry blood pressure transmitters to measure intracranial pressure (ICP) in freely moving rats. Curr. Neurovasc. Res. 6, 62-69 (2009).
- Crutchfield, J. S., Narayan, R. K., Robertson, C. S., Michael, L. H. Evaluation of a fiberoptic intracranial pressure monitor. J. Neurosurg. 72, 482-487 (1990).
- Bolander, R., Mathie, B., Bir, C., Ritzel, D., Vandevord, P. Skull Flexure as a Contributing Factor in the Mechanism of Injury in the Rat when Exposed to a Shock Wave. Ann. Biomed. Eng. , (2011).
- Chavko, M., Koller, W. A., Prusaczyk, W. K., McCarron, R. M. Measurement of blast wave by a miniature fiber optic pressure transducer in the rat brain. J. Neurosci. Methods. 159, 277-281 (2007).
- Chavko, M. Relationship between orientation to a blast and pressure wave propagation inside the rat brain. J. Neurosci. Methods. 195, 61-66 (2011).
- Leonardi, A. D., Bir, C. A., Ritzel, D. V., VandeVord, P. J. Intracranial pressure increases during exposure to a shock wave. J. Neurotrauma. 28, 85-94 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon