このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
光ファイバ圧力トランスデューサを使用したラットの硬膜外頭蓋内圧測定
要約
頭蓋骨内の圧力を記録するための新たな手法が記載されています。低侵襲の方法では、正確に重要な脳外傷を引き起こすことなく、麻酔ラットの頭蓋内圧(ICP)を測定する光ファイバ圧力検出システムを使用しています。技術は、実験モデルの広い範囲で使用することができます。
要約
上昇した頭蓋内圧(ICP)は、脳卒中、外傷性脳損傷と心停止を含む虚血性脳損傷のいくつかの形で重大な問題である。この上昇は、テント切痕ヘルニア1,2,3,4、中脳圧迫、神経学的欠損または脳梗塞2,4の増加という形で、さらに神経損傷の原因になります。現在の治療は、しばしば臨床の現場5,6,7に昇格したICPを制御するには不十分である。したがって、基本的なメカニズムの理解を促進すると高架ICPの新しい治療法を開発するために動物モデルでのICP測定の正確な方法が必要である。
両方の臨床および実験的な設定ではICPは直接測定せずに推定することはできません。 ICPのカテーテルの挿入のいくつかのメソッドは、現在存在しています。これらの脳室内カテーテルは、ヒト8 ICP測定の臨床"ゴールドスタンダード"となっています。このメソッドはINV頭蓋骨と脳組織を介してカテーテルのインスツルメンテーションの部分的な除去はolves。その結果、室内カテーテルは6から11パーセント9の感染率を持っています。このため、硬膜下血腫と硬膜外cannulationsは、虚血性損傷の動物モデルにおいて好ましい方法となっています。
11,12,13,14,15を様々なICP測定技術は、動物モデルに適応されており、これらのうち、液体で満たされたテレメトリカテーテル10およびソリッド·ステート·カテーテルは、最も頻繁に使用されています。液体で満たされたシステムでは、偽のICP測定値で、結果の行の気泡を開発する傾向がある。ソリッド·ステート·プローブ( 図1)この問題を回避する。さらなる問題は、実験結果を変える可能性の脳損傷を引き起こすことなく、頭蓋骨の下や脳室にカテーテルフィッティングです。したがって、我々は硬膜外腔と連続してICPカテーテルを配置する方法を開発し、でもねを回避しているEDは、頭蓋骨と脳の間に挿入することができます。
圧力センサーの位置が(カテーテルの非常に先端で)このモデルでは、高忠実度ICP信号を生成することが判明したので、光ファイバ圧力カテーテル(420LP、SAMBAセンサ、スウェーデン)は硬膜外の場所でICPを用いて測定した。我々の方法で使用することができる同様の光ファイバ技術の13の他のメーカーがあります。信号が監視ネジの存在によって湿らされるようカテーテル先端の側に位置する圧力センサを持つ代替固体カテーテルは、このモデルは適していません。
ここでは、ICPを測定するための比較的簡単で正確な方法を提示します。このメソッドは、ICP関連動物モデルの広い範囲で使用できます。
プロトコル
1。頭蓋骨の浸透
- イソフルラン(5%誘導、1.5から2パーセントのメンテナンス)70%N 2で、30%O 2でラットをAnaesthetize。麻酔導入後、麻酔ノーズコーンラットの鼻を配置し、温暖化プレート上で発生しやすいラットを配置します。
- 麻酔を維持しながら、頭が安定するまで耳に棒を挿入し、定位フレームに頭部を固定します。呼吸が損なわれないことを確認してください。 ( 図2-a)。
- 1.5cmの皮膚正中頭切開を行う前に、長期的な局所麻酔剤、ブピバカイン0.3ミリリットル0.5%(ファイザー社、オーストラリア)で皮下に頭皮を注入します。 (滅菌機器や手袋を使用する必要があります。)
- はっきりとラムダとブレグマを見つけるために、軟組織と周囲の筋肉を解剖鈍らせる。皮膚や結合組織を撤回。
- 露出した頭蓋骨に圧力を加えることによって、任意の出血を止める。過度の頭蓋骨の出血が焼灼されることがあります。
- 歯のDRIを使用する1ミリメートル先端バリ、バリ、右頭頂骨に広い穴2 mmのでしょう。上矢状静脈洞を回避し、ICPセンサの配置を確保するため穿頭横2ミリメートルとブレグマから後方2 mmのストロークの研究のため、虚血領域を超えています。別の場所では、他のアプリケーションにも同様に適しているであろう。バリ硬膜上頭蓋半透明になる深さまで穴。 ( 図2-B)。
- 穴の底に頭蓋骨を削除するには、0.5ミリメートル先端バリでバリを交換してください。
- 頭蓋骨が割れを開始すると、破片がクリアされ穴の基地を確保し、残りのすべての頭蓋骨を削除するには、45°の鉗子を使用しています。 ( 図3)。
2。ネジの修正および挿入
- 旋盤および0.7 mmのドリルビットを使用して、六角頭のネジを介して0.7ミリメートルの穴を開けます。
- それを約1.5回転を回して穴に監視しているネジを挿入します(最小量のを使用しように)基本的な組織を損傷しないように頭蓋骨にネジを固定するために必要になります。 ( 図2-Cおよび図4)。
- バリ左頭頂骨にアンカーネジ第二の穴、横2ミリメートルとブレグマから後方2ミリメートル。この穴は、頭蓋骨の完全浸透を必要としないので、1ミリメートルの先端バリは、ねじの挿入のために頭蓋骨を薄くするために使用されます。
- 第二の穴に2×4 mm六角頭ネジを挿入します。このネジは、歯科用セメント、したがって、頭蓋骨に監視しているネジを固定するのに役立ちます。
- ネジの頭のベースに歯科用セメントのモノマーとポリマーを混合し、適用する転送ピペットを使用しています。
- 歯科用セメントは、少なくとも10分間乾燥することができます。
3。頭蓋内の圧力トランスデューサの挿入
- 白の修正液を使用して、先端から光ファイバーセンサー4ミリメートルをマークします。
- 滅菌生理食塩水(0.9%)でモニターのネジの穴を埋めるおよびnoを確保気泡がねじ内に存在する。
- プローブの先端がネジの最後のレベルになるようにネジにICPプローブ4ミリメートルを挿入します。先端が硬膜を貫くしないことを確認してください。
- 換気と血圧脈波を反映してICPトレースが観察できるようになるまでネジ内でプローブの先端を調整します。 ( 図5)。
4。気密シールを形成
- 気密シールは、正確なICPの読み取りに必要不可欠です。 1:1の比率で粘性のある生体適合性のコーキング材料モノマーとポリマーを混合します。圧力センサはプローブの先端にあり、この中空外ネジ内にあるため、光ファイバプローブの軸にコーキング材の適用は、センサの圧力感度に影響を与えません。
- プローブと監視のネジの頭の周りの薄層を適用します。 ICPプローブを変位させることは避けてください。
- 5分間に設定することができます。
- 第二レイを適用します。全体の監視ネジとプローブの周りにコーキング材のER。液体がコーキング材料内の任意のクレバスから漏れないことを確認してください。 ( 図2-D)。
- 耳·バーを削除します。
- ラットでは、腹臥位に残っている、またはICPモニタリング中に仰臥位に慎重に回転させることができる。
- 完了する手順の概略は、( 図6)に示されている。
5。頭蓋内の圧力トランスデューサの取り外しおよび再挿入
- 完了ICPモニタリングでは、ICPセンサは優しくネジとコーキング材からカテーテルを引いて削除される可能性があります。
- SAMBAセンサは先端の腐食を防止するために、1パーセントTerg-A-Zymeソリューションに直ちに行われなければなりません。
- コーキング材に残っている穴はコーキング材の追加の層で覆われるべきである。 (ラットは、この段階で起こされるかもしれません)。
- 追加の監視のためのSAMBAカテーテルを挿入するには、スライスネジの頭のレベルでコーキング材。
- 5.3 - 手順3.2を繰り返します。
6。代表的な結果
図5は、10秒以上ICPの測定値を表現したものです。ベースラインでは、Wistar系ラットの平均ICPは6 mmHgである。 図5に示すように短い周期のイベントは、血圧脈波を反映しています。より長い周期のイベントは、換気のイベントを示します。 SAMBAセンサー3-4 mmHgで1〜2 mmHgのパルス振幅の換気の振幅を反映していることに注意してください。
各実験ではSAMBAセンサの位置を検証するために、ICPのトレースは腹部の圧迫や無呼吸の期間などの呼吸器イベントへの応答性をテストする必要があります。腹部の圧縮を図7に描かれています。
無呼吸の期間は、( 図8に示すように)ほとんどの実験INVOで観察される自発的に動物を呼吸lving。これらのイベントは、呼吸器(ダイヤフラムトランスデューサ)と動脈圧のトレース上での呼吸変形の有無によって生理的なレコードで識別されます。 ICPトレースで同等の変更は、ICPのプローブの位置を検証します。
図9は、耳·バー(ステップ4.6)を除去した後の典型的なICPのトレースを示しています。頭蓋内容積、したがって増加したICPの頭蓋骨と、その結果混乱のわずかな圧縮工程1.2結果の耳棒の挿入。耳·バーの除去で5 mmHgの - センサーが正しく配置されている場合、ICPは、少なくとも4をドロップします。
組織学的分析は、圧力センサとネジのすぐ下皮質領域への損傷をチェックするために使用されることがあります。外傷性と非外傷性スクリュー挿入の例を図4に描かれています。
_upload/3689/3689fig1.jpg "/>
図1。流体は、Vs SAMBA ICPトレースを満たしていた。ICPがSAMBA光ファイバカテーテル( 上 )と流体の満たされたカテーテル( 下 )を経由して同時に記録した。平均ICPの値が両方のトレースで類似していたしかし、流体を充填カテーテル信号は、特に明確な呼吸と動脈圧の光ファイバカテーテルで見られた波形と比較して湿らせた。
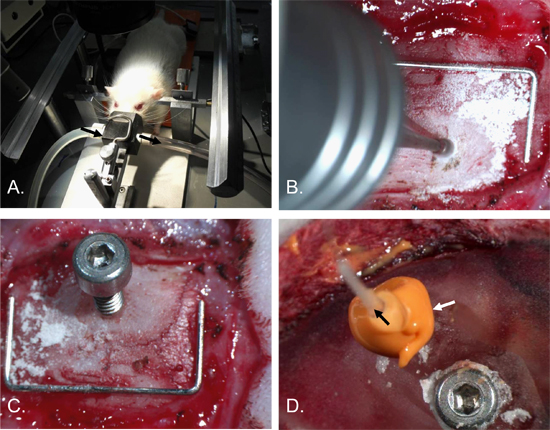
図2。頭蓋内圧カテーテルの挿入の手順。ラットの頭部は耳のバーや麻酔ノーズコーン[A]と定位フレームに固定されました。穴は、直径約2mm、右頭頂骨[B]に掘削された。シャフト0.7mmの穴と2×4 mmネジが挿入された[C]。アンカーネジは、左頭頂骨と頭蓋骨と歯科用セメントで覆われ、手術部位に挿入した。 ICP cathetER( 黒矢印 ) は 、ねじ穴とコーキング材( 白い矢印 )[D]で作られた気密シールを挿入した。主食(スケール)= 12×5 mmである。
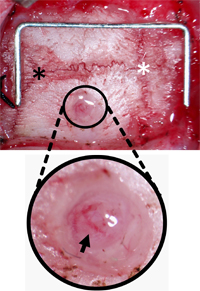
図3。ネジ穿頭孔の向きを監視します 。頭蓋骨は、ラムダ( 黒アスタリスク )とブレグマ( 白アスタリスク )と横方向の2ミリメートルとブレグマから後方2mmのドリル穴を見つけるために結合組織からクリアされました。穴は、硬膜と軟膜血管( 黒矢印 )をそのまま残し破片がクリアされました。主食(スケール)= 12×5 mmである。
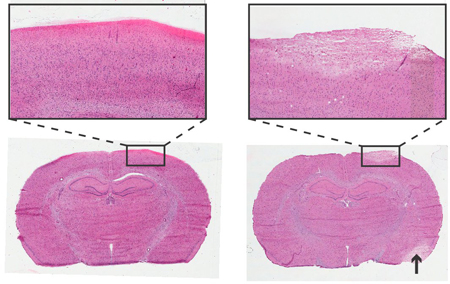
図4。 24時間ICPモニタリングねじのインスツルメンテーション後のラットの脳の組織。Haemotoxylinとエオシン染色、6μmの冠状断面。左:非外傷性のネジ挿入。右:外傷性ねじの挿入、蒼白の領域は脳卒中損傷部位( 矢印 )に似た細胞の形態と損傷した組織を示しています。 4xの目的で挿入します。

図5。典型的なICPトレースします。パルス圧力波は、振幅が小さい(*)のイベントで描かれている。換気は長い周期(#)のイベントに反映されます。
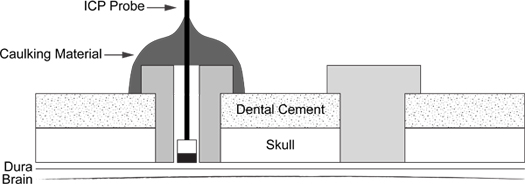
図6。 ICPプローブ挿入図 。図では、サポートネジ( 右 )とネジ( 左 )にコーキング材コーティングされたICPプローブの配置を示しています。
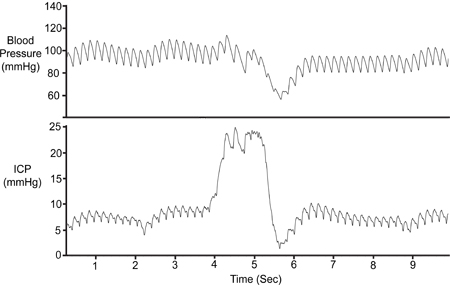
図7。腹部の圧縮。腹部は一時的にICP信号の可能性を検証する(〜1秒)圧縮された。減少し脳の静脈還流の圧縮の結果、頭蓋内容積を増加させるため、ICPを増加させる。動脈圧(PA)は初期のICP上昇した後にのみ低下した。
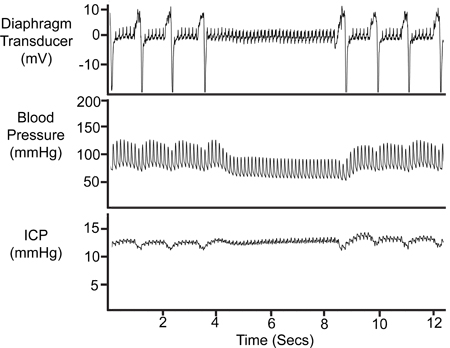
図8。 Apnoeaの期間。呼吸の一時停止は、ダイアフラムトランスデューサトレース、動脈圧(Pa)とトレースとICPのトレースに反映されます。
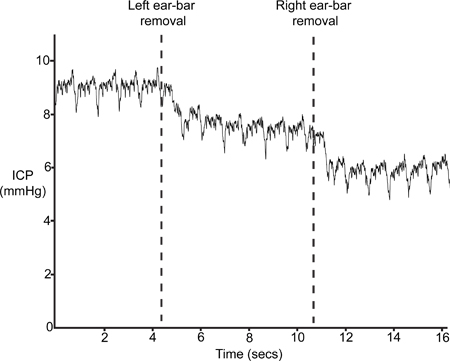
図9。耳バーの取り外し。ICPは定位フレーム耳·バーの除去と削除する必要があります。
ディスカッション
ここで紹介する手順は、頭蓋内圧の非常に敏感かつ正確に記録することができます。この低侵襲技術は、硬膜外腔ではなく、脳組織または心室の圧力センサを配置することによって、重要な脳外傷を避けることができます。
重要な手順は次のとおりです。1)頭蓋骨を介して掘削 - ケアはピアス硬膜や脳組織の基礎となる損傷しないように注意しなければなりません。2)...
開示事項
我々は、開示することは何もありません。
謝辞
このプロジェクトは、国立脳卒中財団、ハンター医学研究所(HMRI)と国立保健医療研究評議会(NH&MRC)、オーストラリアによって資金を供給された。彼らの技術的専門知識のためのニューカッスル大学の保健ワークショップスタッフの学部に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 歯科用セメントのモノマー | ヘンリーシャイン | VX-SC500MLL | |
| 歯科用セメントポリマー | ヘンリーシャイン | VX-SC1000GCL4 | |
| 歯科用ドリルバリサイズ12 | ガンズ歯科 | EL104S001012/10 | |
| 歯科用ドリルバリサイズ6 | ガンズ歯科 | EL104S001006/10 | |
| 金属ネジ | 金物店 | 2×4 mmの六角。 (軸貫通0.7ミリメートルの穴で実験室の変更) | |
| SAMBAコントロールユニット | ハーバード装置 | 50433102 | |
| SAMBAセンサ | ハーバード装置 | 50461122 | 420 LP、15センチメートルベアファイバ、無線不透明なコーティング |
| Silagum AVモノコーキング材 | ガンズ歯科 | RG 9152 | Vinylpolysiloxanes、水素ポリシロキサン、フィラー、顔料、添加剤、触媒plantinum |
| Terg-A-Zyme | Alconox株式会社 | 1304 | 酵素活性な粉末洗剤 |
参考文献
- Ng, L. K., Nimmannitya, J. Massive cerebral infarction with severe brain swelling: a clinicopathological study. Stroke. 1, 158-163 (1970).
- Plum, F. Brain swelling and edema in cerebral vascular disease. Res. Publ. Assoc. Res. Nerv. Ment. Dis. 41, 318-348 (1966).
- Ropper, A. H., Shafran, B. Brain edema after stroke. Clinical syndrome and intracranial pressure. Arch. Neurol. 41, 26-29 (1984).
- Silver, F. L., Norris, J. W., Lewis, A. J., Hachinski, V. C. Early mortality following stroke: a prospective review. Stroke. 15, 492-496 (1984).
- Geraci, E. B., Geraci, T. A. Hyperventilation and head injury: controversies and concerns. J. Neurosci. Nurs. 28, 381-387 (1996).
- Schwab, S., Aschoff, A., Spranger, M., Albert, F., Hacke, W. The value of intracranial pressure monitoring in acute hemispheric stroke. Neurology. 47, 393-398 (1996).
- Adams, H. P. Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association. Stroke. 34, 1056-1083 (2003).
- Zhong, J. Advances in ICP monitoring techniques. Neurol. Res. 25, 339-350 (2003).
- Aucoin, P. J. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am. J. Med. 80, 369-376 (1986).
- Silasi, G., MacLellan, C. L., Colbourne, F. Use of telemetry blood pressure transmitters to measure intracranial pressure (ICP) in freely moving rats. Curr. Neurovasc. Res. 6, 62-69 (2009).
- Crutchfield, J. S., Narayan, R. K., Robertson, C. S., Michael, L. H. Evaluation of a fiberoptic intracranial pressure monitor. J. Neurosurg. 72, 482-487 (1990).
- Bolander, R., Mathie, B., Bir, C., Ritzel, D., Vandevord, P. Skull Flexure as a Contributing Factor in the Mechanism of Injury in the Rat when Exposed to a Shock Wave. Ann. Biomed. Eng. , (2011).
- Chavko, M., Koller, W. A., Prusaczyk, W. K., McCarron, R. M. Measurement of blast wave by a miniature fiber optic pressure transducer in the rat brain. J. Neurosci. Methods. 159, 277-281 (2007).
- Chavko, M. Relationship between orientation to a blast and pressure wave propagation inside the rat brain. J. Neurosci. Methods. 195, 61-66 (2011).
- Leonardi, A. D., Bir, C. A., Ritzel, D. V., VandeVord, P. J. Intracranial pressure increases during exposure to a shock wave. J. Neurotrauma. 28, 85-94 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved