Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Epidurale Intrakranielle Druckmessung in Ratten mit einem LWL-Druckaufnehmer
In diesem Artikel
Zusammenfassung
Eine neue Technik, um die Drücke innerhalb des Schädels aufnehmen beschrieben. Die minimal-invasive Methode verwendet eine Glasfaser-Druck-Sensing-System genau zu messen Hirndruck (ICP) in narkotisierten Ratten ohne wesentliche Hirn-Trauma. Die Technik kann in einem weiten Bereich von experimentellen Modellen verwendet werden.
Zusammenfassung
Erhöhten intrakraniellen Druck (ICP) ist ein bedeutendes Problem in mehreren Formen von ischämischen Hirnschädigung wie Schlaganfall, Schädelhirntrauma und Herzstillstand. Diese Erhöhung kann zu einem weiteren neurologischen Verletzungen führen, in Form von transtentorielle Herniation 1,2,3,4, Mittelhirn Kompression, neurologische Defizite oder erhöhte Hirninfarkt 2,4. Aktuelle Therapien sind oft unzureichend, um erhöhten ICP im klinischen Umfeld 5,6,7 steuern. So gibt es einen Bedarf für eine genaue Methoden der ICP-Messung in Tiermodellen zu unserem Verständnis der grundlegenden Mechanismen zu fördern und zu neuen Behandlungen für erhöhten ICP zu entwickeln.
Sowohl in der klinischen und experimentellen Einstellung ICP kann nicht ohne direkte Messung geschätzt werden. Mehrere Methoden der ICP-Katheter zur Zeit existieren. Davon sind der intraventrikulären Katheter hat sich der klinische "Goldstandard" der ICP-Messung beim Menschen 8. Diese Methode involves die teilweise Entfernung des Schädels und die Instrumentierung des Katheters durch Hirngewebe. Folglich haben intraventrikulären Katheter eine Infektionsrate von 11.6% 9. Aus diesem Grund haben subduralen und epidurale Kanülen werden die bevorzugten Verfahren in Tiermodellen von ischämischen Schädigung.
Verschiedene Techniken wurden ICP-Messung für Tiermodelle angepasst, und von diesen sind mit Flüssigkeit gefüllte Telemetrie Katheter 10 und Katheter festen Zustand die am häufigsten verwendete 11,12,13,14,15. Die Flüssigkeit gefüllte Systeme sind anfällig für die Entwicklung von Luftblasen in der Leitung, was zu falschen Messungen ICP. Solid-State-Sonden dieses Problem vermeiden (Abbildung 1). Ein weiteres Problem ist passend Katheter unter dem Schädel oder in die Ventrikel, ohne dass eine Hirnschädigung, die die experimentellen Ergebnisse beeinflussen könnten. Deshalb haben wir eine Methode, die eine ICP-Katheter angrenzend an den Epiduralraum platziert entwickelt, aber vermeidet die need, um es zwischen Schädel und Gehirn einzufügen.
Lichtleitfaser Druck Katheter (420LP, SAMBA Sensoren, Schweden) wurde verwendet, um ICP bei den Epiduralraum Ort zu messen, da die Lage des Drucksensors (an der äußersten Spitze des Katheters) wurde gefunden, dass eine High-Fidelity-ICP-Signal in diesem Modell zu erzeugen . Es gibt andere Hersteller von ähnlichen optischen Faser 13, die mit Technologien unsere Methode verwendet werden kann. Alternative festen Zustand Katheter, die den Drucksensor an der Seite der Katheterspitze angeordnet sind, nicht geeignet sein, dieses Modell an, wenn das Signal durch die Anwesenheit des Abfrageschraube gedämpft werden.
Hier präsentieren wir eine relativ einfache und genaue Methode zur ICP zu messen. Dieses Verfahren kann in einem breiten Bereich von ICP erhältlichen Tiermodellen verwendet werden.
Protokoll
1. Schädel-Penetration
- Betäuben Ratten mit Isofluran (5% Induktion, 1,5-2% Wartung) in 70% N 2 und 30% O 2. Nach Einleitung der Narkose, legen Sie die Ratte in Bauchlage auf einer Warmhalteplatte, die Positionierung der Ratte Nase in ein Anästhetikum Bugspitze.
- Unter Beibehaltung Anästhesie, sichern Sie den Kopf in einen stereotaktischen Rahmen, Einsetzen der Ohr-Bars, bis der Kopf wird stabilisiert. Stellen Sie sicher, Atmung nicht beeinträchtigt wird. (2-A).
- Inject Kopfhaut subkutan mit langfristiger örtlicher Betäubung, Bupivacain 0,3 ml 0,5% (Pfizer, Australien), bevor sie eine 1,5 cm Haut Mittellinie Kopf Einschnitt. (Sterile Instrumente und Handschuhe sollten benutzt werden.)
- Blunt sezieren das weiche Gewebe und die umliegenden Muskeln, klar zu lokalisieren Lambda und Bregma. Ziehen Sie die Haut und Bindegewebe.
- Stem eine Blutung durch Druck auf den Schädel ausgesetzt. Übermäßige Schädel Blutungen können verödet werden.
- Verwendung einer dentalen drill mit einem 1 mm Spitze Grat, Grat ein Loch von 2 mm Breite in das rechte Scheitelbein. Burr das Loch 2 mm lateral und 2 mm posterior von Bregma, um den Sinus sagittalis superior zu vermeiden und die Platzierung des ICP Sensor über das ischämische Bereich, für Hub Studien. Alternative Standorte wäre ebenso für andere Anwendungen geeignet. Burr das Loch bis zu einer Tiefe, wo der Schädel über der Dura wird durchscheinend. (2-B).
- Ersetzen Sie den Grat mit einem 0,5 mm Spitze Grat auf den Schädel an der Basis der Bohrung zu entfernen.
- Wenn der Schädel zu knacken beginnt, verwenden 45 ° Zange, um alle restlichen Schädel zu entfernen, wodurch die Basis des Loch wird von Trümmern geräumt. (Abbildung 3).
2. Schraube Umbau und Insertion
- Bohren Sie ein 0,7 mm Loch in einer hexagonalen Hammerschraube mit einer Drehbank und 0,7 mm-Bohrer.
- Legen Sie die Monitoring-Schraube in das Loch, indem Sie es etwa 1,5 Umdrehungen (verwenden Sie den Mindestbetrag vondreht Schraube benötigt, um in Schädel zu sichern, um nicht zugrunde liegenden Gewebeschäden an). (Abbildung 2-C und Abbildung 4).
- Burr ein zweites Loch für eine Ankerschraube im linken Scheitelbein, 2 mm und 2 mm lateral posterior von Bregma. Dieses Loch erfordert keine vollständige Durchdringung des Schädels, so dass der 1 mm Spitze Grat verwendet wird, um den Schädel für Schraubeninsertion verdünnen.
- Legen Sie eine 2 x 4 mm Sechskant-Kopfschraube in das zweite Loch. Diese Schraube hilft, die Dentalzement und damit die Überwachung Schraube am Schädel zu verankern.
- Mit Hilfe einer Pipette zu mischen und anzuwenden Zahnzement Monomer und Polymer auf der Basis der Kopf der Schrauben.
- Erlauben Sie Zahnzement für mindestens 10 Minuten trocknen.
3. Hirndruck Transducer Insertion
- Mit weißen Korrekturflüssigkeit, markieren Sie den faseroptischen Sensor 4 mm von der Spitze.
- Füllen Sie das Loch des Monitoring-Schraube mit einer sterilen Kochsalzlösung (0,9%) und sicherzustellen, dass keineLuftblasen vorhanden sind innerhalb der Schraube.
- Legen Sie die ICP-Sonde 4 mm in der Schraube, so dass die Spitze der Sonde mit dem Ende der Schraube ist. Sicherstellen, dass die Spitze nicht durchbohren die Dura.
- Passen Sie die Spitze der Sonde in der Schraube, bis ein ICP Spur reflektiert Lüftungs-und Blutdruck-Puls-Wellen beobachtet werden kann. (5).
4. Eine luftdichte Dichtung
- Eine luftdichte Abdichtung ist zwingend notwendig, zu einer genauen Lektüre ICP. Mischen eines viskosen Dichtungsmaterial biokompatiblen Monomeren und Polymeren in einem Verhältnis von 1:1. Da der Drucksensor an der Spitze der Sonde, und dies ist innerhalb des ausgehöhlten Schraube weist Anwendung Dichtungsmaterial an der Welle der faseroptischen Sonde keine Auswirkung auf Druck Empfindlichkeit des Sensors.
- Tragen Sie eine dünne Schicht um die Sonde und der Leiter der Monitoring-Schraube. Vermeiden Verschieben des ICP-Sonde.
- Lassen Sie es 5 Minuten eingestellt.
- Tragen Sie eine zweite LaienER von Dichtungsmaterial um die gesamte Überwachung Schraube und Sonde. Stellen Sie sicher, dass keine Flüssigkeit wird von allen Spalten im Dichtungsmaterial undicht. (2-D).
- Entfernen Sie Ohr-Bars.
- Die Ratte kann in der Bauchlage zu bleiben, oder werden sorgfältig gedreht, in der Rückenlage während der ICP-Überwachung.
- Eine schematische Darstellung der ausgeführten Prozedur wird in (6) dargestellt.
5. Hirndruck Transducer Entfernen und Wiedereinsetzen
- Nach Beendigung Hirndruckmessung kann die ICP-Sensor durch leichtes Ziehen der Katheter aus der Schraube und Dichtungsmaterial entfernt werden.
- Die SAMBA-Sensor sollte sofort sein Platz in 1% Terg-A-Zyme Lösung bis zur Spitze Korrosion zu vermeiden.
- Das Loch in der verbleibenden Dichtungsmaterial sollte mit einer zusätzlichen Schicht aus Dichtungsmaterial abgedeckt werden. (Rat kann in diesem Stadium geweckt werden).
- Um den Samba-Katheter für zusätzliche Überwachung wieder einsetzen, in Scheiben schneidenDie Dichtungsmaterial auf der Ebene der Kopf der Schraube.
- Wiederholen Sie die Schritte von 3,2 bis 5,3.
6. Repräsentative Ergebnisse
Abbildung 5 ist eine Darstellung des ICP-Werte über 10 Sekunden. Zu Beginn der Studie ist die durchschnittliche ICP in einer Wistar-Ratte 6 mmHg. Die Ereignisse des kürzeren Abständen in 5 dargestellt während Blutdruck Pulswellen. Die Ereignisse von mehr Periodizität zeigen, Lüftungs-Veranstaltungen. Beachten Sie, dass der Samba-Sensor eine Belüftung Amplitude von 3-4 mmHg und Pulsamplitude von 1-2 mmHg widerspiegelt.
Um die Position des SAMBA-Sensor in jedem Experiment zu bestätigen, sollte ICP Spuren für das Ansprechen auf abdominale Kompressionen und respiratorische Ereignisse, wie zum Beispiel Perioden von Apnoe getestet werden. Ein Bauchkompressionsgurt ist in 7 dargestellt.
Perioden von Apnoe (dargestellt in Abbildung 8) sind in den meisten Experimenten beobachtet invo liebenden spontan atmenden Tieren. Diese Ereignisse werden auf die physiologischen Aufzeichnungen durch das Fehlen einer respiratorischen Ausschläge auf der Atemwege (Membrane Wandler) und arteriellen Drucks Spuren identifiziert. Eine entsprechende Änderung in der ICP-Trace validiert die ICP-Probe-Positionierung.
9 zeigt eine typische ICP Spur nach dem Entfernen der Ohr-Bars (Schritt 4.6). Das Einsetzen der Ohr-Bars in Schritt 1.2 ergibt sich eine leichte Kompression des Schädels und der daraus resultierenden Störungen in intrakraniellen Volumens und damit eine erhöhte ICP. Wenn der Sensor richtig positioniert ist, wird ICP lassen mindestens 4 bis 5 mmHg mit der Entfernung der Ohr-Bars.
Die histologische Analyse verwendet werden, um für eventuelle Schäden an der kortikalen Bereich unmittelbar unter dem Drucksensor und Schraube zu überprüfen. Ein Beispiel eines traumatischen und nicht-traumatische Einschraubtiefe ist in 4 dargestellt.
_upload/3689/3689fig1.jpg "/>
Abbildung 1. Flüssigkeit gefüllt Vs SAMBA ICP Traces. ICP gleichzeitig wurde über die SAMBA LWL-Katheter (oben) und einer Flüssigkeit gefüllt Katheter (unten) aufgezeichnet. Die mittleren ICP-Werte waren in beiden Spuren, wie das Fluid gefüllten Katheters Signal wurde gedämpft insbesondere im Vergleich zu der klaren Atemwege und arteriellen Druck Wellenformen mit der faseroptischen Katheters zu sehen.
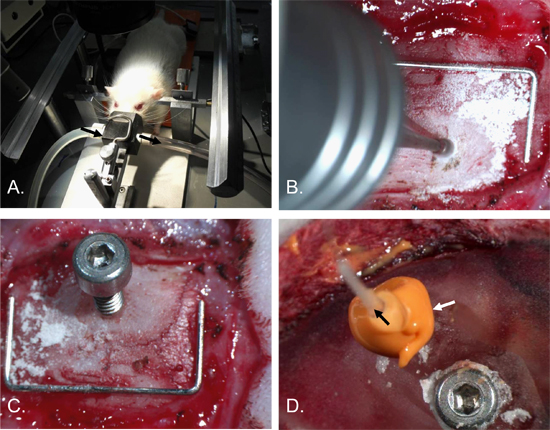
Abbildung 2. Hirndruck Kathetereinführung Vorgehensweise. Die Ratte wurde der Kopf in einen stereotaktischen Rahmen mit Ohr-Bars und ein Betäubungsmittel Nasenkonus [A] gesichert. Ein Loch, etwa 2 mm im Durchmesser, wurde in den rechten Scheitelbein [B] gebohrt. Ein 2 x 4 mm Schraube mit einem 0,7 mm Loch in der Welle eingesetzt wurde [C]. Eine Ankerschraube in die linke Scheitelbein und der Schädel und Operationsstelle in Dentalzement abgedeckt eingefügt. Die ICP cathetER (schwarzer Pfeil) wurde dann in das Schraubenloch und eine luftdichte Abdichtung mit dem Dichtungsmaterial (weißer Pfeil) [D] gemacht eingefügt. Staple (für Scale) = 12 mm x 5 mm.
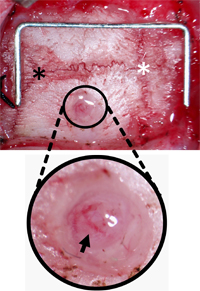
Abbildung 3. Abfrageschraube Bohrloch Orientierung. Der Schädel wurde von Bindegewebe gerodet, um Lambda (schwarzer Stern) und Bregma (weißer Stern) zu lokalisieren und das Loch gebohrt, 2 mm und 2 mm lateral posterior von Bregma. Das Loch wurde von Schutt Verlassen der Dura und Pia-Gefäße (schwarzer Pfeil) intakt gelöscht. Staple (für Scale) = 12 mm x 5 mm.
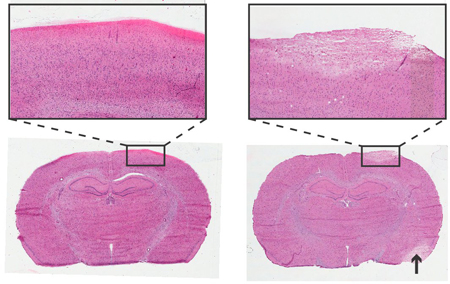
Abbildung 4. Histologie von Rattenhirn 24 Stunden nach der Instrumentierung von ICP-Monitoring-Schraube. Haemotoxylin und Eosin-Färbung, 6 um koronalen Abschnitte. Links: Nicht-traumatische Schraubeninsertion. Rechts: Traumatische Schraubeninsertion,Bereich der Blässe zeigt beschädigtes Gewebe mit ähnlichen Zellmorphologie zu streicheln beschädigt Bereich (Pfeil). Fügt mit 4x Ziel.

Abbildung 5. Typische ICP Trace. Pulse Druckwellen werden durch Ereignisse kleinerer Amplitude (*) dargestellt. Die Belüftung erfolgt durch Veranstaltungen von mehr Periodizität (#) wider.
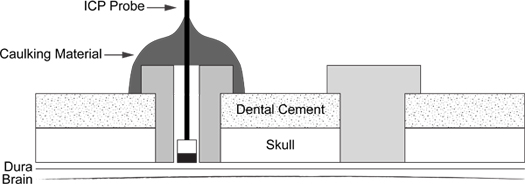
Abbildung 6. ICP Sondeneinbaulänge Schematische. Diagramm zeigt die Anordnung von Support-Schraube (rechts) und Dichtungsmaterial beschichtet ICP-Sonde in die Schraube (links).
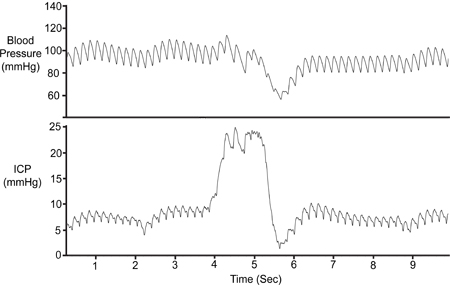
Abbildung 7. Bauchpresse. Das Abdomen wurde vorübergehend komprimiert (~ 1 sec), um die Lebensfähigkeit des ICP-Signal zu validieren. Komprimierung führt zu einer verringerten zerebralen venösen Rückfluss,zunehmende intrakranielle Volumen und damit steigende ICP. Der arterielle Druck (Pa) wurde, kann nur nach dem ersten Anstieg ICP.
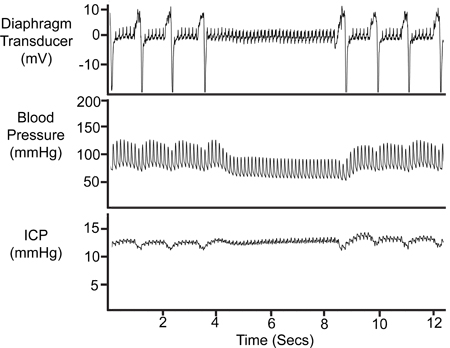
8. Zeitraum der Apnoe. Die vorübergehende Einstellung der Atmung wird in der Technik gefertigte Wandler Spur wider, der arterielle Druck (Pa) Spur und die ICP-Trace.
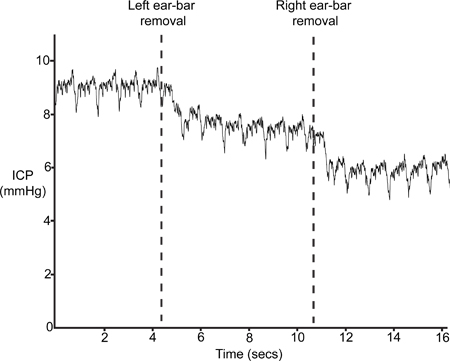
Abbildung 9. Ear-Bar Entfernung. ICP sollten mit der Entfernung der stereotaktischen Rahmen Ohr-Bars fallen zu lassen.
Diskussion
Das hier vorgestellte Verfahren ermöglicht eine sehr empfindliche und genaue Erfassung von Hirndruck. Diese minimal invasive Technik vermeidet erhebliche Hirn-Trauma, indem Sie den Drucksensor im Epiduralraum und nicht das Hirngewebe oder Herzkammern.
Die entscheidenden Schritte sind: 1) Bohren durch den Schädel - darauf zu achten, nicht zu durchbohren die Dura oder Schäden zugrunde liegenden Hirngewebes werden; 2) sicherzustellen, dicht mit dem Dichtungsmaterial - wenn es irgendein Leck,...
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Dieses Projekt wurde von der National Stroke Foundation, Hunter Medical Research Institute (HMRI) und National Health and Medical Research Council (MRC & NH), Australien finanziert. Besonderer Dank geht an der Fakultät für Gesundheitswissenschaften Werkstatt Mitarbeiter an der Universität Newcastle für ihre fachliche Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Zahnzement Monomer | Henry Schein | VX-SC500MLL | |
| Zahnzement Polymer | Henry Schein | VX-SC1000GCL4 | |
| Dentalbohrmaschinen Burr-Größe 12 | Gunz Dental | EL104S001012/10 | |
| Dentalbohrmaschinen Burr-Größe 6 | Gunz Dental | EL104S001006/10 | |
| Blechschraube | Eisenwarengeschäft | 2 x 4 mm, Sechskantkopf. (Von 0,7 mm Loch durch den Schaft gebohrt Labor-modifiziert) | |
| SAMBA Control Unit | Harvard Apparatus | 50433102 | |
| SAMBA-Sensor | Harvard Apparatus | 50461122 | 420 LP, 15cm unisolierten Faser, Radio-opaken Beschichtung |
| Silagum AV Mono Dichtungsmaterial | Gunz Dental | RG 9152 | Vinylpolysiloxanen, Hydrogenpolysiloxane, Füllstoff, Pigmente, Additive, Plantinum Katalysators |
| Terg-A-Zyme | Alconox, Inc. | 1304 | Enzyme-aktiv Waschpulver |
Referenzen
- Ng, L. K., Nimmannitya, J. Massive cerebral infarction with severe brain swelling: a clinicopathological study. Stroke. 1, 158-163 (1970).
- Plum, F. Brain swelling and edema in cerebral vascular disease. Res. Publ. Assoc. Res. Nerv. Ment. Dis. 41, 318-348 (1966).
- Ropper, A. H., Shafran, B. Brain edema after stroke. Clinical syndrome and intracranial pressure. Arch. Neurol. 41, 26-29 (1984).
- Silver, F. L., Norris, J. W., Lewis, A. J., Hachinski, V. C. Early mortality following stroke: a prospective review. Stroke. 15, 492-496 (1984).
- Geraci, E. B., Geraci, T. A. Hyperventilation and head injury: controversies and concerns. J. Neurosci. Nurs. 28, 381-387 (1996).
- Schwab, S., Aschoff, A., Spranger, M., Albert, F., Hacke, W. The value of intracranial pressure monitoring in acute hemispheric stroke. Neurology. 47, 393-398 (1996).
- Adams, H. P. Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association. Stroke. 34, 1056-1083 (2003).
- Zhong, J. Advances in ICP monitoring techniques. Neurol. Res. 25, 339-350 (2003).
- Aucoin, P. J. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am. J. Med. 80, 369-376 (1986).
- Silasi, G., MacLellan, C. L., Colbourne, F. Use of telemetry blood pressure transmitters to measure intracranial pressure (ICP) in freely moving rats. Curr. Neurovasc. Res. 6, 62-69 (2009).
- Crutchfield, J. S., Narayan, R. K., Robertson, C. S., Michael, L. H. Evaluation of a fiberoptic intracranial pressure monitor. J. Neurosurg. 72, 482-487 (1990).
- Bolander, R., Mathie, B., Bir, C., Ritzel, D., Vandevord, P. Skull Flexure as a Contributing Factor in the Mechanism of Injury in the Rat when Exposed to a Shock Wave. Ann. Biomed. Eng. , (2011).
- Chavko, M., Koller, W. A., Prusaczyk, W. K., McCarron, R. M. Measurement of blast wave by a miniature fiber optic pressure transducer in the rat brain. J. Neurosci. Methods. 159, 277-281 (2007).
- Chavko, M. Relationship between orientation to a blast and pressure wave propagation inside the rat brain. J. Neurosci. Methods. 195, 61-66 (2011).
- Leonardi, A. D., Bir, C. A., Ritzel, D. V., VandeVord, P. J. Intracranial pressure increases during exposure to a shock wave. J. Neurotrauma. 28, 85-94 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten