Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Péridurale Mesure de la pression intracrânienne chez le rat en utilisant un transducteur de pression à fibre optique
Dans cet article
Résumé
Une nouvelle technique pour enregistrer les pressions à l'intérieur du crâne est décrite. Procédé minimalement invasive utilise un système de pression à fibre optique de détection pour mesurer la pression intracrânienne (PIC) chez le rat anesthésié sans provoquer un traumatisme cérébral significative. La technique peut être utilisée dans un large éventail de modèles expérimentaux.
Résumé
Élévation de la pression intracrânienne (PIC) est un problème important dans plusieurs formes de lésion cérébrale ischémique, y compris accident vasculaire cérébral, traumatisme crânien et un arrêt cardiaque. Cette élévation peut entraîner des blessures neurologiques plus loin, sous la forme d'une hernie transtentorielle 1,2,3,4, la compression du mésencéphale, déficit neurologique ou cérébrale accrue du myocarde 2,4. Les thérapies actuelles sont souvent insuffisantes pour contrôler une PIC élevée dans le milieu clinique 5,6,7. Il ya donc un besoin pour des méthodes précises de mesure ICP dans des modèles animaux pour faire avancer notre compréhension des mécanismes de base et de développer de nouveaux traitements pour une PIC élevée.
Dans les deux cas le milieu clinique et expérimentale ICP ne peut pas être estimé sans mesure directe. Plusieurs méthodes de l'insertion du cathéter ICP existent actuellement. Parmi ceux-ci le cathéter intraventriculaire est devenu la clinique «gold standard» de la mesure ICP chez l'homme 8. Cette méthode involves l'élimination partielle du crâne et de l'instrumentation du cathéter à travers le tissu cérébral. Par conséquent, les cathéters intraventriculaires ont un taux d'infection des enfants de 6-11% 9. Pour cette raison, canulations sous-duraux et péridurale sont devenues les méthodes privilégiées dans les modèles animaux de lésions ischémiques.
Diverses techniques de mesure du PIC ont été adaptées pour les modèles animaux, et parmi eux, les cathéters de télémétrie remplies de liquide 10 et cathéters semi-conducteurs sont le plus fréquemment utilisé 11,12,13,14,15. Les systèmes remplis de liquide sont susceptibles de développer des bulles d'air dans la ligne, résultant en des lectures fausses PIC. Sondes statiques éviter ce problème (Figure 1). Un problème supplémentaire est cathéters de montage dans le cadre du crâne ou dans les ventricules, sans causer de lésions cérébrales qui pourraient modifier les résultats expérimentaux. Par conséquent, nous avons développé une méthode qui place un cathéter ICP contiguë à l'espace épidural, mais évite le neced pour l'insérer entre le crâne et le cerveau.
Un cathéter à fibre optique de pression (420LP, Capteurs SAMBA, Suède) a été utilisé pour mesurer ICP à l'endroit péridurale parce que l'emplacement du capteur de pression (à la pointe du cathéter) a été trouvée pour produire un signal de haute fidélité ICP dans ce modèle . Il ya d'autres fabricants de technologies similaires à fibres optiques 13 qui peuvent être utilisés avec notre méthodologie. Alternatives cathéters à l'état solide, qui ont le capteur de pression situé sur le côté de la pointe du cathéter, ne serait pas approprié pour ce modèle en tant que signal seraient atténués par la présence de la vis de surveillance.
Ici, nous présentons une méthode relativement simple et précis pour mesurer ICP. Cette méthode peut être utilisée dans un large éventail de modèles animaux PIC connexes.
Protocole
1. Pénétration du crâne
- Anesthésiez rat avec de l'isoflurane (induction de 5%, l'entretien 1,5-2%) dans 70% de N 2 et 30% d'O 2. Après l'induction de l'anesthésie, placez le rat à plat ventre sur une plaque chauffante, positionner le nez du rat dans un cône de nez anesthésie.
- Tout en maintenant l'anesthésie, fixer la tête dans un cadre stéréotaxique, en insérant les oreilles les barreaux jusqu'à la tête est stabilisée. Assurez-vous la respiration ne soit pas compromise. (Figure 2-A).
- Injecter du cuir chevelu sous-cutanée avec de longue durée anesthésique local, la bupivacaïne 0,3 ml à 0,5% (Pfizer, Australie) avant de prendre une 1,5 cm tête la peau médiane incision. (Instruments et des gants stériles doivent être utilisés.)
- Blunt disséquer les tissus mous et les muscles environnants pour situer clairement Lambda et Bregma. Rétracter la peau et du tissu conjonctif.
- Tige tout saignement en appliquant une pression sur le crâne exposé. Saignement excessif du crâne peut être cautérisé.
- L'utilisation d'un dentiste drill avec une fraise de 1 mm pointe, fraise un trou de 2 mm de large dans l'os pariétal droit. Fraise du trou 2 mm et 2 mm latérale postérieure du Bregma pour éviter le sinus longitudinal supérieur et assurer la mise en place du capteur de PIC est sur le territoire ischémique, pour des études de course. D'autres emplacements serait également approprié pour d'autres applications. Fraise du trou à une profondeur où le crâne-dessus de la dure-mère soit translucide. (Figure 2-B).
- Remplacer la bavure avec une pointe de 0,5 mm bavure pour enlever le crâne à la base du trou.
- Lorsque le crâne commence à se fissurer, utiliser 45 ° pince pour enlever toute crâne restante, assurant la base du trou est dégagé de débris. (Figure 3).
2. Modification à vis et de l'Insertion
- Percez un trou de 0,7 mm à travers une vis à tête hexagonale à tête à l'aide d'un tour et de 0,7 mm mèche.
- Insérez la vis de surveillance dans le trou en tournant dans le environ 1,5 tours (utiliser le montant minimum detourne nécessaires pour garantir la vis dans le crâne de façon à ne pas endommager les tissus sous-jacent). (Figure 2-C et la figure 4).
- Fraise un second trou pour une vis d'ancrage dans l'os pariétal gauche, 2 mm et 2 mm latérale postérieure du Bregma. Ce trou ne nécessite pas de pénétration complète du crâne, de sorte que la pointe de 1 mm bavure est utilisé pour fluidifier le crâne pour l'insertion des vis.
- Insérez un 2 x 4 mm hexagonale vis à tête dans le deuxième trou. Cette vis permet d'ancrer le ciment dentaire et donc la vis de surveillance sur le crâne.
- Utilisation d'une pipette de transfert pour mélanger et appliquer monomère de ciment dentaire et de polymère à la base de la tête des vis.
- Permettez-ciment dentaire à sécher pendant au moins 10 minutes.
3. Intracrânienne d'insertion du capteur de pression
- Utilisation du liquide correcteur blanc, marquer le capteur à fibre optique de 4 mm de la pointe.
- Remplir le trou de la vis de surveillance avec une solution saline stérile (0,9%) et d'assurer pasbulles d'air sont présentes dans la vis.
- Insérer le PIC sonde 4 mm dans la vis de sorte que la pointe de la sonde est de niveau avec l'extrémité de la vis. Assurez-vous de la pointe ne pas percer la dure-mère.
- Ajuster la pointe de la sonde au sein de la vis jusqu'à ce qu'une trace PIC réfléchissante ventilation et de sang ondes d'impulsions de pression peut être observée. (Figure 5).
4. Former un joint étanche à l'air
- Un joint étanche à l'air est impératif à une lecture précise du PIC. Mélanger une visqueuse monomère biocompatible matière de calfatage et de polymère dans un rapport de 1:1. Parce que le capteur de pression est à l'extrémité de la sonde, et ceci dans la vis évidée, l'application de matière de calfatage à l'arbre de la sonde à fibre optique est sans effet sur la sensibilité du capteur de pression.
- Appliquez une fine couche autour de la sonde et la tête de la vis de surveillance. Éviter de déplacer la sonde ICP.
- Laisser reposer pendant 5 minutes.
- Appliquer une mise secondeer de la matière de calfeutrage autour de la vis de contrôle complet et la sonde. Veiller à ce qu'aucun liquide ne s'échappe de toutes les crevasses dans le produit de calfeutrage. (Figure 2-D).
- Retirer l'oreille-bars.
- Le rat peut rester en position couchée, ou être soigneusement la rotation dans la position dorsale pendant monitorage de la PIC.
- Un schéma de la procédure terminée est représenté dans (Figure 6).
5. Enlèvement du capteur de pression intracrânienne et de la Réinsertion
- A la fin de suivi du PIC, le capteur ICP peut être retiré en tirant doucement sur le cathéter à partir du matériau vis et le calfeutrage.
- Le capteur SAMBA doit être immédiatement placer dans 1% Terg-A-Zyme solution pour éviter la corrosion de pointe.
- Le trou restant dans le matériau de calfatage doit être recouverte d'une couche supplémentaire de matériau de calfeutrage. (Rat peut être réveillé à ce stade).
- Pour réinsérer le cathéter SAMBA pour la surveillance supplémentaire, trancherle matériau de calfeutrage au niveau de la tête de la vis.
- Répétez les étapes 3.2 - 5.3.
6. Les résultats représentatifs
La figure 5 est une représentation de plus de dix lectures PIC secondes. Au départ, l'ICP en moyenne chez un rat Wistar est de 6 mmHg. Les événements de périodicité plus courte représenté dans la figure 5 réfléchir les ondes de la pression artérielle d'impulsions. Les événements de plus la périodicité montrent les événements de ventilation. Notez que le capteur SAMBA reflète une amplitude de ventilation de mmHg 3-4 et de 1-2 amplitude d'impulsion mmHg.
Pour valider la position du capteur SAMBA dans chaque expérience, les traces du PIC doivent être testés pour la réactivité à des compressions abdominales et des événements respiratoires, telles que des périodes d'apnée. Un compression abdominale est représenté sur la figure 7.
Des périodes d'apnée (illustré dans la figure 8) sont observées dans la plupart des expériences invo lving respirant spontanément les animaux. Ces événements sont identifiés sur les registres physiologiques par une absence de déformations des voies respiratoires sur des voies respiratoires (transducteur à membrane) et des traces de pression artérielle. Une modification équivalente dans la trace ICP valide le positionnement de la sonde ICP.
La figure 9 représente une trace typique ICP après la suppression de l'AER-bars (étape 4.6). L'insertion des oreilles-bars à l'étape 1.2 se traduit par une légère compression du crâne et de la perturbation conséquente du volume intracrânien et donc une augmentation de la PIC. Si le capteur est correctement positionné, le PIC va baisser d'au moins 4 à 5 mm Hg avec la suppression de l'AER-bars.
L'analyse histologique peut être utilisé pour vérifier les dommages causés à l'aire corticale immédiatement sous le capteur de pression et vis. Un exemple d'une insertion de vis traumatique et non traumatique est représenté dans la figure 4.
_upload/3689/3689fig1.jpg "/>
Figure 1. Rempli de fluide Vs SAMBA Traces PIC. ICP a été enregistrée simultanément par l'intermédiaire du SAMBA fibre optique cathéter (en haut) et un cathéter rempli de fluide (en bas). Les valeurs moyennes du PIC étaient semblables dans les deux traces, mais le signal cathéter rempli de fluide a été notamment freiné par rapport à l'appareil respiratoire claire et courbes de pression artérielle observée avec le cathéter à fibre optique.
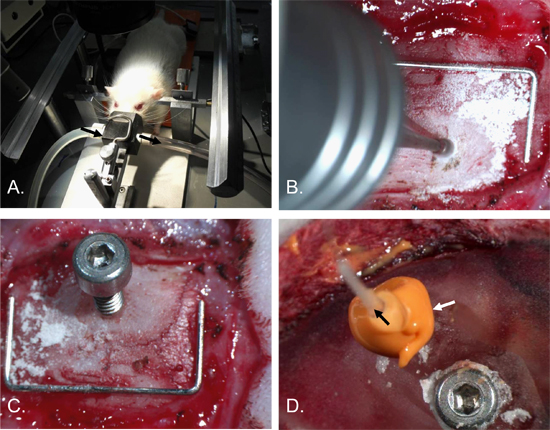
Figure 2. Intracrânienne procédure d'insertion du cathéter de pression. La tête du rat a été fixé dans un cadre stéréotaxique d'oreille bars et d'un cône de nez anesthésie [A]. Un trou, d'environ 2 mm de diamètre, a été foré dans l'os pariétal droit [B]. Une vis 2 x 4 mm avec un trou 0,7 mm dans l'arbre a été inséré [C]. Une vis d'ancrage a été insérée dans l'os pariétal gauche et le crâne et du site opératoire recouvert de ciment dentaire. Le cathet ICPer (flèche noire) a ensuite été inséré dans le trou de vis et un joint étanche à l'air fait avec le matériau de calfeutrage (flèche blanche) [D]. Staple (pour l'échelle) = 12 mm x 5 mm.
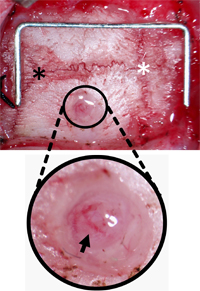
Figure 3. Vis de surveillance du trou de trépan Orientation. Le crâne a été autorisé de tissu conjonctif pour localiser Lambda (astérisque noire) et Bregma (astérisque blanc) et le trou 2 mm latéral et 2 mm en arrière de Bregma. Le trou a été dégagés des débris de quitter la dure-mère et des vaisseaux pie-mère (flèche noire) intactes. Staple (pour l'échelle) = 12 mm x 5 mm.
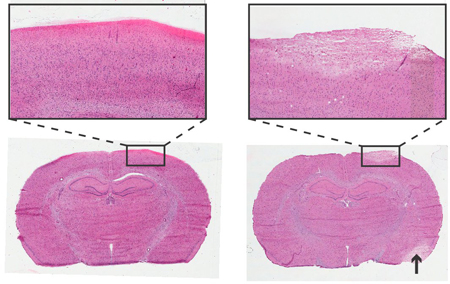
Figure 4. Histologie du cerveau de rat 24 heures après Instrumentation de la vis du PIC-Surveillance. Hématoxyline et coloration à l'éosine, 6 pm coupes coronales. Gauche: l'insertion des vis non-traumatique. A droite: l'insertion des vis-traumatique,zone de pâleur représente tissus endommagés par la morphologie cellulaire semblable à la zone endommagée accident vasculaire cérébral (flèche). Inserts à objectif 4x.

Figure 5. Typiques du PCI. Trace des ondes de pression d'impulsions sont représentées par des événements de moindre amplitude (*). La ventilation est reflété par les événements de plus la périodicité (#).
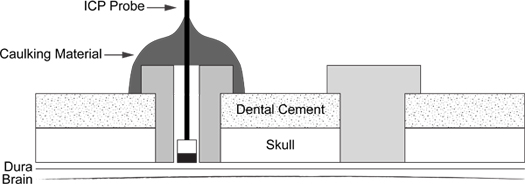
Figure 6. ICP sonde d'insertion schématique. Diagramme illustre le placement de vis de support (à droite) et le calfeutrage enrobé ICP sonde dans la vis (à gauche).
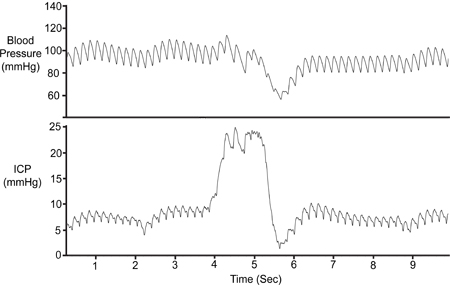
Figure 7. Une compression abdominale. L'abdomen a été temporairement comprimé (~ 1 sec) pour valider la viabilité du signal ICP. La compression entraîne diminution du retour veineux cérébral,l'augmentation du volume intracrânien et donc d'augmenter la PIC. La pression artérielle (Pa) a chuté seulement après la hausse initiale du PIC.
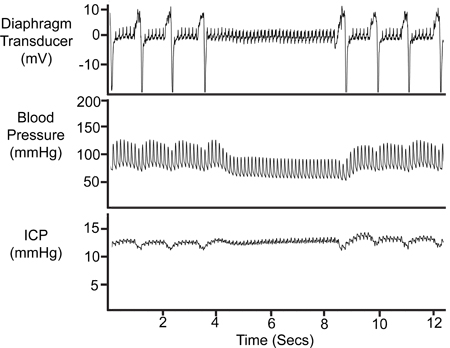
Figure 8. Période de l'apnée. La cessation temporaire de la respiration se reflète dans la trace du transducteur à membrane, la pression artérielle (Pa) trace et la trace ICP.
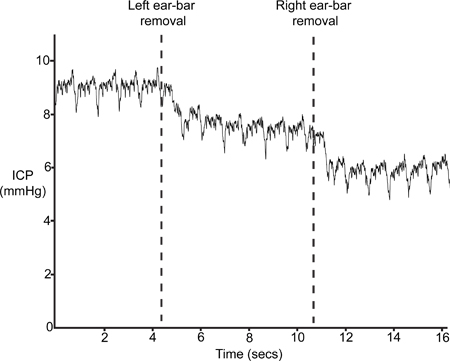
Figure 9. Ear-Bar enlèvement. ICP devrait baisser avec la suppression des stéréotaxiques permet aux écouteurs de barres.
Discussion
La procédure présentée ici permet un enregistrement très sensible et précis de la pression intracrânienne. Cette technique mini-invasive évite un traumatisme cérébral significative par le positionnement du capteur de pression dans l'espace épidural et non le tissu cérébral ou les ventricules.
Les étapes critiques: 1) de forage à travers le crâne - il faut prendre soin de ne pas percer la dure-mère ou des dommages qui sous-tend le tissu cérébral, 2) assurer un joint éta...
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce projet a été financé par la Fondation nationale des maladies, Hunter Medical Research Institute (HMRI) et la Santé nationale et du Medical Research Council (NH & MRC), en Australie. Un merci spécial à la Faculté de personnel de l'atelier santé à l'Université de Newcastle pour leur expertise technique.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Monomère ciment dentaire | Henry Schein | VX-SC500MLL | |
| Dentaire ciment polymère | Henry Schein | VX-SC1000GCL4 | |
| Foret fraise de dentiste-taille 12 | Gunz dentaire | EL104S001012/10 | |
| Foret fraise de dentiste-taille 6 | Gunz dentaire | EL104S001006/10 | |
| Vis Métal | Quincaillerie | 2 x 4 mm, à tête hexagonale. (Laboratoire modifiée de 0,7 mm trou percé à travers l'arbre) | |
| SAMBA Control Unit | Harvard Apparatus | 50433102 | |
| SAMBA capteur | Harvard Apparatus | 50461122 | 420 LP, 15cm fibre nue, radio-opaque de revêtement |
| Silagum AV Mono produit de calfeutrage | Gunz dentaire | RG 9152 | Vinylpolysiloxanes, les polysiloxanes hydrogène, de remplissage, des pigments, des additifs, catalyseurs plantinum |
| Terg-A-Zyme | Alconox, Inc | 1304 | Enzyme-actif détergent en poudre |
Références
- Ng, L. K., Nimmannitya, J. Massive cerebral infarction with severe brain swelling: a clinicopathological study. Stroke. 1, 158-163 (1970).
- Plum, F. Brain swelling and edema in cerebral vascular disease. Res. Publ. Assoc. Res. Nerv. Ment. Dis. 41, 318-348 (1966).
- Ropper, A. H., Shafran, B. Brain edema after stroke. Clinical syndrome and intracranial pressure. Arch. Neurol. 41, 26-29 (1984).
- Silver, F. L., Norris, J. W., Lewis, A. J., Hachinski, V. C. Early mortality following stroke: a prospective review. Stroke. 15, 492-496 (1984).
- Geraci, E. B., Geraci, T. A. Hyperventilation and head injury: controversies and concerns. J. Neurosci. Nurs. 28, 381-387 (1996).
- Schwab, S., Aschoff, A., Spranger, M., Albert, F., Hacke, W. The value of intracranial pressure monitoring in acute hemispheric stroke. Neurology. 47, 393-398 (1996).
- Adams, H. P. Guidelines for the early management of patients with ischemic stroke: A scientific statement from the Stroke Council of the American Stroke Association. Stroke. 34, 1056-1083 (2003).
- Zhong, J. Advances in ICP monitoring techniques. Neurol. Res. 25, 339-350 (2003).
- Aucoin, P. J. Intracranial pressure monitors. Epidemiologic study of risk factors and infections. Am. J. Med. 80, 369-376 (1986).
- Silasi, G., MacLellan, C. L., Colbourne, F. Use of telemetry blood pressure transmitters to measure intracranial pressure (ICP) in freely moving rats. Curr. Neurovasc. Res. 6, 62-69 (2009).
- Crutchfield, J. S., Narayan, R. K., Robertson, C. S., Michael, L. H. Evaluation of a fiberoptic intracranial pressure monitor. J. Neurosurg. 72, 482-487 (1990).
- Bolander, R., Mathie, B., Bir, C., Ritzel, D., Vandevord, P. Skull Flexure as a Contributing Factor in the Mechanism of Injury in the Rat when Exposed to a Shock Wave. Ann. Biomed. Eng. , (2011).
- Chavko, M., Koller, W. A., Prusaczyk, W. K., McCarron, R. M. Measurement of blast wave by a miniature fiber optic pressure transducer in the rat brain. J. Neurosci. Methods. 159, 277-281 (2007).
- Chavko, M. Relationship between orientation to a blast and pressure wave propagation inside the rat brain. J. Neurosci. Methods. 195, 61-66 (2011).
- Leonardi, A. D., Bir, C. A., Ritzel, D. V., VandeVord, P. J. Intracranial pressure increases during exposure to a shock wave. J. Neurotrauma. 28, 85-94 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon