需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
依赖的PDZ-CFTR的大分子信号复合物的体外分析
摘要
囊性纤维化跨膜电导调节器(CFTR),上皮细胞的氯离子通道,已与多种蛋白质相互作用和调节重要的细胞过程的CFTR序序介导的相互作用,其中已经有据可查。这个协议描述我们开发组装的PDZ-依赖的CFTR大分子信号复合物的方法在体外。
摘要
囊性纤维化跨膜电导调节器(CFTR),主要位于上皮细胞的顶膜的氯离子通道,起着至关重要的作用,在跨上流体稳态1-3。 CFTR基因有牵连的两个主要疾病:囊性纤维化(CF)4和第5分泌性腹泻。在CF的CFTR氯离子通道的功能活动,合成或降低。这种疾病会影响美国的约1 6 2500白种人。过度CFTR的活动也被牵连毒素诱导的分泌性腹泻(如霍乱毒素和热稳定大肠杆菌肠毒素)刺激cAMP或cGMP生产在肠道内的7例。
越来越多的证据表明CFTR和其他蛋白质的数目越来越多,包括运输,离子通道,受体,激酶,磷酸酶,信号之间的物理和功能相互作用的存在ING分子和细胞骨架的元素,CFTR和其结合蛋白之间相互作用已被证明要严格调节在体外和体内8-19 CFTR介导的跨膜离子转运。在这个协议中,我们只注重方法,援助在CFTR的羧基末端,它拥有一个蛋白质结合基序之间的相互作用的研究[简称为PSD95/Dlg1/ZO-1(序)序],和PDZ结构域所指的脚手架蛋白,其中包含一个特定的绑定模块组。到目前为止,几个不同的PDZ骨架蛋白已绑定到CFTR的羧基末端与各种亲缘关系,如NHERF1,NHERF2,PDZK1,PDZK2,CAL(CFTR的相关配体),Shank2,把握20-27。内CFTR的PDZ结构图案是公认的PDZ骨架蛋白是在过去四年在C端(即1477-DTRL-1480在人类的CFTR)20个氨基酸。有趣的是,CFTR的,可以绑定多个PDZ结构域都NHERFs和PDZK1,尽管有不同的亲和力22。这方面的CFTR的具有约束力的多价已被证明是功能性的意义,这表明,PDZ结构骨架蛋白可能促进CFTR的形成大分子信号为特定/选择性和高效率的信号复合物在细胞16-18。
已开发多个生化分析研究,CFTR涉及蛋白质的相互作用,如免疫共沉淀,下拉法,成对结合法,比色法成对结合实验,和复杂的大分子组装检测16-19,28,29 。在这里,我们重点对1的PDZ基序依赖CFTR含大分子体外 ,这是我们的实验室研究蛋白质或域的域的相互作用,涉及的CFTR 16-19,28,29广泛用于复杂装配的详细程序。
研究方案
1。标记细菌中的重组融合蛋白表达和纯化
- 放大定义CFTR的一览表2,MRP2的,MRP4,β2受体,和NHERFs(全长或PDZ1过或PDZ2域地区的C-尾(最后50-100个氨基酸,包含在C-末端的PDZ结构图案) )通过PCR方法。
- PCR产物克隆到pGEX4T-1载体(如GST-NHERFs的,GST-MRP4 CT),GST融合蛋白的MBP融合蛋白的质粒pMAL-C2载体(如的MBP-β2受体的CT,MBP-CFTR的CT ),pET30-S融合蛋白(如他 - S-CFTR的CT,他的S-PDZK1)。
- 变换在蛋白酶缺陷E.大肠杆菌菌株(大肠杆菌BL21-DE3),以减少可能出现的重组蛋白的降解。
- 在37℃培养过夜增长在卢里亚Bertani培养基含有适当的抗生素(如氨苄青霉素或卡那霉素)(pH值7.0)。在1:10稀释过夜培养,另2小时增长在37°C。在杜奇与0.5-1米M为接下来的4小时在30℃经IPTG在8000离心沉淀细胞×G为10分钟,在4°C。
- 蔗糖缓冲液裂解细胞(含50 M M的Tris-HCl,pH值8.0,1 M M 1 M M的EDTA,PMSF,10%的蔗糖)溶菌酶(1毫克/毫升),0.2%的Triton X-100和蛋白酶抑制剂。从1升文化起源的细胞沉淀用20毫升。
- 在4°C,在30分钟摇床混合
- 自旋为30分钟,在4°C,在20000×G收集上清。
- 到上层清液,加入1毫升以下的树脂/琼脂糖珠(50%蔗糖缓冲泥浆):
- GST融合蛋白谷胱甘肽琼脂糖珠。
- 爪珠-S的融合蛋白。
- MBP融合蛋白的直链淀粉树脂。
- 组合为4小时,在4°Ç在摇床。
- 洗珠重新悬浮在1X PBS(15毫升),混合2公里N,纺纱800×2分钟,弃去上清Ğ。六次重复此步骤。
- 从珠,通过各自的洗脱缓冲液(2毫升,每1毫升珠洗脱缓冲液)洗脱蛋白质。
- GST融合蛋白的洗脱缓冲:25 M M的Tris-HCl(pH值8.0),140 M M氯化钠和20 M M谷胱甘肽。
- 他的融合蛋白的洗脱缓冲液:20 M M的Tris-HCl(pH值8.0)M氯化钠,500米和200米M咪唑。
- MBP融合蛋白的洗脱缓冲液:20 M M的Tris-HCl(pH值8.0),200米M氯化钠,1 M M M M的EDTA,1数码地面电视,和10 M M麦芽糖。
- 透析1X PBS对2大号洗脱蛋白质在4°C间(以避免可能的蛋白质降解)。改变PBS每4小时的四倍。蛋白作为小等分1 Centricon滤波器(截止10,000兆瓦,Millipore公司)和存储集中在-80°C。
- DET貂皮Bradford法蛋白浓度。评估通过SDS-PAGE使用BSA作为标准蛋白质量。如果蛋白质的完整性是不能令人满意的,如二次净化凝胶过滤或离子交换程序可以使用。 (例如,我们用一个G-75琼脂糖凝胶柱进一步纯化GST融合蛋白)。
2。细胞培养和细胞裂解液的制备
- 文化幼仓鼠肾细胞(BHK),稳定过表达的CFTR WT和的CFTR his10或BHK细胞,瞬时过表达旗一览表2-WT或旗一览表2ΔSTL,Madin 4197犬肾(MDCK细胞细胞),稳定过表达MRP2的鹰的最低限度的基本培养基(MEM)的5%CO 2含10%小牛血清,青霉素/链霉素聚苯乙烯瓶在37°C间。
- 文化人类胚胎肾293细胞(HEK293细胞),稳定过表达的CFTR WT的CFTR his10的在杜尔贝科“的改良Eagle培养基(DMEM培养基)在37°C 5%的CO 2与10%小牛血清和青霉素/链霉素聚苯乙烯瓶补充。
- 裂解细胞裂解液(PBS - 0.2%TRITON-X-100的补充含有M M phenylmethylsulphonyl氟化物,1微克/毫升抑肽酶,1微克/毫升亮肽素,1微克/毫升胃蛋白酶抑制剂,蛋白酶抑制剂的混合物);使用500μL裂解液,每60毫米培养皿,1000μL裂解液,每100毫米的培养皿。
- 20分钟摇滚细胞裂解液在4°C,并删除15分钟在16000×g下离心的不溶性物质,在4°C。确定由Bradford法蛋白浓度。
(3) 在体外一个CFTR含的高分子复合体大会(CFTR的PDZK1-MRP4)
- 到200μL裂解缓冲液(PBS - 0.2%的Triton-X的100蛋白酶抑制剂),添加20μg纯化GST-MRP4-C终端50 AA(CT50)融合蛋白。
- 加入S-PDZK1融合蛋白纯化的各种款项(0-40微克)。
- 上旋转22°1-2 C H搅拌机混合的两种蛋白质。
- 加入20微升谷胱甘肽珠(50%浆料)的蛋白质混合物,继续拌匀,另1小时。这一步也被称为成对结合。
- 在此期间,准备HEK293细胞裂解过度旗,CFTR(WT)如上所述,在第2步)。
- 裂解液洗两次复杂。旋转800×G为每洗1分钟,小心吸出上清后,每洗。谨慎使用不吸在底部的珠子。
- 添加上述准备HEK293细胞裂解珠,轻轻混合为3小时(或隔夜)在4°C。
- 洗珠广泛裂解液三个步骤3.6)倍。
- 洗脱的蛋白质使用30μL的样品缓冲液(5×):0.6米的Tris-HCl(pH值6.8),50%的甘油,2%的SDS,0.1%溴酚蓝;含5%β-巯基乙醇。
- 孵育在37°C间水浴10-15分钟,和自旋为5000×30秒Ğ沉淀珠。
- 加载到4-15%凝胶洗脱液。
- 运行约30-40分钟的SDS-PAGE。
- 蛋白条带转移到PVDF膜,为1.5小时。
- 座中的TBS-吐温膜含有5%非脂乳。
- 酝酿的初级抗体(如抗CFTR的抗体,R1104)膜在4°C间,过夜。
- 膜用TBS-吐温洗5分钟,六次。
- 在22°C孵育45分钟二次抗体(如羊抗鼠HRP标记的第二抗体)膜
- 膜用TBS-吐温洗5分钟,六次。
- 通过的ECL蛋白带可视化。
- 代表性的数据, 如图1所示。
如图1所示的CFTR含大分子信号在体外组装的复杂的例子。 MRP4的C-末端50个氨基酸(MRP4-CT50),,PDZK1,全长度的CFTR( 图1, 底部 )之间形成一个大分子复合物。形成复合物剂量依赖性增加,越来越多的中介蛋白质,PDZK1( 图1, 底部 )18。
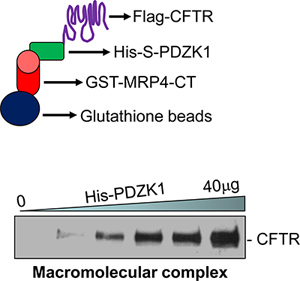
图1图示( 顶部 )的大分子复杂的检测。大分子复合物在体外检测与三种蛋白质在剂量依赖性( 底部 )18(GST-MRP4-CT50,他- S-PDZK1,旗CFTRwt)。
| 的CFTR的NHERF1-β2 AR(见14) | CFTR的NHERF2-LPA的2(注释15) | CFTR的PDZ蛋白MRP的2(注释17) | CFTR的PDZK1-MRP4(注释16) | |
| 亲和力珠 | 直链淀粉树脂 | S - 蛋白琼脂糖 | 直链淀粉树脂 | 谷胱甘肽琼脂糖 |
| 纯化的蛋白质-1 | MBP的β-2受体的CT | - S-CFTR的CT | MBP-CFTR的CT | GST-MRP4 CT |
| 纯化的蛋白质-2 | GST-NHERF1 | GST-NHERF2的 | 的GST-PDZ蛋白 | - S-PDZK1 |
| 纯化蛋白3(或细胞裂解) | CFTR基因-WT的CFTR his10的的 (染BHK的HEK细胞裂解) | 旗-LPA的2-WT或旗一览表2ΔSTL(染BHK细胞裂解物) | MRP2的(MDCK细胞裂解) | 纯化旗的CFTR WT或的CFTR his10(或细胞裂解物) |
| 抗体 | 抗-CFTR的IgG | 反旗酶的 | 抗-MRP2的IgG | 反旗酶的 |
表1总结各种CFTR的含大分子复合物在体外组装。
Access restricted. Please log in or start a trial to view this content.
讨论
在这个协议中,我们展示了一个方法, 在体外装配,检测包含使用纯化蛋白(或蛋白质碎片)和/或细胞裂解大分子信号复合物的CFTR报告以前16-19,29,30。为了达到最佳效果临界点以下,在筹备过程中,需要特别注意:
- 重要的是,洗脱缓冲液的pH值调整到8.0后加入还原型谷胱甘肽的纯化GST融合蛋白,如步骤1)中所述时。此外还原型谷胱甘肽后,pH值可低到3.0。如果PH值未调整?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
我们的工作一直支持由美国心脏协会(大中华区东南亚联盟)开始赠款援助0765185B,艾尔莎美国帕迪基金会的研究经费,韦恩州立大学校内的启动基金和心血管研究所伊希斯倡议的奖助学金。这种方法在体外 CFTR的大分子复杂的装配最初率先博士AP那仁(田纳西大学健康科学中心)。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| pGEX4T-1载体 | GE医疗集团 | 28-9545-49 | 原Amersham Biosciences公司 |
| 质粒pMAL-C2载体 | New England Biolabs公司 | ||
| pET30载体 | 电解二氧化锰化学品 | 69077-3 | 前Novagen公司 |
| 谷胱甘肽琼脂糖珠 | BD公司 | 554780 | |
| 直链淀粉树脂 | New England Biolabs公司 | E8021S | |
| 爪珠 | Clontech公司 | 635501 | |
| 还原型谷胱甘肽 | BD公司 | 554782 | |
| 咪唑 | 费舍尔 | BP305-50 | |
| 麦芽糖 | 费舍尔 | BP684-500 | |
| S - 蛋白琼脂糖 | 电解二氧化锰化学品 | 69704-3 | 前Novagen公司 |
| 反旗酶的 | 西格玛 | A8592 | |
| 抗-CFTR的IgG | 定制 | R1104 | 单克隆抗体识别抗原的CFTR AA 722-734 |
| 抗-MRP2的IgG | Chemicon公司国际 | MAB4148 | 现在部分的微孔 |
表2。特定的试剂和设备。
参考文献
- Anderson, M. P. Demonstration that CFTR is a chloride channel by alteration of its anion selectivity. Science. 253, 202-205 (1991).
- Bear, C. E. Purification and functional reconstitution of the cystic fibrosis transmembrane conductance regulator (CFTR. Cell. 68, 809-818 (1992).
- Quinton, P. M. Chloride impermeability in cystic fibrosis. Nature. 301, 421-422 (1983).
- Cheng, S. H. Defective intracellular transport and processing of CFTR is the molecular basis of most cystic fibrosis. Cell. 63, 827-834 (1990).
- Gabriel, S. E., Brigman, K. N., Koller, B. H., Boucher, R. C., Stutts, M. J. Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model. Science. 266, 107-109 (1994).
- Li, C., Naren, A. P. CFTR chloride channel in the apical compartments: spatiotemporal coupling to its interacting partners. Integr. Biol (Camb). 2, 161-177 (2010).
- Chao, A. C. Activation of intestinal CFTR Cl- channel by heat-stable enterotoxin and guanylin via cAMP-dependent protein kinase. Embo. J. 13, 1065-1072 (1994).
- Gabriel, S. E., Clarke, L. L., Boucher, R. C., Stutts, M. J. CFTR and outward rectifying chloride channels are distinct proteins with a regulatory relationship. Nature. 363, 263-268 (1993).
- McNicholas, C. M. Sensitivity of a renal K+ channel (ROMK2) to the inhibitory sulfonylurea compound glibenclamide is enhanced by coexpression with the ATP-binding cassette transporter cystic fibrosis transmembrane regulator. Proc. Natl. Acad. Sci. USA. 93, 8083-8088 (1996).
- Schreiber, R., Nitschke, R., Greger, R., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator activates aquaporin 3 in airway epithelial cells. J. Biol. Chem. 274, 11811-11816 (1999).
- Shumaker, H., Amlal, H., Frizzell, R., Ulrich, C. D. 2nd, Soleimani, M. CFTR drives Na+-nHCO-3 cotransport in pancreatic duct cells: a basis for defective HCO-3 secretion in CF. Am. J. Physiol. 276, 16-25 (1999).
- Ahn, W. Regulatory interaction between the cystic fibrosis transmembrane conductance regulator and HCO3- salvage mechanisms in model systems and the mouse pancreatic duct. J. Biol. Chem. 276, 17236-17243 (2001).
- Sugita, M., Yue, Y., Foskett, J. K. CFTR Cl- channel and CFTR-associated ATP channel: distinct pores regulated by common gates. Embo. J. 17, 898-908 (1998).
- Naren, A. P. Regulation of CFTR chloride channels by syntaxin and Munc18 isoforms. Nature. 390, 302-305 (1997).
- Naren, A. P. Syntaxin 1A is expressed in airway epithelial cells, where it modulates CFTR Cl(-) currents. J. Clin. Invest. 105, 377-386 (2000).
- Naren, A. P. A macromolecular complex of beta 2 adrenergic receptor, CFTR, and ezrin/radixin/moesin-binding phosphoprotein 50 is regulated by PKA. Proc. Natl. Acad. Sci. USA. 100, 342-346 (1073).
- Li, C. Lysophosphatidic acid inhibits cholera toxin-induced secretory diarrhea through CFTR-dependent protein interactions. J. Exp. Med. 202, 975-986 (2005).
- Li, C. Spatiotemporal coupling of cAMP transporter to CFTR chloride channel function in the gut epithelia. Cell. 131, 940-951 (2007).
- Li, C., Schuetz, J. D., Naren, A. P. Tobacco carcinogen NNK transporter MRP2 regulates CFTR function in lung epithelia: implications for lung cancer. Cancer Lett. 292, 246-253 (2010).
- Hall, R. A. A C-terminal motif found in the beta2-adrenergic receptor, P2Y1 receptor and cystic fibrosis transmembrane conductance regulator determines binding to the Na+/H+ exchanger regulatory factor family of PDZ proteins. Proc. Natl. Acad. Sci. U.S.A. 95, 8496-8501 (1998).
- Short, D. B. An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton. J. Biol. Chem. 273, 19797-19801 (1998).
- Wang, S., Yue, H., Derin, R. B., Guggino, W. B., Li, M. Accessory protein facilitated CFTR-CFTR interaction, a molecular mechanism to potentiate the chloride channel activity. Cell. 103, 169-179 (2000).
- Sun, F. E3KARP mediates the association of ezrin and protein kinase A with the cystic fibrosis transmembrane conductance regulator in airway cells. J. Biol. Chem. 275, 29539-29546 (2000).
- Cheng, J. A Golgi-associated PDZ domain protein modulates cystic fibrosis transmembrane regulator plasma membrane expression. J. Biol. Chem. 277, 3520-3529 (1074).
- Scott, R. O., Thelin, W. R., Milgram, S. L. A novel PDZ protein regulates the activity of guanylyl cyclase C, the heat-stable enterotoxin receptor. The Journal of biological chemistry. 277, 22934-22941 (1074).
- Lee, J. H. Dynamic regulation of cystic fibrosis transmembrane conductance regulator by competitive interactions of molecular adaptors. The Journal of biological chemistry. 282, 10414-10422 (2007).
- Gee, H. Y., Noh, S. H., Tang, B. L., Kim, K. H., Lee, M. G. Rescue of DeltaF508-CFTR trafficking via a GRASP-dependent unconventional secretion pathway. Cell. 146, 746-760 (2011).
- Naren, A. P. Methods for the study of intermolecular and intramolecular interactions regulating CFTR function. Met. Molecul. Med. 70, 175-186 (2002).
- Li, C., Roy, K., Dandridge, K., Naren, A. P. Molecular assembly of cystic fibrosis transmembrane conductance regulator in plasma membrane. The Journal of biological chemistry. 279, 24673-24684 (2004).
- Li, C., Naren, A. P. Analysis of CFTR Interactome in the Macromolecular Complexes. Met. Molecul. Med. 741, 255-270 (2011).
- Wu, Y. A chemokine receptor CXCR2 macromolecular complex regulates neutrophil functions in inflammatory diseases. J. Biol. Chem. , (2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。