É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise in vitro de PDZ-dependentes Complexos Macromoleculares CFTR Sinalização
Neste Artigo
Resumo
A fibrose cística regulador da condutância transmembranar (CFTR), um canal de cloreto epitelial, tem sido relatado para interagir com várias proteínas e regulam importantes processos celulares, entre eles os CFTR PDZ motivo mediadas-interacções têm sido bem documentados. Este protocolo descreve métodos desenvolvidos para montar um macromolecular CFTR PDZ-dependente sinalização complexo In vitro.
Resumo
A fibrose cística reguladora da condutância transmembrana (CFTR), um canal de cloreto localizados principalmente nas membranas apicais das células epiteliais, desempenha um papel crucial na homeostasia de fluidos transepitelial 1-3. CFTR tem sido implicado em duas doenças principais: fibrose cística 4 (CF) e secretora diarreia 5. Na FC, a síntese ou a actividade funcional do CFTR Cl-canal é reduzida. Esta doença afecta cerca de 1 em 2500 caucasianos nos Estados Unidos 6. Actividade CFTR excessiva também tem sido implicado em casos de toxina induzida por diarreia secretória (por exemplo, por toxina da cólera e enterotoxina calor coli estável E.) que estimula a produção de cAMP ou cGMP no intestino 7.
Evidências sugerem a existência de interações físicas e funcionais entre CFTR e um número crescente de outras proteínas, incluindo os transportadores, canais iônicos, receptores, quinases, fosfatases, sinalmoléculas ing, e os elementos do citoesqueleto, e estas interacções entre CFTR e as suas proteínas de ligação têm sido mostrados para ser criticamente envolvidos na regulação mediada por CFTR transporte de iões transepitelial in vitro e também in vivo 8-19. Neste protocolo, vamos nos concentrar apenas sobre os métodos que auxiliam no estudo das interações entre CFTR cauda carboxilo terminal, que possui um motivo de ligação às proteínas [referido como PSD95/Dlg1/ZO-1 (PDZ) motivo], e um grupo de andaime proteínas, que contêm um módulo de ligação específica referida como domínios PDZ. Até agora, várias proteínas diferentes PDZ andaime têm sido relatados para se ligar ao terminal carboxilo da cauda de CFTR, com afinidades diferentes, tais como NHERF1 e NHERF2 e PDZK1 e PDZK2, CAL (CFTR-associated ligando), Shank2, e agarrar 20-27. O motivo PDZ dentro CFTR que é reconhecido pelo PDZ andaime proteínas são os últimos quatro aminoácidos no terminal C (ie, 1477-DTRL-1480 em CFTR humano) 20. Curiosamente,CFTR pode ligar mais do que um domínio PDZ de ambos os NHERFs e PDZK1, embora com diferentes afinidades 22. Este multivalência com respeito à ligação CFTR foi mostrado para ser de importância funcional, sugerindo que as proteínas PDZ andaime pode facilitar a formação de complexos macromoleculares CFTR sinalização para a sinalização específicas / selectiva e eficaz em células 16-18.
Vários ensaios bioquímicos têm sido desenvolvidos para estudar CFTR-envolvendo interacções proteína, tais como co-imunoprecipitação, suspenso ensaio, pares ensaio de ligação, por pares de ensaio colorimétrico de ligação, e doseamento macromolecular montagem complexa 16-19,28,29 . Aqui vamos nos concentrar sobre os procedimentos detalhados de montagem de um PDZ motivo dependente da CFTR macromolecular contendo complexo in vitro, que é usado amplamente por nosso laboratório para estudar proteína-proteína ou domínio domínio interações envolvendo CFTR 16-19,28,29.
Protocolo
1. Expressão e Purificação de Proteínas de Fusão recombinantes Tagged em bactérias
- Amplificar regiões definidas do C-caudas (os últimos 50-100 aminoácidos contendo os motivos PDZ em C-terminal) para CFTR, LPA 2, MRP2, MRP4, β 2 AR, e NHERFs (comprimento completo ou PDZ1 ou PDZ2 domínios ) por metodologia de PCR.
- Clonar os produtos de PCR em pGEX4T-1 vector para GST-proteínas de fusão (tal como GST-NHERFs, GST-MRP4 CT), pMAL-C2 vector para MBP de fusão de proteínas (tais como MBP-β 2 AR CT, MBP-CFTR CT ), e pET30 para His-S-proteínas de fusão (como o seu-S-CFTR CT, His-S-PDZK1).
- Transformar num E. protease deficiente coli estirpe (BL21-DE3) para minimizar a degradação da proteína recombinante possível.
- Crescer a cultura durante a noite a 37 ° C em meio Luria-Bertani meio (pH 7,0) contendo antibióticos apropriados (tais como a ampicilina ou canamicina). Dilui-se a cultura durante a noite a 1:10 e crescer durante mais 2 h, a 37 ° C. Emduzir com 0,5-1 m M IPTG para a próxima 4 horas a 30 ° C. Sedimentar as células por centrifugação a 8000 × g durante 10 min a 4 ° C.
- Lisar as células em tampão de sacarose (50 m M de Tris-HCl, pH 8,0, 1 m M de EDTA, 1 m M de PMSF, e 10% de sacarose) contendo lisozima (1 mg / mL), Triton 0,2% X-100, e protease inibidores. Use 20 mL de sedimento de células proveniente de 1 L de cultura.
- Misturar num agitador rotativo durante 30 min a 4 ° C.
- Girar a 20.000 xg durante 30 min a 4 ° C. Recolher o sobrenadante claro.
- Para o sobrenadante claro, adicionar 1 mL de resina nas seguintes / agarose (suspensão de 50% em tampão de sacarose):
- Pérolas de glutationa agarose para proteínas de fusão GST.
- Contas Talon para His-S proteínas de fusão.
- Amilose resina para proteínas de fusão MBP.
- Mistura-se durante 4 horas a 4 ° C em um agitador rotativo.
- Lavar os grânulos por ressuspensão em PBS 1x (15 mL), misturando durante 2 min, girando a 800 × g durante 2 min, e descartar o sobrenadante. Repita este passo para seis vezes.
- Eluir a proteína a partir das pérolas usando tampão de eluição respectivo (2 mL de tampão de eluição por 1 ml de esferas).
- Tampão de eluição para as proteínas de fusão GST: 25 m M de Tris-HCl (pH 8,0), 140 m M de NaCl, e 20 m M glutationa reduzida.
- Tampão de eluição de proteínas sua fusão: 20 m M de Tris-HCl (pH 8,0), 500 m M de NaCl, e 200 m M imidazol.
- Tampão de eluição para proteínas de fusão MBP: 20 m M de Tris-HCl (pH 8,0), 200 m M de NaCl, 1 m M de EDTA, 1 m M de DTT, e 10 m M maltose.
- Dialisar as proteínas eluídas contra 2 L de 1x PBS a 4 ° C (para evitar a degradação da proteína possível). Alterar PBS a cada 4 horas, durante quatro vezes. Concentra-se a proteína utilizando um filtro de Centricon (10.000 cutoff MW, Millipore) e armazenada como pequenas alíquotas a -80 ° C.
- Detarminho concentração da proteína pelo método de Bradford. Avaliar a qualidade de proteína por SDS-PAGE utilizando BSA como padrão. Se a integridade da proteína não for satisfatório, os processos de purificação secundários, tais como filtração em gel ou de permuta iónica podem ser utilizados. (Por exemplo, utilizou-se um G-75 coluna de Sepharose para purificar ainda mais GST-proteína de fusão).
2. Cultura de Células e Preparação lisado celular
- Cultura rim de hamster bebé (BHK) que de forma estável sobre-expresso CFTR-wt e CFTR-his10 ou células BHK que transitoriamente sobre-express-Flag LPA 2-peso ou Bandeira-LPA 2-ΔSTL e Madin-Darby rim canino (MDCK ) as células que expressam de forma estável sobre-MRP2 em meio essencial mínimo de Eagle (MEM) contendo 10% de soro fetal de vitelo e penicilina / estreptomicina em frascos de poliestireno a 37 ° C com 5% de CO 2.
- Cultura de rim embrionário humano 293 (HEK293) células que de forma estável sobre-expresso CFTR-wt e CFTR-his10 em Dulbecco'Média s modificado de Eagle (DMEM) suplementado com 10% de soro fetal bovino e penicilina / estreptomicina, em frascos de poliestireno a 37 ° C com 5% de CO 2.
- Lisar as células em tampão de lise (PBS - 0,2% de Triton-X-100 suplementado com uma mistura de inibidores de protease contendo 1 M de fluoreto de fenilmetilsulfonil m, 1 ug / ml de aprotinina, 1 ug / mL de leupeptina, 1 ug / mL de pepstatina); utilização 500 uL de tampão de lise para cada placa de Petri de 60 mm, e 1000 uL de tampão de lise para cada placa de Petri de 100 mm.
- Balançar a célula lisados durante 20 min a 4 ° C, e remover o material insolúvel por centrifugação a 16.000 xg durante 15 min a 4 ° C. Determinar a concentração de proteína pelo ensaio de Bradford.
3. Em Assembléia Vitro de um complexo macromolecular contendo CFTR (CFTR-PDZK1-MRP4)
- Em 200 uL de tampão de lise (PBS - 0,2% de Triton-X 100 + inibidores da protease), adicionar 20 ug de GST-purificada MRP4-C-terminal50 aa (CT50) proteína de fusão.
- Adicionar várias quantidades (0-40 ug) de Purificou His-S-PDZK1 proteína de fusão.
- Misturar as duas proteínas num misturador rotativo a 22 ° C durante 1-2 h.
- Adicionar 20 pérolas de glutationa microlitro (50% de lama) na mistura de proteínas, e continuar a misturar por mais 1 h. Este passo é também referido como pares de ligação.
- Durante este tempo, preparar os lisados de células HEK293 que superexpressam a bandeira-CFTR (em peso) como acima descrito no Passo 2).
- Lavar o complexo duas vezes com tampão de lise. Girar a 800 × g durante 1 min para cada lavagem e aspirar cuidadosamente o sobrenadante após cada lavagem. Tenha cuidado para não sugar as contas no fundo.
- Adicionar os preparados acima HEK293 lisados de células para os grânulos, e misturar suavemente a 4 ° C durante 3 h (ou durante a noite).
- Lavar os grânulos extensivamente três vezes com tampão de lise, conforme descrito no Passo 3,6).
- Eluir as proteínas utilizando 30 uL Tampão de amostra (5 ×): 0,6 M Tris-HCl (pH 6,8), glicerol a 50%, SDS a 2%, e 0,1% de azul de bromofenol; contendo 5% de β-mercaptoetanol.
- Incubar a 37 ° C banho de água durante 10-15 min, e giram a 5000 × g durante 30 s para precipitar os grânulos.
- Carregar todo o eluído em gel de 4-15%.
- Executar SDS-PAGE para cerca de 30-40 min.
- Transferir bandas de proteína para a membrana PVDF, durante 1,5 horas.
- Bloquear a membrana em TBS-Tween contendo gordura do leite a 5% não.
- Incubar a membrana com o anticorpo primário (tais como anti-CFTR IgG, R1104) a 4 ° C, durante a noite.
- Lava-se a membrana com TBS-Tween durante 5 min, seis vezes.
- Incubar a membrana com anticorpo secundário (tal como o anticorpo de cabra anti-rato conjugado com HRP nd 2) durante 45 min a 22 ° C.
- Lava-se a membrana com TBS-Tween durante 5 min, seis vezes.
- Visualizar as bandas de proteínas através de ECL.
- Os dados representativos são mostrados na Figura 1.
Um exemplo de CFTR contendo complexo macromolecular de sinalização que foi montado in vitro é mostrado na Figura 1. Um complexo macromolecular foi formado entre MRP4 C-terminal 50 aminoácidos (MRP4-CT50) e PDZK1, e de comprimento completo CFTR (Figura 1, parte inferior). A formação do complexo aumentou dose-dependente com quantidades crescentes de proteína do intermediário, PDZK1 (Figura 1, parte inferior) 18.
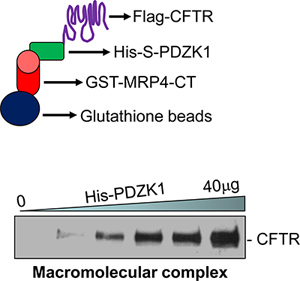
Figura 1. Uma representação pictórica do ensaio complexo macromolecular (topo). Um complexo macromolecular foi detectada in vitro com três proteínas (GST-MRP4-CT50, His-S-PDZK1, e-Flag CFTRwt) de uma forma dependente da dose (inferior) 18.
| CFTR-NHERF1-β 2 AR (ref. 14) | CFTR-NHERF2-LPA 2 (ref. 15) | CFTR-PDZ proteínas-MRP 2 (ref. 17) | CFTR-PDZK1-MRP4 (ref. 16) | |
| Contas de afinidade | Resina de amilose | S-proteína de agarose | Resina de amilose | Glutationa agarose |
| Purificou-proteína-1 | MBP β-2 AR CT | His-S-CFTR CT | MBP-CFTR CT | GST-MRP4 CT |
| Purificou-2 de proteína | GST-NHERF1 | GST-NHERF2 | GST-PDZ proteínas | His-S-PDZK1 |
| Proteína purificada-3 (ou lisados de células) | CFTR-wt ou CFTR-his10 (BHK ou lisados de células HEK) | BandeiraLPA-2-em peso ou bandeira-LPA 2-ΔSTL (lisados de células BHK) | MRP2 (lisados de células MDCK) | Purificou-Flag CFTR-wt ou CFTR-his10 (ou lisados de células) |
| Anticorpo | Anti-IgG CFTR | Anti-Flag HRP | Anti-IgG MRP2 | Anti-Flag HRP |
Resumo Tabela 1. De vários complexos de CFTR contendo macromoleculares montadas in vitro.
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste protocolo que demonstraram um método para a montagem in vitro e detecção de um complexo macromolecular CFTR contendo sinalização utilizando proteínas purificadas (ou fragmentos de proteínas) e / ou lisados celulares como relatado anteriormente 16-19,29,30. Para alcançar melhores resultados os seguintes pontos críticos durante o processo de preparação requerem especial atenção:
- É importante que o pH do tampão de eluição ser ajustado para 8,0 após a adição d...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Nosso trabalho foi suportado por concessões do American Heart Association (Grande Afiliado Sudeste) A partir de doações em ajuda-0765185B, a Elsa U. Pardee Foundation bolsa de investigação, e Wayne State University fundo de inicialização intramural e Cardiovascular Research Institute prêmio Iniciativa de Isis. Este método de in vitro conjunto complexo macromolecular CFTR foi originalmente pioneira pelo Dr. AP Naren (University of Tennessee Health Science Center).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de Catálogo | Comentários |
| pGEX4T-1 vector | GE Healthcare | 28-9545-49 | anteriormente Amersham Biosciences |
| pMAL-C2 vector | New England Biolabs | ||
| pET30 vector | Merck Química | 69077-3 | anteriormente Novagen |
| Esferas de agarose de glutationa | BD Biosciences | 554780 | |
| Resina de amilose | New England Biolabs | E8021S | |
| Contas Talon | Clontech | 635501 | |
| glutationa reduzida | BD Biosciences | 554782 | |
| imidazol | Pescador | BP305-50 | |
| maltose | Pescador | BP684-500 | |
| S-proteína de agarose | Merck Química | 69704-3 | anteriormente Novagen |
| Anti-Flag HRP | Sigma | A8592 | |
| Anti-IgG CFTR | Feito sob encomenda | R1104 | mAb reconhecendo CFTR epítopo em aa 722-734 |
| Anti-IgG MRP2 | Chemicon International | MAB4148 | Agora uma parte da Millipore |
Tabela 2. Reagentes específicos e equipamentos.
Referências
- Anderson, M. P. Demonstration that CFTR is a chloride channel by alteration of its anion selectivity. Science. 253, 202-205 (1991).
- Bear, C. E. Purification and functional reconstitution of the cystic fibrosis transmembrane conductance regulator (CFTR. Cell. 68, 809-818 (1992).
- Quinton, P. M. Chloride impermeability in cystic fibrosis. Nature. 301, 421-422 (1983).
- Cheng, S. H. Defective intracellular transport and processing of CFTR is the molecular basis of most cystic fibrosis. Cell. 63, 827-834 (1990).
- Gabriel, S. E., Brigman, K. N., Koller, B. H., Boucher, R. C., Stutts, M. J. Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model. Science. 266, 107-109 (1994).
- Li, C., Naren, A. P. CFTR chloride channel in the apical compartments: spatiotemporal coupling to its interacting partners. Integr. Biol (Camb). 2, 161-177 (2010).
- Chao, A. C. Activation of intestinal CFTR Cl- channel by heat-stable enterotoxin and guanylin via cAMP-dependent protein kinase. Embo. J. 13, 1065-1072 (1994).
- Gabriel, S. E., Clarke, L. L., Boucher, R. C., Stutts, M. J. CFTR and outward rectifying chloride channels are distinct proteins with a regulatory relationship. Nature. 363, 263-268 (1993).
- McNicholas, C. M. Sensitivity of a renal K+ channel (ROMK2) to the inhibitory sulfonylurea compound glibenclamide is enhanced by coexpression with the ATP-binding cassette transporter cystic fibrosis transmembrane regulator. Proc. Natl. Acad. Sci. USA. 93, 8083-8088 (1996).
- Schreiber, R., Nitschke, R., Greger, R., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator activates aquaporin 3 in airway epithelial cells. J. Biol. Chem. 274, 11811-11816 (1999).
- Shumaker, H., Amlal, H., Frizzell, R., Ulrich, C. D. 2nd, Soleimani, M. CFTR drives Na+-nHCO-3 cotransport in pancreatic duct cells: a basis for defective HCO-3 secretion in CF. Am. J. Physiol. 276, 16-25 (1999).
- Ahn, W. Regulatory interaction between the cystic fibrosis transmembrane conductance regulator and HCO3- salvage mechanisms in model systems and the mouse pancreatic duct. J. Biol. Chem. 276, 17236-17243 (2001).
- Sugita, M., Yue, Y., Foskett, J. K. CFTR Cl- channel and CFTR-associated ATP channel: distinct pores regulated by common gates. Embo. J. 17, 898-908 (1998).
- Naren, A. P. Regulation of CFTR chloride channels by syntaxin and Munc18 isoforms. Nature. 390, 302-305 (1997).
- Naren, A. P. Syntaxin 1A is expressed in airway epithelial cells, where it modulates CFTR Cl(-) currents. J. Clin. Invest. 105, 377-386 (2000).
- Naren, A. P. A macromolecular complex of beta 2 adrenergic receptor, CFTR, and ezrin/radixin/moesin-binding phosphoprotein 50 is regulated by PKA. Proc. Natl. Acad. Sci. USA. 100, 342-346 (1073).
- Li, C. Lysophosphatidic acid inhibits cholera toxin-induced secretory diarrhea through CFTR-dependent protein interactions. J. Exp. Med. 202, 975-986 (2005).
- Li, C. Spatiotemporal coupling of cAMP transporter to CFTR chloride channel function in the gut epithelia. Cell. 131, 940-951 (2007).
- Li, C., Schuetz, J. D., Naren, A. P. Tobacco carcinogen NNK transporter MRP2 regulates CFTR function in lung epithelia: implications for lung cancer. Cancer Lett. 292, 246-253 (2010).
- Hall, R. A. A C-terminal motif found in the beta2-adrenergic receptor, P2Y1 receptor and cystic fibrosis transmembrane conductance regulator determines binding to the Na+/H+ exchanger regulatory factor family of PDZ proteins. Proc. Natl. Acad. Sci. U.S.A. 95, 8496-8501 (1998).
- Short, D. B. An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton. J. Biol. Chem. 273, 19797-19801 (1998).
- Wang, S., Yue, H., Derin, R. B., Guggino, W. B., Li, M. Accessory protein facilitated CFTR-CFTR interaction, a molecular mechanism to potentiate the chloride channel activity. Cell. 103, 169-179 (2000).
- Sun, F. E3KARP mediates the association of ezrin and protein kinase A with the cystic fibrosis transmembrane conductance regulator in airway cells. J. Biol. Chem. 275, 29539-29546 (2000).
- Cheng, J. A Golgi-associated PDZ domain protein modulates cystic fibrosis transmembrane regulator plasma membrane expression. J. Biol. Chem. 277, 3520-3529 (1074).
- Scott, R. O., Thelin, W. R., Milgram, S. L. A novel PDZ protein regulates the activity of guanylyl cyclase C, the heat-stable enterotoxin receptor. The Journal of biological chemistry. 277, 22934-22941 (1074).
- Lee, J. H. Dynamic regulation of cystic fibrosis transmembrane conductance regulator by competitive interactions of molecular adaptors. The Journal of biological chemistry. 282, 10414-10422 (2007).
- Gee, H. Y., Noh, S. H., Tang, B. L., Kim, K. H., Lee, M. G. Rescue of DeltaF508-CFTR trafficking via a GRASP-dependent unconventional secretion pathway. Cell. 146, 746-760 (2011).
- Naren, A. P. Methods for the study of intermolecular and intramolecular interactions regulating CFTR function. Met. Molecul. Med. 70, 175-186 (2002).
- Li, C., Roy, K., Dandridge, K., Naren, A. P. Molecular assembly of cystic fibrosis transmembrane conductance regulator in plasma membrane. The Journal of biological chemistry. 279, 24673-24684 (2004).
- Li, C., Naren, A. P. Analysis of CFTR Interactome in the Macromolecular Complexes. Met. Molecul. Med. 741, 255-270 (2011).
- Wu, Y. A chemokine receptor CXCR2 macromolecular complex regulates neutrophil functions in inflammatory diseases. J. Biol. Chem. , (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados