È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'analisi in vitro dei complessi CFTR PDZ-dipendenti macromolecolari di segnalazione
In questo articolo
Riepilogo
Transmembrana della fibrosi cistica regolatore conduttanza (CFTR), un canale cloruro epiteliale, è stata riportata per interagire con varie proteine e regolano importanti processi cellulari, tra i quali i CFTR PDZ motivo mediate da interazioni sono stati ben documentati. Questo protocollo descrive i metodi che abbiamo sviluppato per assemblare un PDZ-dipendente macromolecolare CFTR segnalazione complessa In vitro.
Abstract
Transmembrana della fibrosi cistica regolatore della conduttanza (CFTR), un canale del cloro si trova soprattutto a livello delle membrane apicali delle cellule epiteliali, gioca un ruolo cruciale nella omeostasi del liquido transepiteliale 1-3. CFTR è stata implicata in due importanti malattie: fibrosi cistica (CF) 4 e 5 secretoria diarrea. In CF, la sintesi o attività funzionale della CFTR Cl-canale è ridotta. Questo disturbo colpisce circa 1 su 2500 caucasici negli Stati Uniti 6. Attività eccessiva CFTR è stata anche implicata in casi di tossina indotta diarrea secretoria (ad esempio, da tossina del colera e stabile al calore enterotossina E. coli) che stimola la produzione di cAMP o cGMP nell'intestino 7.
Accumulare le prove suggeriscono l'esistenza di interazioni fisiche e funzionali tra CFTR e un numero crescente di altre proteine, tra trasportatori, canali ionici, recettori, chinasi, fosfatasi, segnalemolecole zione ed elementi del citoscheletro, e queste interazioni tra CFTR e le sue proteine leganti hanno dimostrato di essere criticamente coinvolte nella regolazione CFTR trasporto mediato transepiteliale ionico in vitro e in vivo 8-19. In questo protocollo, ci concentriamo solo sui metodi che gli aiuti nello studio delle interazioni tra CFTR carbossile terminale della coda, che possiede una proteina di legame motivo [denominato PSD95/Dlg1/ZO-1 (PDZ) motivo], e un gruppo di proteine scaffold, che contengono un modulo di legame specifico denominato domini PDZ. Finora, molte diverse proteine PDZ ponteggi sono stati riportati da associare alla coda terminale carbossile di CFTR con affinità diverse, ad esempio, i NHERF1 NHERF2 e PDZK1 e PDZK2 e CAL (CFTR-associata ligando), Shank2, e GRASP 20-27. Il motivo PDZ all'interno CFTR che è riconosciuto da PDZ proteine scaffold è ultimi quattro amminoacidi al C terminale (cioè, 1477-DTRL-1480 in umano CFTR) 20. Interessante,CFTR può legare più di un dominio PDZ sia NHERFs e PDZK1, pur in diversi affinità 22. Questa polivalenza rispetto CFTR legame ha dimostrato di essere di importanza funzionale, suggerendo che le proteine PDZ impalcatura può facilitare la formazione di complessi macromolecolari CFTR segnalazione per la segnalazione specifici / selettivo ed efficace in cellule 16-18.
Più saggi biochimici sono stati sviluppati per studiare CFTR, che coinvolge interazioni proteiche, come la co-immunoprecipitazione, pull-down assay, pair-wise saggio di legame, colorimetrico pair-wise saggio di legame, e il dosaggio di assemblaggio macromolecolare complessa 16-19,28,29 . Qui ci concentriamo sulle procedure dettagliate di assemblaggio di un motivo PDZ CFTR-dipendente contenenti macromolecole complesse in vitro, che è ampiamente utilizzato dal nostro laboratorio per studiare proteina-proteina o di dominio nel dominio delle interazioni che coinvolgono CFTR 16-19,28,29.
Protocollo
1. Espressione e purificazione di proteine ricombinanti in batteri Fusion etichettate
- Amplifica le regioni definite del C-code (gli ultimi 50-100 aminoacidi contenenti i motivi PDZ a C-terminale) per CFTR, LPA 2, MRP2, MRP4, β 2 AR, e NHERFs (full-length o PDZ1 o PDZ2 domini ) con approccio PCR.
- Clonare i prodotti di PCR in pGEX4T-1 vettore per le proteine di fusione GST-(come GST-NHERFs, GST-MRP4 CT), pMAL-C2 vettore per MBP-fusione proteine (come MBP-β 2 AR CT, MBP-CFTR CT ), e per i Suoi pET30-S-proteine di fusione (come la sua-S-CFTR CT, His-S-PDZK1).
- Trasforma in una proteasi carente di E. coli ceppo (BL21-DE3) per ridurre al minimo possibile degradazione della proteina ricombinante.
- Crescere la coltura di una notte a 37 ° C in terreno Luria-Bertani (pH 7,0) contenente antibiotici adatti (come ampicillina o kanamicina). Diluire la coltura di una notte a 1:10 e crescere per altre 2 ore a 37 ° C. Indurre con 0,5-1 m M IPTG per i prossimi 4 ore a 30 ° C. Pellet delle cellule per centrifugazione a 8000 g per 10 min a 4 ° C.
- Lisare le cellule in tampone saccarosio (50 m M Tris-HCl, pH 8,0, 1 mM EDTA, 1 mM PMSF, e 10% di saccarosio) contenente lisozima (1 mg / mL), 0,2% Triton X-100, e proteasi inibitori. Usare 20 mL per pellet di cellule proveniente da 1 L della cultura.
- Mescolare su un agitatore rotante per 30 minuti a 4 ° C.
- Spin a 20.000 xg per 30 min a 4 ° C. Raccogliere il surnatante chiaro.
- Nel supernatante chiaro, aggiungere 1 ml delle seguenti resina / agarosio perline (50% slurry in tampone saccarosio):
- Glutatione perline di agarosio per proteine di fusione GST.
- Perle Talon per le Sue S-proteine di fusione.
- Resina amilosio per proteine di fusione MBP.
- Mescolare per 4 ore a 4 ° C su un agitatore rotante.
- Lavare le perle risospendendo in 1x PBS (15 ml), mescolare per 2 min, filatura a 800 g per 2 min, e scartando il supernatante. Ripetere questo passaggio per sei volte.
- Eluire la proteina dalle perline mediante rispettivo buffer di eluizione (2 mL di tampone di eluizione per 1 mL di perline).
- Tampone di eluizione per proteine di fusione GST: 25 m M Tris-HCl (pH 8,0), 140 m M NaCl, e 20 m M glutatione ridotto.
- Tampone di eluizione per le sue proteine di fusione: 20 m M Tris-HCl (pH 8,0), 500 m M NaCl, e 200 mM imidazolo.
- Tampone di eluizione per proteine di fusione MBP: 20 m M Tris-HCl (pH 8,0), 200 m M NaCl, 1 mM EDTA, 1 mM DTT, e 10 mM maltosio.
- Dializzare le proteine eluite contro 2 L di 1x PBS a 4 ° C (per evitare la possibile degradazione delle proteine). Sostituire ogni 4 ore per quattro volte PBS. Concentrare la proteina utilizzando un filtro Centricon (10.000 taglio MW, Millipore), e memorizza come piccole aliquote a -80 ° C.
- Determellino la concentrazione di proteina mediante il metodo Bradford. Valutare qualità delle proteine mediante SDS-PAGE usando BSA come standard. Se l'integrità della proteina non è soddisfacente, le procedure di purificazione secondarie, come la filtrazione su gel o scambio ionico possono essere utilizzati. (Ad esempio, abbiamo utilizzato una colonna G-75 Sepharose per purificare ulteriormente-proteina di fusione GST).
2. Di coltura cellulare e Preparazione del lisato cellulare
- Bambino Cultura renali di criceto (BHK) stabilmente cellule che over-esprimono CFTR-peso e CFTR-his10 o cellule BHK transitoriamente che over-esprimono Flag-LPA 2-peso o Flag-LPA 2-ΔSTL e Madin-Darby rene canino (MDCK stabilmente) cellule che sovra-esprimono MRP2 in mezzo minimo essenziale di Eagle (MEM) contenente 10% siero di vitello fetale e penicillina / streptomicina in fiasche di polistirene a 37 ° C con 5% CO 2.
- Cultura embrionali umane di rene (293 HEK293) stabilmente cellule che over-esprimono CFTR-peso e CFTR-his10 in Dulbecco'S mezzo Eagle modificato (DMEM) integrato con 10% siero fetale bovino e penicillina / streptomicina in fiasche di polistirene a 37 ° C con 5% CO 2.
- Lisare le cellule in tampone di lisi (PBS - 0,2% Triton-X-100 integrato con una miscela di inibitori di proteasi contenenti 1 mM fenilmetilsolfonilfluoruro, 1 ug / ml di aprotinina, 1 ug / mL di leupeptina, 1 ug / ml di pepstatina); uso 500 tampone di lisi microlitri per ogni 60 mm piastra di Petri, e 1000 tampone di lisi microlitri per ogni 100 mm piastra di Petri.
- Rock the lisati cellulari per 20 min a 4 ° C, e rimuovere il materiale insolubile mediante centrifugazione a 16.000 xg per 15 min a 4 ° C. Determinare la concentrazione proteica con il saggio Bradford.
3. In Assemblea in vitro di un CFTR contenente complesso macromolecolare (CFTR-PDZK1-MRP4)
- In 200 microlitri di tampone di lisi (PBS - 0,2% Triton X-100 + inibitori della proteasi), aggiungere 20 mcg purificato GST-MRP4 C-terminale50 bis (CT50), proteina di fusione.
- Aggiungi vari importi (0-40 mg) di purificata His-S-PDZK1 proteina di fusione.
- Mescolare le due proteine su un agitatore rotante a 22 ° C per 1-2 h.
- Aggiungi 20 perle del glutatione pl (50% slurry) nella miscela di proteine, e continuare a mescolare per un altro 1 h. Questa fase viene anche indicato come a coppie legante.
- Durante questo tempo, preparare le HEK293 lisati cellulari che iperesprimono Flag-CFTR (wt) come sopra descritto al punto 2).
- Lavare il complesso due volte con tampone di lisi. Spin a 800 xg per 1 minuto per ogni lavaggio e aspirare accuratamente il supernatante dopo ogni lavaggio. Prestare attenzione a non succhiare le perline in fondo.
- Aggiungere preparato sopra lisati cellulari HEK293 alle perle, e mescolare delicatamente a 4 ° C per 3 h (o tutta la notte).
- Lavare le perline estesamente tre volte con tampone di lisi, come descritte nella Fase 3,6).
- Eluire le proteine con 30 microlitri Sample Buffer (5 ×): 0,6 M Tris-HCl (pH 6,8), 50% glicerolo, 2% SDS, e 0,1% blu di bromofenolo, contenente 5% di β-mercaptoetanolo.
- Incubare in bagnomaria a 37 ° C per 10-15 min, e far girare a 5000 × g per 30 s per far precipitare le perline.
- Caricare tutto l'eluato su gel 4-15%.
- Eseguire SDS-PAGE per circa 30-40 min.
- Trasferimento bande proteiche alla membrana PVDF, per 1,5 ore.
- Bloccare la membrana in TBS-Tween contenente 5% di latte non grasso.
- Incubare la membrana con l'anticorpo primario (ad esempio anti-IgG CFTR, R1104) a 4 ° C, una notte.
- Lavare la membrana con TBS-Tween per 5 min, sei volte.
- Incubare la membrana con anticorpo secondario (come capra anti-topo coniugato HRP-anticorpo 2 °) per 45 min a 22 ° C.
- Lavare la membrana con TBS-Tween per 5 min, sei volte.
- Visualizzare le bande proteiche tramite ECL.
- I dati rappresentativi sono mostrati in Figura 1.
Un esempio di CFTR contenente complesso macromolecolare segnalazione che è stata assemblata in vitro è illustrato nella figura 1. Un complesso macromolecolare è formata tra MRP4 C-terminale di 50 amminoacidi (MRP4-CT50), PDZK1 e full-length CFTR (Figura 1, in basso). La formazione del complesso aumento dose-dipendente con quantità crescenti di proteina intermediario, PDZK1 (Figura 1, in basso) 18.
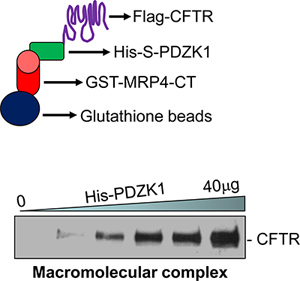
Figura 1. Una rappresentazione pittorica del saggio complesso macromolecolare (in alto). Un complesso macromolecolare è stato rilevato in vitro con tre proteine (GST-MRP4-CT50, His-S-PDZK1, e Flag-CFTRwt) in un modo dipendente dalla dose (in basso) 18.
| CFTR-NHERF1-β 2 AR (rif. 14) | CFTR-NHERF2-LPA 2 (rif. 15) | CFTR-PDZ proteine MRP-2 (rif. 17) | CFTR-PDZK1-MRP4 (rif. 16) | |
| Affinity perline | Amilosio resina | S-proteina agarosio | Amilosio resina | Glutatione agarosio |
| Proteina purificata-1 | MBP-β 2 AR CT | His-S-CFTR CT | MBP-CFTR CT | GST-MRP4 CT |
| Proteina purificata-2 | GST-NHERF1 | GST-NHERF2 | GST-proteine PDZ | His-S-PDZK1 |
| Proteina purificata-3 (o lisati cellulari) | CFTR-peso o CFTR-his10 (BHK o lisati cellulari HEK) | BandieraLPA-2-peso o Flag-LPA 2-ΔSTL (lisati cellulari BHK) | MRP2 (lisati cellulari MDCK) | Purificata Flag-CFTR wt-o-CFTR his10 (o lisati cellulari) |
| Anticorpo | Anti-IgG CFTR | Anti-Flag HRP | Anti-IgG MRP2 | Anti-Flag HRP |
Tabella 1. Sintesi di vari CFTR contenenti complessi macromolecolari assemblati in vitro.
Access restricted. Please log in or start a trial to view this content.
Discussione
In questo protocollo abbiamo dimostrato un metodo in vitro per l'assemblaggio e il rilevamento di una CFTR contenente complesso macromolecolare segnalazione utilizzando proteine purificate (o frammenti di proteine) e / o lisati di cellule come riportato precedentemente 16-19,29,30. Per ottenere i migliori risultati i seguenti punti critici durante il processo di preparazione richiedono una particolare attenzione:
- È importante che il pH del tampone di eluizione essere regolata ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Il nostro lavoro è stato supportato anche da finanziamenti American Heart Association (Greater Southeast Affiliate) Inizio-grant-in-aiuto 0765185B, la Fondazione U. Pardee Elsa assegno di ricerca, e Wayne State University intramurale del fondo di avvio e Cardiovascular Research Institute premio Initiative Isis. Questo metodo di assemblaggio in vitro complesso macromolecolare CFTR è stata originariamente introdotta da Dr. AP Naren (University of Tennessee Health Science Center).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| pGEX4T-1 vettore | GE Healthcare | 28-9545-49 | già Amersham Biosciences |
| pMAL-C2 vettoriale | New England BioLabs | ||
| pET30 vettore | EMD Chemicals | 69077-3 | ex Novagen |
| Glutatione agarosio perline | BD Biosciences | 554780 | |
| Amilosio resina | New England BioLabs | E8021S | |
| Talon perline | Clontech | 635501 | |
| glutatione ridotto | BD Biosciences | 554782 | |
| imidazolo | Pescatore | BP305-50 | |
| maltosio | Pescatore | BP684-500 | |
| S-proteina agarosio | EMD Chemicals | 69704-3 | ex Novagen |
| Anti-Flag HRP | Sigma | A8592 | |
| Anti-IgG CFTR | Su misura | R1104 | mAb riconoscendo CFTR epitopo al aa 722-734 |
| Anti-IgG MRP2 | Chemicon International | MAB4148 | Ora una parte di Millipore |
Tabella 2. Reagenti e attrezzature specifiche.
Riferimenti
- Anderson, M. P. Demonstration that CFTR is a chloride channel by alteration of its anion selectivity. Science. 253, 202-205 (1991).
- Bear, C. E. Purification and functional reconstitution of the cystic fibrosis transmembrane conductance regulator (CFTR. Cell. 68, 809-818 (1992).
- Quinton, P. M. Chloride impermeability in cystic fibrosis. Nature. 301, 421-422 (1983).
- Cheng, S. H. Defective intracellular transport and processing of CFTR is the molecular basis of most cystic fibrosis. Cell. 63, 827-834 (1990).
- Gabriel, S. E., Brigman, K. N., Koller, B. H., Boucher, R. C., Stutts, M. J. Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model. Science. 266, 107-109 (1994).
- Li, C., Naren, A. P. CFTR chloride channel in the apical compartments: spatiotemporal coupling to its interacting partners. Integr. Biol (Camb). 2, 161-177 (2010).
- Chao, A. C. Activation of intestinal CFTR Cl- channel by heat-stable enterotoxin and guanylin via cAMP-dependent protein kinase. Embo. J. 13, 1065-1072 (1994).
- Gabriel, S. E., Clarke, L. L., Boucher, R. C., Stutts, M. J. CFTR and outward rectifying chloride channels are distinct proteins with a regulatory relationship. Nature. 363, 263-268 (1993).
- McNicholas, C. M. Sensitivity of a renal K+ channel (ROMK2) to the inhibitory sulfonylurea compound glibenclamide is enhanced by coexpression with the ATP-binding cassette transporter cystic fibrosis transmembrane regulator. Proc. Natl. Acad. Sci. USA. 93, 8083-8088 (1996).
- Schreiber, R., Nitschke, R., Greger, R., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator activates aquaporin 3 in airway epithelial cells. J. Biol. Chem. 274, 11811-11816 (1999).
- Shumaker, H., Amlal, H., Frizzell, R., Ulrich, C. D. 2nd, Soleimani, M. CFTR drives Na+-nHCO-3 cotransport in pancreatic duct cells: a basis for defective HCO-3 secretion in CF. Am. J. Physiol. 276, 16-25 (1999).
- Ahn, W. Regulatory interaction between the cystic fibrosis transmembrane conductance regulator and HCO3- salvage mechanisms in model systems and the mouse pancreatic duct. J. Biol. Chem. 276, 17236-17243 (2001).
- Sugita, M., Yue, Y., Foskett, J. K. CFTR Cl- channel and CFTR-associated ATP channel: distinct pores regulated by common gates. Embo. J. 17, 898-908 (1998).
- Naren, A. P. Regulation of CFTR chloride channels by syntaxin and Munc18 isoforms. Nature. 390, 302-305 (1997).
- Naren, A. P. Syntaxin 1A is expressed in airway epithelial cells, where it modulates CFTR Cl(-) currents. J. Clin. Invest. 105, 377-386 (2000).
- Naren, A. P. A macromolecular complex of beta 2 adrenergic receptor, CFTR, and ezrin/radixin/moesin-binding phosphoprotein 50 is regulated by PKA. Proc. Natl. Acad. Sci. USA. 100, 342-346 (1073).
- Li, C. Lysophosphatidic acid inhibits cholera toxin-induced secretory diarrhea through CFTR-dependent protein interactions. J. Exp. Med. 202, 975-986 (2005).
- Li, C. Spatiotemporal coupling of cAMP transporter to CFTR chloride channel function in the gut epithelia. Cell. 131, 940-951 (2007).
- Li, C., Schuetz, J. D., Naren, A. P. Tobacco carcinogen NNK transporter MRP2 regulates CFTR function in lung epithelia: implications for lung cancer. Cancer Lett. 292, 246-253 (2010).
- Hall, R. A. A C-terminal motif found in the beta2-adrenergic receptor, P2Y1 receptor and cystic fibrosis transmembrane conductance regulator determines binding to the Na+/H+ exchanger regulatory factor family of PDZ proteins. Proc. Natl. Acad. Sci. U.S.A. 95, 8496-8501 (1998).
- Short, D. B. An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton. J. Biol. Chem. 273, 19797-19801 (1998).
- Wang, S., Yue, H., Derin, R. B., Guggino, W. B., Li, M. Accessory protein facilitated CFTR-CFTR interaction, a molecular mechanism to potentiate the chloride channel activity. Cell. 103, 169-179 (2000).
- Sun, F. E3KARP mediates the association of ezrin and protein kinase A with the cystic fibrosis transmembrane conductance regulator in airway cells. J. Biol. Chem. 275, 29539-29546 (2000).
- Cheng, J. A Golgi-associated PDZ domain protein modulates cystic fibrosis transmembrane regulator plasma membrane expression. J. Biol. Chem. 277, 3520-3529 (1074).
- Scott, R. O., Thelin, W. R., Milgram, S. L. A novel PDZ protein regulates the activity of guanylyl cyclase C, the heat-stable enterotoxin receptor. The Journal of biological chemistry. 277, 22934-22941 (1074).
- Lee, J. H. Dynamic regulation of cystic fibrosis transmembrane conductance regulator by competitive interactions of molecular adaptors. The Journal of biological chemistry. 282, 10414-10422 (2007).
- Gee, H. Y., Noh, S. H., Tang, B. L., Kim, K. H., Lee, M. G. Rescue of DeltaF508-CFTR trafficking via a GRASP-dependent unconventional secretion pathway. Cell. 146, 746-760 (2011).
- Naren, A. P. Methods for the study of intermolecular and intramolecular interactions regulating CFTR function. Met. Molecul. Med. 70, 175-186 (2002).
- Li, C., Roy, K., Dandridge, K., Naren, A. P. Molecular assembly of cystic fibrosis transmembrane conductance regulator in plasma membrane. The Journal of biological chemistry. 279, 24673-24684 (2004).
- Li, C., Naren, A. P. Analysis of CFTR Interactome in the Macromolecular Complexes. Met. Molecul. Med. 741, 255-270 (2011).
- Wu, Y. A chemokine receptor CXCR2 macromolecular complex regulates neutrophil functions in inflammatory diseases. J. Biol. Chem. , (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon