Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
In Vitro Анализ PDZ-зависимый CFTR высокомолекулярных комплексов сигнализации
В этой статье
Резюме
Муковисцидоз трансмембранной проводимости регулятора (CFTR), эпителиальный канал хлорид, как сообщается, взаимодействуют с различными белками и регулировать важные клеточные процессы, среди которых CFTR PDZ мотив-опосредованного взаимодействия были хорошо документированы. Этот протокол описывает методы, которые мы разработали, чтобы собрать PDZ-зависимый CFTR макромолекулярных сигнализации комплекс В пробирке.
Аннотация
Cystic fibrosis transmembrane conductance regulator (CFTR), a chloride channel located primarily at the apical membranes of epithelial cells, plays a crucial role in transepithelial fluid homeostasis1-3. CFTR has been implicated in two major diseases: cystic fibrosis (CF)4 and secretory diarrhea5. In CF, the synthesis or functional activity of the CFTR Cl- channel is reduced. This disorder affects approximately 1 in 2,500 Caucasians in the United States6. Excessive CFTR activity has also been implicated in cases of toxin-induced secretory diarrhea (e.g., by cholera toxin and heat stable E. coli enterotoxin) that stimulates cAMP or cGMP production in the gut7.
Accumulating evidence suggest the existence of physical and functional interactions between CFTR and a growing number of other proteins, including transporters, ion channels, receptors, kinases, phosphatases, signaling molecules, and cytoskeletal elements, and these interactions between CFTR and its binding proteins have been shown to be critically involved in regulating CFTR-mediated transepithelial ion transport in vitro and also in vivo8-19. In this protocol, we focus only on the methods that aid in the study of the interactions between CFTR carboxyl terminal tail, which possesses a protein-binding motif [referred to as PSD95/Dlg1/ZO-1 (PDZ) motif], and a group of scaffold proteins, which contain a specific binding module referred to as PDZ domains. So far, several different PDZ scaffold proteins have been reported to bind to the carboxyl terminal tail of CFTR with various affinities, such as NHERF1, NHERF2, PDZK1, PDZK2, CAL (CFTR-associated ligand), Shank2, and GRASP20-27. The PDZ motif within CFTR that is recognized by PDZ scaffold proteins is the last four amino acids at the C terminus (i.e., 1477-DTRL-1480 in human CFTR)20. Interestingly, CFTR can bind more than one PDZ domain of both NHERFs and PDZK1, albeit with varying affinities22. This multivalency with respect to CFTR binding has been shown to be of functional significance, suggesting that PDZ scaffold proteins may facilitate formation of CFTR macromolecular signaling complexes for specific/selective and efficient signaling in cells16-18.
Multiple biochemical assays have been developed to study CFTR-involving protein interactions, such as co-immunoprecipitation, pull-down assay, pair-wise binding assay, colorimetric pair-wise binding assay, and macromolecular complex assembly assay16-19,28,29. Here we focus on the detailed procedures of assembling a PDZ motif-dependent CFTR-containing macromolecular complex in vitro, which is used extensively by our laboratory to study protein-protein or domain-domain interactions involving CFTR16-19,28,29.
протокол
1. Выражение и очистка рекомбинантных белков слияния меткой у бактерий
- Усиление определенных регионах С-хвосты (последние 50-100 аминокислот, содержащих PDZ мотивы в С-конца) для CFTR, 2 МПУ, MRP2, MRP4, β 2 AR, и NHERFs (во всю длину или PDZ1 или PDZ2 области ) на подходе ПЦР.
- Клонирование ПЦР-продуктов в pGEX4T-1 вектор GST-синтез белков (например, GST-NHERFs, GST-MRP4 КТ), pMAL-C2 вектор MBP-синтез белков (например, MBP-β 2 AR КТ, MBP-CFTR CT ), а pET30 Его-S-белков слияния (например, его-S-CFTR CT Его-S-PDZK1).
- Преобразование в протеазы с дефицитом E. палочки штамма (BL21-DE3), чтобы минимизировать возможные рекомбинантный деградации белков.
- Рост культуры в течение ночи при 37 ° C в Лурия-Бертани среды (рН 7,0), содержащий соответствующие антибиотики (например, ампициллин или канамицин). Развести ночной культуры в 1:10 и расти в течение еще 2 ч при 37 ° C. Вдуче с 0,5-1 м М ИПТГ на ближайшие 4 ч при 30 ° C. Гранул клеток путем центрифугирования при 8000 х г в течение 10 мин при 4 ° C.
- Лизировать клетки Сахароза буфера (50 м М Трис-HCl, рН 8,0, 1 м М ЭДТА, 1 м M PMSF, и 10% сахарозы), содержащий лизоцим (1 мг / мл), 0,2% Triton X-100, а протеазы ингибиторы. Используйте 20 мл в осадок клеток, происходящих из 1 л культуры.
- Смешайте на роторном шейкере в течение 30 мин при 4 ° C.
- Спиновая на 20000 х г в течение 30 мин при 4 ° C. Соберите прозрачный супернатант.
- В прозрачный супернатант, добавляют 1 мл следующие смолы / агарозных шариков (50% раствор сахарозы в буфер):
- Глутатион агарозном шарики для белков GST синтеза.
- Талон бисером Его-S слитых белков.
- Амилозы смолы для MBP белков слияния.
- Смешать в течение 4 ч при температуре 4 ° C на роторном шейкере.
- Вымойте бусины суспендирования в 1x PBS (15 мл), смешивание 2 милип, вращается со скоростью 800 × г в течение 2 минут, и отбрасывая супернатант. Повторите этот шаг для шесть раз.
- Элюции белка из бисера с использованием соответствующего буфера элюирования (2 мл элюирующего буфера в 1 мл из бисера).
- Буфер для элюции белков слияния GST: 25 м М Трис-HCl (рН 8,0), 140 м М NaCl и 20 м M восстановленный глутатион.
- Элюирование буфер для его белков слияния: 20 м М Трис-HCl (рН 8,0), 500 м М NaCl и 200 м М имидазола.
- Элюции буфера для MBP белков слияния: 20 м М Трис-HCl (рН 8,0), 200 м М NaCl, 1 м М ЭДТА, 1 м M DTT, и 10 м M мальтозы.
- Диализировать элюированных белки от 2 л 1x PBS при 4 ° С (чтобы избежать возможной деградации белка). Изменение PBS каждые 4 ч в четыре раза. Концентрат белка помощью Centricon фильтр (10000 МВт среза, Millipore) и хранить в качестве небольшой порции при температуре -80 ° C.
- Detгорностай концентрации белка методом Брэдфорд. Оцените качество белка на SDS-страницы с помощью BSA в качестве стандартов. Если целостность белка не является удовлетворительным, вторичные процедуры очистки, такие как гель-фильтрации или ионного обмена могут быть использованы. (Например, мы использовали G-75 сефарозы колонке для дальнейшей очистки GST-синтез белка).
2. Культуры клеток и подготовки Клеточный лизат
- Культуры ребенка почек хомяка (ВНК) клеток, что стабильно более-экспресс CFTR-вес и CFTR-his10 или ВНК клетки, которые временно по-экспресс Флаг-LPA 2-вес или флаг-LPA 2-ΔSTL и Мадин-Darby собачьи почки (MDCK ) клеток, что стабильно более-экспресс MRP2 в минимально необходимого среднего орла (MEM), содержащей 10% эмбриональной телячьей сыворотки и пенициллин / стрептомицин в полистирола колбах при температуре 37 ° C с 5% CO 2.
- Культуры человеческих эмбриональных почек 293 (HEK293) клеток, что стабильно более-экспресс CFTR-вес и CFTR-his10 в Дульбекко"Среды с изменения Орла (DMEM) с добавлением 10% эмбриональной телячьей сыворотки и пенициллин / стрептомицин в полистирола колбах при температуре 37 ° C с 5% CO 2.
- Лизиса клеток в буфере для лизиса (PBS - 0,2% Triton-X-100 дополнена смеси ингибиторов протеаз, содержащей 1 м M phenylmethylsulphonyl фтора, 1 мкг / мл апротинина, 1 мкг / мл leupeptin, 1 мкг / мл пепстатина), использование 500 мкл буфера для лизиса для каждого 60-мм чашки Петри и 1000 мкл буфера для лизиса для каждого 100-мм чашки Петри.
- Рок клеточных лизатов в течение 20 мин при 4 ° С, и удалить нерастворимый материал с помощью центрифугирования при 16000 х г в течение 15 мин при 4 ° C. Определение концентрации белка в анализе Брэдфорда.
3. In Vitro Ассамблеи CFTR содержащими высокомолекулярных комплекс (CFTR-PDZK1-MRP4)
- В 200 мкл лизирующего буфера (PBS - 0,2% Triton X-100 + ингибиторы протеазы), добавьте 20 мкг очищенного GST-MRP4-C терминал50 а (CT50) гибридный белок.
- Добавить различных количествах (0-40 мг) очищенной Его-S-PDZK1 гибридного белка.
- Смешайте две белки на роторном смесителе при температуре 22 ° С в течение 1-2 часов.
- Добавить 20 мкл бисером глутатион (50% раствор) в белковую смесь, и продолжать смешивать еще 1 час. Этот шаг также называют попарно обязательным.
- За это время подготовить HEK293 клеточные лизаты, что гиперэкспрессией Флаг-CFTR (вес), как описано выше в шаге 2).
- Вымойте комплекс дважды лизис буфера. Спиновая 800 × г в течение 1 мин для каждого мытья и тщательно аспирации супернатант после каждого мытья. Будьте осторожны, чтобы не сосать у бусин в нижней.
- Добавьте выше подготовленные HEK293 лизатов клетки бисером, и осторожно перемешать при температуре 4 ° С в течение 3 часов (или ночь).
- Вымойте бисером широко три раза лизис буфера, как описано в шаге 3.6).
- Элюции белков с использованием 30 мкл буфера образца (5 ×): 0.6 M Трис-HCl (рН 6,8), 50% глицерина, 2% SDS и 0,1% бромфенола синий, содержащих 5% β-меркаптоэтанола.
- Инкубируйте в 37 ° С на водяной бане 10-15 мин, а спина при 5000 х г в течение 30 сек для осаждения бисера.
- Загрузите все элюата на 4-15% гель.
- Запуск SDS-PAGE около 30-40 мин.
- Передача белка полосы на мембрану PVDF, за 1,5 часа.
- Блок мембраны в TBS-твин, содержащий 5% без молочного жира.
- Инкубировать мембрану с первичными антителами (например, анти-IgG CFTR, R1104) при 4 ° C в течение ночи.
- Промойте мембрану с TBS-Tween в течение 5 минут, в шесть раз.
- Инкубируйте мембраны с вторичными антителами (например, антимышиного HRP-2 сопряженных антител) в течение 45 мин при 22 ° C.
- Промойте мембрану с TBS-Tween в течение 5 минут, в шесть раз.
- Визуализация белка полосы с помощью ECL.
- Представитель данные представлены на рисунке 1.
Пример CFTR содержащих высокомолекулярные сигнализации комплекса, который был собран в пробирке показано на рисунке 1. Макромолекулярных комплекс был создан между MRP4 С-концевой 50 аминокислот (MRP4-CT50), PDZK1 и полнометражных CFTR (рис. 1, внизу). Образование комплекса увеличена в зависимости от дозы с увеличением количества посредников белка, PDZK1 (рис. 1, внизу) 18.
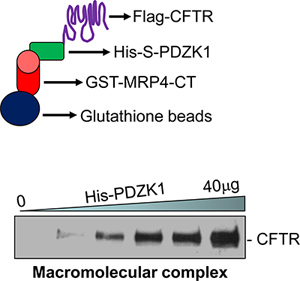
Рисунок 1. Наглядное представление анализа сложных высокомолекулярных (сверху). Макромолекулярных комплекс был обнаружен в пробирке с тремя белками (GST-MRP4-CT50 Его-S-PDZK1, и флаг-CFTRwt) в зависимости от дозы (внизу) 18.
| CFTR-NHERF1-β 2 AR (см. 14) | CFTR-NHERF2-LPA 2 (см. 15) | CFTR-PDZ белки-MRP 2 (см. 17) | CFTR-PDZK1-MRP4 (см. 16) | |
| Affinity бисера | Амилозы смолы | S-белка агарозном | Амилозы смолы | Глутатион агарозном |
| Очищенный белок-1 | MBP-β 2 AR CT | Его-S-CFTR CT | MBP-CFTR CT | GST-MRP4 CT |
| Очищенный белок-2 | GST-NHERF1 | GST-NHERF2 | GST-PDZ белки | Его-S-PDZK1 |
| Очищенный белок-3 (или клеточных лизатов) | CFTR-вес или CFTR-his10 (ВНК или лизаты НЕК клетки) | ФлагМПУ-2-вес или флаг-LPA 2-ΔSTL (ВНК лизатов клеток) | MRP2 (MDCK лизатов клеток) | Очищенная Флаг-CFTR-вес или CFTR-his10 (или клеточных лизатов) |
| Антитело | Анти-IgG CFTR | Anti-Flag HRP | Анти-IgG MRP2 | Anti-Flag HRP |
Таблица 1. Обзор различных CFTR содержащих высокомолекулярные комплексы собраны в пробирке.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этом протоколе мы показали метод в пробирке сборки и обнаружения CFTR содержащие высокомолекулярные сигнализации комплексного использования очищенных белков (или фрагменты белка) и / или клеточных лизатов, как сообщалось ранее 16-19,29,30. Для достижения наилучших результатов с...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Наша работа была поддержана грантами от Американской ассоциации сердца (Большой Юго-Восточной Партнерская) Начало-грантов в помощь 0765185B, Эльза У. Парди фонда грант, и Wayne State University очной запуске фонда и научно-исследовательского института сердечно-сосудистой Isis инициативы награду. Этот метод экстракорпорального CFTR сборки сложных высокомолекулярных изначально первым доктором AP Naren (Университет Теннесси Научного центра здоровья).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
| pGEX4T-1 вектор | GE Healthcare | 28-9545-49 | ранее Amersham Biosciences |
| pMAL-C2 вектор | Новая Англия BioLabs | ||
| pET30 вектор | EMD химическими веществами | 69077-3 | ранее Novagen |
| Глутатион агарозном бисера | BD Biosciences | 554780 | |
| Амилозы смолы | Новая Англия BioLabs | E8021S | |
| Талон бисера | Clontech | 635501 | |
| восстановленного глутатиона | BD Biosciences | 554782 | |
| имидазол | Рыбак | BP305-50 | |
| мальтоза | Рыбак | BP684-500 | |
| S-белка агарозном | EMD химическими веществами | 69704-3 | ранее Novagen |
| Anti-Flag HRP | Сигма | A8592 | |
| Анти-IgG CFTR | Изготовленный на заказ | R1104 | МКА признании CFTR эпитоп в аа 722-734 |
| Анти-IgG MRP2 | Международный Chemicon | MAB4148 | Теперь часть Millipore |
Таблица 2. Специальные реагенты и оборудование.
Ссылки
- Anderson, M. P. Demonstration that CFTR is a chloride channel by alteration of its anion selectivity. Science. 253, 202-205 (1991).
- Bear, C. E. Purification and functional reconstitution of the cystic fibrosis transmembrane conductance regulator (CFTR. Cell. 68, 809-818 (1992).
- Quinton, P. M. Chloride impermeability in cystic fibrosis. Nature. 301, 421-422 (1983).
- Cheng, S. H. Defective intracellular transport and processing of CFTR is the molecular basis of most cystic fibrosis. Cell. 63, 827-834 (1990).
- Gabriel, S. E., Brigman, K. N., Koller, B. H., Boucher, R. C., Stutts, M. J. Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model. Science. 266, 107-109 (1994).
- Li, C., Naren, A. P. CFTR chloride channel in the apical compartments: spatiotemporal coupling to its interacting partners. Integr. Biol (Camb). 2, 161-177 (2010).
- Chao, A. C. Activation of intestinal CFTR Cl- channel by heat-stable enterotoxin and guanylin via cAMP-dependent protein kinase. Embo. J. 13, 1065-1072 (1994).
- Gabriel, S. E., Clarke, L. L., Boucher, R. C., Stutts, M. J. CFTR and outward rectifying chloride channels are distinct proteins with a regulatory relationship. Nature. 363, 263-268 (1993).
- McNicholas, C. M. Sensitivity of a renal K+ channel (ROMK2) to the inhibitory sulfonylurea compound glibenclamide is enhanced by coexpression with the ATP-binding cassette transporter cystic fibrosis transmembrane regulator. Proc. Natl. Acad. Sci. USA. 93, 8083-8088 (1996).
- Schreiber, R., Nitschke, R., Greger, R., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator activates aquaporin 3 in airway epithelial cells. J. Biol. Chem. 274, 11811-11816 (1999).
- Shumaker, H., Amlal, H., Frizzell, R., Ulrich, C. D. 2nd, Soleimani, M. CFTR drives Na+-nHCO-3 cotransport in pancreatic duct cells: a basis for defective HCO-3 secretion in CF. Am. J. Physiol. 276, 16-25 (1999).
- Ahn, W. Regulatory interaction between the cystic fibrosis transmembrane conductance regulator and HCO3- salvage mechanisms in model systems and the mouse pancreatic duct. J. Biol. Chem. 276, 17236-17243 (2001).
- Sugita, M., Yue, Y., Foskett, J. K. CFTR Cl- channel and CFTR-associated ATP channel: distinct pores regulated by common gates. Embo. J. 17, 898-908 (1998).
- Naren, A. P. Regulation of CFTR chloride channels by syntaxin and Munc18 isoforms. Nature. 390, 302-305 (1997).
- Naren, A. P. Syntaxin 1A is expressed in airway epithelial cells, where it modulates CFTR Cl(-) currents. J. Clin. Invest. 105, 377-386 (2000).
- Naren, A. P. A macromolecular complex of beta 2 adrenergic receptor, CFTR, and ezrin/radixin/moesin-binding phosphoprotein 50 is regulated by PKA. Proc. Natl. Acad. Sci. USA. 100, 342-346 (1073).
- Li, C. Lysophosphatidic acid inhibits cholera toxin-induced secretory diarrhea through CFTR-dependent protein interactions. J. Exp. Med. 202, 975-986 (2005).
- Li, C. Spatiotemporal coupling of cAMP transporter to CFTR chloride channel function in the gut epithelia. Cell. 131, 940-951 (2007).
- Li, C., Schuetz, J. D., Naren, A. P. Tobacco carcinogen NNK transporter MRP2 regulates CFTR function in lung epithelia: implications for lung cancer. Cancer Lett. 292, 246-253 (2010).
- Hall, R. A. A C-terminal motif found in the beta2-adrenergic receptor, P2Y1 receptor and cystic fibrosis transmembrane conductance regulator determines binding to the Na+/H+ exchanger regulatory factor family of PDZ proteins. Proc. Natl. Acad. Sci. U.S.A. 95, 8496-8501 (1998).
- Short, D. B. An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton. J. Biol. Chem. 273, 19797-19801 (1998).
- Wang, S., Yue, H., Derin, R. B., Guggino, W. B., Li, M. Accessory protein facilitated CFTR-CFTR interaction, a molecular mechanism to potentiate the chloride channel activity. Cell. 103, 169-179 (2000).
- Sun, F. E3KARP mediates the association of ezrin and protein kinase A with the cystic fibrosis transmembrane conductance regulator in airway cells. J. Biol. Chem. 275, 29539-29546 (2000).
- Cheng, J. A Golgi-associated PDZ domain protein modulates cystic fibrosis transmembrane regulator plasma membrane expression. J. Biol. Chem. 277, 3520-3529 (1074).
- Scott, R. O., Thelin, W. R., Milgram, S. L. A novel PDZ protein regulates the activity of guanylyl cyclase C, the heat-stable enterotoxin receptor. The Journal of biological chemistry. 277, 22934-22941 (1074).
- Lee, J. H. Dynamic regulation of cystic fibrosis transmembrane conductance regulator by competitive interactions of molecular adaptors. The Journal of biological chemistry. 282, 10414-10422 (2007).
- Gee, H. Y., Noh, S. H., Tang, B. L., Kim, K. H., Lee, M. G. Rescue of DeltaF508-CFTR trafficking via a GRASP-dependent unconventional secretion pathway. Cell. 146, 746-760 (2011).
- Naren, A. P. Methods for the study of intermolecular and intramolecular interactions regulating CFTR function. Met. Molecul. Med. 70, 175-186 (2002).
- Li, C., Roy, K., Dandridge, K., Naren, A. P. Molecular assembly of cystic fibrosis transmembrane conductance regulator in plasma membrane. The Journal of biological chemistry. 279, 24673-24684 (2004).
- Li, C., Naren, A. P. Analysis of CFTR Interactome in the Macromolecular Complexes. Met. Molecul. Med. 741, 255-270 (2011).
- Wu, Y. A chemokine receptor CXCR2 macromolecular complex regulates neutrophil functions in inflammatory diseases. J. Biol. Chem. , (2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены