A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בניתוח מבחנה של PDZ תלויי macromolecular תסביכים CFTR לשידור אותות
In This Article
Summary
סיסטיק פיברוזיס הטרנסממברני הרגולטור המוליכות (CFTR), ערוץ כלוריד אפיתל, דווחה אינטראקציה עם חלבונים שונים לווסת תהליכים תאיים חשובים, ביניהם את PDZ CFTR מוטיב בתיווך אינטראקציות תועדו היטב. פרוטוקול זה מתאר שיטות שפיתחנו כדי להרכיב macromolecular PDZ תלוי CFTR איתות מורכבת במבחנה.
Abstract
סיסטיק פיברוזיס הטרנסממברני הרגולטור המוליכות (CFTR), ערוץ כלוריד נמצא בעיקר בקרום הפסגה של תאים אפיתל, ממלא תפקיד מכריע הומאוסטזיס נוזל transepithelial 1-3. CFTR היה מעורב בשתי מחלות עיקריות: סיסטיק פיברוזיס (CF) 4 ו הפרשה שלשולים 5. ב CF, סינתזה או פעילות פונקציונלית של CFTR Cl ערוצים מצטמצם. הפרעה זו משפיעה על כ 1 ב 2500 לבנים בארצות הברית 6. פעילות CFTR מוגזם גם היה מעורב במקרים של שלשול, הרעלן המושרה הפרשה (למשל, על ידי רעלן כולרה enterotoxin יציבה חום א coli), אשר ממריץ את ייצור cGMP cAMP או במעיים 7.
צבירת ראיות מציע קיומה של אינטראקציה פיזית בין תפקודי CFTR, ומספר גדל והולך של חלבונים אחרים, כולל מובילי, תעלות יונים, רצפטורים, קינאזות, phosphatases, אותותמולקולות תית, ואלמנטים cytoskeletal, וכן את יחסי הגומלין בין CFTR וחלבונים מחייב שלה הוכחו להיות מעורב באופן קריטי בוויסות CFTR בתיווך התחבורה יון transepithelial במבחנה גם in vivo 8-19. בפרוטוקול זה, אנחנו מתמקדים רק השיטות המסייעים בחקר יחסי הגומלין בין זנב מסוף carboxyl CFTR, אשר מחזיק מוטיב חלבון מחייב [המכונה PSD95/Dlg1/ZO-1 (PDZ) מוטיב], ו קבוצה של פיגום חלבונים, אשר מכילים מודול מחייב ספציפית המכונה תחומים PDZ. עד כה, כמה חלבונים שונים PDZ הפיגום דווחו להיקשר זנב מסוף carboxyl של CFTR עם זיקות שונות, כגון NHERF1, NHERF2, PDZK1, PDZK2, CAL (CFTR הקשורים ליגנד), Shank2, ולתפוס 20-27. מוטיב PDZ בתוך CFTR, שמוכר על ידי PDZ פיגום חלבונים הוא האחרון ארבע חומצות אמינו בתחנה הסופית C (כלומר, 1477, DTRL-1480 ב CFTR אדם) 20. מענייןCFTR יכולה לאגד יותר מושלם PDZ של שני NHERFs ו PDZK1, אם כי עם שינוי זיקות 22. Multivalency זה ביחס CFTR מחייב הוכח להיות בעל משמעות תפקודית, דבר המצביע על כך PDZ חלבונים הפיגום יכול להקל על היווצרות macromolecular CFTR איתות קומפלקסים של איתות ספציפיים / סלקטיביים ויעיל בתאים 16-18.
מבחני ביוכימיים רבים פותחו ללמוד CFTR-מעורבים אינטראקציות חלבון, כגון immunoprecipitation משותפת, הנפתח assay, זוג מבחינת assay מחייב, assay colorimetric זוג מבחינת מחייב, והרכבה מורכב macromolecular assay 16-19,28,29 . כאן נתמקד הנהלים המפורטים של הרכבת מוטיב תלוי PDZ CFTR המכיל macromolecular מורכב במבחנה, שבו נעשה שימוש נרחב על ידי המעבדה שלנו ללמוד חלבונים או תחום תחומים אינטראקציות מעורבים CFTR 16-19,28,29.
Protocol
1. ביטוי וטיהור של חלבון רקומביננטי היתוך שתויגו בחיידקים
- להגביר באזורים מוגדרים של ה-C-זנבות (האחרונים 50-100 חומצות אמינו המכילות המוטיבים PDZ בתחנה הסופית, ג) CFTR, אמ"ע 2, MRP2, MRP4, β 2 AR, ו NHERFs (באורך מלא או PDZ1 או PDZ2 תחומים ) על ידי גישה PCR.
- לשכפל את מוצרי ה-PCR לתוך וקטור-1 pGEX4T עבור GST-Fusion חלבונים (כגון GST-NHERFs, GST-MRP4 CT), pMAL-C2 וקטור עבור MBP-Fusion חלבונים (כמו MBP-β 2 AR-CT, MBP-CFTR CT ), ו pET30 for-S-Fusion שלו חלבונים (כמו שלו S-CFTR CT, שלו S-PDZK1).
- המרה של פרוטאז ה-לקויה זן coli (BL21-DE3) כדי למזער את החלבון ניתן השפלה רקומביננטי.
- לגדול בתרבות לילה ב 37 מעלות צלזיוס לוריא-Bertani בינוני (pH 7.0) המכיל אנטיביוטיקה המתאימה (כגון ampicillin או kanamycin). לדלל את תרבות הלילה בשעה 1:10 ולגדול עוד 2 שעות ב 37 ° C. בתוךדוצ'ה עם 0.5-1 מ 'מ IPTG עבור H 4 הבא בשעה 30 ° C. גלולה את התאים על ידי צנטריפוגה ב 8000 × גר 10 דקות ב 4 מעלות ג
- Lyse התאים במאגר סוכרוז (50 מ 'M-Tris HCl, pH 8.0, 1 מ' M EDTA, 1 מ 'מ PMSF, סוכרוז ו 10%) המכיל ליזוזים (1 מ"ג / מ"ל), טריטון 0.2% X-100, ו פרוטאז מעכבי. השתמש 20 מ"ל של תא גלולה שמקורם L 1 של התרבות.
- מערבבים על שייקר רוטרי למשך 30 דקות ב 4 ° C.
- מסובבים 20000 × g למשך 30 דקות ב 4 ° C. איסוף supernatant ברור.
- אל supernatant ברור, הוסף 1 מ"ל של שרף / agarose החרוזים הבאים (slurry 50% במאגר סוכרוז):
- גלוטתיון agarose חרוזים עבור חלבונים GST היתוך.
- טופר חרוזים עבור חלבונים שלו מכלל היתוך.
- Amylose שרף עבור חלבונים MBP היתוך.
- תערובת H 4 על 4 מעלות צלזיוס על שייקר סיבובית.
- לשטוף את החרוזים על ידי resuspending ב 1x PBS (15 מ"ל), ערבוב של 2 מיילn, מסתובב ב 800 × g עבור 2 דקות, ואת השלכת supernatant. חזור על פעולה זו במשך שש פעמים.
- Elute חלבון מן החרוזים באמצעות חיץ elution בהתאמה (2 חיץ elution מ"ל לכל 1 מ"ל של חרוזים).
- מאגר elution עבור חלבונים GST היתוך: 25 מ 'מ טריס-HCl (pH 8.0), 140 M NaCl, ו 20 מ' מ מופחת גלוטתיון.
- Elution חיץ של חלבונים היתוך שלו: 20 מ 'מ טריס-HCl (pH 8.0), 500 מ' M NaCl, ו 200 מ 'מ imidazole.
- Elution חיץ של חלבונים MBP היתוך: 20 מ 'מ טריס-HCl (pH 8.0), 200 מ' M NaCl, 1 מ 'M EDTA, 1 מ' מ DTT, ו 10 מ 'מ מלטוז.
- Dialyze החלבונים eluted נגד L 2 של 1x PBS ב 4 ° C (כדי למנוע פירוק חלבונים אפשרי). שנה PBS כל 4 שעות במשך ארבע פעמים. לרכז את החלבון באמצעות מסנן Centricon (10,000 הפסקת MW, Millipore) וחנות כמו aliquots קטנים ב -80 ° C.
- Detסמור ריכוז חלבון בשיטת ברדפורד. להעריך את איכות החלבון על ידי SDS-PAGE באמצעות BSA כמו סטנדרטים. אם שלמות של החלבון אינו משביע רצון, הליכי טיהור משניים כגון סינון ג'ל או חילוף יונים ניתן להשתמש. (למשל, השתמשנו עמודה G-75 Sepharose להמשיך לטהר GST-Fusion חלבון).
2. התא התרבות lysate הכנה Cell
- תרבות התינוק אוגר בכליות (BHK) התאים ביציבות יתר אקספרס CFTR-WT ו-CFTR his10 או תאים BHK כי זמני יתר אקספרס הדגל אמ"ע 2-WT או הדגל אמ"ע 2-ΔSTL, ואת מדין, דארבי כליות כלבים (MDCK התאים) ביציבות יתר אקספרס MRP2 במדיום חיוני מינימום של הנשר (MEM) המכילים 10% עוברית עגל בסרום פניצילין / סטרפטומיצין ב צלוחיות קלקר על 37 מעלות צלזיוס עם 5% CO 2.
- אדם תרבות עובריים כליה 293 (HEK293) התאים ביציבות יתר אקספרס CFTR-WT ו-CFTR his10 ב Dulbecco"בינוני זה שונה הנשרים (DMEM) השלימו עם 10% בסרום שור עוברית פניצילין / סטרפטומיצין ב צלוחיות קלקר על 37 מעלות צלזיוס עם 5% CO 2.
- Lyse התאים במאגר תמוגה (PBS - 0.2% Triton-X-100 השלימו עם תערובת של מעכבי הפרוטאז המכילים פלואוריד 1 מ 'מ phenylmethylsulphonyl, 1 מיקרוגרם / מ"ל aprotinin, 1 מיקרוגרם / מ"ל leupeptin, 1 מיקרוגרם / pepstatin מ"ל); שימוש 500 תמוגה חיץ μL על צלחת פטרי כל 60 מ"מ, ו 1000 מאגר תמוגה μL על צלחת פטרי כל 100 מ"מ.
- רוק התא lysates במשך 20 דקות ב 4 ° C, ולהסיר את חומר מסיס על ידי צנטריפוגה של 16,000 × גרם במשך 15 דקות ב 4 ° C. לקבוע את ריכוז החלבון על ידי assay ברדפורד.
3. ב העצרת מבחנה של CFTR קומפלקס המכיל Macromolecular (CFTR-PDZK1-MRP4)
- אל μL 200 מאגר תמוגה (PBS - 0.2% טריטון X-100 + מעכבי פרוטאז), להוסיף 20 מיקרוגרם מטוהרים GST-MRP4-C טרמינל50 AA (CT50) חלבון היתוך.
- הוספת כמויות שונות (0-40 מיקרוגרם) של מטוהרים שלו S-PDZK1 חלבון היתוך.
- מערבבים את שני חלבונים על מערבל סיבובית על 22 מעלות צלזיוס במשך 1-2 שעות.
- הוסף 20 חרוזים גלוטתיון μL (50% slurry) לתוך תערובת החלבונים, וממשיכים לערבב לעוד 1 ש. שלב זה מכונה גם זוג מבחינת מחייב.
- במהלך תקופה זו, להכין את HEK293 lysates תא overexpress הדגל CFTR (WT) כמתואר לעיל בשלב 2).
- לשטוף את מורכבות פעמיים עם חיץ תמוגה. מסובבים 800 גר '× 1 דקות לכביסה כל ובזהירות לשאוב supernatant לאחר כל שטיפה. היזהר לא למצוץ את החרוזים בחלק התחתון.
- מוסיפים את לעיל מוכנים HEK293 lysates התא אל חרוזים, לערבב בעדינות על 4 מעלות צלזיוס למשך 3 שעות (או לילה).
- לשטוף את החרוזים נרחבת שלוש פעמים עם חיץ תמוגה כמתואר בשלב 3.6).
- Elute את החלבונים באמצעות 30 חוצץ לדוגמא μL (5 ×): 0.6 מ ' טריס-HCl (pH 6.8), גליצרול 50%, SDS 2%, ו -0.1% bromophenol כחול, המכיל 5% β-mercaptoethanol.
- דגירה של 37 ° C אמבט מים במשך 10-15 דקות, ועל הספין של 5000 × 30 גרם של S כדי לזרז את החרוזים.
- לטעון את כל eluate על ג'ל 4-15%.
- הפעל SDS-PAGE בערך 30-40 דקות.
- העברת להקות חלבון הממברנה PVDF, עבור 1.5 שעות.
- לחסום את הממברנה ב-TBS Tween המכיל 5% שומן לא.
- דגירה הממברנה עם הנוגדן הראשוני (כגון אנטי CFTR IgG, R1104) בשעה 4 ° C, למשך הלילה.
- לשטוף את הממברנה עם TBS-Tween במשך 5 דקות, שש פעמים.
- דגירה הממברנה עם נוגדן משנית (כגון אנטי העכבר עז נוגדנים HRP-מצומדות nd 2) במשך 45 דק 'ב 22 ° C.
- לשטוף את הממברנה עם TBS-Tween במשך 5 דקות, שש פעמים.
- דמיינו את להקות חלבון באמצעות ECL.
- הנתונים מייצגים מוצגות באיור 1.
דוגמה מורכבת CFTR המכיל macromolecular מאותת כי נערכו במבחנה מוצג באיור 1. מורכב macromolecular הוקמה בין MRP4 בטרמינל C-50 חומצות אמינו (MRP4-CT50), PDZK1, וכן באורך מלא CFTR (איור 1, למטה). היווצרות קומפלקס גדל מינון dependently עם כמויות הולכות וגדלות של חלבון מתווך, PDZK1 (איור 1, למטה) 18.
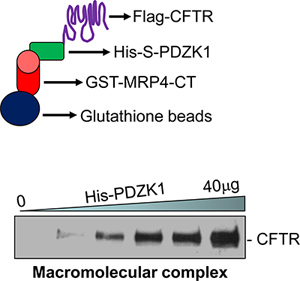
באיור 1. ייצוג בתמונות של assay מורכב macromolecular (למעלה). מורכב macromolecular התגלה במבחנה שלושה חלבונים (GST-MRP4-CT50, שלו S-PDZK1, ואת הדגל CFTRwt) באופן תלויות מינון (למטה) 18.
| CFTR-NHERF1-β 2 AR (ref. 14) | CFTR-NHERF2-LPA 2 (ref. 15) | CFTR-PDZ חלבונים-MRP 2 (ref. 17) | CFTR-PDZK1-MRP4 (ref. 16) | |
| זיקה חרוזים | Amylose שרף | S-חלבון agarose | Amylose שרף | גלוטתיון agarose |
| מטוהרים חלבון-1 | MBP-β 2 AR-CT | שלו-S-CFTR CT | MBP-CFTR CT | GST-CT MRP4 |
| מטוהרים חלבון-2 | GST-NHERF1 | GST-NHERF2 | GST-PDZ חלבונים | שלו-S-PDZK1 |
| מטוהרים חלבון-3 (או lysates התא) | CFTR-WT או CFTR-his10 (BHK או lysates HEK התא) | דגלאמ"ע-2-WT או הדגל אמ"ע 2-ΔSTL (lysates BHK התא) | MRP2 (lysates סלולריים MDCK) | מטוהרים הדגל CFTR-WT או CFTR-his10 (או lysates התא) |
| נוגדן | Anti-CFTR IgG | Anti-Flag HRP | Anti-IgG MRP2 | Anti-Flag HRP |
1. טבלה מסכמת של CFTR המכילים קומפלקסים שונים macromolecular התאספו במבחנה.
Access restricted. Please log in or start a trial to view this content.
Discussion
בפרוטוקול זה הראינו שיטה במבחנה הרכבה זיהוי של CFTR המכיל קומפלקס macromolecular איתות באמצעות חלבונים מטוהרים (או שברי חלבונים) ו / או lysates סלולריים כפי שדווח בעבר 16-19,29,30. כדי להשיג את התוצאות הטובות ביותר הנקודות הבאות קריטיות בתהליך ההכנה דורשים התייחסות מיוחדת: ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
העבודה שלנו כבר נתמך על ידי תרומות של איגוד הלב האמריקני (שותפים רבתי דרום מזרח) התחלת-מענק-in-0765185B סיוע, ע 'אלזה Pardee קרן מענק מחקר, ויין סטייט קרן ההפעלה עירונית, לב וכלי דם מכון המחקר איזיס הפרס היוזמה. שיטה זו של באסיפה חוץ גופית CFTR מורכב macromolecular היה במקור חלוץ ידי ד"ר AP Naren (אוניברסיטת טנסי למדעי הבריאות מרכז).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| pGEX4T-1 וקטור | GE Healthcare | 28-9545-49 | בעבר Amersham Biosciences |
| pMAL-C2 וקטור | ניו אינגלנד Biolabs | ||
| pET30 וקטור | EMD כימיקלים | 69077-3 | בעבר Novagen |
| גלוטתיון agarose חרוזים | BD Biosciences | 554780 | |
| Amylose שרף | ניו אינגלנד Biolabs | E8021S | |
| טופר חרוזים | Clontech | 635501 | |
| גלוטתיון מופחתת | BD Biosciences | 554782 | |
| imidazole | דיג | BP305-50 | |
| מלטוז | דיג | BP684-500 | |
| S-חלבון agarose | EMD כימיקלים | 69704-3 | בעבר Novagen |
| Anti-Flag HRP | סיגמא | A8592 | |
| Anti-CFTR IgG | מחוייט | R1104 | MAB הכרה CFTR epitope ב-AA 722-734 |
| Anti-IgG MRP2 | Chemicon הבינלאומי | MAB4148 | עכשיו חלק Millipore |
טבלה 2. חומרים כימיים ספציפיים וציוד.
References
- Anderson, M. P. Demonstration that CFTR is a chloride channel by alteration of its anion selectivity. Science. 253, 202-205 (1991).
- Bear, C. E. Purification and functional reconstitution of the cystic fibrosis transmembrane conductance regulator (CFTR. Cell. 68, 809-818 (1992).
- Quinton, P. M. Chloride impermeability in cystic fibrosis. Nature. 301, 421-422 (1983).
- Cheng, S. H. Defective intracellular transport and processing of CFTR is the molecular basis of most cystic fibrosis. Cell. 63, 827-834 (1990).
- Gabriel, S. E., Brigman, K. N., Koller, B. H., Boucher, R. C., Stutts, M. J. Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model. Science. 266, 107-109 (1994).
- Li, C., Naren, A. P. CFTR chloride channel in the apical compartments: spatiotemporal coupling to its interacting partners. Integr. Biol (Camb). 2, 161-177 (2010).
- Chao, A. C. Activation of intestinal CFTR Cl- channel by heat-stable enterotoxin and guanylin via cAMP-dependent protein kinase. Embo. J. 13, 1065-1072 (1994).
- Gabriel, S. E., Clarke, L. L., Boucher, R. C., Stutts, M. J. CFTR and outward rectifying chloride channels are distinct proteins with a regulatory relationship. Nature. 363, 263-268 (1993).
- McNicholas, C. M. Sensitivity of a renal K+ channel (ROMK2) to the inhibitory sulfonylurea compound glibenclamide is enhanced by coexpression with the ATP-binding cassette transporter cystic fibrosis transmembrane regulator. Proc. Natl. Acad. Sci. USA. 93, 8083-8088 (1996).
- Schreiber, R., Nitschke, R., Greger, R., Kunzelmann, K. The cystic fibrosis transmembrane conductance regulator activates aquaporin 3 in airway epithelial cells. J. Biol. Chem. 274, 11811-11816 (1999).
- Shumaker, H., Amlal, H., Frizzell, R., Ulrich, C. D. 2nd, Soleimani, M. CFTR drives Na+-nHCO-3 cotransport in pancreatic duct cells: a basis for defective HCO-3 secretion in CF. Am. J. Physiol. 276, 16-25 (1999).
- Ahn, W. Regulatory interaction between the cystic fibrosis transmembrane conductance regulator and HCO3- salvage mechanisms in model systems and the mouse pancreatic duct. J. Biol. Chem. 276, 17236-17243 (2001).
- Sugita, M., Yue, Y., Foskett, J. K. CFTR Cl- channel and CFTR-associated ATP channel: distinct pores regulated by common gates. Embo. J. 17, 898-908 (1998).
- Naren, A. P. Regulation of CFTR chloride channels by syntaxin and Munc18 isoforms. Nature. 390, 302-305 (1997).
- Naren, A. P. Syntaxin 1A is expressed in airway epithelial cells, where it modulates CFTR Cl(-) currents. J. Clin. Invest. 105, 377-386 (2000).
- Naren, A. P. A macromolecular complex of beta 2 adrenergic receptor, CFTR, and ezrin/radixin/moesin-binding phosphoprotein 50 is regulated by PKA. Proc. Natl. Acad. Sci. USA. 100, 342-346 (1073).
- Li, C. Lysophosphatidic acid inhibits cholera toxin-induced secretory diarrhea through CFTR-dependent protein interactions. J. Exp. Med. 202, 975-986 (2005).
- Li, C. Spatiotemporal coupling of cAMP transporter to CFTR chloride channel function in the gut epithelia. Cell. 131, 940-951 (2007).
- Li, C., Schuetz, J. D., Naren, A. P. Tobacco carcinogen NNK transporter MRP2 regulates CFTR function in lung epithelia: implications for lung cancer. Cancer Lett. 292, 246-253 (2010).
- Hall, R. A. A C-terminal motif found in the beta2-adrenergic receptor, P2Y1 receptor and cystic fibrosis transmembrane conductance regulator determines binding to the Na+/H+ exchanger regulatory factor family of PDZ proteins. Proc. Natl. Acad. Sci. U.S.A. 95, 8496-8501 (1998).
- Short, D. B. An apical PDZ protein anchors the cystic fibrosis transmembrane conductance regulator to the cytoskeleton. J. Biol. Chem. 273, 19797-19801 (1998).
- Wang, S., Yue, H., Derin, R. B., Guggino, W. B., Li, M. Accessory protein facilitated CFTR-CFTR interaction, a molecular mechanism to potentiate the chloride channel activity. Cell. 103, 169-179 (2000).
- Sun, F. E3KARP mediates the association of ezrin and protein kinase A with the cystic fibrosis transmembrane conductance regulator in airway cells. J. Biol. Chem. 275, 29539-29546 (2000).
- Cheng, J. A Golgi-associated PDZ domain protein modulates cystic fibrosis transmembrane regulator plasma membrane expression. J. Biol. Chem. 277, 3520-3529 (1074).
- Scott, R. O., Thelin, W. R., Milgram, S. L. A novel PDZ protein regulates the activity of guanylyl cyclase C, the heat-stable enterotoxin receptor. The Journal of biological chemistry. 277, 22934-22941 (1074).
- Lee, J. H. Dynamic regulation of cystic fibrosis transmembrane conductance regulator by competitive interactions of molecular adaptors. The Journal of biological chemistry. 282, 10414-10422 (2007).
- Gee, H. Y., Noh, S. H., Tang, B. L., Kim, K. H., Lee, M. G. Rescue of DeltaF508-CFTR trafficking via a GRASP-dependent unconventional secretion pathway. Cell. 146, 746-760 (2011).
- Naren, A. P. Methods for the study of intermolecular and intramolecular interactions regulating CFTR function. Met. Molecul. Med. 70, 175-186 (2002).
- Li, C., Roy, K., Dandridge, K., Naren, A. P. Molecular assembly of cystic fibrosis transmembrane conductance regulator in plasma membrane. The Journal of biological chemistry. 279, 24673-24684 (2004).
- Li, C., Naren, A. P. Analysis of CFTR Interactome in the Macromolecular Complexes. Met. Molecul. Med. 741, 255-270 (2011).
- Wu, Y. A chemokine receptor CXCR2 macromolecular complex regulates neutrophil functions in inflammatory diseases. J. Biol. Chem. , (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved