需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在整个细胞群在单细胞水平上研究细胞周期蛋白B的蛋白水解
摘要
中期向后期过渡被触发,通过后期促进复合物(APC / C)依赖的泛素化和随后的破坏细胞周期蛋白B.在这里,我们建立了一个系统,脉冲追踪标签,可以监控在整个细胞群的细胞周期蛋白B蛋白水解和有利于检测干扰的有丝分裂关卡。
摘要
两个子细胞在细胞分裂过程中染色体之间平等分配的前提条件是保证遗传稳定性1。染色体分离过程中的不准确之处是恶性肿瘤的一个标志,并伴有渐进性疾病2-4。有丝分裂纺锤体组装检查点(SAC)是一个监督机制,阻碍直到每一个染色体的细胞在中期建立了稳定的双极连接到有丝分裂纺锤体1。 SAC发挥其功能的干扰与激活APC / C亚基CDC20阻止蛋白水解的securin和细胞周期蛋白B和染色体分离和有丝分裂退出。不当安装的染色体防止沉默的SAC的信号,导致继续抑制APC / C CDC20,直到问题得到解决,以避免染色体分离现象的原因,非整倍体和恶性生长。
在我的大多数研究APC / C-依赖的蛋白降解的影响及的不当染色体附件上利用了主轴中断使用微管解聚或稳定的药物来干扰微管与染色体附件。由于干扰微管动力学影响的运输和国产化的关键调节,这些程序承担的风险,导致人为影响5。
要研究如何SAC干扰APC / C-依赖的蛋白降解的细胞周期蛋白B的有丝分裂过程中泰然自若的细胞群,我们建立了组蛋白H2-GFP为基础的系统,该系统允许同时监测中期调整的有丝分裂染色体的细胞周期蛋白B 6和蛋白水解。
要描绘的蛋白水解的公司,我们产生了嵌合细胞周期蛋白B,报道分子的C-末端的SNAP部分6( 图1)。 SNAP-部分是在一个自标记反应,能够形成共价键烷基鸟嘌呤-载体(SNAP基板)7,8( 图1)。 SNAP底物分子都是现成的,进行广泛的不同的荧光染料。嵌合细胞周期蛋白B-SNAP分子成为膜可渗透SNAP衬底的生长介质7( 图1)添加后标记。荧光强度的细胞周期蛋白B-SNAP标记反应后,在一个脉冲追踪反应类似的方式和荧光强度反映细胞周期蛋白B降解6( 图1)的水平的下降。我们的系统有利于在大量的细胞(或多个细胞群)在平行的有丝分裂,APC / C-依赖的蛋白降解的监测。由此,该系统可以是一个有价值的工具,以确定代理/小分子,能够干扰蛋白水解活性,在中期到后期过渡。此外,作为在有丝分裂过程中合成的细胞周期蛋白B最近已被建议作为一个重要mechanis米,在小鼠和人类保持cyclin B的表达水平基本稳定9,10促进有丝分裂块,这个系统使我们能够分析细胞周期蛋白B蛋白水解的一个元素平衡的平衡6。
研究方案
1。显微镜玻片上播种的U2OS细胞周期蛋白B-SNAP记者细胞(克隆11个单元6)
- Trypsinize汇合的的SNAP记者被允许异步增长对数生长期至少48小时的细胞,。
- 与8孔显微镜室(恒定细胞分布)。
用于播种的细胞到8以及显微镜室在一个恒定的分布在整个表面的显微镜室,离心10,000个细胞,并重新悬浮在350μl的无酚红的正常生长培养基(补充有10%牛胎儿血清,青霉素/链霉素和丙酮酸钠)。细胞悬浮液转移到显微镜室( 图2)。
使用8孔显微镜室(最大细胞密度在中心)。
用于播种细胞的中心显微镜chamb的在更高的密度在呃,用300μl的无酚红的正常生长介质加载腔室。仔细添加5000细胞的显微镜室( 图2)的中心。
工作96以及特殊的光学板(恒定细胞分布)。
在一个恒定的分布在整个表面上的阱用于播种到96孔板中的细胞,离心5000细胞,并重新悬浮于300μl的无酚红的正常生长介质中。细胞悬浮液转移到96孔板中。根据所需的井含细胞的总数,调整细胞数和总体积的悬浮液介质中( 图2)。
工作96以及特殊的光学板(最大细胞密度在中心)。
对于细胞接种到96孔板上,小心地加入1500细胞在15μl的无酚红的正常生长介质中的小型会议室升下降到各孔中,以达到限制细胞生长的孔中( 图2)的中心的中心。
- 允许标准细胞培养条件下(37℃,100%的空气湿度,5%CO 2)下的生长至少18小时的种子细胞。
2。记者细胞染色与SNAP基
- 前30分钟的染色程序的开头允许无酚红的正常生长培养基的等分试样升温至37℃。
- 对于容易处理的SNAP基板的(在我们的例子TMR星级)溶解在DMSO中的TMR星级在400μM的原液,它可以储存于-20℃下以获得一个浓度
- 染色前,在200μl的无酚红正常的生长培养基中(37℃),得到最终的标签的浓度为1μM的0.5微升的TMR星级原液稀释。
- 删除异步生长的细胞正常生长培养基从孵育在labeling介质在标准培养条件下25分钟。
- 拆下标签介质和洗涤细胞4次,用无酚红的正常生长培养基中(37℃)。孵育细胞在300μl的无酚红的正常生长培养基中(37℃)30分钟。运输到显微镜之前更换培养基用新鲜的无酚红的正常生长培养基中(37℃),以除去残留的未结合的SNAP基板。
- 运输细胞显微镜在发泡胶框上预先温热(37℃),以尽量减少温度变化的热块。
3。荧光强度的测量
- 前两小时,分析的气候室中的空气温度调节到37℃,在干燥的模式,以便使与它的所有组件的整个显微镜到所需的温度。预加热湿度设定之前,重要的是要避免缩合和随后的损坏显微镜。
- 调节空气湿度吨“O 60%,CO 2至5%之前开始分析的。
- 开始扫描^ R采集软件定义标准设置( 见表1)。
- 定义的位置的孔,以进行分析。
- 定义采集周期时间(ΔT)的绝对数量的采集周期。
- 如果需要更高的井数的分析,选择硬件自动对焦,否则就足够了单独使用软件的自动对焦。
- 开始的前两个采样周期的采集和监督。该显微镜将专注于组蛋白的H2-GFP信号,随后在该通道的第一图像采集前的过滤器被改变,并获取相应的TMR星图像( 图3)。然后重复内的阱和要检查的每一个的孔的所有位置,再次重复之前的下一个周期。
4。分析蛋白水解型材U唱扫描^ R
- 启动扫描^ R分析软件和分析图像的细胞核由组蛋白H2-GFP,定义为主要对象,可视化,使用的阈值,基于信号强度和在分离周边小区的分水岭算法来协助。的细胞核与细胞质组成的子对象,应该建立TMRstar分析。 (主要对象的重要属性是X和Y位置,时间,最大和平均强度为主要对象的总强度除以区域TMRstar子对象的GFP)。这个分析过程可能需要几个小时,由于大量的数据数量。
- 切换到跟踪模式,以可视化的子对象平均TMR星荧光强度随着时间的推移细胞的痕迹,分配给分析的主要对象( 图4)。要检查的细胞的数目可以通过选通持续至少140次循环的这些测量值,并具有高的最大强度的H2-GFP收窄。展望在较大数量的细胞,允许第一代表和客观的视图( 图4)。
- 选择感兴趣的小区的痕迹,以可视化组蛋白的H2-GFP和TMR星级荧光同时在单细胞水平上( 图5A)。
- 使用利益的单元格上单击鼠标右键,并说明组蛋白H2-GFP和细胞周期蛋白B-SNAP的TMR星为每一个时间点产生一个导出的图片库。
- 更改的人口模式的扫描^ R分析软件和门的区域利益的细胞上的X和Y散点图( 图5B)表示。
- 应用新的散点图窗口选通区域和可视化意味着TMR星荧光强度随着时间的推移( 图5C)。
- 出口到Microsoft Excel中的数据(时间和荧光强度)为进一步计算。
5。代表性的成果
无花果URE 5D和图5E示出细胞周期蛋白B动力学,由TMR星级荧光强度的曲线,表示一个单元,通过一个常规的有丝分裂所得无染色体错位的迹象( 图5E)。核膜击穿后的细胞质(NEBD,如所表示的红色三角形)压实后,TMR星荧光强度显示的同构的窗口(在图中的明亮区域)的突然增加,直到达到时,细胞进入中期,6。荧光强度保持在一个稳定的水平,只要通过前期和中期的细胞进入,然后开始迅速下降,一旦所有的染色体已建立了稳定的中期板( 图5D和5E)。这一下降过程中染色体分离之前后期(蓝色曲线上的点)。在后期有丝分裂的的质开始decondense(蓝色条)和单元采用相间形态,而荧光强度曲线接近高原是低于高原前有丝分裂( 图5D和5E)。
| 自动对焦设置 | 组蛋白H2-GFP(主要对象获取设置) | 细胞周期蛋白B-SNAP标有TMR星 (采集设置) | 采集循环时间重复 |
| 自动对焦+ / -39微米粗24层 精细自动对焦 + / -5.4微米14层 | GFP过滤器设置: 曝光时间:100毫秒 光照强度:25% | TRITC过滤器设置: 曝光时间:150毫秒 光照强度:33.3% | 2〜5分钟。 |
| GFP过滤器设置: 曝光时间:12毫秒 光照强度:12.5% | 继续分析(限于通过减少空气湿度为60%至48小时) |
表1中。标准设置用于分析细胞周期蛋白B的蛋白质水解。组蛋白用作H2-GFP细胞周期蛋白B-SNAP荧光强度测量的参考结构来定义的焦点平面。聚焦过程中的光强相比,图像采集设置,以避免累积光毒性较低。
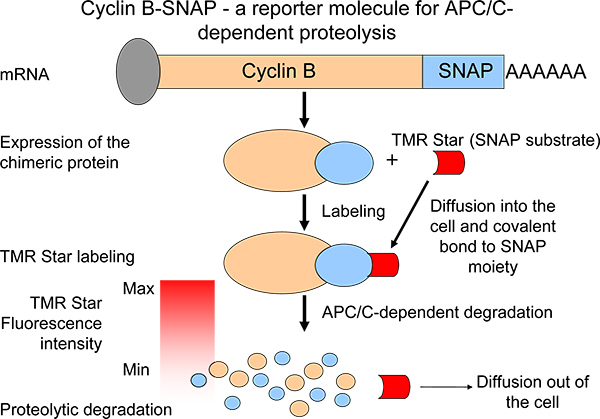
图1。细胞周期蛋白B蛋白水解通过表达的嵌合细胞周期蛋白B衍生物与类似的内源性蛋白的降解特性的测量示意图 。脉冲追踪标记后的荧光强度的下降是APC / C活性的措施。
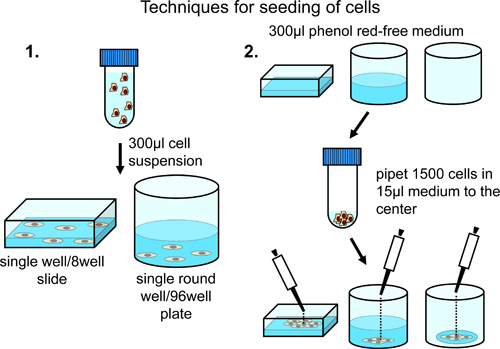
图2。分析定期分配的8孔幻灯片或96孔板中的细胞。细胞的整个表面的阱是通过再悬浮于最终体积为300微升,并建议,如果只有一个或几个位置手动定义进行分析。富集的中心区域中的单元格的实现通过添加细胞的预充液或空井中心。这种技术建议的情况下在不同的井的自动图像采集。

图3。序列的数据采集 A)检测组蛋白H2-GFP用于在有丝分裂过程中染色体对准焦点平面的定义和监测。 B)的TMR星级的荧光强度的荧光强度是脉冲追踪的绝对量,标记的细胞周期蛋白B-SNAP的量度。
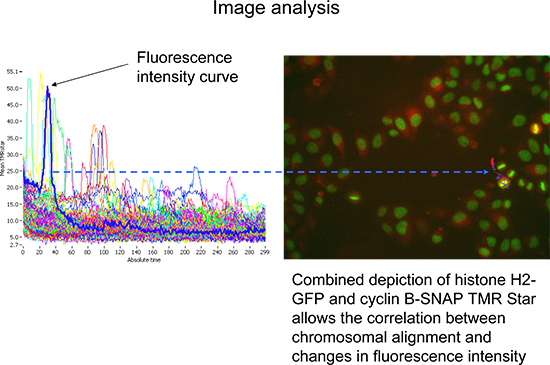
图4。 ^ R代表扫描分析软件为基础的描写平均TMR星荧光强度(总TMRstar强度除以面积)随着时间的推移选择的代表电池跟踪(蓝色)。相应的图像(如右图所示)允许的同步可视化,组蛋白:H2-GFP(绿色)和细胞周期蛋白B-SNAP(红色)。 点击这里查看大图 。
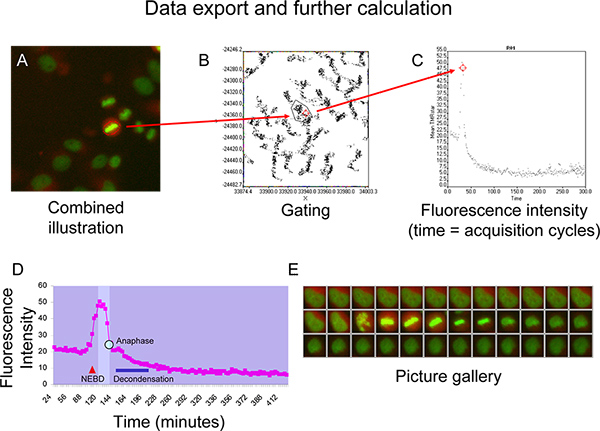
图5:A + B)举例门点的单元格的XY散点图的利息。 C)使用散点图的平均TMRstar的荧光强度(的总TMRstar强度除以面积)随着时间的推移可视化。 D + E)代表同构的窗口(上图)brigher领域之间的核被膜破裂NEBD()和:染色质decondensation(蓝色条),在Microsoft Excel中产生的荧光强度曲线,细胞周期蛋白B-SNAP。后期用T表示他的蓝点在曲线上。 点击此处查看大图 。
动画1。 点击此处查看补充电影 。
讨论
我们在座的活细胞成像为基础的方法,促进细胞周期蛋白B同时监测蛋白质和染色体排列。这种方法允许在单细胞水平上研究的有丝分裂控制中泰然自若的细胞群。细胞周期蛋白B降解曲线的APC / C的活性和促进直接的见解,从而间接地反映了状态的SAC 6。
这种方法,即使建立了基于扫描^ R软件,可以很容易地被复制任何类似的显微镜站。此外,使用我们的逆转录病毒的?...
披露声明
没有利益冲突的声明。
致谢
我们非常感谢S.泰勒提供的pLPCX组蛋白H2-GFP质粒。我们感谢R. Mertelsmann为持续的支持。这项工作是由德国研究联合会的支持。
材料
| Name | Company | Catalog Number | Comments |
| 产品名称 | 公司 | 目录编号 | 评论(可选) |
| 报道细胞系 | 产生的房子,6 | 克隆11个记者细胞 (U2OS基于细胞周期蛋白B-SNAP细胞) | |
| 逆转录病毒的细胞周期蛋白B-SNAP表达载体 | 产生的房子,6 | pLNCX2细胞周期蛋白B mut5-SNAP | |
| 免费的phenolred-DMEM | Gibco公司 | 21063-029 | FCS,丙酮酸钠,青霉素/链霉素补充要求 |
| SNAP-细胞TMR明星 | New England Biolabs公司 | S9105S | 原液400μM的在DMSO中 |
| 特别Opstics板,96孔 | 深圳科诗特 | 3720 | |
| μ-幻灯片8,ibiTreat | Ibidi | 80826 | |
| 显微镜装置 | 奥林巴斯 | IX-81倒置显微镜与气候室 | |
| 目标 | 奥林巴斯 | UPLSAPO 20X物镜(NA 0.75) | |
| 采集软件 | 奥林巴斯 | 扫描^ R采集软件(v.2.2.09) | |
| 分析软件 | 奥林巴斯 | 扫描^ R分析软件(v.1.2.0.6) |
参考文献
- Musacchio, A., Salmon, E. D. The spindle-assembly checkpoint in space and time. Nat. Rev. Mol. Cell Biol. 8, 379-393 (2007).
- Nasmyth, K. Segregating sister genomes: the molecular biology of chromosome separation. Science. 297, 559-565 (2002).
- Cahill, D. P. Mutations of mitotic checkpoint genes in human cancers. Nature. 392, 300-303 (1998).
- Lengauer, C., Kinzler, K. W., Vogelstein, B. Genetic instabilities in human cancers. Nature. 396, 643-649 (1998).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-4892 (2010).
- Schnerch, D. Monitoring APC/C activity in the presence of chromosomal misalignment in unperturbed cell populations. Cell Cycle. 11, (2012).
- Keppler, A. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat. Biotechnol. 21, 86-869 (2003).
- Jansen, L. E., Black, B. E., Foltz, D. R., Cleveland, D. W. Propagation of centromeric chromatin requires exit from mitosis. J. Cell. Biol. 176, 795-805 (2007).
- Malureanu, L. Cdc20 hypomorphic mice fail to counteract de novo synthesis of cyclin B1 in mitosis. J. Cell Biol. 191, 313-329 (2010).
- Mena, A. L., Lam, E. W., Chatterjee, S. Sustained spindle-assembly checkpoint response requires de novo transcription and translation of cyclin B1. PLoS One. 5, (2010).
- Wolthuis, R. Cdc20 and Cks direct the spindle checkpoint-independent destruction of cyclin. A. Mol. Cell. 30, 290-302 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。