Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El estudio de la proteólisis de ciclina B en el nivel de células individuales en poblaciones de células enteras
En este artículo
Resumen
Metafase anafase transición se activa a través de la promoción de complejos anafase (APC / C)-dependiente de ubiquitinación y posterior destrucción de la ciclina B. En este caso, hemos establecido un sistema que, a raíz de pulso-caza etiquetado, permite monitorizar la proteólisis de ciclina B en poblaciones de células enteras y facilita la detección de interferencia por el puesto de control mitótico.
Resumen
Distribución equitativa de los cromosomas entre las dos células hijas durante la división celular es un requisito previo para garantizar la estabilidad genética 1. Imprecisiones en la separación de los cromosomas son una característica de malignidad y asociado con la enfermedad progresiva 2-4. El punto de control de ensamblaje del huso (SAC) es un mecanismo de vigilancia mitótico que retiene las células en metafase hasta que cada cromosoma individual ha establecido una unión bipolar estable para el huso mitótico 1. El SAC ejerce su función por la interferencia con la activación de APC / C subunidad Cdc20 para bloquear la proteolisis de securin y ciclina B y así separación de los cromosomas y la salida de mitosis. Fijación incorrecta de cromosomas impide el silenciamiento de SAC señalización y provoca la inhibición continuada de APC / C Cdc20 hasta que se resuelva el problema para evitar missegregation cromosómica, aneuploidía y tumores malignos 1.
La mayoría de los estudios que abordaron la influence de apego indebido cromosómico en APC / C dependiente de proteólisis aprovechó la interrupción del husillo mediante despolimerización de microtúbulos o la estabilización de los medicamentos para interferir con apego a los microtúbulos cromosómicos. Dado que la interferencia con la cinética de microtúbulos pueden afectar el transporte y localización de reguladores críticos, estos procedimientos llevan un riesgo de inducir efectos artificiales 5.
Para estudiar cómo el SAC interfiere con la APC / C dependiente de proteólisis de ciclina B durante la mitosis en las poblaciones de células imperturbable, hemos establecido un sistema de histonas H2-GFP-base que permitió la monitorización simultánea de la alineación de los cromosomas en metafase mitótica y la proteólisis de la ciclina B 6 .
Para describir perfiles proteolíticos, hemos generado una ciclina B quimérico molécula indicadora con un resto C-terminal de SNAP 6 (Figura 1). En una reacción de auto-etiquetado, la SNAP-resto es capaz de formar enlaces covalentes conalkylguanine-portadoras (sustrato SNAP) 7,8 (Figura 1). Moléculas de sustrato SNAP son fácilmente disponibles y llevar a un amplio espectro de diferentes fluorocromos. Quiméricos ciclina B-SNAP moléculas se vuelven marcado después de la adición del sustrato de SNAP-membrana permeable al medio de crecimiento 7 (Figura 1). Después de la reacción de marcaje, la intensidad de la ciclina B-SNAP fluorescencia cae en una reacción de tipo de pulso y persecución manera y las intensidades de fluorescencia reflejan los niveles de ciclina B degradación 6 (Figura 1). Nuestro sistema facilita el seguimiento de mitótico APC / C dependiente de la proteolisis en un gran número de células (o varias poblaciones de células) en paralelo. De esta manera, el sistema puede ser una herramienta valiosa para identificar agentes / moléculas pequeñas que son capaces de interferir con la actividad proteolítica en la metafase a anafase de transición. Además, como la síntesis de la ciclina B durante la mitosis Recientemente se ha sugerido como un mecanicista importantesm en el fomento de un bloque mitótico en ratones y seres humanos al mantener los niveles de ciclina expresión B 9,10 estables, este sistema nos ha permitido analizar la proteólisis de ciclina B como un elemento de un equilibrio satisfactorio 6.
Protocolo
1. La siembra de U2OS basados en células Reporter ciclina B-SNAP (clon 11 Celdas 6) en la cámara de diapositivas para microscopio
- Tripsinizar las células subconfluentes reportero SNAP que se dejaron crecer de forma asincrónica en fase log durante al menos 48 h.
- Trabajar con 8 cámaras de microscopio pocillos (distribución constante de las células).
Para la siembra de las células sobre 8 cámaras de microscopio pocillos a una distribución constante a través de toda la superficie de la cámara del microscopio, centrífuga de 10.000 células y resuspender en 350 l de rojo fenol libre de medio de crecimiento normal (suplementado con fetal 10% de suero bovino, penicilina / estreptomicina y piruvato de sodio). Transferir la suspensión celular a la cámara del microscopio (Figura 2).
Trabajar con 8 cámaras de microscopio pocillos (densidad celular máxima en el centro).
Para la siembra de las células a una densidad mayor en el centro de la chamb microscopioer, cargar la cámara con 300 l de rojo fenol libre de medio de crecimiento normal. Añadir 5.000 células cuidadosamente hasta el centro de la cámara del microscopio (Figura 2).
Trabajar con 96 placas óptica bien especiales (distribución constante de las células).
Para la siembra de células en placas de 96 pocillos a una distribución constante a través de toda la superficie del pozo, centrifugar 5.000 células y resuspender en 300 l de rojo fenol libre de medio de crecimiento normal. Transferir la suspensión celular a una placa de 96 pocillos. Dependiendo del número total de células que contienen pozos requeridos, ajustar el número de células y el volumen total del medio de suspensión (Figura 2).
Trabajar con 96 placas óptica bien especiales (densidad celular máxima en el centro).
Para la siembra de células en placas de 96 pocillos, añadir cuidadosamente 1.500 células en 15 l de rojo fenol libre de medio de crecimiento normal en un small gota al centro de cada pocillo para lograr una restricción del crecimiento celular al centro del pozo (Figura 2).
- Permitir que las células sembradas a crecer durante al menos 18 horas en condiciones estándar de cultivo celular (37 º C, humedad 100% de aire, 5% de CO 2).
2. La tinción de las células con el sustrato de SNAP Reporter
- 30 min antes del inicio del procedimiento de tinción permitir alícuotas de rojo fenol libre de medio de crecimiento normal para calentar a 37 ° C.
- Para facilitar la manipulación del sustrato SNAP (en nuestro caso TMR estrella) disolver Star TMR en DMSO para obtener una concentración en la solución stock de 400 mM, que se pueden almacenar a -20 ° C.
- Antes de la tinción, diluir 0,5 l de solución stock de Star TMR en 200 l de rojo fenol libre de medio de crecimiento normal (37 ° C) para obtener una concentración etiquetado final de 1 mM.
- Eliminar el medio de crecimiento normal de las células asincrónicamente creciente e incubar en lAbeling medio durante 25 min en condiciones estándar de cultivo.
- Eliminar etiquetado células medianas y lavado cuatro veces con rojo fenol libre de medio de crecimiento normal (37 ° C). Se incuban las células en 300 l de rojo fenol libre de medio de crecimiento normal (37 ° C) durante 30 min. Antes de transportar al microscopio sustituir el medio fresco con rojo fenol libre de medio de crecimiento normal (37 ° C) para eliminar el sustrato de SNAP residual no unido.
- Transporte células al microscopio en una caja de espuma de poliestireno en una pre-calentado (37 ° C) del bloque de calor para minimizar la variación de temperatura.
3. Medición de la intensidad de fluorescencia
- Dos horas antes del análisis de ajustar la temperatura del aire de la cámara climática a 37 ° C en modo de secado con el fin de llevar el microscopio con todos sus componentes a la temperatura deseada. El precalentamiento antes de la humedad es importante para evitar daños por condensación y posterior al microscopio.
- Ajuste t humedad del aireo 60% y CO 2 al 5% antes del inicio del análisis.
- Inicie el software Scan ^ Adquisición R y definir la configuración estándar (ver tabla 1).
- Definir las posiciones de los pocillos a analizar.
- Definir la Dt (tiempo de adquisición de ciclo) y el número absoluto de ciclos de adquisición.
- Si el análisis de un mayor número de pozos se desea, seleccionar autoenfoque de hardware, de lo contrario, es suficiente para utilizar el autofoco software solo.
- Inicie la adquisición y supervisión para los ciclos de adquisición de las dos primeras. El microscopio se centrará en la histona H2-GFP señal, con la posterior adquisición de una primera imagen en ese canal antes de que se cambia el filtro y la correspondiente imagen TMR Star es adquirido (Figura 3). Esto se repite para todas las posiciones dentro de un pozo y para cada uno de los pozos a ser examinados, antes de repetir otra vez el ciclo siguiente.
4. Análisis de perfiles u proteolíticacantar Scan ^ R
- Iniciar la exploración ^ software de análisis R y analizar las imágenes con los núcleos celulares, como se visualiza por histona H2-GFP, que se define como el objeto principal, utilizando un umbral basado en la intensidad de la señal y un algoritmo de cuenca para ayudar en la separación de las células vecinas. Un subobjeto que consiste en un núcleo con citoplasma debe ser creado para el análisis TMRstar. (Propiedades importantes del objeto principal son posiciones X e Y, el tiempo y máxima y las intensidades medias de GFP para el objeto principal y la intensidad total dividida por el área para el subobjeto TMRstar.) Este proceso de análisis puede tardar varias horas debido a la gran cantidad de datos cantidades.
- Cambiar el modo de rastrear para visualizar la media subobjeto TMR Star intensidad de fluorescencia con el tiempo (trazas de células), asigna a los objetos analizados principales (Figura 4). El número de células para ser examinadas puede ser reducido por gating sobre dichas mediciones de duración mínima de 140 ciclos y con una alta intensidad máxima de H2-GFP. Buscandoa mayor número de células permite que un representante primera y vista objetivo (Figura 4).
- Seleccione una traza de células de interés para visualizar las histonas H2-GFP y TMR Star fluorescencia simultáneamente en el nivel de célula única (Figura 5A).
- Con el botón derecho del ratón en una celda de interés y generar una galería de imágenes exportable para la ilustración de la histona H2-GFP y ciclina B-SNAP Star TMR para cada punto de tiempo.
- Cambie al modo de población del software Scan ^ Análisis de R y la puerta de la región en la que se representa la célula de interés en la parcela X vs Y punto (Figura 5B).
- Aplique una ventana nueva trama de puntos para la región acotada y visualizar significa TMR Star intensidad de fluorescencia con el tiempo (Figura 5C).
- Exportar datos (tiempo y la intensidad de fluorescencia) a Microsoft Excel para el cálculo posterior.
5. Los resultados representativos
Higoure 5D y 5E muestran la cinética de la ciclina B, representado por una curva TMR Star intensidad de fluorescencia, de una célula que procede a través de una mitosis normal sin signos de falta de alineación cromosómica (Figura 5E). Tras la compactación del citoplasma después de la envoltura nuclear desglose (NEBD, según lo indicado por el triángulo rojo), TMR Star intensidad de fluorescencia muestra un aumento abrupto hasta que la ventana isomorfo (área más brillante en el diagrama) se alcanza cuando la célula entra en la prometafase 6. La intensidad de fluorescencia se mantiene en un nivel estable, siempre y cuando las ganancias de células a través de la profase y metafase y luego empieza a disminuir rápidamente una vez que todos los cromosomas han establecido una placa de metafase estable (Figura 5D y 5E). Esta caída precede separación de los cromosomas durante la anafase (punto azul en la curva). En la mitosis finales de la cromatina empieza a decondense (barras azules) y la célula adopta la morfología de la interfase, mientras que la curva de intensidad de fluorescencia se aproxima a unameseta que es más baja que la meseta antes de la mitosis (Figura 5D y 5E).
| Enfoque automático ajustes | Histona H2-GFP (ajustes principales de adquisición de objetos) | Ciclina B-SNAP etiquetados con TMR Star (Ajustes de adquisición) | Repeticiones de adquisición de tiempo de ciclo |
| Grueso de enfoque automático + / -39 m 24 Capas Fine enfoque automático + / -5,4 M 14 Capas | GFP juego de filtros: Tiempo de exposición: 100 mseg Intensidad de la luz: 25% | TRITC juego de filtros: Tiempo de exposición: 150 mseg Intensidad de la luz: 33,3% | 2 a 5 min. |
| GFP juego de filtros: Tiempo de exposición: 12 ms Intensidad de la luz: 12,5% | Hasta 48 horas de análisis continuo (limitado por la humedad del aire reducida de 60%) |
Tabla 1. Ajustes estándar se utilizan para el análisis de la ciclina B proteólisis. Histonas H2-GFP se utilizó como una estructura de referencia para definir el plano de enfoque para la medición de la intensidad de la ciclina B-SNAP fluorescencia. Las intensidades de luz durante el procedimiento de centrado son más bajos en comparación con los valores de adquisición de imágenes para evitar la fototoxicidad acumulativo.
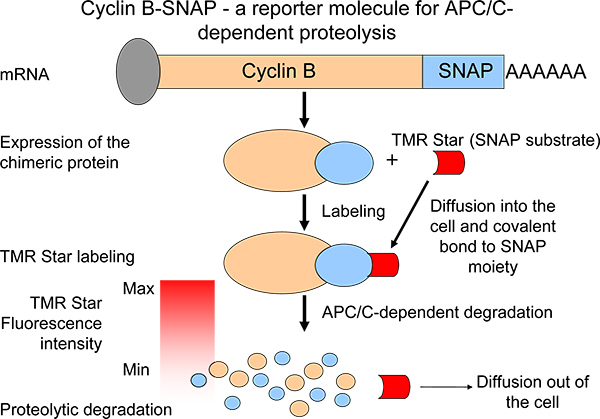
Figura 1. Esquema de la medición de la proteólisis de ciclina B a través de la expresión de un derivado de la ciclina B quimérica con características de degradación similares a la proteína endógena. La disminución de la intensidad de fluorescencia después de pulso-caza etiquetado es una medida de APC / C-actividad.
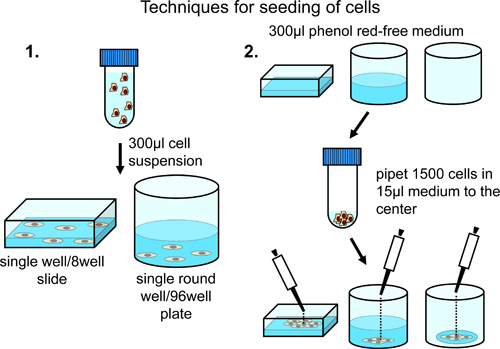
Figura 2. El análisis de las células en portaobjetos y 8 o 96 placas. Distribución regular de lacélulas a través de la superficie del pozo se consigue mediante resuspensión en un volumen final de 300 l y se recomienda, si sólo unas posiciones único o pocos se definen manualmente para el análisis. Enriquecimiento de las células en la región central se consigue por adición de células al centro de pozos prellenadas o vacío. Esta técnica se recomienda en el caso de adquisición de imágenes automatizado en diferentes pozos.

Figura 3. Secuencia de adquisición de datos. A) Detección de las histonas H2-GFP se utiliza para la definición de foco plano y el seguimiento de alineación cromosómica durante la mitosis. B) La intensidad de fluorescencia de la intensidad de fluorescencia Star TMR es una medida de la cantidad absoluta de pulso-caza etiquetados ciclina B-SNAP.
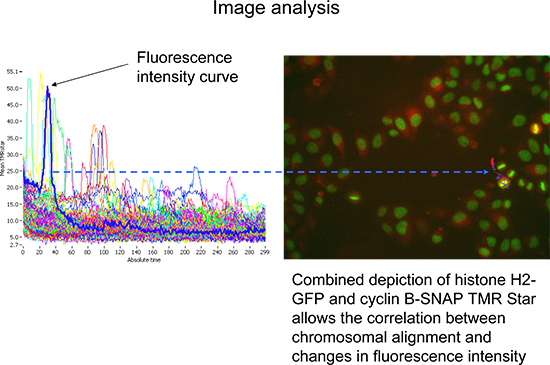
Figura 4. Representante Scan ^ R Análisis basado en software representación de la media Star TMRla intensidad de fluorescencia (intensidad TMRstar total dividido por área) en el tiempo. Selección de una traza célula representativa (azul). Las imágenes correspondientes (que se muestra a la derecha) permite la visualización simultánea de las histonas H2-GFP (verde) y ciclina B-SNAP (rojo). Haga clic aquí para ampliar la cifra .
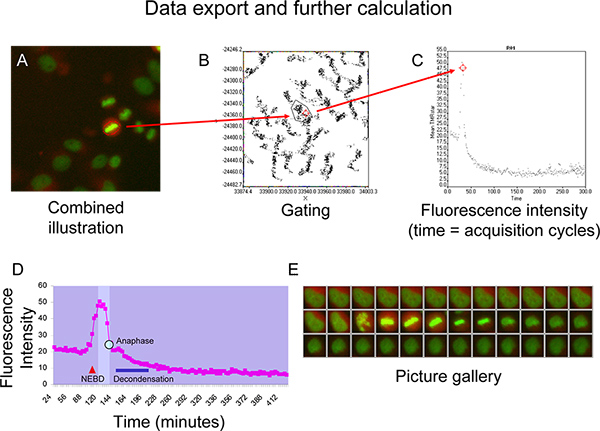
Figura 5. A + B) Ejemplo para la inyección de puntos que representa una célula de interés en el gráfico XY-punto. C) La visualización de la intensidad media de fluorescencia TMRstar (intensidad TMRstar total dividido por área) en el tiempo utilizando el gráfico de puntos. D + E) Representante curva intensidad de la fluorescencia de la ciclina B-SNAP con ventana isomorfo (campo brigher en el diagrama) entre NEBD (desglose envoltura nuclear) y la cromatina descondensación (barra azul) generado en Microsoft Excel. Anafase se indica por tél punto azul en la curva. Haga clic aquí para ampliar la cifra .
Película 1. Haga clic aquí para ver la película suplementario .
Discusión
Presentamos aquí un enfoque de células vivas imágenes basada en facilitar el seguimiento simultáneo de la ciclina B proteólisis y la alineación de los cromosomas. Este enfoque permite el estudio del control mitótico en imperturbable poblaciones de células en el nivel de célula única. Ciclina B curvas de degradación de facilitar conocimientos directos en la actividad de la APC / C y así indirectamente reflejan el estado de la SAC 6.
Este enfoque, aunque establece en bas...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a S. Taylor para la prestación del pLPCX-Histone H2-GFP plásmido. Damos las gracias a R. Mertelsmann apoyo continuo. Este trabajo fue apoyado por la Deutsche Forschungsgemeinschaft.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del producto | Empresa | Número de catálogo | Comentarios (opcional) |
| Reportero línea celular | generado internamente como se describe 6 | 11 clonar células informadoras (U2OS basados ciclina B-SNAP células que expresan) | |
| Ciclina B-retroviral vector de expresión de SNAP | generado internamente como se describe 6 | pLNCX2-ciclina B mut5-SNAP | |
| Phenolred libre de DMEM | Gibco | 21063-029 | La suplementación con FCS, piruvato sódico, penicilina / estreptomicina-micina requiere |
| SNAP-Cell TMR-Star | New England Biolabs | S9105S | Solución de 400 mM en DMSO |
| Opstics Plato Especial, 96 y | Costar | 3720 | |
| μ-Slide 8 bien, ibiTreat | Ibidi | 80826 | |
| Microscopía unidad | Olimpo | IX-81 microscopio inverso con cámara climática | |
| Objetivo | Olimpo | UPLSAPO objetivo de 20x (AN 0,75) | |
| Adquisición de software | Olimpo | Scan ^ R Adquisición de software (v.2.2.09) | |
| Análisis de software | Olimpo | Scan ^ R Análisis de software (v.1.2.0.6) |
Referencias
- Musacchio, A., Salmon, E. D. The spindle-assembly checkpoint in space and time. Nat. Rev. Mol. Cell Biol. 8, 379-393 (2007).
- Nasmyth, K. Segregating sister genomes: the molecular biology of chromosome separation. Science. 297, 559-565 (2002).
- Cahill, D. P. Mutations of mitotic checkpoint genes in human cancers. Nature. 392, 300-303 (1998).
- Lengauer, C., Kinzler, K. W., Vogelstein, B. Genetic instabilities in human cancers. Nature. 396, 643-649 (1998).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-4892 (2010).
- Schnerch, D. Monitoring APC/C activity in the presence of chromosomal misalignment in unperturbed cell populations. Cell Cycle. 11, (2012).
- Keppler, A. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat. Biotechnol. 21, 86-869 (2003).
- Jansen, L. E., Black, B. E., Foltz, D. R., Cleveland, D. W. Propagation of centromeric chromatin requires exit from mitosis. J. Cell. Biol. 176, 795-805 (2007).
- Malureanu, L. Cdc20 hypomorphic mice fail to counteract de novo synthesis of cyclin B1 in mitosis. J. Cell Biol. 191, 313-329 (2010).
- Mena, A. L., Lam, E. W., Chatterjee, S. Sustained spindle-assembly checkpoint response requires de novo transcription and translation of cyclin B1. PLoS One. 5, (2010).
- Wolthuis, R. Cdc20 and Cks direct the spindle checkpoint-independent destruction of cyclin. A. Mol. Cell. 30, 290-302 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados