A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
לומד Proteolysis של cyclin B ברמת התא הבודד באוכלוסיות תאים שלמות
In This Article
Summary
Metaphase לanaphase מעבר מופעל באמצעות anaphase-קידום מורכב (APC / C)-התלוי ubiquitination וההרס הבא של cyclin B. הנה, הקים מערכת ש, בעקבות דופק מרדף תיוג, מאפשר ניטור proteolysis B cyclin באוכלוסיות תאים שלמות ו מאפשר זיהוי של הפרעה על ידי המחסום המיטוטי.
Abstract
חלוקה שווה של הכרומוזומים בין תאי הבת 2 במהלך חלוקת תא היא תנאי הכרחית להבטחת יציבות גנטית 1. אי דיוקים במהלך הפרדת כרומוזום הם סימן היכר של ממאירות וקשורים עם מחלה מתקדמת 2-4. מחסום הרכבת הציר (SAC) הוא מנגנון מעקב המיטוטי שמחזיק בחזרה תאים בmetaphase עד שכל כרומוזום יחיד קימה מצורפת דו קוטבי יציבה לכישור המיטוטי 1. SAC מפעיל הפונקציה שלה על ידי הפרעה לactivating APC / C מקטע Cdc20 לחסום proteolysis של securin וcyclin B ובכך הפרדת כרומוזום ויציאה המיטוטי. התקשרות לא תקינה של כרומוזומים מונעת השתקה של SAC איתות וגורמת לעיכוב מתמשך של APC / C Cdc20 עד שהבעיה תיפתר, כדי למנוע missegregation כרומוזום, aneuploidy וגידולים ממאירים 1.
רוב המחקרים שעסקוnfluence של התקשרות לא תקינה כרומוזומלית בproteolysis התלוי C APC / נצל שיבוש ציר באמצעות depolymerizing או microtubule ייצוב-תרופות להתערב בקובץ מצורף לmicrotubules כרומוזומלית. מאז התערבות בקינטיקה microtubule יכולה להשפיע התחבורה והלוקליזציה של רגולטורים קריטיים, הליכים אלה לשאת סיכון של גרימת אפקטים מלאכותיים 5.
כדי ללמוד איך SAC מפריע APC / C proteolysis התלוי של cyclin B במהלך מיטוזה בשלוות נפש אוכלוסיות תאים, הקים מערכת היסטון H2-GFP מבוסס-שאפשרה ניטור סימולטני של יישור metaphase של כרומוזומים mitotic וproteolysis של cyclin 6 B .
לתאר פרופילי proteolytic, יצר מולקולת כתב B cyclin chimeric עם מחצית C-מסוף SNAP 6 (איור 1). בתגובת תיוג עצמי, SNAP-המחצית היא מסוגלת ליצור קשרים כימיים עםalkylguanine-נישאים (מצע SNAP) 7,8 (איור 1). מולקולות מצע SNAP זמינות ולבצע מגוון רחב של fluorochromes השונה. מולקולות cyclin chimeric B-SNAP להיות מתויגות על תוספת של מצע SNAP קרום החדיר למדיום הגידול 7 (איור 1). בעקבות תגובת התיוג, עוצמת קרינת B-SNAP cyclin צונחת בתגובה כמו אופן ועוצמות קרינה משקפת רמות של cyclin B 6 שפלה (איור 1) הדופק מרדף. המערכת שלנו מאפשרת ניטור של המיטוטי proteolysis התלוי C APC / במספר גדול של תאים (או מספר אוכלוסיות תאים) במקביל. כך, המערכת עשויה להיות כלי רב ערך כדי לזהות סוכנים / מולקולות קטנות כי הם מסוגלים להפריע לפעילות פרוטאוליטי בmetaphase לanaphase מעבר. יתר על כן, כסינתזה של cyclin B במהלך מיטוזה באחרונה הציע כan mechanis חשובמ 'בטיפוח בלוק המיטוטי בעכברים ובבני אדם על ידי רמות cyclin B ביטוי יציבות 9,10 שמירה, מערכת זו אפשרה לנו לנתח proteolysis B cyclin כאלמנט אחד של שיווי משקל מאוזן 6.
Protocol
1. זריעה של תאי U2OS מבוססי cyclin B-SNAP Reporter (11 תאים משובטים 6) בשקופיות קאמריות מיקרוסקופ
- Trypsinize תאי כתב SNAP subconfluent שהורשו לגדול באופן אסינכרוני בשלב יומן במשך לפחות 48 שעות.
- עבודה עם 8 תאי מיקרוסקופ היטב (חלוקה מתמדת של תאים).
לזריעה של תאים על 8 תאי מיקרוסקופ גם בהפצה קבועה על פני כל השטח של חדר מיקרוסקופ, צנטריפוגה 10,000 תאים וresuspend ב350 μl של מדיום גידול הרגיל פנול האדום חינם (בתוספת 10% בסרום שור עוברי, פניצילין / סטרפטומיצין ונתרן פירובט). העברת השעית תא לתא מיקרוסקופ (איור 2).
עבודה עם 8 תאי מיקרוסקופ גם (צפיפות תאים מרבית במרכז).
לזריעה של תאים בצפיפות גבוהה יותר במרכז chamb מיקרוסקופאה, טען קאמרי עם 300 μl של מדיום גידול הרגיל פנול האדום חופשי. הוסף 5000 תאים בזהירות למרכז חדר מיקרוסקופ (איור 2).
עבודה עם 96 צלחות אופטיקה גם מיוחדות (חלוקה מתמדת של תאים).
לזריעה של תאים על גבי 96 גם צלחות בהפצה קבועה על פני כל השטח של הבאר, סרכזת 5000 תאים וresuspend ב 300 μl של מדיום גידול הרגיל פנול האדום חופשי. להעביר את השעית התא לצלחת 96 היטב. תלוי במספר הכולל של בארות תא המכילים הנדרשות, להתאים את מספר התא והנפח הכולל של מדיום ההשעיה (איור 2).
עבודה עם 96 צלחות אופטיקה גם מיוחדות (צפיפות תאים מרבית במרכז).
לזריעה של תאים על גבי 96 גם צלחות, להוסיף 1,500 תאים בזהירות ב15 μl של מדיום גידול הרגיל פנול האדום חופשי בsmalאני צונח למרכז זה את זה היטב כדי להשיג הגבלה של צמיחת תאים למרכז היטב (איור 2).
- לאפשר לתאים לגדול seeded ללפחות 18 שעות בתנאי תרבות תאים סטנדרטיים (37 מעלות צלזיוס, 100% לחות באוויר, 5% CO 2).
2. צביעת תאי Reporter עם תשתית SNAP
- 30 דקות לפני תחילת הליך ההכתמה לאפשר aliquots של מדיום גידול הרגיל פנול האדום ללא לחמם עד 37 מעלות צלזיוס
- לטיפול קל של מצע SNAP (במקרה שלנו TMR סטאר) לפזר כוכב TMR בDMSO להשיג ריכוז בפתרון המניות של 400 מיקרומטר, שניתן לאחסן ב -20 ° C.
- לפני הצביעה, לדלל 0.5 μl של פתרון מניית סטאר TMR ב200 μl של מדיום פנול האדום ללא נורמלי צמיחה (37 מעלות צלזיוס) כדי להשיג ריכוז תיוג סופי של 1 מיקרומטר.
- הסר מדיום גידול רגיל מתאי הגידול באופן אסינכרוני ומדגיר labeling בינוני במשך 25 דקות בתנאי התרבות סטנדרטיות.
- הסרת תיוג תאים בינוניים ולשטוף ארבע פעמים עם מדיום פנול אדום ללא נורמלי צמיחה (37 מעלות צלזיוס). דגירת תאים ב300 μl של מדיום פנול האדום ללא נורמלי צמיחה (37 מעלות צלזיוס) למשך 30 דקות. לפני ההעברה למיקרוסקופ להחליף הבינוני עם מדיום טרי פנול אדום ללא נורמלי צמיחה (37 מעלות צלזיוס) כדי להסיר את מצע SNAP מאוגד שיורית.
- תאי הובלה למיקרוסקופ בקופסא קלקר בטרום התחממו (37 ° C) לחסום חום כדי למזער את שינויי טמפרטורה.
3. מדידה של עוצמת קרינה
- שתי שעות לפני הניתוח להתאים את טמפרטורת האוויר של חדר האקלים ל 37 מעלות צלזיוס במצב יבש על מנת להביא את כל מיקרוסקופ עם כל מרכיביו לטמפרטורה הרצויה. טרום חימום לפני קביעת הלחות חשוב להימנע מעיבוי ובעקבות ניזק למיקרוסקופ.
- התאם t לחות האווירo 60% ו 2 עד 5% CO לפני תחילת הניתוח.
- התחל ^ תוכנת רכישת R הסריקה ולהגדיר הגדרות סטנדרטיות (ראה טבלה 1).
- הגדר את עמדותיהם של הבארות לניתוחו.
- הגדר Δt (זמן מחזור רכישה) ומספר המוחלט של מחזורי רכישה.
- אם ניתוח של מספר גבוה יותר של בארות הוא רצוי, בחר חומרת פוקוס אוטומטי, אחר זה מספיק כדי להשתמש בפוקוס אוטומטי באמצעות תוכנה בלבד.
- התחל הרכישה ולפקח על רכישת שני המחזורים הראשונים. מיקרוסקופ יתמקד באות היסטון H2-GFP, עם הרכישה הבאה של תמונה ראשונה שבערוץ לפני המסנן השתנה ותמונת כוכב TMR המקבילה נרכשה (איור 3). אז זה חוזר על עצמו לכל התפקידים ובכן לכל אחת מהבארות לבחינה, לפני שיחזרו במחזור הבא שוב.
4. ניתוח של u פרופילים פרוטאוליטיםלשיר הסריקה ^ R
- התחל ^ תוכנת ניתוח R סריקה ולנתח את התמונות בגרעין התא, כדמיין ידי היסטון H2-GFP, שהוגדר כמטרה העיקרית, תוך השימוש בסף המבוסס על עוצמת אות ואלגוריתם פרשת מים כדי לסייע בהפרדת תאים שכנים. Subobject המורכב מגרעין עם ציטופלסמה יש ליצור לניתוח TMRstar. (תכונות חשובות של האובייקט העיקרי הן עמדות Y X ו, זמן, ומקסימום ואומרות עוצמות של ה-GFP לאובייקט המרכזי ועוצמת הכולל חלקי שטח לTMRstar subobject.) תהליך ניתוח זה עשוי להימשך מספר שעות בשל נתונים גדולים כמויות.
- שינוי להתחקות מצב כדי להמחיש את עוצמת subobject ממוצע TMR כוכב פלואורסצנטי לאורך הזמן (עקבות סלולריות), שהוקצתה למטרות העיקריות נותחה (איור 4). מספר התאים לבחינה ניתן מצטמצם אצל gating על המדידות האלה נמשכים לפחות 140 מחזורים ובעצמה מרבית גבוהה של H2-GFP. הסתכלותבמספרים גדולים יותר של תאים מאפשרים נציג ראשון ותמונה אובייקטיבית (איור 4).
- בחר עקבות תא של עניין כדי להמחיש היסטון H2-GFP וTMR כוכב פלואורסצנטי בו זמנית ברמת התא הבודדה (5A איור).
- באמצעות לחיצה הימנית בעכבר על תא של עניין וליצור גלריית תמונות ליצוא להמחשה של היסטון H2-GFP וcyclin B-SNAP TMR כוכב עבור כל נקודת זמן אחת.
- שינוי למצב האוכלוסייה של ^ תוכנת סריקת R ניתוח והשער באזור שבו התא של עניין מיוצג על מגרש X לעומת Y הנקודה (5B איור).
- החל חלון עלילת נקודה חדשה לאזור המגודר ולדמיין מתכוון עוצמת TMR כוכב פלואורסצנטי לאורך הזמן (איור 5 ג).
- נתוני יצוא (זמן ועוצמת קרינה) ל-Microsoft Excel לחישוב נוסף.
5. נציג תוצאות
תאנהיור 5D ו5E מתארים B קינטיקה cyclin, מיוצגת על ידי עקומת עוצמת קרינת כוכב TMR, בתא שממשיך במיטוזה רגילה ללא סימנים של חוסר כרומוזומלית (האיור 5E). עם הדחיסה של ציטופלסמה בעקבות התמוטטות מעטפת גרעין (NEBD, כפי שצוין על ידי משולש האדומה), עוצמת קרינת TMR כוכב מראה עלייה פתאומית עד שחלון איזומורפית (אזור בהיר בתרשים) הוא הגיע כאשר התא נכנס 6 prometaphase. עוצמת קרינה נשארה ברמה יציבה כל עוד תמורת התא דרך prophase וmetaphase ואז מתחילה לרדת במהירות פעם אחת כל הכרומוזומים הקימו צלחת metaphase יציבה (האיור 5D ו5E). ירידה זו מקדימה הפרדת כרומוזום במהלך anaphase (נקודה כחולה בעיקול). במיטוזה מאוחר הכרומטין מתחיל decondense (כחולות) והתא מאמץ מורפולוגיה interphase אילו עקומת עוצמת הקרינה מתקרבתרמה שהיא נמוכה מהרמה לפני מיטוזה (האיור 5D ו5E).
| הגדרות פוקוס אוטומטי | היסטון H2-GFP (הגדרות רכישת אובייקט עיקריות) | Cyclin B-SNAP TMR מסומן עם כוכבים (הגדרות רכישה) | חזרות זמן מחזור רכישה |
| גסות פוקוס אוטומטיים + / -39 מיקרומטר 24 שכבות פוקוס אוטומטי פיין + / -5.4 מיקרומטר 14 שכבות | GFP מסנן מוגדר: זמן חשיפה: 100 אלפיות עוצמת אור: 25% | TRITC מסנן מוגדר: זמן חשיפה: 150 אלפיות עוצמת אור: 33.3% | 2-5 דקות. |
| GFP מסנן מוגדר: זמן חשיפה: 12 msec עוצמת אור: 12.5% | עד 48 שעות של ניתוח המשך (מוגבל על ידי לחות אוויר המופחתת של 60%) |
טבלת 1. הגדרות סטנדרטיות לאלו המשמשים לניתוח proteolysis B cyclin. היסטון H2-GFP שמש כמבנה עזר להגדיר מטוס המוקד למדידה של עוצמת קרינת B-cyclin SNAP. עוצמות אור במהלך הליך ההתמקדות הן נמוכות בהשוואה להגדרות תמונת רכישה, כדי למנוע phototoxicity מצטבר.
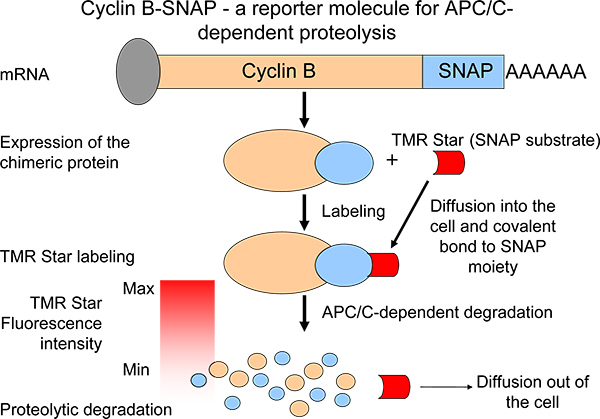
איור 1. סכמטי של מדידת proteolysis B cyclin דרך ביטוי של נגזרת B cyclin chimeric עם מאפיינים דומים לפירוק חלבון אנדוגני. הירידה בעוצמת קרינה אחרי דופק מרדף תיוג היא אמצעי של פעילות APC C /.
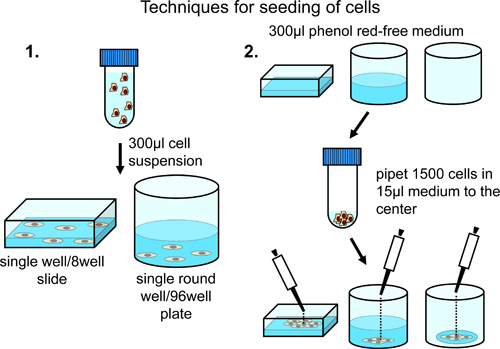
איור 2. ניתוח של תאים על 8 או 96 שקופיות גם גם צלחות. הפצה רגילה שלתאים על פני השטח של הבאר מושגים על ידי resuspension בנפח סופי של 300 μl ומומלץ, אם רק עמדות בודדות או כמה מוגדרות באופן ידני לניתוח. העשרה של תאים באזור המרכז מושגת על ידי תוספת של תאים למרכז בארות prefilled או ריקות. טכניקה זו מומלצת במקרה של רכישת תמונה אוטומטית בבארות שונות.

איור 3. רצף של נתוני רכישה.) איתור של היסטון H2-GFP משמש להגדרת מוקד מטוס וניטור של מערך הכרומוזומים במהלך מיטוזה. B) עוצמת קרינה של עוצמת TMR כוכב פלואורסצנטי היא מדד לסכום המוחלט של דופק מרדף מתויג cyclin B-SNAP.
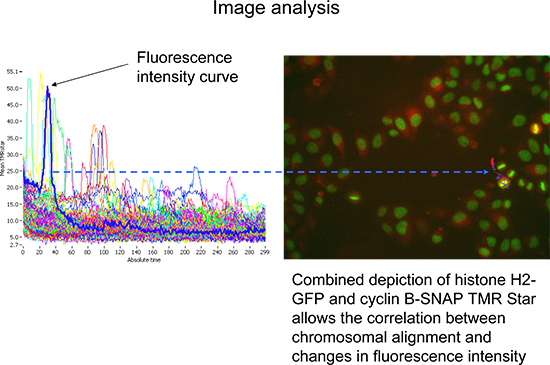
איור 4. נציג סריקת תיאור ^ ניתוח מבוסס תוכנת R של TMR כוכב ממוצעעוצמות קרינה (סה"כ עוצמת TMRstar החלקית שטח) לאורך זמן. בחירה של עקבות תא נציג (כחול). את התמונות המתאימות (נראה מהימין) תאפשרנה הדמיה סימולטני של היסטון H2-GFP (ירוק) וcyclin B-SNAP (אדום). לחץ כאן לצפייה בדמות גדולה.
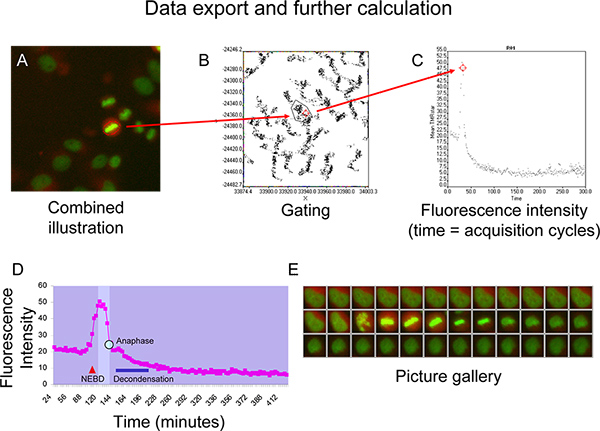
איור 5. + B) לדוגמה עבור gating של נקודות המייצגות תא של ריבית על עלילת XY הנקודות. ג) ויזואליזציה של העצמה הממוצעת TMRstar פלואורסצנטי (סה"כ עוצמת TMRstar החלקית שטח) לאורך הזמן באמצעות עלילת הנקודה. D + E) עקומת נציג פלואורסצנטי עוצמת cyclin B-SNAP עם חלון איזומורפית (שדה brigher בתרשים) בין NEBD (התמוטטות מעטפת גרעין) והכרומטין decondensation (פס כחול) שכנוצר ב-Microsoft Excel. Anaphase מצוין באמצעות tהוא נקודה כחולה על העקומה. לחץ כאן לצפייה בדמות גדולה.
סרט 1. לחץ כאן לצפייה בסרט משלים.
Discussion
אנו מציגים כאן גישה מבוססת הדמיה חייה תאים להקל ניטור סימולטני של proteolysis cyclin B ויישור כרומוזום. גישה זו מאפשרת לימוד שליטה בהמיטוטי מוטרדת אוכלוסיות תאים ברמת התא הבודדה. עקומות שפלת B cyclin להקל תובנה ישירות לפעילות של APC / C ובכך בעקיפין משקפות את המצב של 6 SAC.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו מודים לס טיילור למתן H2-GFP פלסמיד pLPCX-היסטון. אנו מודים לר 'Mertelsmann לתמיכה מתמשכת. עבודה זו נתמכה על ידי Forschungsgemeinschaft דויטשה.
Materials
| Name | Company | Catalog Number | Comments |
| שמו של מוצר | חברה | מספר קטלוגים | תגובות (אופציונלי) |
| שורת תאי כתב | נוצר בבית כמתואר 6 | שיבוט תאי כתב 11 (תאי cyclin U2Os מבוססי B-SNAP מבטאים) | |
| וקטור cyclin retroviral B-SNAP ביטוי | נוצר בבית כמתואר 6 | pLNCX2-cyclin B mut5-SNAP | |
| Phenolred ללא DMEM | Gibco | 21063-029 | תוספת של FCS, פירובט נתרן, פניצילין / strepto-mycin נדרשת |
| SNAP-Cell TMR-Star | ניו אינגלנד Biolabs | S9105S | 400 מיקרומטר פתרון לניירות הערך בDMSO |
| פלייט Opstics מיוחד, 96 גם | כוכב משנה | 3720 | |
| μ-Slide 8 היטב, ibiTreat | Ibidi | 80826 | |
| יחידה מיקרוסקופית | אולימפוס | IX-81 מיקרוסקופ הפוך עם תא האקלים | |
| מטרה | אולימפוס | 20x האובייקטיבי UPLSAPO (NA 0.75) | |
| תוכנת רכישה | אולימפוס | סריקת ^ R רכישת התוכנה (v.2.2.09) | |
| תוכנת ניתוח | אולימפוס | סריקת ^ R ניתוח התוכנה (v.1.2.0.6) |
References
- Musacchio, A., Salmon, E. D. The spindle-assembly checkpoint in space and time. Nat. Rev. Mol. Cell Biol. 8, 379-393 (2007).
- Nasmyth, K. Segregating sister genomes: the molecular biology of chromosome separation. Science. 297, 559-565 (2002).
- Cahill, D. P. Mutations of mitotic checkpoint genes in human cancers. Nature. 392, 300-303 (1998).
- Lengauer, C., Kinzler, K. W., Vogelstein, B. Genetic instabilities in human cancers. Nature. 396, 643-649 (1998).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-4892 (2010).
- Schnerch, D. Monitoring APC/C activity in the presence of chromosomal misalignment in unperturbed cell populations. Cell Cycle. 11, (2012).
- Keppler, A. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat. Biotechnol. 21, 86-869 (2003).
- Jansen, L. E., Black, B. E., Foltz, D. R., Cleveland, D. W. Propagation of centromeric chromatin requires exit from mitosis. J. Cell. Biol. 176, 795-805 (2007).
- Malureanu, L. Cdc20 hypomorphic mice fail to counteract de novo synthesis of cyclin B1 in mitosis. J. Cell Biol. 191, 313-329 (2010).
- Mena, A. L., Lam, E. W., Chatterjee, S. Sustained spindle-assembly checkpoint response requires de novo transcription and translation of cyclin B1. PLoS One. 5, (2010).
- Wolthuis, R. Cdc20 and Cks direct the spindle checkpoint-independent destruction of cyclin. A. Mol. Cell. 30, 290-302 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved