Method Article
设置简单的轻表为显微镜
摘要
本协议描述了一个光片显微镜的建立和实施对C的体内成像线虫胚胎。
摘要
快和低光毒性成像技术是先决条件,研究生物的全盘发展。轻质板材基于显微降低光漂白和比较,激光共聚焦显微镜光毒性作用,同时提供3D图像与亚细胞分辨率。这里我们提出了一种基于光片的显微镜,它是由一个直立显微镜和一小部分的光片的产生光电机械元件的安装。该协议描述了如何建立,对准显微镜表征光片。此外,它详细介绍了如何实现该方法在C的全盘成像线虫使用一个简单的观察室的胚胎。该方法允许的3D两色时间推移电影在几个小时内发展的捕获。这应该减轻细胞形态,细胞分裂和蛋白质标记在很长一段时间的跟踪。
引言
一个生物体的形成和塑造涉及细胞运动,细胞形态变化,细胞分裂和细胞分化。了解这些过程的进展和需要协调三个维度的能力和亚细胞分辨率快速成像工具。其中包括与这些体内成像能力的技巧,光板照明显微镜也被称为单/选择性平面照明显微镜具有生产低光毒性作用,低光漂白1,2的独特优势。
在片材的照明显微镜,将样品从侧面由一个光片,它执行光学切片照亮。照明路径和检测路径是彼此垂直和光片对齐到与检测物镜的物方焦平面重合。样品被放置在两条路径相交,一个ND可沿检测轴移动,让3D成像。感兴趣的唯一的平面被照亮,并在同一时间被检测到该平面的所有点。这显著增加了采集速度,并降低光致漂白和光毒性相比,共聚焦显微镜3。
实际上,板材照明显微镜是易于安装和对齐:对于二维成像,无扫描是必要的既不是为了检测部分,也没有照明部;作为与切片能力宽视场技术中,三维成像可以由平台保持的样品的单一轴的移动来获得。
在这里,我们在C的全盘成像提出一个简单的光薄片显微镜及其实施的设立为线虫胚胎。C.线虫的胚胎非常适合生活在体内 IMA更改,由于其透明度,不变的血统和千篇一律的细胞定位4,5。所开发的光片的设置是基于一个标准的直立显微镜的检测。下面介绍的协议详细介绍了如何构建和调整激励模块/路径,测试及表征光片和安装样品三维成像。它还提供了对表达荧光标记不同菌株的设置收购时间推移电影的例子。
研究方案
1,设置了光板和检测路径
图1给出了光学装置的总体方案。
- 放置和固定在光学平台上的显微镜和激光。
- 结合激光器488纳米,561纳米和405纳米与相应的分色镜。经过分色镜,激光器,必须精确地共同对准。注意,激光波长的光,分色镜和光学滤波器的选择是由实验中所用的特定荧光标记物的吸收光谱确定的。
- 放置在声光可调谐滤波器(AOTF)。使用供应商提供的测试板来调整AOTF的频率和功率。当井对齐的,约90%的激光功率是在最大调谐如由功率计测量发射。请注意,某些激光器可以完全由软件控制,从而可以使AOTF不必要的。
- 放置和固定望远镜。注意,该望远镜是由两个镜头,扩大光束到等于或大于所述照明物镜的后孔的直径的宽度。具有最小焦距的镜头应该是第一位的。
- 这里,对准并固定潜望镜使向上的光路更靠近圆柱形透镜的后孔。注意,潜望镜的两个反射镜被安装的方式,其长轴是铺设在所述反射镜的倾角,以反映该完全展开的光束。
- 将旁边的潜望镜退出柱面透镜。注意,该柱面透镜将光束聚焦在一个方向上并使其准直,在另一个方向上,从而形成一个光片。
- 通过使用照明物镜重新聚焦所产生的光片。注意,照明目标的图像聚焦点应与上述被检测的对象的焦点重合。投射的光束,一个画面(如墙壁)在长距离上。将照明目标沿着照明光束轴,以获取有关光片的画面锐利的轮廓。
- 将四线(405/488/561/638)发射滤光片在显微镜(立方体)保留的地方。
- 将EMCCD相机在显微镜输出端口。
- 通过在钻孔中的显微镜载物台螺丝固定在显微镜载物台的第一本手册翻译阶段。注意,平移台的边缘具有定位于约2厘米的距离显微镜载物台的中央,从而使试管居中低于检测物镜。
- 固定在第一个,第二手动平移台。两个阶段的方向必须垂直(X和Y的翻译)。
- 修正了在Z压电阶段前两个阶段的顶部。注意,电动载物台可以用来代替压电阶段。
- 修复比色皿HOLDER( 见图2),在各阶段的顶部。反应杯将因此被放置在照明路径的交叉点和检测路径,它们是相互垂直的。
2,检查灯板
- 填充的玻璃比色皿用荧光溶液,并将其放置在样品架在两个光路的交叉点。光片因此可见。它必须是水平的,并且对称/中心相对于所述检测物镜。
- 取出圆柱形透镜和获取图像来测量光片的厚度。注意,光片的厚度取决于照明物镜(约3-4微米NA = 0.3)的数值孔径(NA)。注意,对于一个给定的透镜,该光板的厚度可以增加,减少有狭缝进入后孔的光束的大小。需要注意的是荧光微球可用于测量斧显微镜的IAL和横向分辨率。
- 放回柱面透镜在实验开始之前。
3,C的安装线虫胚胎
下面的步骤被描绘于图3。
- 使用钻石标记笔切了一块10×20×1mm的载玻片。
- 制备5%的细菌用琼脂在水中煮沸,并在加热块维持在60℃。
- 加50微升的上述切片载玻片的一侧聚-L-赖氨酸,晾干。
- 放置在板凳上载玻片和修复它。
- 并列切一块滑板与固定滑动,并加入融化的琼脂顶部下降。使用另一个清洁的显微镜载玻片上,得到薄琼脂垫挤琼脂。
- 让琼脂垫,以消除顶部幻灯片之前干燥。
- 切在固定滑动侧面的琼脂垫,以留下过量的大约3毫米的Of琼脂和轻轻地取出固定滑动。
- 加入50微升的琼脂聚-L-赖氨酸,并让它完全干燥。
- 把妊娠蠕虫在M9培养基在手表玻璃。
- 切断蠕虫在用手术刀外阴的水平,以释放胚胎。
- 下一个双目确定胚胎在感兴趣的阶段,通过使用微细吸管收集它们。
- 将胚胎在涂有聚-L-赖氨酸是突出于切一块载玻片的琼脂的一部分。将胚胎仅次于幻灯片的边框。在琼脂的边界不定位胚胎,因为他们将没有足够的稳定。轻轻地取出的液体,以使胚胎会粘在聚-L-赖氨酸层上。
- 快速对齐胚胎,以避免干燥。
- 放置在塑料培养皿切割滑动,并轻轻加的M9培养基中以覆盖滑动。
- 检查下的蛋都还停留在琼脂双目。
C. 4。记录线虫发展
- 修正了先前的准备(切幻灯片,琼脂加胚胎)在样品架上,并把它放在一个杯中。 图4描述了自制的支架和图5显示了在观察范围内的比色皿的景色。
- 固定在压电阶段的反应杯。
- 确定与明视场照明胚胎的位置。
- 启动国产软件控制AOTF中,相机和压电阶段。请注意,一个免费的软件,如事无巨细,也可以使用。
- 选择激光线和电源(AOTF)。
- 使用3个方向舞台支撑圆柱透镜和照明透镜调节光片的位置。移动载物台沿横向方向(X),以获得最亮的信号。调节光片的再Z位置和纵向位置(Y),以获得第Ë最好的信噪比。注意,光片焦点的位置可能需要进行调整,从一个胚胎到另一个,以纠正光路长度的差异。
- 获取的时间推移的图像,选择曝光时间,增益,两个图像,以及将所获取的图像的数量,以及激光功率之间的时间。 2颜色获取,选择第二个激光线。两个彩色图像是连续获得的。
- 为了获得AZ堆栈,也可以选择和开始和结束的压电岗位的两片之间的距离。
结果
从三个不同C.三3D延时录制的实验线虫菌株示出的数据,可以使用上述的片光显微镜的设置获得的类型。我们检查了这些条件下,胚胎发育正常速度和生存的成像,与以前的报告表明SPIM成像造成三只光毒性低的水平相一致线虫胚胎6,7。
第一株表达融合到绿色荧光蛋白(zuIs178; stIs10024)的组蛋白。在2小时内进行与一叠20片(切片1微米之间的距离)取每37秒记录, 图6示出在不同时间点在堆栈中的一个平面上。这两个interphasic核(箭头)和浓缩的染色质丝分裂(箭头)都清晰可见。
第二应变表达融合到绿色荧光蛋白(ruIs57)微管蛋白和组蛋白融合到的mCherry(itIs37; stIs10226)。用一叠20片(切片1微米之间的距离)取每105秒时16分钟,进行记录, 图7示出了堆叠和不同的时间点的不同平面上。相关电影1显示三维重建在连续3个时间点。在除法中,有丝分裂纺锤体(绿色)和稠合的染色体(红色)是清楚可见的,允许细胞分裂取向的发展过程中的跟踪。
第三个菌株表达载脂蛋白VIT-2融合到绿色荧光蛋白(pwIs23)和绑定的mCherry(ltIs44)的膜。用一叠10片(切片1微米之间的距离)取每30秒在25分钟内进行记录, 图8示出了叠层和不同的时间点的不同平面上。卵黄脂蛋白颗粒(绿色)的细胞内的快速运动可以很容易地其次。
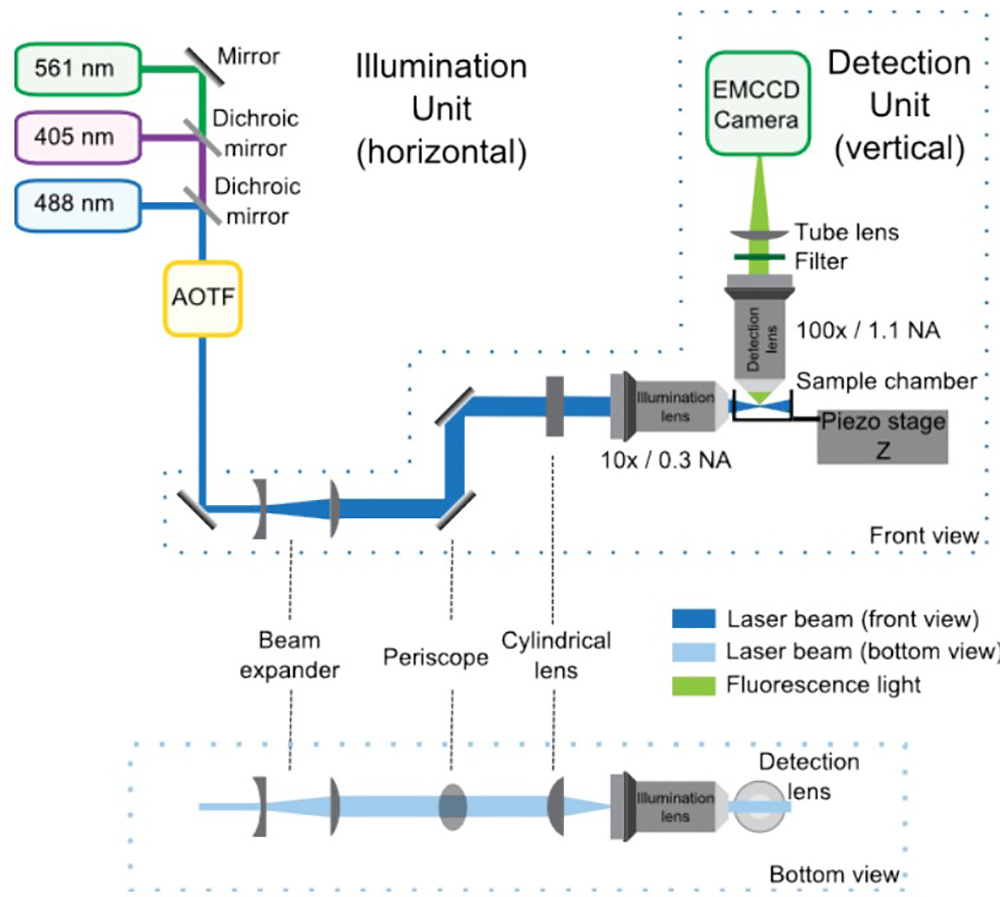
图1:SPIM光学装置的照明和检测单元,前视图和底视图组成 。在照明单元中,激光通过分色镜组合输入AOTF中,它控制每个激光器的功率独立。然后,该望远镜由4倍增加的光束的大小和潜望镜把它到显微镜的高度。柱面透镜构成的光片,它是由所述照明物镜重新聚焦。检测单元集成在直立显微镜和主要由检测透镜,过滤器,管透镜和EMCCD。样品被放置在照明和探测路径之间的交叉点。压电阶段允许样品垂直(Z轴)的位移三维采集。
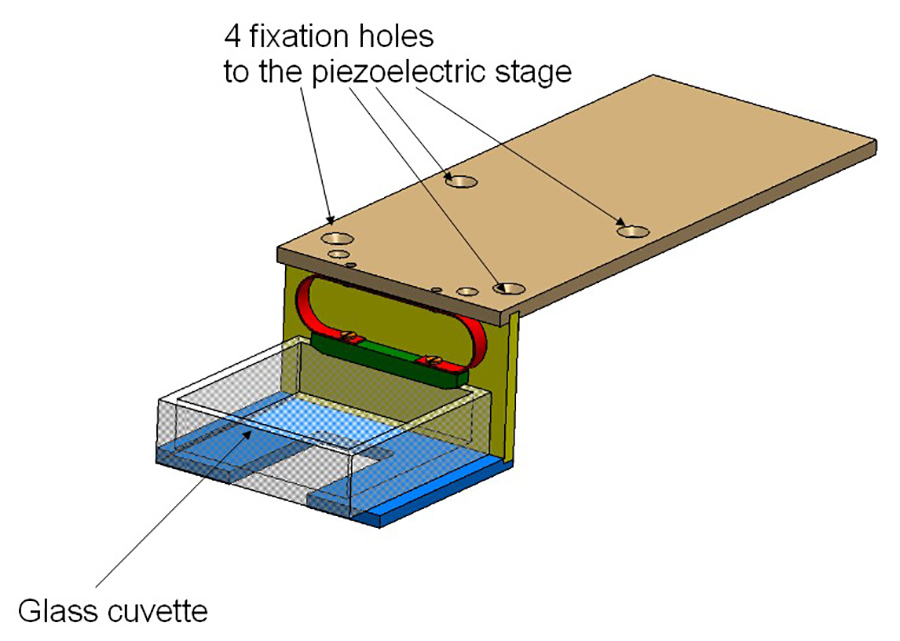
图2:试管支架夹持器由3个铝板和拧在该压电阶段。玻璃比色杯是由一个弹簧(红色)持有。
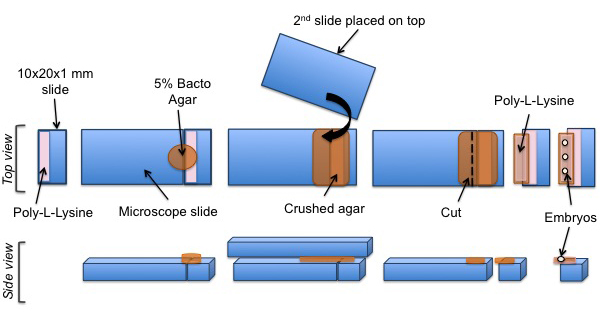
图3:C的安装协议线虫胚胎SPIM实验 。甲切一块玻璃上涂有聚-L-赖氨酸。琼脂的垫被定位在涂层表面。聚-L-赖氨酸,然后加入到琼脂板。最后,C。线虫胚胎在聚-L-赖氨酸包被的琼脂垫对齐。
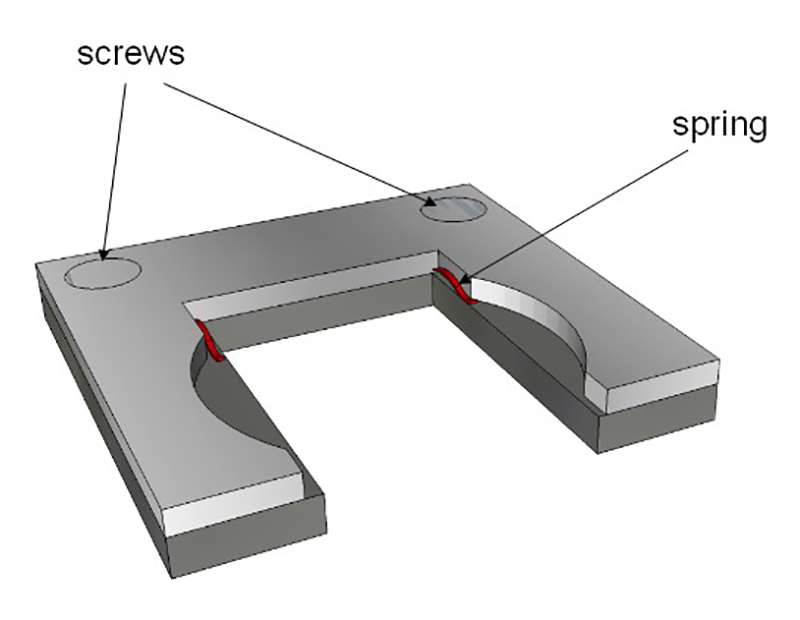
图4:样品架 。保持器装配到玻璃比色皿的内部尺寸。两个弹簧(红色)保持载玻片( 图3中描述)。这架然后把玻璃比色皿内。
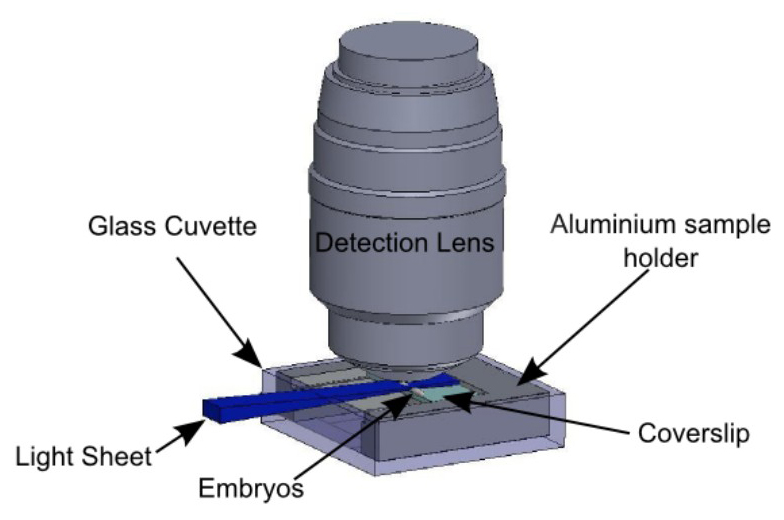
图5:。样品架在观察范围内胚是根据协议概括在图3中固定于载玻片上的滑动是通过图4中所描述的样品架保持的样品架被插入到玻璃比色皿,由图2中所描述的保持器保持。光片是水平的,我lluminates从侧面胚胎。检测物镜是垂直的,该样品的上方。
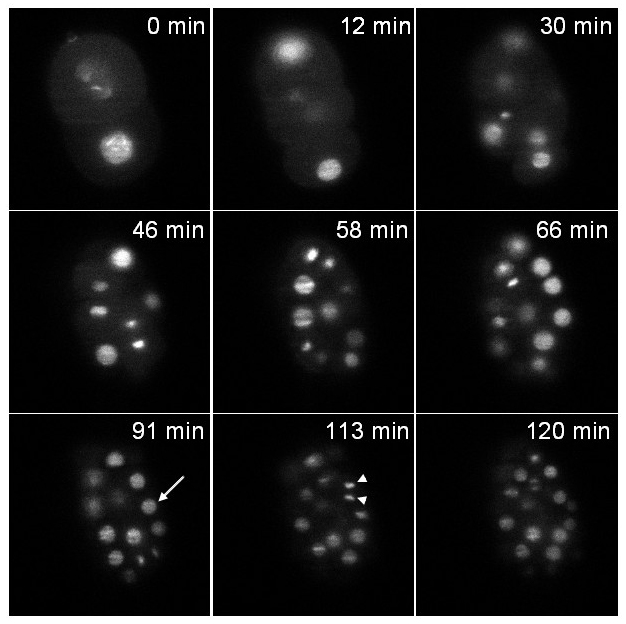
图6:记录一个C的线虫胚胎表达的组蛋白:: GFP融合转基因胚胎的单一平面影像表达一种组蛋白:: GFP融合(zuIs178; stIs10024)在不同时间点的影像从3D延时录制提取:。栈由20片(切片1微米之间的距离);每片曝光时间:30毫秒;堆栈之间的时间间隔:37秒;总采集时间:2小时。箭头:interphasic核,箭头:浓缩的有丝分裂染色质。在t = 0分钟的胚胎在2 - 细胞阶段和在t = 120分钟的胚胎含有约70细胞在正常发育S作为预期尿尿(注意,只包含在一个单一平面内的细胞是可见的图像,而不是胚胎的全部细胞)。照明的功率为30μW在488纳米(在照明目标的出口测量)。 请点击此处观看该视频。
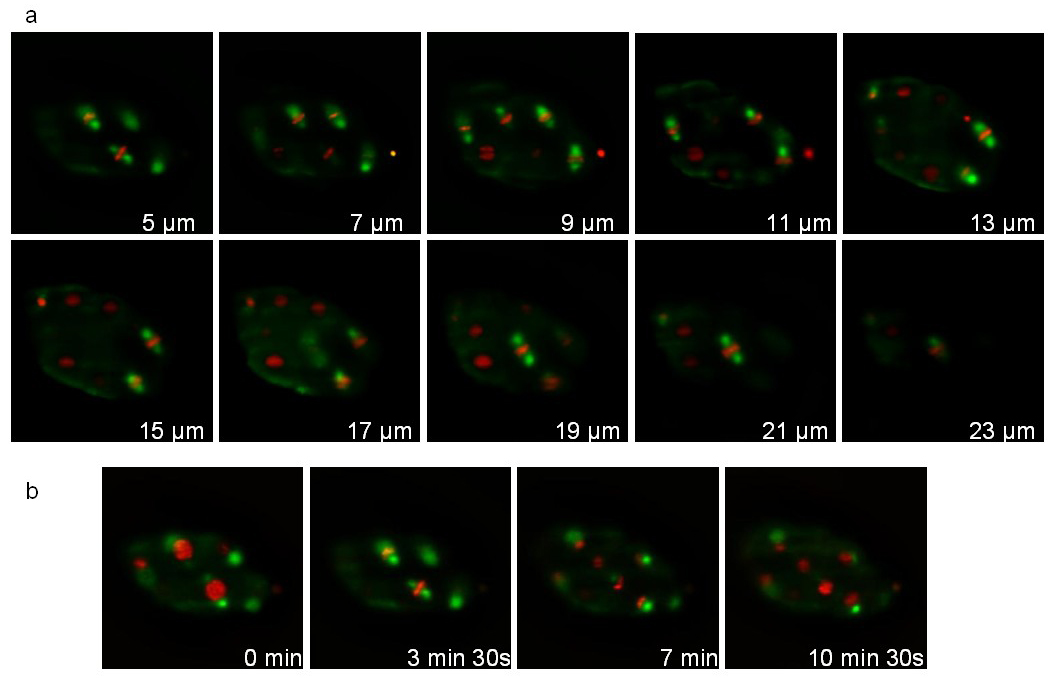
图7:记录一个C的线虫胚胎表达微管蛋白:: GFP融合和组蛋白:: mCherry的融合。从C的3D延时录制图像中提取线虫胚胎表达微管蛋白:: GFP融合(ruIs57)和组蛋白:: mCherry的融合(itIs37; stIs10226)。拍摄条件:收购一摞20片(1片之间的距离微米),每105秒;总采集时间:16分钟;曝光时间:200毫秒为每个通道。 面板显示10片相同的堆栈。 图 b显示了相同的片每210秒。照明的功率为30μW和300μW,为488和561 nm的激光器,分别为(在照明目标的出口测量)。 请点击此处观看该视频。
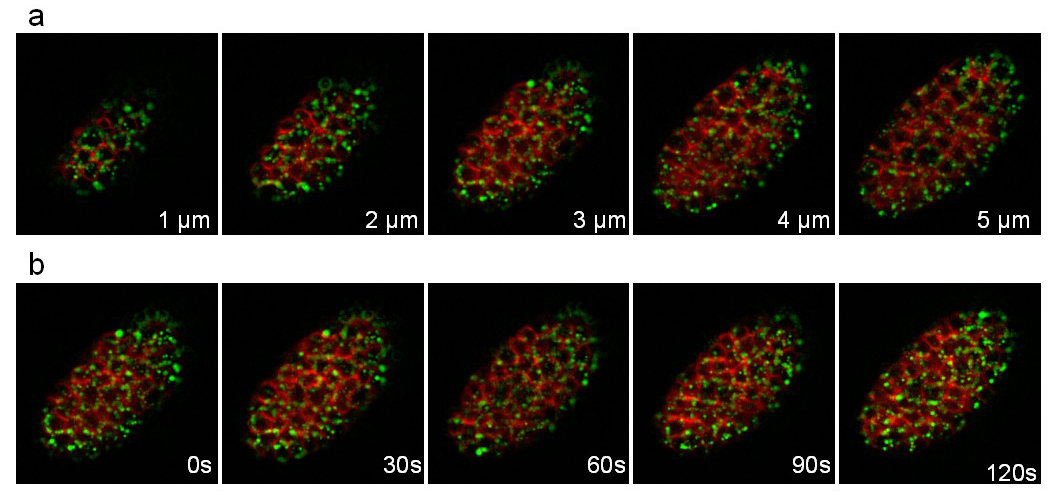
图8:记录一个C的线虫胚胎表达VIT-2 :: GFP融合和膜针对性的mCherry。图片从C的3D延时录制提取线虫胚胎表达VIT-2 :: GFP融合(PWIS23)和一个膜定位的mCherry(ltIs44)。拍摄条件:收购一摞10片(1片微米之间的距离),每30秒;总采集时间:25分钟;每个通道曝光时间:200毫秒。 面板显示了相同的堆栈的5第一片。 图 b显示了相同的切片每30秒。 请点击此处观看该视频。
讨论
本协议描述了一个简单的安装光片镜检为C的体内成像线虫胚胎。需要创建并对准光片,包括激光器,光束扩展器,准直和聚焦透镜的光学元件,可以很容易地安装在光具座上。在与一个堂堂正正的显微镜检测路径和摄像机组合,这提供了一个简单的解决方案来设置一个光片显微镜。
这种几何形状使得样品环境简单。的活体被放置在玻璃比色皿,其被保持,定位并通过一小部分的机械件移动。作为钢板照明显微镜是切片能力的宽视场技术,只有电动单轴运动所需的3D成像。这限制了同步的要求,以一个单一的扫描元件,便于软件的开发。相较于iSPIM 6我们直立GEOMETRY允许使用高NA物镜的进行检测。相比SPIM的设置,不同的物镜在水平面内样品的安装和一系列胚胎的成像更容易。总之,这一技术的实现是简单的并且可以与小的专门知识光学来实现。这是一个更便宜的替代的共焦显微镜具有更高的速度和降低光毒性,但较低的轴向分辨率的缺点的优点。
我们还开发了一个简单的和可重复的方法来安装C。线虫的胚胎在体内使用这个系统的成像。在安装过程是快速的(15分钟),并且是适合于日常的实验。对于C。线虫成像,这种简单的设置的优点是至少两个褶皱:(i) 于全盘成像是可能的,不旋转,因此三维重建是直接的; (ⅱ)样品的安装是容易的,多个胚胎可以顺序成像在同一张幻灯片。我们发现时间推移电影的例子有足够的时间分辨率来观察细胞分裂和细胞形态的变化。光薄片显微镜来研究下的权力线虫发展也已最近由其他人6,7,8所示,因此,这种技术将是非常有用的,研究C的形态发生和图案形成线虫胚胎。
可这个系统也可以用来分析其他模式生物的发展?认识到这一点很重要薄片照明显微镜的小型和透明生物体(如C)的实施线虫是比较大的生物体如果蝇胚胎不那么严格, 在果蝇的托托成像通常需要旋转和多视图重建9,10。激励从两侧用共线激发物镜也可以降低所造成的attenuat的阴影效果离子灯11。然而,这里介绍的设置仍然适用于果蝇胚胎的图像一侧,具有低白化,低光毒性。这种设置也可能是有用的图像和小的胚胎透明,如海鞘类动物或斑马鱼。
披露声明
作者什么都没有透露。
致谢
我们感谢Lenne的所有成员和Bertrand实验室,特别是奥利维尔相思的软件开发和热雷米Capoulade讨论。我们也感谢PICsL-IBDM成像设备,尤其是克劳德·莫雷蒂和布莱斯Detailleur技术支持。
这项工作是由ATIP补助金从国家科学研究中心(到P-FL和VB)的支持下,Labex INFORM补助(至P-FL和VB)和赠款赛诺菲 - 安万特公司(以VB)。我们承认由法新社国立德拉RECHERCHE支持法国 - 生物成像的基础设施(ANR-10-INSB-04-01,称之为"INVESTISSEMENTS德艾文莉")。
材料
| Name | Company | Catalog Number | Comments |
| SPIM | |||
| Detection | |||
| upright microscope | ZEISS | Axiophot 1 | |
| 100x W objective (NA 1.1, W.D. 2.5mm) | NIKON | ||
| EMCCD back illuminated | ANDOR | DU-885K-CS0-#VP | |
| Illumination | |||
| LASER 488 nm / 60 mW | TOPTICA | iBeam smart | |
| LASER 405 nm / 120 mW | TOPTICA | iBeam smart | |
| LASER 561 nm / 500 mW | COBOLT | JIVE 500 | for time lapse imaging, 50 or 100mW is enough |
| filter Quad line laser rejectionband ZET 405/488/561/638 | AHF | F57-405 | |
| Dichroic 405 | AHF | F38-405 | |
| Dichroic 488 | SEMROCK | Di01-R488 | |
| AOTF | AA | AOTFnC-400.650-TN | |
| mirror | |||
| lens 50 mm | THORLABS | telescope 5X | |
| lens 200 mm | THORLABS | telescope 5X | |
| periscope | THORLABS | RS99/M | |
| cylindrical lens f=100mm | THORLABS | ACY254-100-A | |
| 10X NA 0,3 | NIKON | ||
| xyz stage | NEWPORT | ||
| Sample | |||
| Bacto Agar | Bectkton Dickinson | 214010 | 5% in water |
| Poly-L-Lysine solution | Sigma | P8920 | |
| Capillaries GC100F-10, 1.0mm oD, 0,58mm ID, 100 mm L | Havard Appartus | 30-0019 | |
| Aspiration tube (mouth pipette) | Dutsher | 55005 | |
| M9 medium: | |||
| KH2PO4 (3g/L) | Any supplier | ||
| Na2HPO4 (6g/L) | Any supplier | ||
| NaCL (5g/L) | Any supplier | ||
| MgSO4 (1 mM final) | Any supplier | ||
| cuvette holder | HOME MADE | made by Brice Detailleur | |
| sample holder | HOME MADE | made by Claude Moretti | |
| x stage | NEWPORT | ||
| coverslip 50x20x1 mm | MARIENFELD | cut then in 10x20x1mm | |
| piezo electric stage with amplifier/controller | PI | P-622.ZCD / E-625.CR | |
| cuvette 40mmx40mmx10mm | HELLMA | 704.002-OG.40 mm- 10mm high | |
| Diamond Point Glass Marking Pencil | VWR | ||
| Software | |||
| C++ (Qt) home made software | developed by Olivier Blanc and Claire Chardès, available on request. Alternative solutions: micromanager or labview | ||
参考文献
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305, 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136, 1963-1975 (2009).
- Reynaud, E. G., Krzic, U., Greger, K., Stelzer, E. H. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. HFSP J. 2, 266-275 (2008).
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol. 100, 64-119 (1983).
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods Cell Biol. 106, 377-412 (2011).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 108, 17708-17713 (2011).
- Giurumescu, C. A., Kang, S., Planchon, T. A., Betzig, E., Bloomekatz, J., Yelon, D., Cosman, P., Chisholm, A. D. Quantitative semi-automated analysis of morphogenesis with single-cell resolution in complex embryos. Development. 139, 4271-4279 (2012).
- Gao, L., Shao, L., Higgins, C. D., Poulton, J. S., Peifer, M., Davidson, M. W., Wu, X. F. Noninvasive Imaging beyond the Diffraction Limit of 3D Dynamics in Thickly Fluorescent Specimens. Cell. 151, 1370-1385 (2012).
- Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., Hufnagel, L. Multiview light-sheet microscope for rapid in toto imaging. Nat Methods. 9, 730-733 (2012).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview light-sheet microscopy. Nat Methods. 9, 755-763 (2012).
- Huisken, J., Stainier, D. Y. Even fluorescence excitation by multidirectional selective plane illumination microscopy (mSPIM). Opt Lett. 32, 2608-2610 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。