Method Article
Настройка простого Light Лист микроскоп для
В этой статье
Резюме
Этот протокол описывает установку светового листа микроскопом и его реализацию для в естественных изображений C. Элеганс эмбрионов.
Аннотация
Быстрые и низкие фототоксические методы визуализации являются предпосылкой для изучения развития организмов в целом. Свет лист на основе микроскопии снижает фото-отбеливание и фототоксические эффекты по сравнению с конфокальной микроскопии, обеспечивая при этом 3D изображения с субклеточной резолюции. Здесь мы представляем установку светового листа на основе микроскопа, который состоит из прямой микроскоп и небольшим набором оптико-механических элементов для генерации светового листа. Протокол описывает, как построить, совместите микроскоп и характеризуют света лист. Кроме того, подробно описывается, как реализовать метод для в целом визуализации С. Элеганс эмбрионов с использованием простого наблюдения камеры. Метод позволяет захват 3D две цветов покадровой фильмов по несколько часов развития. Это должно облегчить отслеживание формы клеток, клеточных делений и меченных белков в течение длительных периодов времени.
Введение
Формирование и формирование организма включает в себя клеточные движения, изменения формы клеток, деление клеток и дифференцировку клеток. Понимание прогрессирование и координации этих процессов требуют быстрых инструментов образа с трех измерениях возможностей и субклеточном резолюции. Среди методов с этими в естественных условиях возможности визуализации, свет лист освещение микроскопия также называют одного / селективный самолет освещение микроскопия имеет уникальное преимущество получения низких-фототоксичной эффекты и низким фотообесцвечивания 1,2.
В листового освещения микроскопии, образец освещается со стороны световым листа, который выполняет оптического секционирования. Путь освещение и путь обнаружения перпендикулярны друг друга, и свет лист выровнен совпадает с объектной фокальной плоскости объектива обнаружения. Образец помещают на пересечении двух путей,й можно перемещать вдоль оси обнаружения, чтобы 3D визуализации. Только плоскость интерес горит и все точки этой плоскости обнаруживаются в то же время. Это значительно увеличивает скорость сбора и снижает фотообесцвечивания а также фототоксичность по сравнению с конфокальной микроскопии 3.
Практически, лист освещение микроскопии проста в настройке и выравнивания: для двумерной визуализации, сканирования не нужно ни для части обнаружения, ни для освещения части; как метод широким полем с возможностью секционирования, трехмерных изображений может быть получено одним движением оси стадии держа образец.
Здесь мы представляем создание простого света листового микроскопа и его реализации для в целом визуализации С. Элеганс эмбрионов. С. Элеганс эмбрионов хорошо подходят, чтобы жить в естественных условиях ИмаПеренять из-за их прозрачности, инвариант происхождение и стереотипные ячейку позиционирует 4,5. Разработанный свет установка лист на основе стандартного вертикального микроскопа для обнаружения. Протокол, представленные ниже подробно описывается, как построить и выровнять модуль / путь, испытание возбуждения и характеризуют света лист и установите образец для 3D визуализации. Он также приводит примеры покадровой фильмов, приобретенных с установкой на различных штаммов, выражающих флуоресцентных маркеров.
протокол
1. Настройка Light Лист и Путь обнаружения
Рисунок 1 дает общую схему оптического установки.
- Поместите и исправить микроскоп и лазеры на оптическом столе.
- Комбинат лазеры 488 нм, 561 нм и 405 нм с соответствующими дихроичных зеркал. После дихроичных зеркал, лазеры должны быть точно совмещены. Заметим, что выбор лазерных длин волн, дихроичных зеркал и оптических фильтров определяется из спектров поглощения конкретных флуоресцентных меток, используемых в экспериментах.
- Поместите фильтр перестраиваемый акустическую-оптических (AOTF). Используйте тестовый лист, предоставленную поставщиком для регулировки частоты и мощь AOTF. Когда хорошо выровнены, около 90% мощности лазерного излучения передается при максимальной настройке как измерено PowerMeter. Обратите внимание, что некоторые лазеры могут быть полностью контролируется программным обеспечением, которые могли бы сделать AOTF ненужным.
- Место и закрепитетелескоп. Следует отметить, что телескоп, состоящий из двух линз, которые расширяют луч шириной, равной или большей, чем диаметр задней апертуры освещения объектива. Объектив с наименьшим фокусным расстоянием должно стоять на первом.
- Место, выровнять и зафиксировать перископ принося вверх оптический путь ближе к задней апертуре цилиндрической линзы. Обратите внимание, что два зеркала из перископ установлены таким образом, что их длинная ось лежит на наклона зеркала для того, чтобы отразить полностью расширенную луч.
- Поместите цилиндрическую линзу рядом с перископа выхода. Следует отметить, что цилиндрическая линза фокусирует пучок в одном направлении и выходит она коллимированный в другом направлении, тем самым образуя легкую лист.
- Перефокусируйте образованную светло-лист с помощью подсветки линзы объектива. Заметим, что образ фокусом освещения цели должны совпадать с объекта координационного центра объектива обнаружения. Направляйте лучна экране (например, стены) на большом расстоянии. Перемещение подсветки цели вдоль оси пучка света, чтобы получить на экране четкие контуры светового листа.
- Поместите четырехъядерный линия (405/488/561/638) фильтров выбросов в соответствующие места в микроскоп (куб).
- Поместите EMCCD камеру на выходной порт микроскопа.
- Fix первый ручной этап перевода на столик микроскопа с помощью винтов в отверстия, просверленные в столик микроскопа. Следует отметить, что край этапе перевода должен быть расположен приблизительно в 2 см от центра столике микроскопа, так что кювета сосредоточена ниже обнаружения объектива.
- Закрепите второй ручной этап перевода на первой. Направления два этапа должны быть перпендикулярны (X и Y) переводы.
- Закрепите этап Z пьезоэлектрический в верхней части двух предыдущих этапов. Следует отметить, что моторизованный этап может быть использован вместо пьезоэлектрической стадии.
- Закрепите кюветы HoldeR (рис. 2) в верхней части этапов. Кювета, таким образом, быть размещены на пересечении пути освещения и пути обнаружения, которые перпендикулярны друг другу.
2. Проверка Light Лист
- Заполните стеклянную кювету с флуоресцентным решения, и разместить его на держатель образца на пересечении двух оптических путей. Свет лист, таким образом, видно. Он должен быть горизонтальным, и симметричный / по центру по отношению к обнаружения объектива.
- Извлеките цилиндрическую линзу и получить изображение, чтобы измерить толщину листа света. Следует отметить, что толщина листа света зависит от числовой апертуры (NA) осветительного объектива (примерно 3-4 мкм для NA = 0,3). Обратите внимание, что для данного объектива, толщина светового листа может быть увеличена за счет уменьшения размера пучка, поступающего в заднюю апертуру с разрезом. Обратите внимание, что флуоресцентные микросферы могут быть использованы для измерения топорриала и боковой Разрешение микроскопа.
- Установите на цилиндрическую линзу перед началом эксперимента.
3. Монтаж С. Элеганс Эмбрионы
Следующие шаги изображены на рисунке 3.
- Используйте ручку бриллиантами маркировки отрезать кусок предметного стекла 10 х 20 х 1 мм.
- Подготовьте 5% бактоагар в воде, варить его и поддерживать его в нагревательном блоке при 60 ° С
- Добавить 50 мкл поли-L-лизина на одной стороне разреза части слайда, дают ей высохнуть.
- Поставьте микроскопа на скамейке и исправить ее.
- Juxtapose отрезанный кусок слайда с фиксированной слайда и добавить каплю расплавленного агара на самом верху. Сожмите агар с использованием другой чистый микроскопа, чтобы получить тонкий агар площадку.
- Разрешить агар площадку высохнуть, прежде чем снимать верхнюю слайд.
- Разрежьте агар площадку на стороне фиксированной горкой для того, чтобы оставить избыток примерно 3 мм Øе агар и удалить мягко фиксированную слайд.
- Добавить 50 мкл поли-L-лизина на агар и дайте ему полностью высохнуть.
- Положите беременных червей в среде М9 в часовое стекло.
- Обрежьте червей на уровне вульвы скальпелем, чтобы освободить эмбрионов.
- Под бинокль определить эмбрионов на стадии интерес и собирать их с помощью микрокапиллярных пипетки.
- Поместите эмбрионов со стороны агара, покрытые поли-L-лизина, который выступает из разрезанной части слайда. Наведите эмбрионов в непосредственной близости от границы слайда. Не устанавливайте эмбрионов на границе агара, потому что они не будут достаточно стабильными. Удалить жидкость осторожно так, что эмбрионы будет прилипать на поли-L-лизина слоя.
- Быстро выровнять эмбрионов, чтобы избежать высыхания.
- Поместите сократить слайд в пластиковой чашке Петри и осторожно добавить среде М9, чтобы покрыть слайд.
- Проверьте под бинокль, что яйца все еще застряли на агар.
4. Запись C. Разработка Элеганс
- Fix предыдущую подготовку (выемка горка, агар плюс эмбрионов) в держатель образца и поместить его в кювете. Рисунок 4 описывает самодельный держатель и 5 показан вид на кювету в контексте наблюдения.
- Fix кювету на пьезоэлектрического этапе.
- Определить положение эмбрионов с ярким поля освещения.
- Запустите самодельное программное обеспечение, управляющий AOTF, камеру и пьезоэлектрический этап. Обратите внимание, что бесплатное программное обеспечение, например, микроменеджер, также может быть использован.
- Выберите лазерной линии и мощности (AOTF).
- Отрегулируйте положение светового листа с помощью этап 3 направления поддержки цилиндрическую линзу и освещения объектив. Переместить сцену вдоль поперечного направления (X), чтобы получить самый яркий сигнал. Регулировка затем Z положение светового листа, и продольное положение (Y), чтобы получить тыс.э лучшее отношение сигнала к шуму. Следует отметить, что положение светового листа фокусе возможно, должны быть скорректированы с одного эмбриона к другому, чтобы исправить различия в легких длин путей.
- Для приобретения покадровой изображений выберите время экспозиции, получить, время между двумя изображениями, а также о количестве изображений, которые будут приобретены, и мощности лазера. Для 2 приобретении цвета, выбрать второй лазерный луч. Две цветные изображения приобретаются последовательно.
- Для приобретения аз стек, также выбрать расстояние между двумя ломтиками и начало и конец позиции пьезоэлектрических.
Результаты
Три 3D эксперименты покадровой записи с трех разных C. Элеганс штаммы иллюстрируют тип данных, которые можно получить при помощи светового микроскопа лист установку, описанную выше. Мы проверили, что в этих условиях эмбрионы развиваются в нормальном темпе и пережить изображений, в соответствии с более ранними сообщениями о том, что изображения SPIM вызывает только низкие уровни фототоксичности в С. Элеганс эмбрионов 6,7.
Первый штамм выражает гистонов, слитый с GFP (zuIs178; stIs10024). Запись проводили в течение 2 часов со стеком 20 ломтиков (расстояние между кусочками 1 мкм) каждые 37 сек. 6 иллюстрирует одну плоскость стека в различные моменты времени. Оба интерфазовыми ядер (стрелка) и сгущенное митотический хроматин (стрелы) четко видны.
Второй штамм выражает тубулина, слитый с GFP (ruIs57) и гистоновслит с mCherry (itIs37; stIs10226). Запись проводилась в течение 16 мин со стеком 20 ломтиков (расстояние между слоями 1 мкм), принятым каждый 105 сек. Рисунок 7 иллюстрирует различные самолеты стека и различные моменты времени. Соответствующий фильм 1 отображает 3D реконструкции на 3 последовательных временных точках. Во время деления, митотическое веретено (зеленый) и сокращенная хромосомы (красный) отчетливо видны позволяя отслеживать деление клетки ориентаций в процессе разработки.
Третий штамм выражает аполипопротеина ВИТ-2, слитый с GFP (pwIs23) и связанный с мембраной mCherry (ltIs44). Запись проводилась в течение 25 мин со стеком 10 ломтиков (расстояние между слоями 1 мкм), принятым каждые 30 сек. Рисунок 8 иллюстрирует различные самолеты стека и различные моменты времени. Быстрые движения частиц желток липопротеинов (зеленый) в клетках может быть легкопоследовало.
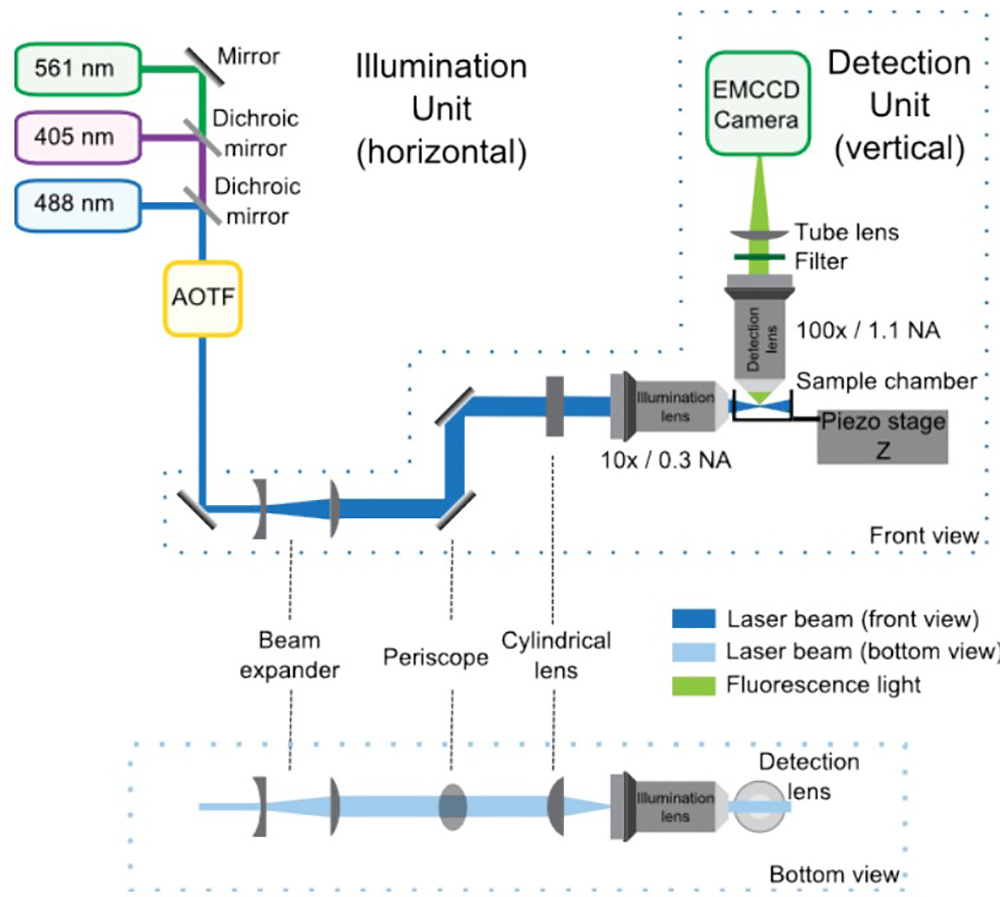
Рисунок 1: SPIM оптический установки состоит из освещения и обнаружения единиц, перед и донных видов. В осветительного блока, лазеры, объединенные дихроичных зеркал введите AOTF, которая контролирует власть каждого лазера самостоятельно. Затем телескоп увеличивает размер пучка по 4 раза и перископ доводит ее до высоты микроскопом. Цилиндрическая линза образует световой лист, который переориентирована на подсветки цели. Блок детектирования встроен в вертикального микроскопа и в основном состоит из линзы обнаружения, фильтра, трубки линзы и EMCCD. Образец расположены на пересечении между освещенности и обнаружения путей. Пьезоэлектрический этап позволяет вертикальные (Z) смещения образцадля 3D приобретения.
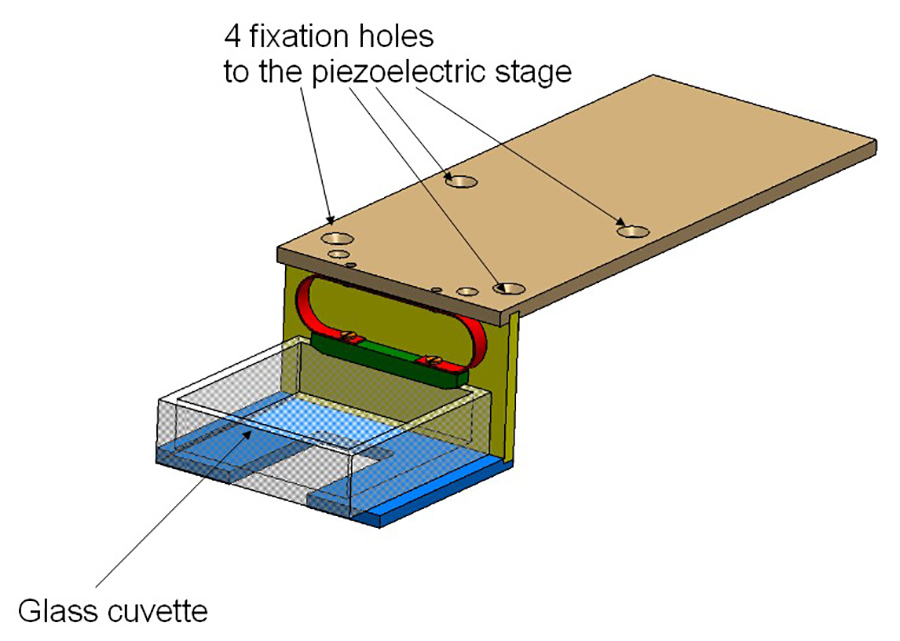
Рисунок 2:. Держатель кюветы держатель состоит из 3 алюминиевых пластин и ввинчивается в пьезоэлектрического стадии. Стеклянная кювета проводится с помощью пружины (в красном).
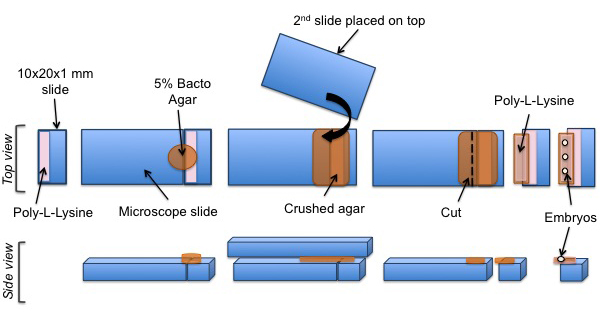
Рисунок 3: Монтаж протокол С. эмбрионы Элеганс для SPIM экспериментов. Вырезать кусок стекла покрывают поли-L-лизина. Колодки агара расположена на поверхности с покрытием. Поли-L-лизин Затем добавляют на агаровой панели. Наконец, С. Elegans эмбрионы были выровнены по поли-L-лизин покрытием агар площадку.
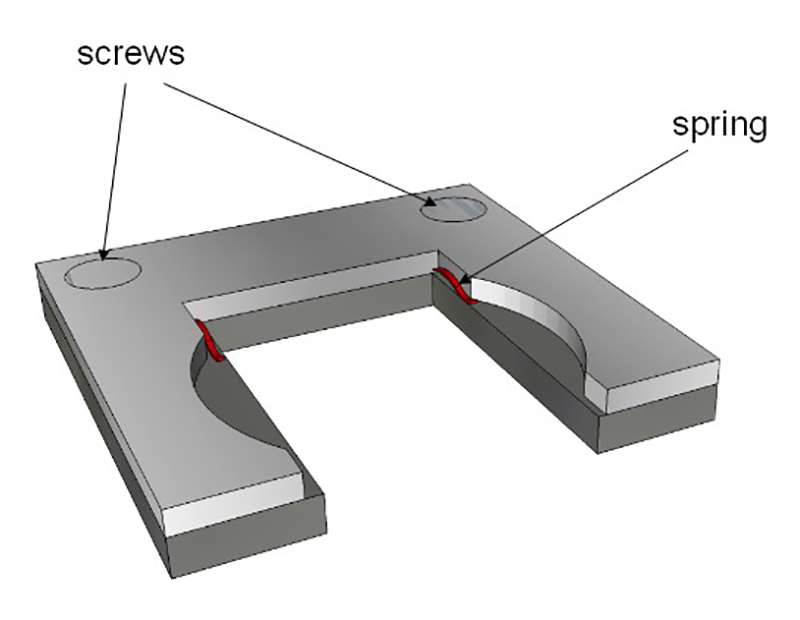
Рисунок 4: Держатель образца. Держатель подходит к внутренним размерам стекла кюветы. Два пружины (в красном) провести предметное стекло (описанный на рисунке 3). Этот держатель Затем положить внутрь стеклянной кювете.
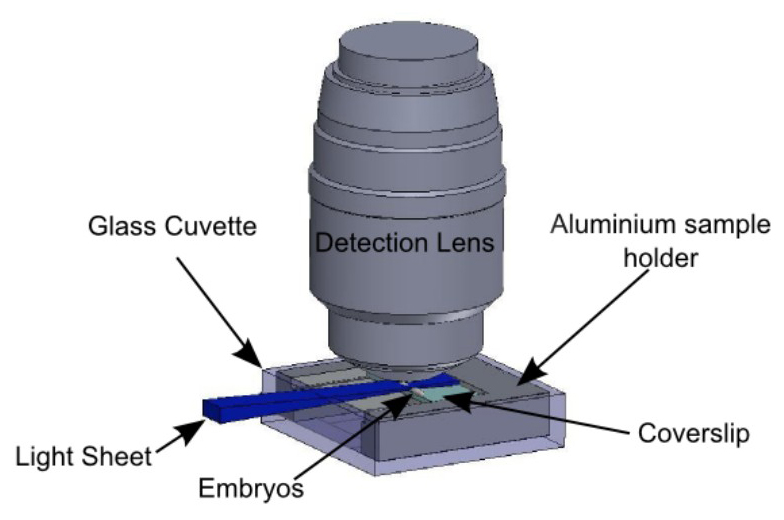
Рисунок 5:... Держатель образца в контексте наблюдения Эмбрионы иммобилизуют на предметное стекло в соответствии с протоколом подведены на рисунке 3 слайд удерживается держателем образца, описанного на рисунке 4 Держатель образца вставляется в стеклянную кювету, удерживается держателем, описанным на фиг.2. свет лист горизонтально и яlluminates эмбрионов со стороны. Обнаружение объектив расположен вертикально, над образцом.
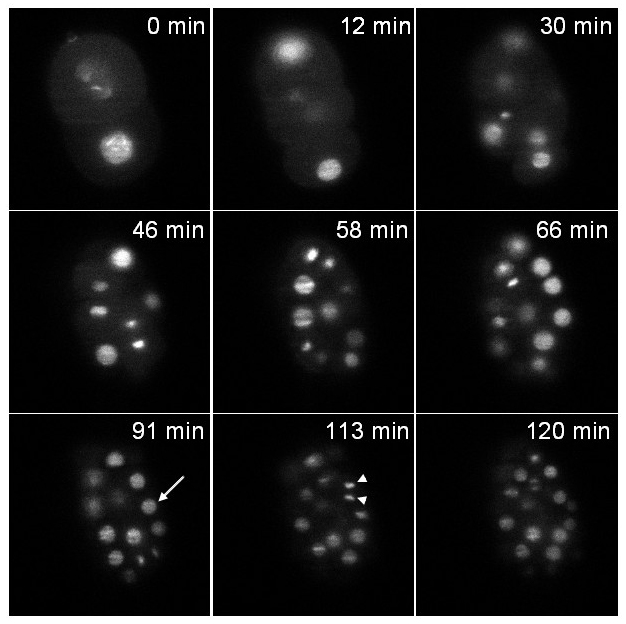
Рисунок 6: Запись из С. Элеганс эмбрионов выражения гистонов :: GFP слияние одной плоскости изображения трансгенного эмбриона выражения гистонов :: GFP фьюжн (zuIs178; stIs10024) в различные моменты времени изображения, извлеченные из 3D-покадровой записи:.. стеки из 20 кусочков ( Расстояние между кусочками 1 мкм); время экспозиции за часть: 30 мс; интервал времени между стеками: 37 сек; Общее время приема: 2 часа. Стрелка: интерфазовыми ядро, стрелы: сгущенное митотический хроматин. При Т = 0 мин эмбрион на стадии 2-клеток и при Т = 120 мин эмбрион содержит около 70 клеток, как ожидалось при нормальных с развитиеммочился (обратите внимание, что только клетки, содержащиеся в одной плоскости могут видеть на фотографиях, и не все клетки эмбриона). Власть освещения было 30 мкВт при 488 нм (измеряется на выходе из освещения цели). Пожалуйста, нажмите здесь, чтобы посмотреть это видео.
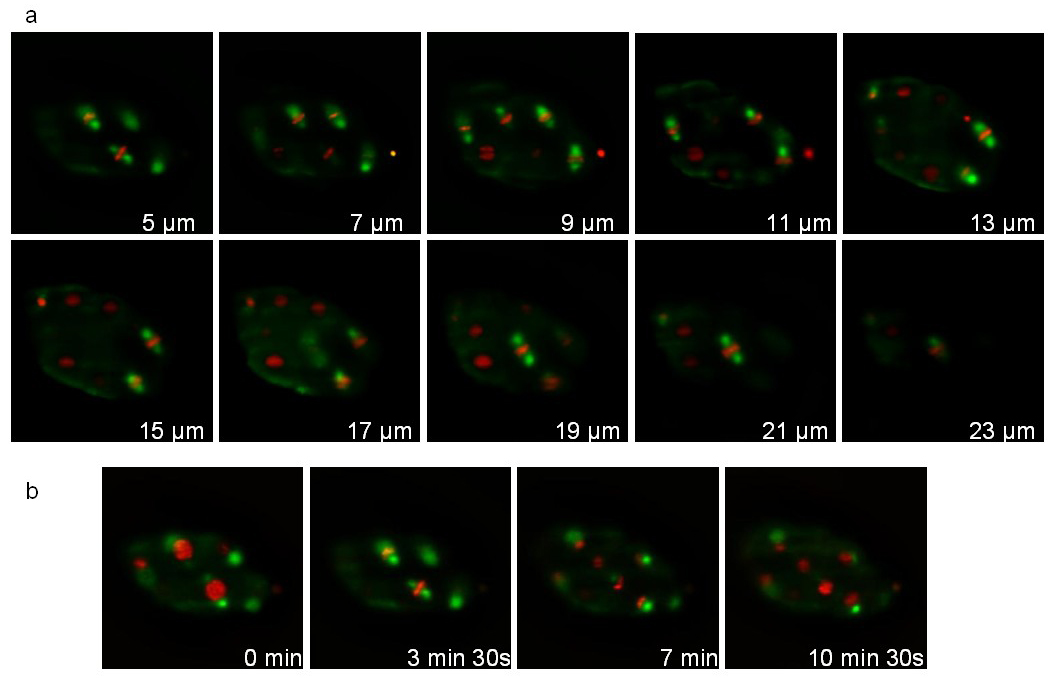
Рисунок 7: Запись из С. Элеганс эмбрионов выражения ТУБУЛИН :: GFP слияния и гистонов :: mCherry фьюжн. изображения, извлеченные из 3D-покадровой записи о С. Элеганс эмбрионов выражения ТУБУЛИН :: GFP слияние (ruIs57) и гистона :: mCherry фьюжн (itIs37; stIs10226). Условия съемки: приобретение стопку 20 ломтиков (расстояние между ломтиками 1мкм) каждый 105 сек; общее время приобретения: 16 мин; Время экспозиции: 200 мс для каждого канала. Панель показывает 10 ломтиков одном стеке. Панель б показывает тот же слайс каждый 210 сек. Власть освещения было 30 мкВт и 300 мкВт, для 488 и 561 нм лазеров, соответственно (измеренных на выходе из освещения цели). Пожалуйста, нажмите здесь, чтобы посмотреть это видео.
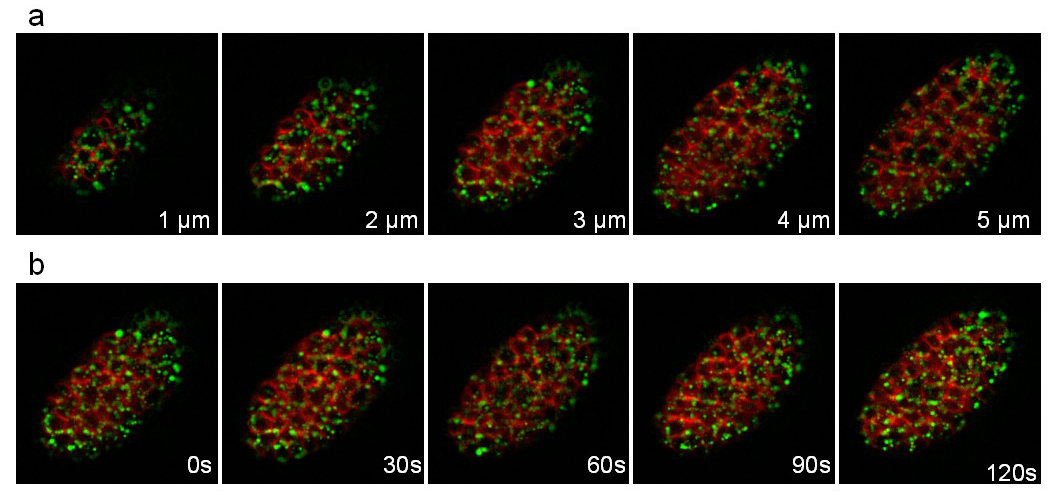
Рисунок 8: Запись из С. Элеганс эмбрионов выражения ВИТ-2 :: GFP слияния и мембрану, ориентированные mCherry. изображения, извлеченные из 3D-покадровой записи о С. Элеганс эмбрионов выражения ВИТ-2 :: GFP слияние (ИЭСs23) и мембрану, ориентированные mCherry (ltIs44). Запись условия: приобретение стопку 10 ломтиков (расстояние между слоями 1 мкм) каждые 30 сек; общее время приобретения: 25 мин; время экспозиции на канал: 200 мс. Панель показывает первые 5 ломтиков одном стеке. Панель б показывает тот же слайс каждый 30сек. Пожалуйста, нажмите здесь, чтобы посмотреть это видео.
Обсуждение
Этот протокол описывает простую настройку света листового микроскопии для в естественных изображений C. Элеганс эмбрионов. Оптические элементы, необходимые для создания и выравнивания светового лист, в том числе лазеров, расширителя пучка, коллимации и фокусирующих линз, может быть легко установлен на оптической скамье. В сочетании с прямой микроскоп для пути обнаружения и камерой, это обеспечивает простое решение для установки света лист микроскопа.
Эта геометрия делает среду образец просто. Живой образец помещают в стеклянную кювету, которая проводится, расположенным и переехал небольшим набором механических частей. Как лист освещение микроскопия широкий методика поле с возможностью секционирования, только один ось моторизованный движение, необходимое для 3D изображений. Это ограничивает требование синхронизации к одному сканирующего элемента и способствует разработке программного обеспечения. По сравнению с ISPIM 6 прямохождение геометрическимры позволяет использовать высокое NA объектива для обнаружения. По сравнению с SPIM установок с объективов в горизонтальной плоскости монтаж образца и изображений из серии эмбрионов легче. В целом, реализация этой техники прост и может быть достигнуто с небольшим опытом работы в оптике. Это более дешевая альтернатива конфокальной микроскопов с преимуществами более высокой скорости и уменьшения фототоксичности но недостатком более низким разрешением осевой.
Мы также разработали простой и воспроизводимый способ монтирования C. эмбрионы Элеганс для естественных изображений с использованием этой системы. Процедура монтажа быстро (15 мин) и подходит для повседневной экспериментов. Для С. томография Элеганс, преимущества этой простой установки как минимум два-складки: (я) в области обработки изображений Тото можно без вращения и, следовательно, 3D-реконструкция проста; (II) образец монтаж легко и множественные эмбрионы могут быть последовательно отображенына том же слайде. Мы показали примеры покадровой фильмов с достаточной временным разрешением для наблюдения деления клеток и изменения формы клеток. Власть света листового микроскопии для изучения C. разработка Элеганс также был недавно показано другими 6, 7, 8. Таким образом, этот метод будет очень полезно для изучения морфогенеза и паттерна С. Элеганс эмбрионов.
Может эта система также может быть использован для анализа развития других модельных организмов? Важно признать, что реализация листового освещения микроскопии для малого и прозрачной организма, таких как C. Элеганс является менее строгим, чем для более крупных организмов, таких как эмбрионов дрозофилы. в целом визуализации дрозофилы обычно требуется вращение и с несколькими представлениями реконструкции 9, 10. Возбуждение с двух сторон с коллинеарных объективных возбуждения линз также может снижение теневые эффекты, вызванные ослабляетсяион света 11. Тем не менее, установка, представленные здесь, все еще приспособлены к одной стороне изображение эмбрионов Drosophila, с низкой отбеливания и низкой photoxicity. Эта установка также может быть полезно изображения малого и прозрачных эмбрионах, таких как асцидий или рыбок данио.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим всех членов Lenne и Бертран лаборатории, в частности Оливье Блан для разработки программного обеспечения и Жереми Capoulade для обсуждения. Мы также благодарим изображений объекта PICsL-IBDM, в частности Клод Моретти и Brice Detailleur за технической поддержкой.
Эта работа была поддержана ATIP грантов от CNRS (до П.-ФЗ и VB), Labex ИНФОРМ грант (П.-ФЗ и VB) и гранта от Sanofi-Aventis (в VB). Мы признаем, Франция-Bioimaging инфраструктуры, поддерживаемый Национальным агентством де-ла-Recherche (ANR-10-INSB-04-01, называют «Investissements d'Avenir").
Материалы
| Name | Company | Catalog Number | Comments |
| SPIM | |||
| Detection | |||
| upright microscope | ZEISS | Axiophot 1 | |
| 100x W objective (NA 1.1, W.D. 2.5mm) | NIKON | ||
| EMCCD back illuminated | ANDOR | DU-885K-CS0-#VP | |
| Illumination | |||
| LASER 488 nm / 60 mW | TOPTICA | iBeam smart | |
| LASER 405 nm / 120 mW | TOPTICA | iBeam smart | |
| LASER 561 nm / 500 mW | COBOLT | JIVE 500 | for time lapse imaging, 50 or 100mW is enough |
| filter Quad line laser rejectionband ZET 405/488/561/638 | AHF | F57-405 | |
| Dichroic 405 | AHF | F38-405 | |
| Dichroic 488 | SEMROCK | Di01-R488 | |
| AOTF | AA | AOTFnC-400.650-TN | |
| mirror | |||
| lens 50 mm | THORLABS | telescope 5X | |
| lens 200 mm | THORLABS | telescope 5X | |
| periscope | THORLABS | RS99/M | |
| cylindrical lens f=100mm | THORLABS | ACY254-100-A | |
| 10X NA 0,3 | NIKON | ||
| xyz stage | NEWPORT | ||
| Sample | |||
| Bacto Agar | Bectkton Dickinson | 214010 | 5% in water |
| Poly-L-Lysine solution | Sigma | P8920 | |
| Capillaries GC100F-10, 1.0mm oD, 0,58mm ID, 100 mm L | Havard Appartus | 30-0019 | |
| Aspiration tube (mouth pipette) | Dutsher | 55005 | |
| M9 medium: | |||
| KH2PO4 (3g/L) | Any supplier | ||
| Na2HPO4 (6g/L) | Any supplier | ||
| NaCL (5g/L) | Any supplier | ||
| MgSO4 (1 mM final) | Any supplier | ||
| cuvette holder | HOME MADE | made by Brice Detailleur | |
| sample holder | HOME MADE | made by Claude Moretti | |
| x stage | NEWPORT | ||
| coverslip 50x20x1 mm | MARIENFELD | cut then in 10x20x1mm | |
| piezo electric stage with amplifier/controller | PI | P-622.ZCD / E-625.CR | |
| cuvette 40mmx40mmx10mm | HELLMA | 704.002-OG.40 mm- 10mm high | |
| Diamond Point Glass Marking Pencil | VWR | ||
| Software | |||
| C++ (Qt) home made software | developed by Olivier Blanc and Claire Chardès, available on request. Alternative solutions: micromanager or labview | ||
Ссылки
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305, 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136, 1963-1975 (2009).
- Reynaud, E. G., Krzic, U., Greger, K., Stelzer, E. H. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. HFSP J. 2, 266-275 (2008).
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol. 100, 64-119 (1983).
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods Cell Biol. 106, 377-412 (2011).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 108, 17708-17713 (2011).
- Giurumescu, C. A., Kang, S., Planchon, T. A., Betzig, E., Bloomekatz, J., Yelon, D., Cosman, P., Chisholm, A. D. Quantitative semi-automated analysis of morphogenesis with single-cell resolution in complex embryos. Development. 139, 4271-4279 (2012).
- Gao, L., Shao, L., Higgins, C. D., Poulton, J. S., Peifer, M., Davidson, M. W., Wu, X. F. Noninvasive Imaging beyond the Diffraction Limit of 3D Dynamics in Thickly Fluorescent Specimens. Cell. 151, 1370-1385 (2012).
- Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., Hufnagel, L. Multiview light-sheet microscope for rapid in toto imaging. Nat Methods. 9, 730-733 (2012).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview light-sheet microscopy. Nat Methods. 9, 755-763 (2012).
- Huisken, J., Stainier, D. Y. Even fluorescence excitation by multidirectional selective plane illumination microscopy (mSPIM). Opt Lett. 32, 2608-2610 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены