Method Article
Için bir Basit Işık Formu Mikroskop Kurma
Bu Makalede
Özet
Bu protokol, bir ışık mikroskobu tabaka setup ve C in vivo görüntüleme için uygulanmasını açıklamaktadır elegans embriyolar.
Özet
Hızlı ve düşük fototoksik görüntüleme teknikleri toto organizmaların gelişimini incelemek için ön koşul vardır. Subsellüler çözünürlükte 3D görüntüler sunarken, hafif levha bazında mikroskopisi, foto-ağartma ve konfokal mikroskopi göre fototoksik etkilerini azaltır. Burada dik bir mikroskop ve ışık tabakanın oluşturulması için opto-mekanik elemanlarının küçük bir set oluşan bir ışık mikroskobu bazlı tabaka, bir kurulum mevcut. Protokol, inşa mikroskop hizalayın ve ışık tabakası karakterize anlatılmaktadır. Buna ek olarak, C toto görüntüleme yöntemini uygulamak için nasıl ayrıntıları elegans basit bir gözlemi odacığı kullanılarak embriyolar. Yöntem geliştirme birkaç saatten fazla 3D iki-renk time-lapse film yakalama sağlar. Bu uzun süre üzerinde hücre şekli, hücre bölünmeleri ve etiketli proteinlerin izleme kolaylığı olmalıdır.
Giriş
Bir organizmanın oluşumu ve şekillendirme hücre hareketleri, hücre şekli değişiklikleri, hücre bölünmesi ve hücre farklılaşması içerir. Bu süreçlerin ilerlemesini ve koordinasyonunu Anlamak üç boyut özelliği ve subsellüler çözünürlüğü ile hızlı görüntüleme araçları gerektirir. Bu in vivo görüntüleme yetenekleri ile teknikler arasında, hafif levha aydınlatma mikroskobu da tek / seçici düzlem aydınlatma mikroskopisi adlandırılan düşük fototoksik etkilerini ve 1,2 düşük ışıkla üreten benzersiz bir avantaja sahiptir.
Tabaka aydınlatma mikroskopi, numune optik kesit yerine hafif bir levha ile taraftan aydınlatılır. Aydınlatma yolu ve algılama yol birbirine dik olan ve ışık tabaka algılama objektif lens nesne odak düzlemi denk hizalanır. Numune, iki yol kesiştiği yerleştirilen birnd 3D görüntü sağlamak için algılama ekseni boyunca hareket ettirilebilir. Ilgi sadece düzlemi aydınlatılır ve bu düzlemin tüm noktalar aynı anda tespit edilir. Bu durum elde etme hızını artırır ve konfokal mikroskopi 3 ile karşılaştırıldığında, photobleaching hem de fototoksisite azaltır.
Iki boyutlu görüntüleme için, herhangi bir tarama algılama kısmı için, ne de aydınlatma kısmı için ne gereklidir;: Pratik olarak, sac aydınlatma mikroskopisi kurulum ve uyum sağlamaya kolaydır yeteneği kesit ile bir geniş alan teknik olarak, üç boyutlu görüntü örnek tutma aşamasının, bir tek eksenli bir hareket ile elde edilebilir.
Burada C toto görüntüleme için basit bir ışık mikroskobu levha ve uygulama kurulmasını sunmak elegans embriyolar. C. elegans embriyolar de in vivo ima yaşamak için uygundurOnların şeffaflığı nedeniyle Ging, değişmeyen soy ve hücre basmakalıp, 4,5 konumlandırır. Geliştirilen ışık tabaka ayar tespit edilmesi için standart bir dik bir mikroskop dayanmaktadır. Aşağıda sunulan protokol oluşturmak ve hizaya uyarma modülü / yolunu, testi ve ışık tabakası karakterize ve 3D görüntüleme için örnek monte etmek nasıl ayrıntıları. Ayrıca floresan belirteçlerin ifade çeşitli cinsler üzerinde kurulum ile edinilen time-lapse film örnekleri sağlar.
Protokol
1.. Işık Sheet ve Algılama Yolu ayarlama
Şekil 1, bu optik kurulum genel bir şema sağlar.
- Optik masaya mikroskop ve lazerler yerleştirin ve sabitleyin.
- Lazerler 488 nm, 561 nm ve gelen dikroik aynalar ile 405 nm birleştirin. Dikroik aynalar sonra, lazerler tam işbirliği olmalıyız. Lazer dalga boyu, dikroik aynalar ve optik filtrelerin seçimi deneylerde kullanılan özel flüoresan etiket absorpsiyon spektrumları belirlenir unutmayın.
- Akustik-optik ayarlanabilir filtre (AOTF) yerleştirin. AOTF frekansını ve gücünü ayarlamak için tedarikçi tarafından sağlanan sınama sayfasını kullanın. Iyi hizalandığı zaman bir Güçmetrelerden ile ölçülen, lazer gücünün yaklaşık% 90 bir yüksek ayar iletilir. AOTF gereksiz hale olabilir, bazı lazerler tamamen yazılım tarafından kontrol edilebilir olduğunu unutmayın.
- Yerleştirin ve düzeltmekteleskop. Teleskop eşit veya aydınlatma objektif lens arka açıklığın çapından daha büyük bir genişliğe ışını genişletmek iki lens oluşmaktadır unutmayın. Küçük odak uzaklığına sahip objektifi ilk gelmelidir.
- Yer, uyum ve yakın silindirik lens arka diyafram yukarı optik yolunu getirerek periskop düzeltmek. Periskop iki ayna uzun ekseni tam olarak genişletilmiş ışınını yansıtmak için, aynanın eğimi üzerinde durur bir şekilde monte edilir unutmayın.
- Yanındaki periskop çıkmak için silindirik lens yerleştirin. Silindirik lens bir yöne ışın odaklanır ve böylece hafif bir levha oluşturulması, diğer yönde collimated bırakır unutmayın.
- Aydınlatma objektif lens kullanarak elde edilen ışık tabakası yönlendirmesi. Aydınlatma amacı görüntü odak noktası bulgulama hedefi nesne odak noktası ile aynı olmalıdır unutmayın. DemetiUzun bir mesafe bir ekranda (örneğin bir duvara). Işık tabakanın ekran keskin hatları üzerinde elde etmek için aydınlatma kiriş ekseni boyunca aydınlatma amacı taşıyın.
- Mikroskop (küp) olarak ayrılmış bir yerde dörtlü hattı (405/488/561/638) emisyon filtresi yerleştirin.
- Mikroskop çıkış limanında EMCCD kamerayı yerleştirin.
- Mikroskop aşamasında açılan deliklere vida ile mikroskop sahnede ilk manuel çeviri aşamasında düzeltmek. Çeviri aşamasının kenar küvet algılama objektif lens altında ortalanır ve böylece, uzağa mikroskop kademesinin merkezine yaklaşık 2 cm konumlandırılmasını sahip olduğuna dikkat edin.
- İlk birinde ikinci manuel çeviri aşamasında düzeltmek. Iki aşamadan yönleri (X ve Y çeviri) dik olması gerekir.
- Önceki iki aşamada üstündeki Z piezoelektrik sahne düzeltildi. Motorlu bir aşamada yerine piezoelektrik aşamasının kullanılabilir unutmayın.
- Küveti holde Fixr aşamaları üstündeki (bkz. Şekil 2). Bu şekilde küvet aydınlatma yolu kesiştiği ve birbirine dik olan algılama yol, yerleştirilecektir.
2.. Light Sheet denetleme
- Floresan çözeltisi olan bir cam küvet doldurun ve iki optik yolları kesiştiği numune tutucuya yerleştirin. Işık levha böylece görünür. Bu yatay olmak zorundadır, ve simetrik / algılama objektif lens göre merkezlenmiştir.
- Silindirik lens çıkarın ve ışık tabakanın kalınlığını ölçmek için bir görseli kazanır. Işık tabakanın kalınlığı aydınlatma objektif lensi (NA için yaklaşık 3-4 um = 0.3) sayısal açıklık (NA) bağlı olduğunu not edin. Belirli bir lens için unutmayın, ışık-tabakasının kalınlığı bir yarık ile arka deliğe giren kirişin boyutunu azaltarak arttırılabilir. Flüoresan mikro balta ölçmek için kullanılabilir unutmayınmikroskobu ial ve yanal çözünürlük.
- Deneye başlamadan önce silindirik merceği geri koydu.
3.. C. montajı elegans Embriyolar
Aşağıdaki adımlar, Şekil 3'te resmedilmiştir.
- 10 x 20 x 1 mm bir cam slayt bir parça kesmek için bir elmas-işaretleme kalemi kullanın.
- % 5 Bacto-agar hazırlanması 60 ° C de su içinde, kaynatın ve bir ısıtıcı blok korumak
- Slaydın kesme parçasının bir tarafında, poli-L-lisin, 50 ul, bu kurutun.
- Bankta bir mikroskop lamı yerleştirin ve bunu düzeltmek.
- Sabit slayt ile sürgünün kesme parçası yan yana ve üst agar erimiş bir damla ekleyin. Bir ince agar ped almak için başka bir temiz bir mikroskop lamı kullanılarak agar sıkıştırın.
- Agar pad, üst kızağın çıkarmadan önce kurumasını bekleyin.
- , Yaklaşık 3 mm o fazlalığı bırakmak için sabit sürgünün yan tarafında bulunan agar ped Cutf agar ve yavaşça sabit slayt kaldırmak.
- Agarda poli-L-lisin 50 mcL ekleyin ve tamamen kurumasını bekleyin.
- Bir saat cam M9 ortamda gebe solucanlar koyun.
- Embriyoların serbest bırakmak için bir neşter ile vulva seviyesinde solucanlar kesin.
- Bir binoküler altında ilgi aşamada embriyoların belirlemek ve microcapillary pipet kullanarak bunları toplamak.
- Slaydın kesim parçasından çıkıntı yapan ve poli-L-lisin ile kaplanmış olan agar parçası embriyolar yerleştirin. Sadece yanında slayt sınırına embriyolar yerleştirin. Yeterince kararlı olmayacak çünkü ağar sınırında embriyoların pozisyon yok. Embriyolar, poli-L-lisin tabaka üzerinde kalacak şekilde yavaşça sıvıyı çıkarın.
- Çabuk kuruma önlemek için embriyolar hizalayın.
- Bir plastik Petri kabındaki kesim slayt yerleştirin ve yavaşça slayt kapsayacak M9 orta ekleyin.
- Yumurta hala agar üzerinde sıkışmış bir binoküler altında kontrol edin.
C. 4. Kayıt elegans Geliştirme
- , Numune tutucu içindeki, önceki hazırlama (kesme slayt, agar artı embriyo) saptamak ve bir küvet içine yerleştirin. Şekil 4, ev yapımı tutucusunu tarif etmektedir ve Şekil 5, gözlem bağlamında küvet bir görünüşünü göstermektedir.
- Piezoelektrik sahnede küvet düzeltmek.
- Parlak bir alan aydınlatma ile embriyoların konumunu belirlemek.
- AOTF, kamera ve piezoelektrik sahne kontrol ev yapımı yazılımını başlatın. Böyle micromanager gibi ücretsiz bir yazılım, de kullanılabilir unutmayın.
- Lazer hattı ve güç (AOTF) seçin.
- Silindirik lens ve aydınlatma merceği destekleyen 3 tarifi sahne kullanarak ışık tabakanın konumunu ayarlayın. En parlak sinyali elde etmek için yanal yön (X) boyunca sahne hareket ettirin. Th elde etmek için daha sonra ışık tabakanın Z konumu ve uzunlamasına konum (Y) ayarlayıngürültü oranı e iyi sinyal. Işık tabaka odak pozisyonu hafif yol uzunlukları farklılıkları düzeltmek için bir embriyo diğerine ayarlanması gerekebilir unutmayın.
- Zaman atlamalı görüntüler elde etmek için, iki görüntü, hem de elde edilecek görüntülerin sayısı ve lazer güç arasında zaman kazanmak, pozlama süresini seçin. 2 renk edinimi için, ikinci bir lazer satırı seçin. İki renkli görüntüler art arda elde edilir.
- Az yığınını kazanmak için, aynı zamanda, iki dilim arasındaki mesafeyi ve başlangıç ve piezoelektrik pozisyonları biten seçin.
Sonuçlar
Üç farklı C. Üç 3D time-lapse kayıt deneyleri elegans suşu, yukarıda tarif edilen levha ışık mikroskobu kurulumu kullanılarak elde edilebilir veri tipini göstermektedir. Biz, bu koşullar altında embriyoları SPIM görüntüleme C 'de sadece düşük seviyelerde fototoksisite neden olduğunu gösteren daha önceki raporlar ile uyumludur, normal hızda geliştirmek ve görüntüleme hayatta kontrol elegans 6,7 embriyolar.
İlk gerginlik GFP (; stIs10024 zuIs178) kaynaşmış bir histon ifade eder. Kayıt her 37 saniye alınan 20 dilim (dilim 1 um arasındaki mesafe) bir yığını ile 2 saat boyunca gerçekleştirildi. 6, farklı zaman noktalarında, yığının bir düzlemi Şekil göstermektedir. Hem interphasic çekirdekleri (ok) ve yoğunlaştırılmış mitotik kromatin (ok başı) açıkça görülebilir.
İkinci streyn GFP (ruIs57) kaynaşmış bir tübülin ve bir histon ekspresemCherry (; stIs10226 itIs37) kaynaşmış. Kayıt her 105 sn alınan 20 dilim (dilimler 1 mikron arasındaki mesafe) bir yığın ile 16 dakika boyunca yapıldı. 7. yığını ve farklı zaman noktalarında farklı düzlemleri göstermektedir Şekil. Ilişkili film 1 görüntüler 3 ardışık zaman noktalarında rekonstrüksiyon 3D. Bölünme sırasında, mitotik iğ (yeşil) ve yoğunlaştırıldı kromozomlar (kırmızı) açık bir şekilde gelişimi esnasında hücre bölünmesi yönelimlerin izleme sağlayan görebilir.
Üçüncü suşu GFP (pwIs23) kaynaştırılmış apolipoprotein VIT-2 ifade eden ve mCherry (ltIs44) bağlanmış bir zar. Kayıt her 30 sn alınan 10 dilim (dilimler 1 mikron arasındaki mesafe) bir yığın ile 25 dakika boyunca yapıldı. 8. yığını ve farklı zaman noktalarında farklı düzlemleri göstermektedir Şekil. Hücrelerin içinde sarısı lipoprotein partikülleri (yeşil) hızlı hareketleri kolaylıkla olabilirizledi.
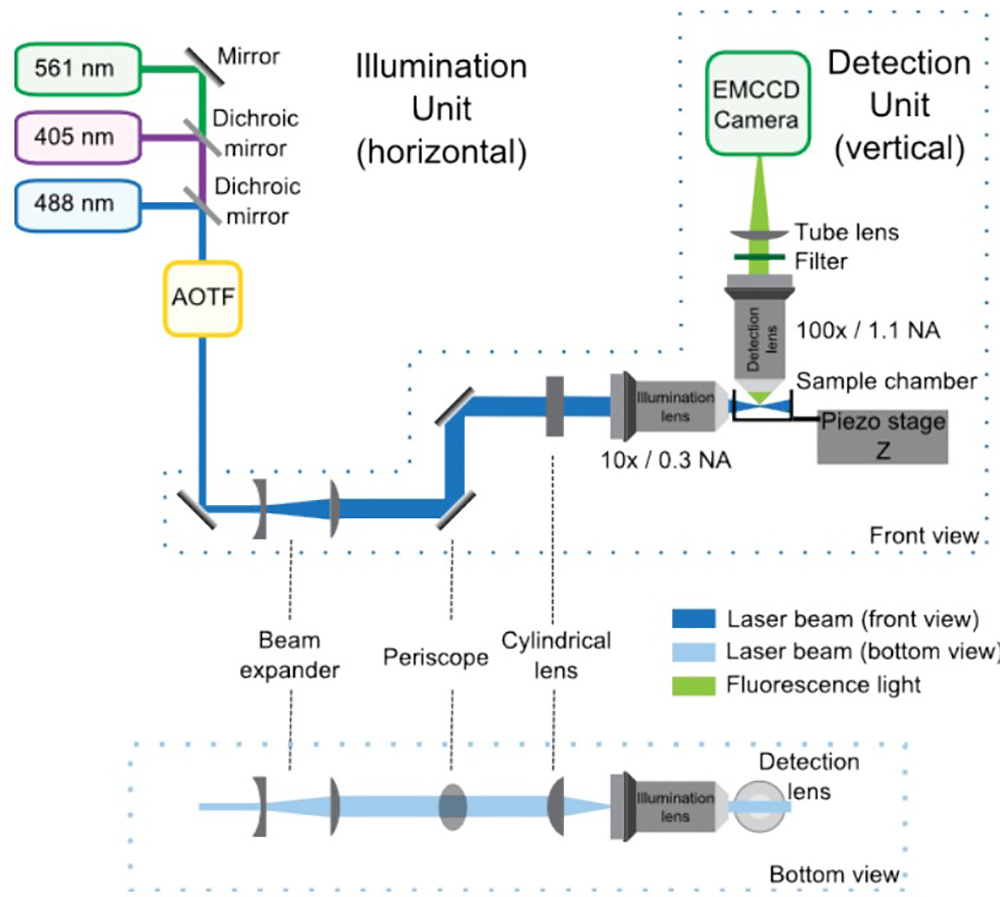
Şekil 1: aydınlatma ve algılama birimleri, ön ve alt görünümleri oluşan SPIM optik kurulum. Aydınlatma ünitesinde, dikroik aynalar ile kombine lazer bağımsız olarak her lazerin gücünü kontrol AOTF girin. Daha sonra, teleskop 4-kat kiriş boyutunu artırır ve periskop mikroskop yüksekliğine getirir. Silindirik lens aydınlatma amacı ile yeniden odaklanır ışık tabakası oluşturur. Deteksiyon ünitesi dik bir mikroskop entegre edilmiştir ve temel olarak algılama lens, filtre, tüp lens ve EMCCD tarafından oluşur. Numune, aydınlatma ve saptama yolları arasındaki kesişme konumlandırılır. Bir piezoelektrik aşama sağlar: numunenin dikey (Z) yer değiştirmeleri3D edinimi için.
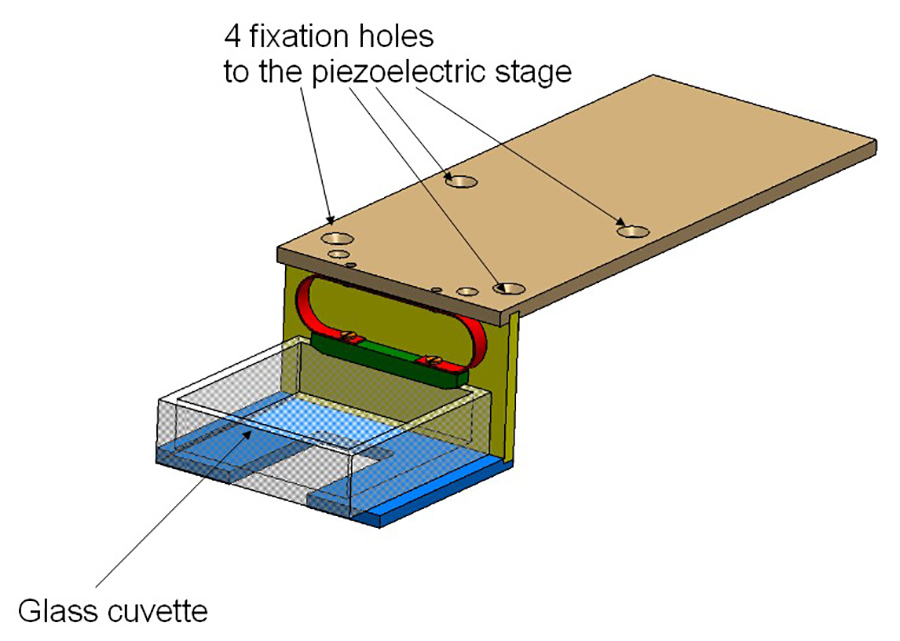
Şekil 2:. Küvet tutucu tutucu 3 alüminyum plakalar oluşur ve piezoelektrik sahnede vidalanır. Cam küvet (kırmızı) bir yay tarafından yapılır.
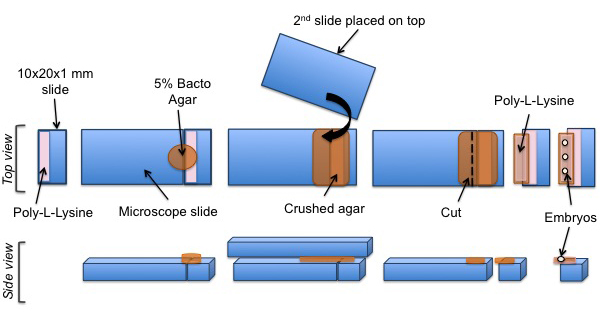
Şekil 3: C Montaj protokol SPIM deneyler için elegans embriyolar. Bir cam kesme parçası, poli-L-lisin ile kaplanmıştır. Agar bir ped kaplanmış yüzeyi üzerinde konumlandırılmıştır. Poli-L-lisin sonra agar ped üzerine ilave edilir. Son olarak, C. elegans embriyolar, poli-L-lizin kaplı agar pedi üzerinde hizalanır.
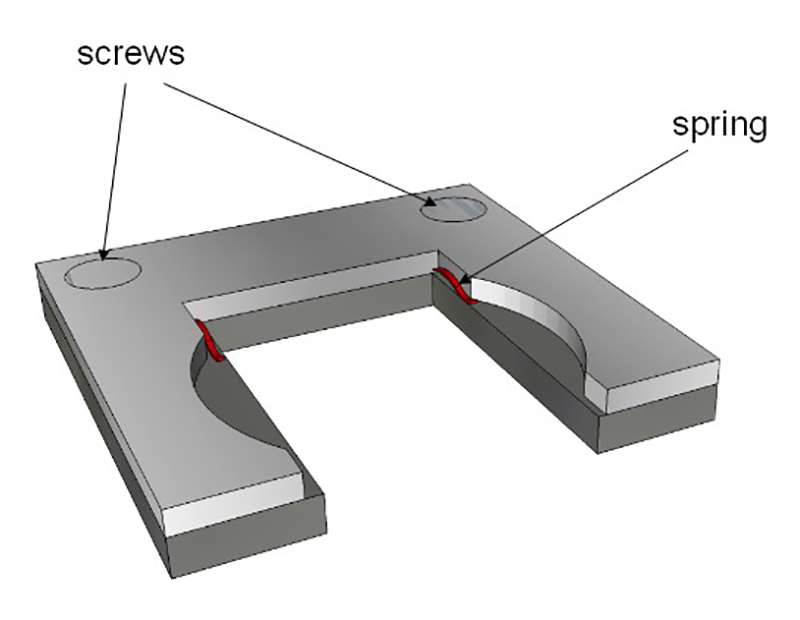
Şekil 4: Örnek yeri. Tutucu cam küvetinin iç boyutlarına uyar. (Kırmızı) iki yayları (Şekil 3 'de tarif edilen) cam slayt tutun. Bu tutucu sonra cam küvet içine konur.
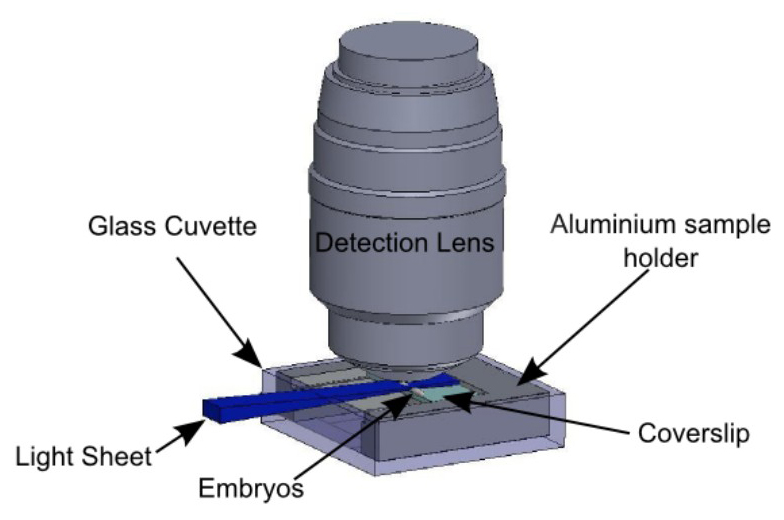
Şekil 5:... Numune tutucu gözlem bağlamında Embriyolar protokol, Şekil 3'te özetlenebilir göre olan cam kesit üzerinde immobilize edilmektedir slayt, Şekil 4 'de tarif edilen numune tutucu tarafından tutulan numune taşıyıcı cam küvet içinde eklenir, Şekil 2'de tarif edilen tutucu tarafından tutulan. ışık tabaka i yatay vetaraftan embriyolar lluminates. Algılama objektif numune üzerinde, dikeydir.
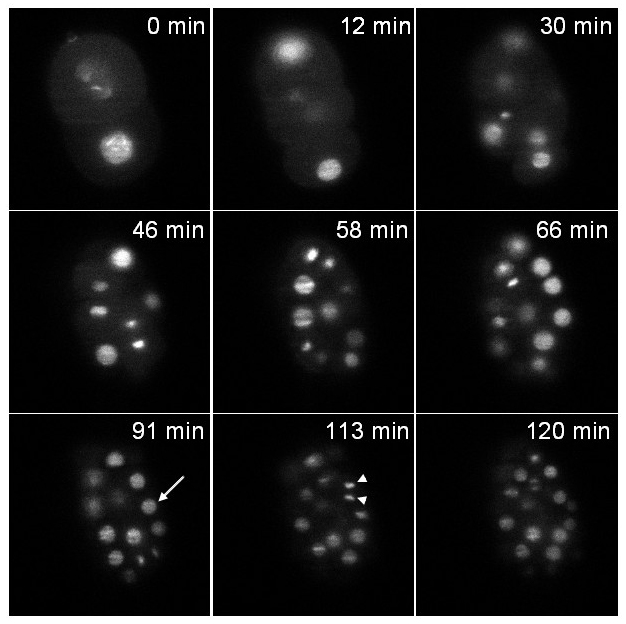
Şekil 6: Bir C kayıt histon :: GFP füzyon ifade elegans embriyo bir transgenik embriyo Tek düzlem görüntüleri bir histon :: GFP füzyon (zuIs178; stIs10024) ifade farklı zaman noktalarında 3D time-lapse kayıt çıkarılan Görüntüler:.. 20. dilimleri (yapılan yığınları dilimleri 1 mikron arasındaki mesafe); dilim başına maruz kalma süresi: 30 msn; yığınlar arasındaki zaman aralığı: 37 sn; toplam alma süresi: 2 saat. Ok: interphasic çekirdeği, ok başı: yoğunlaştırılmış mitoz kromatin. T = 0 dak embriyo 2 hücreli aşamada ve normal gelişim s altında, beklendiği gibi, t = 120 dakika yaklaşık 70 embriyo hücreleri içeren(tek bir düzlem içinde, sadece hücreler, embriyo tüm hücreleri değil resimlerde görülebilir ve unutmayın) işedi. Aydınlatma gücü (aydınlatma amacı çıkışında ölçülen) 488 nm'de 30 μW oldu. Videoyu izlemek için buraya tıklayınız.
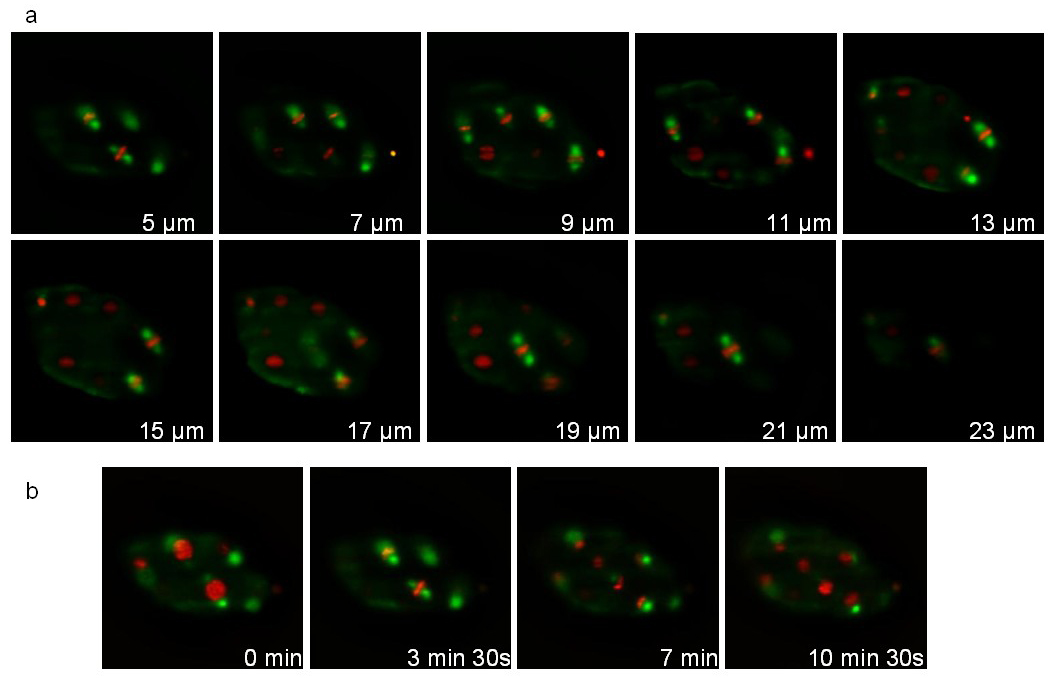
Şekil 7: Bir C kayıt elegans bir Tubulin :: GFP füzyon ifade embriyo ve bir Histone :: MCherry füzyon. bir C 3D time-lapse kayıt çıkarılan Görüntüler Bir Tubulin :: GFP füzyon (ruIs57) ve histon :: MCherry füzyon (; stIs10226 itIs37) ifade elegans embriyo. Kayıt koşulları: 1 dilim arasında 20 dilimleri (mesafe bir yığın edinimimikron) her 105 sn; toplam alma süresi: 16 dakika; maruz kalma süresi: Her kanal için 200 msn. Panel aynı yığın 10 dilim gösterir. Panel b aynı dilim her 210 sn gösterir. Aydınlatma gücü (aydınlatma amacı çıkışında ölçülen), sırasıyla 488 ve 561 nm lazerler, 30 μW ve 300 μW oldu. Videoyu izlemek için buraya tıklayınız.
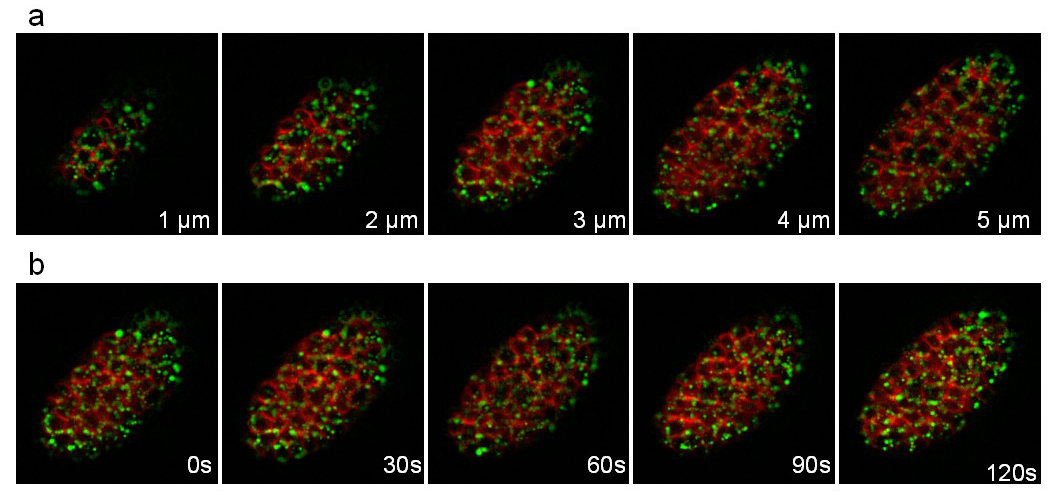
Şekil 8: bir C kayıt Bir VIT-2 :: GFP füzyon ifade elegans embriyo ve C 3D time-lapse kayıt çıkarılan bir membran hedefli MCherry. Görüntüler elegans embriyo bir VIT-2 :: GFP füzyon ifade (PADS23) ve bir membran-hedefli mCherry (ltIs44). Kayıt koşulları: 10 dilim (dilimler 1 mikron arasındaki mesafe) her 30 saniye bir yığın satın alınması; toplam alma süresi: 25 dakika; Kanal başına maruz kalma süresi: 200 msn. Panel aynı yığının ilk 5 dilim gösterir. Panel b aynı dilim her 30sec gösterir. Videoyu izlemek için buraya tıklayınız.
Tartışmalar
Bu protokol C. in vivo görüntüleme için ışık sac mikroskobu kolay bir kurulum açıklar elegans embriyolar. Lazerler, ışın genişletici, kolimasyonu ve odaklanma lensler de dahil olmak üzere ışık tabakası oluşturmak ve uyum için gerekli optik elemanlar, kolayca bir optik tezgah üzerine monte edilebilir. Algılama yolu ve kamera için dik bir mikroskop ile birlikte, bu kurulum için basit bir çözüm, bir ışık mikroskobu tabaka sağlar.
Bu geometri örnek çevre basit yapar. Canlı numune düzenlenen yerleştirilmiş ve mekanik parçaları küçük bir set ile hareket eden bir cam küvet içinde yerleştirilir. Tabaka aydınlatma mikroskobu yeteneği kesit ile geniş alan teknik olduğu için, yalnızca tek bir eksen motorlu hareket 3D görüntüleme için gereklidir. Bu, tek bir tarama elemanı senkronizasyon ihtiyacı sınırlar ve yazılım geliştirilmesini kolaylaştırır. ISPIM 6 bizim dik geometrik karşılaştırıldığındary tespiti için yüksek NA objektif lens kullanımına izin verir. Yatay düzlemde objektifler ile SPIM kurulumları ile karşılaştırıldığında numune montaj ve embriyonun bir dizi görüntü daha kolaydır. Toplamda, bu tekniğin uygulanması basittir ve optik az uzmanlık ile elde edilebilir. Bu yüksek hız ve düşük fototoksisite ancak daha düşük eksenel kararı dezavantajı avantajları ile konfokal mikroskoplar için ucuz bir alternatif olduğunu.
Ayrıca C montaj için kolay ve tekrarlanabilir bir yöntem geliştirdi Bu sistemi kullanarak in vivo görüntüleme için elegans embriyolar. Montaj prosedürü hızlıdır (15 dakika) ve günlük deneyler için de uygundur. C. için elegans görüntüleme, bu basit kurulum avantajları en az iki-kıvrımlar vardır: toto görüntüleme (i) rotasyon olmadan mümkün değildir ve bu nedenle 3 boyutlu rekonstrüksiyon basittir; (Ii) örnek montaj kolay ve birden fazla embriyoların sırayla görüntülenebilirAynı slaytta. Biz hücre bölünmeleri ve hücre şekil değişiklikleri gözlemlemek için yeterli zamansal çözünürlüğe sahip time-lapse film örnekler gösterdi. C çalışma ışık sac mikroskobu gücü elegans gelişme yakın zamanda diğerleri 6, 7, 8 ile izah edilmiştir. Dolayısıyla, bu teknik, C morfojenezini ve model çalışma için çok yararlı olacaktır elegans embriyo.
Bu sistem aynı zamanda diğer model organizmaların gelişimini analiz etmek için kullanılabilir? Bu, kabul edilmesi önemlidir ki, C gibi küçük ve şeffaf bir organizma için tabaka aydınlatma mikroskobu uygulanması elegans Drosophila embriyolar gibi daha büyük canlılar için daha az katıdır. Drosophila toto görüntülemede normal rotasyon ve multi-view rekonstrüksiyon 9, 10. kolineer uyarma objektif lens ile iki taraftan Uyarımı'nı da attenuat neden gölge etkileri azaltılmış olabilir gerektirirIşık 11 iyon. Yine, burada sunulan kurulum hala düşük ağartma ve düşük photoxicity ile, Drosophila embriyoların görüntü bir tarafına şekilde uyarlanmıştır. Bu kurulum aynı zamanda ascidians veya zebrabalıkları gibi görüntü küçük ve şeffaf embriyolar için yararlı olabilir.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Biz tartışma için yazılım geliştirme ve Jérémie CAPOULADE özellikle Olivier Blanc, tüm Lenne üyeleri ve Bertrand laboratuarları teşekkür ederim. Biz de teknik destek için PICsL-IBDM görüntüleme tesisi, özellikle Claude Moretti ve Brice Detailleur teşekkür ederim.
Bu çalışma (P.-FL ve VB) CNRS dan ATIP hibe tarafından desteklenen, Labex (VB) Sanofi-Aventis gelen ve bir hibe (P.-FL ve VB) hibe INFORM. Biz (ANR-10-InSb-04-01 "INVESTISSEMENTS d'Avenir" diyoruz) Agence Nationale de la Recherche tarafından desteklenen Fransa-Biolmaging altyapısını kabul.
Malzemeler
| Name | Company | Catalog Number | Comments |
| SPIM | |||
| Detection | |||
| upright microscope | ZEISS | Axiophot 1 | |
| 100x W objective (NA 1.1, W.D. 2.5mm) | NIKON | ||
| EMCCD back illuminated | ANDOR | DU-885K-CS0-#VP | |
| Illumination | |||
| LASER 488 nm / 60 mW | TOPTICA | iBeam smart | |
| LASER 405 nm / 120 mW | TOPTICA | iBeam smart | |
| LASER 561 nm / 500 mW | COBOLT | JIVE 500 | for time lapse imaging, 50 or 100mW is enough |
| filter Quad line laser rejectionband ZET 405/488/561/638 | AHF | F57-405 | |
| Dichroic 405 | AHF | F38-405 | |
| Dichroic 488 | SEMROCK | Di01-R488 | |
| AOTF | AA | AOTFnC-400.650-TN | |
| mirror | |||
| lens 50 mm | THORLABS | telescope 5X | |
| lens 200 mm | THORLABS | telescope 5X | |
| periscope | THORLABS | RS99/M | |
| cylindrical lens f=100mm | THORLABS | ACY254-100-A | |
| 10X NA 0,3 | NIKON | ||
| xyz stage | NEWPORT | ||
| Sample | |||
| Bacto Agar | Bectkton Dickinson | 214010 | 5% in water |
| Poly-L-Lysine solution | Sigma | P8920 | |
| Capillaries GC100F-10, 1.0mm oD, 0,58mm ID, 100 mm L | Havard Appartus | 30-0019 | |
| Aspiration tube (mouth pipette) | Dutsher | 55005 | |
| M9 medium: | |||
| KH2PO4 (3g/L) | Any supplier | ||
| Na2HPO4 (6g/L) | Any supplier | ||
| NaCL (5g/L) | Any supplier | ||
| MgSO4 (1 mM final) | Any supplier | ||
| cuvette holder | HOME MADE | made by Brice Detailleur | |
| sample holder | HOME MADE | made by Claude Moretti | |
| x stage | NEWPORT | ||
| coverslip 50x20x1 mm | MARIENFELD | cut then in 10x20x1mm | |
| piezo electric stage with amplifier/controller | PI | P-622.ZCD / E-625.CR | |
| cuvette 40mmx40mmx10mm | HELLMA | 704.002-OG.40 mm- 10mm high | |
| Diamond Point Glass Marking Pencil | VWR | ||
| Software | |||
| C++ (Qt) home made software | developed by Olivier Blanc and Claire Chardès, available on request. Alternative solutions: micromanager or labview | ||
Referanslar
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305, 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136, 1963-1975 (2009).
- Reynaud, E. G., Krzic, U., Greger, K., Stelzer, E. H. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. HFSP J. 2, 266-275 (2008).
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol. 100, 64-119 (1983).
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods Cell Biol. 106, 377-412 (2011).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 108, 17708-17713 (2011).
- Giurumescu, C. A., Kang, S., Planchon, T. A., Betzig, E., Bloomekatz, J., Yelon, D., Cosman, P., Chisholm, A. D. Quantitative semi-automated analysis of morphogenesis with single-cell resolution in complex embryos. Development. 139, 4271-4279 (2012).
- Gao, L., Shao, L., Higgins, C. D., Poulton, J. S., Peifer, M., Davidson, M. W., Wu, X. F. Noninvasive Imaging beyond the Diffraction Limit of 3D Dynamics in Thickly Fluorescent Specimens. Cell. 151, 1370-1385 (2012).
- Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., Hufnagel, L. Multiview light-sheet microscope for rapid in toto imaging. Nat Methods. 9, 730-733 (2012).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview light-sheet microscopy. Nat Methods. 9, 755-763 (2012).
- Huisken, J., Stainier, D. Y. Even fluorescence excitation by multidirectional selective plane illumination microscopy (mSPIM). Opt Lett. 32, 2608-2610 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır