Method Article
הגדרת מיקרוסקופ גיליון אור פשוט עבור
In This Article
Summary
פרוטוקול זה מתאר את ההתקנה של מיקרוסקופ גיליון אור ויישומה לin vivo הדמיה של ג elegans עוברים.
Abstract
טכניקות הדמיה phototoxic מהירה ונמוכות הן תנאי מוקדם כדי ללמוד את ההתפתחות של אורגניזמים בטוטו. מיקרוסקופיה מבוססת גיליון אור מפחיתה צילום הלבנה ואפקטי phototoxic השוואה למיקרוסקופיה confocal, תוך מתן תמונות 3D עם הרזולוציה subcellular. כאן אנו מציגים את תוכנית ההתקנה של מיקרוסקופ אור גיליון מבוסס, שמורכבת ממיקרוסקופ זקוף וקבוצה קטנה של אלמנטי אופטו מכאני עבור הדור של גיליון האור. הפרוטוקול מתאר כיצד לבנות, ליישר מיקרוסקופ ולאפיין את גיליון האור. בנוסף, הוא מפרט כיצד ליישם את השיטה להדמית טוטו של ג elegans עובר באמצעות תא תצפית פשוט. השיטה מאפשרת את לכידתו של הזמן לשגות סרטי שני צבעים 3D מעל כמה שעות של פיתוח. זה אמור להקל על המעקב של צורת תא, חלוקות תא וחלבונים מתויגים על פני תקופות זמן ארוכות.
Introduction
היווצרות ועיצובה של האורגניזם כרוך תנועות תא, שינויים בצורת תא, חלוקת תא והתמיינות תאים. הבנת ההתקדמות ותיאום של תהליכים אלה דורשים כלי הדמיה מהירים עם יכולת תלת ממדים ורזולוציה subcellular. בין הטכניקות עם in vivo יכולות הדמיה אלה, מיקרוסקופיה תאורת גיליון אור הנקראת גם מיקרוסקופיה יחידה / תאורת מטוס סלקטיבית יש את היתרון הייחודי של הפקת אפקטים נמוכים phototoxic ונמוך photobleaching 1,2.
במיקרוסקופיה תאורת גיליון, המדגם הוא מואר מהצד בגיליון אור, אשר מבצע חתך האופטי. נתיב ההארה ואת נתיב הגילוי הוא ניצבים זה לזה וגיליון האור מיושר יעלה בקנה אחד עם מטוס מוקד האובייקט של העדשה האובייקטיבית זיהוי. המדגם ממוקם בצומת של שני נתיבים,nd ניתן להעביר לאורך ציר זיהוי כדי לאפשר הדמיה 3D. רק המטוס של עניין הוא מואר ואת כל הנקודות של המטוס הזה מתגלות באותו הזמן. זה מגדיל באופן משמעותי את מהירות הרכישה ומפחית photobleaching כמו גם phototoxicity בהשוואה למיקרוסקופיה confocal 3.
למעשה, מיקרוסקופיה תאורת גיליון היא קלה להתקנה וalign: עבור שתי הדמיה ממדית, אין סריקה היא הכרחית לא לחלק זיהוי, ולא לחלק התאורה; כטכניקת שדה רחב עם חתך יכולת, ניתן לקבל הדמיה תלת ממדית על ידי תנועת ציר יחידה של הבמה מחזיקה את המדגם.
כאן אנו מציגים את הקמת מיקרוסקופ פשוט אור גיליון ויישומה בתחום הדמיה לטוטו של ג elegans עוברים. ג elegans עוברים מתאימים גם לחיות בvivo הר"יגינג בשל שקיפותם, שושלת בלתי משתנה וסטריאוטיפית תא עמדות 4,5. גיליון התקנת האור פותחה מבוססת על מיקרוסקופ הזקוף סטנדרטי לגילוי. הפרוטוקול המובא להלן מפרט כיצד לבנות וליישר את עירור מודול / נתיב, לבדוק ולאפיין את גיליון האור ולעלות את המדגם עבור ההדמיה 3D. הוא גם מספק דוגמאות של הזמן לשגות סרטים שנרכשו עם ההתקנה על זנים שונים להביע סמני ניאון.
Protocol
1. הגדרת גיליון האור ונתיב איתור
איור 1 נותן תכנית כללית של ההתקנה האופטית.
- מקום ולתקן את המיקרוסקופ והלייזרים על השולחן האופטי.
- משלב לייזרים 488 ננומטר, 561 ננומטר וננומטר 405 עם מראות dichroic המתאימות. אחרי מראות dichroic, הלייזרים צריכים להיות דווקא לשתף מיושרים. שים לב כי הבחירה של אורכי גל הלייזר, מראות dichroic, ומסננים אופטיים נקבעת מספקטרום הספיגה של תוויות ניאון הספציפיות המשמשות בניסויים.
- הנח את מסנן אקוסטי האופטי מתכונן (AOTF). השתמש בגיליון הבדיקה המסופק על ידי הספק כדי להתאים את התדירות והעצמה של AOTF. כאשר מיושר היטב, על 90% מכוח הלייזר מועברים בכוונון מרבי, כפי שנמדדו על ידי powermeter. שים לב שחלק הלייזרים ניתן לשלוט באופן מלא על ידי תוכנה, אשר יכול להפוך את AOTF מיותר.
- מקום ולתקןטלסקופ. שים לב שהטלסקופ מורכב משתי עדשות המרחיבות את הקרן לרוחב שווה או גדול יותר מהקוטר של הצמצם האחורי של העדשה האובייקטיבית התאורה. העדשה עם אורך המוקד הקטן ביותר צריכה לבוא קודם.
- מקום, ליישר ולתקן את פריסקופ להביא כלפי מעלה הנתיב האופטי קרוב יותר לצמצם האחורי של העדשה הגלילית. שים לב ששתי המראות של פריסקופ הם רכובים באופן שהציר הארוך שלהם מנחית על הנטייה של המראה על מנת לשקף את הקרן הרחיבה באופן מלא.
- מניחים את העדשה הגלילית בסמוך ליציאת פריסקופ. שים לב שהעדשה הגלילית מתמקדת הקרן בכיוון אחד ומשאירה אותו collimated בכיוון האחר, וכך יוצר גיליון אור.
- ולמקד את גיליון אור וכתוצאה מכך על ידי שימוש בעדשה אובייקטיבית התאורה. שים לב שנקודת המוקד של התמונה אובייקטיבי התאורה צריכה לחפוף עם מוקד האובייקט של מטרת זיהוי. להקרין את הקרןעל מסך (למשל קיר) במרחקים ארוכים. הזז את מטרת התאורה לאורך ציר אלומת התאורה להשיג בקווי המתאר החדים המסך של גיליון האור.
- למקם את הקו מרובע (405/488/561/638) פליטה לסנן במקום שמורות במיקרוסקופ (הקובייה).
- מקם את המצלמה EMCCD בנמל פלט מיקרוסקופ.
- תקן את שלב התרגום הידני הראשון על הבמה מיקרוסקופ על ידי ברגים בחורים שנקדחו בבמת מיקרוסקופ. שים לב שקצה הבמה התרגום צריך להיות ממוקם בכ -2 ס"מ ממרכז הבמה מיקרוסקופ, כך שקובט מרוכז מתחת לעדשת מטרת זיהוי.
- תקן את שלב התרגום הידני השני על הראשון. הכיוונים של שני שלבים צריכים להיות בניצב (תרגומי X ו-Y).
- תקן את השלב פיזואלקטריים Z בחלק העליון של שני השלבים הקודמים. שים לב ששלב ממונע יכול לשמש במקומו של השלב פיזואלקטריים.
- תקן holde קובטr (ראה איור 2) בחלק העליון של השלבים. קובט יהיה ובכך להיות ממוקם בצומת של דרך ההארה ודרך זיהוי, שהם ניצבים זה לזה.
2. בדיקת גיליון האור
- מלא קובט זכוכית עם פתרון ניאון, ולמקם אותו על בעל המדגם בצומת של שני נתיבים אופטיים. גיליון האור וכך גלוי לעין. זה חייב להיות אופקי, וסימטרי / מרוכז ביחס לעדשת מטרת זיהוי.
- הסר את העדשה הגלילית ולרכוש תמונה כדי למדוד את העובי של גיליון האור. שים לב שהעובי של גיליון האור תלוי בצמצם המספרי (NA) של העדשה האובייקטיבית התאורה (כ 3-4 מיקרומטר לNA = 0.3). שים לב שעבור עדשה נתון, העובי של אור גיליון יכול להיות מוגבר על ידי הקטנת הגודל של הקרן נכנסת בגב הצמצם עם שסע. שימו לב שזעיר מניאון יכול לשמש כדי למדוד את הגרזןרזולוציה ial ורוחב של מיקרוסקופ.
- להחזיר את העדשה הגלילית לפני תחילת הניסוי.
3. ההרכבה של ג elegans עוברים
השלבים הבאים הם בתמונה באיור 3.
- השתמש בעט סימון יהלומים כדי לחתוך חתיכת זכוכית שקופית של מ"מ 10 x 20 x 1.
- הכן 5% bacto-אגר במים, להרתיח אותו ולתחזק אותו בבלוק דוד ב60 ° C.
- הוסף 50 μl של פולי-L-ליזין בצד אחד של פיסת השקופית לחתוך, לאפשר לו להתייבש.
- מקום שקופית מיקרוסקופ על הספסל ולתקן את זה.
- לשים בסמוך פיסת השקופית לחתוך עם השקופית קבועה ולהוסיף טיפה של אגר נמסו בחלקו העליון. לסחוט את אגר באמצעות אחר שקופית מיקרוסקופ נקייה כדי לקבל משטח אגר דק.
- לאפשר למשטח אגר להתייבש לפני הסרת השקופית העליונה.
- חותכים את משטח אגר בצד של השקופית קבועה על מנת להשאיר עודף של כ 3 מ"מ oאגר ו ולהסיר בעדינות את השקופית קבועה.
- הוסף 50 μL של פולי-L-ליזין על אגר ולתת לו להתייבש לחלוטין.
- שים תולעים הרה להולדת במדיום M9 בזכוכית שעון.
- חותכים את התולעים ברמה של הפות עם אזמל כדי לשחרר את העוברים.
- תחת משקפת לזהות את העוברים בשלב של עניין ולאסוף אותם באמצעות פיפטה microcapillary.
- מניחים את העוברים על חלק מאגר מצופה פולי-L-ליזין שבולט מחתיכת השקופיות לחתוך. מניחים את העוברים רק בסמוך לגבול של השקופית. אל תציב את העוברים בגבול של אגר, כי הם לא יהיו יציבים מספיק. הסר בעדינות את הנוזל כך שהעוברים ידבקו על שכבת פולי-L-ליזין.
- במהירות ליישר את העוברים, כדי למנוע התייבשות.
- מניחים את השקף לחתוך בצלחת פטרי פלסטיק ובעדינות להוסיף בינוני M9 כדי לכסות את השקופיות.
- בדוק תחת משקפת שהביצים עדיין תקועות על אגר.
4. הקלטה של ג פיתוח elegans
- תקן את ההכנה הקודמת (שקופיות לחתוך, אגר בתוספת עוברים) בבעל המדגם ולמקם אותו בקובט. איור 4 מתאר את בעל תוצרת בית ואיור 5 מראה נוף של קובט בהקשר תצפית.
- תקן את קובט על הבמה פיזואלקטריים.
- לזהות את מיקומו של עובר עם תאורה בשדה בהיר.
- הפעל את תוכנת תוצרת בית השליטה AOTF, את המצלמה ואת הבמה פיזואלקטריים. שים לב שתוכנה חופשית, כגון micromanager, יכולה לשמש גם.
- בחר את הקו והכוח (AOTF) הלייזר.
- להתאים את המיקום של גיליון האור באמצעות שלב 3 כיווני תמיכה העדשה הגלילית ועדשת התאורה. להזיז את הבמה יחד בכיוון לרוחב (X) כדי לקבל את האות הבהירה. התאם אז Z מיקום של גיליון האור, ואת מיקום האורך (Y) כדי להשיג הדואר האות הטוב ביותר יחס רעש. שים לב שהעמדה של מוקד גיליון האור ייתכן שתצטרך להיות מותאמת מעובר אחד למשנו כדי לתקן את ההבדלים באורכים נתיב אור.
- לרכישת זמן לשגות תמונות, לבחור את זמן החשיפה, להשיג, זמן בין שתי תמונות, כמו גם את מספר התמונות שרכשו, ואת כוח הלייזר. לרכישה 2 צבע, בחר קו לייזר שני. שתי תמונות צבע נרכשות ברציפות.
- כדי לרכוש מחסנית AZ, בחר גם את המרחק בין שתי פרוסות, והתחלה ואת סוף העמדות של פיזואלקטריים.
תוצאות
שלושה ניסויי הקלטת הזמן לשגות 3D משלושה ג שונה elegans זנים להמחיש את סוג הנתונים שניתן להשיג באמצעות התקנת מיקרוסקופ אור הגיליון שתוארה לעיל. בדקנו כי בתנאים אלה עוברים לפתח במהירות רגילה ולשרוד את ההדמיה, עולה בקנה אחד עם דיווחים קודמים המצביעים על כך ההדמיה SPIM גורמת לרמות נמוכות phototoxicity רק בג elegans עוברי 6,7.
הזן הראשון מבטא היסטון התמזגו GFP (zuIs178; stIs10024). הקלטה בוצעה במהלך 2 שעות עם ערימה של 20 פרוסות (מרחק בין פרוסות 1 מיקרומטר) נלקחה כל שניות 37. איור 6 ממחיש מישור אחד של המחסנית בנקודות זמן שונה. שני גרעיני interphasic (חץ) והכרומטין תמצית המיטוטי (ראש חץ) נראים בבירור.
הזן השני מבטא טובולין התמזגו GFP (ruIs57) והיסטוןהתמזגו mCherry (itIs37; stIs10226). הקלטה בוצעה במהלך 16 דקות עם ערימה של 20 פרוסות (מרחק בין פרוסות 1 מיקרומטר) נלקחה כל שניות 105. איור 7 ממחיש מישורים שונים של המחסנית ונקודות זמן שונה. הסרט קשור 1 המציג 3D שחזורים ב3 נקודות זמן רצופות. במהלך החלוקה, ציר mitotic (הירוק) והכרומוזומים מרוכזים (אדום) נראה בבירור המאפשר המעקב של אוריינטציות חלוקת תאים במהלך התפתחות.
הזן השלישי מבטא את אפוליפופרוטאין VIT-2 התמזגו GFP (pwIs23) וקרום מחויב mCherry (ltIs44). הקלטה בוצעה במהלך 25 דקות עם ערימה של 10 פרוסות (מרחק בין פרוסות 1 מיקרומטר) נלקחה כל 30 שניות. איור 8 ממחיש מישורים שונים של המחסנית ונקודות זמן שונה. התנועות מהירות של החלקיקים ליפופרוטאין בחלמון (ירוק) בתוך התאים יכולות להיות בקלותאחריו.
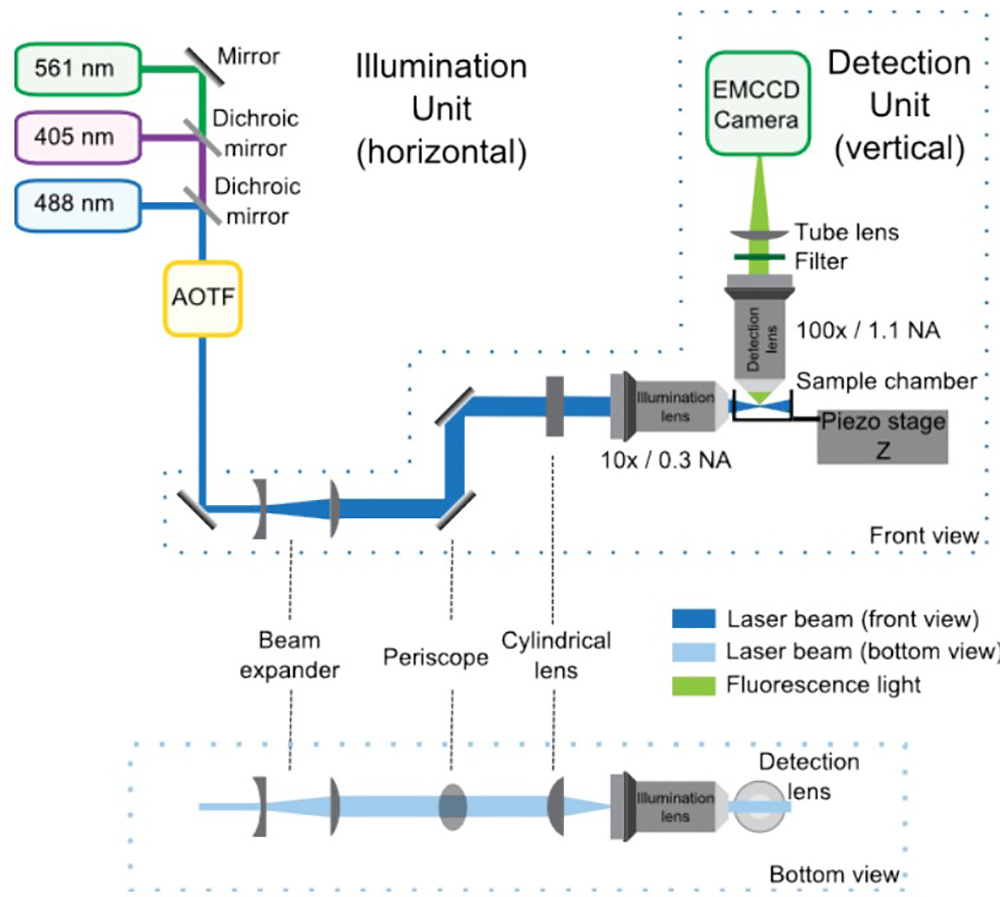
איור 1: התקנה אופטית SPIM המורכב מיחידות התאורה וזיהוי, קדמית ונוף תחתית. ביחידת התאורה, הלייזרים בשילוב ידי מראות dichroic להיכנס AOTF, השולט בכוחו של כל אחד הלייזר באופן עצמאי. לאחר מכן, טלסקופ מגדיל את הגודל של הקרן על ידי פי 4 ופריסקופ מביא אותו לגובה של המיקרוסקופ. העדשה הגלילית מהווה את גיליון האור, אשר מקד מחדש על ידי מטרת ההארה. יחידת האיתור משולבת במיקרוסקופ הזקוף, והוא מורכב בעיקר על ידי עדשת האיתור, הסינון, עדשת הצינור וEMCCD. המדגם ממוקם בצומת שבין נתיבי התאורה וזיהוי. שלב פיזואלקטריים מאפשר התקות אנכיות (Z) של המדגם לרכישת 3D.
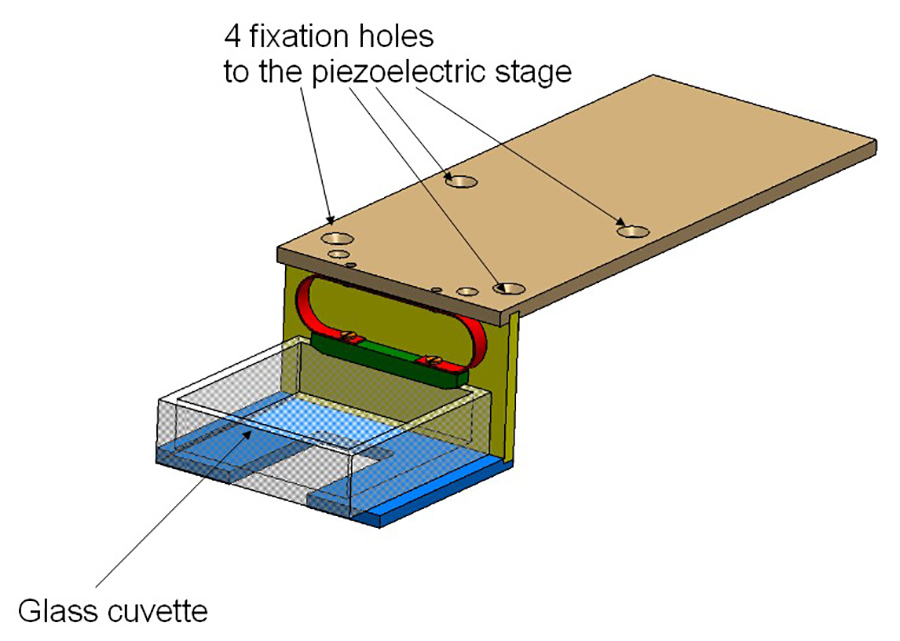
איור 2:. בעל קובט בעל כולל 3 פלטות אלומיניום ומוברג על הבמה פיזואלקטריים. קובט הזכוכית מוחזק על ידי אביב (באדום).
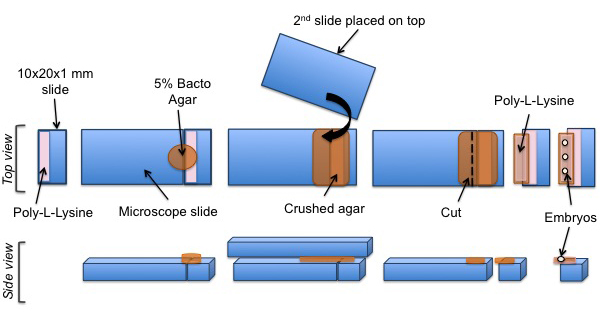
איור 3: התקנת פרוטוקול של ג עוברי elegans לניסויי SPIM. חתיכת הזכוכית לחתוך מצופה פולי-L-ליזין. כרית של אגר ממוקמת על המשטח המצופה. פולי-L-ליזין הוא הוסיף לאחר מכן על הכרית אגר. לבסוף, ג elegans עוברים מיושרים על משטח אגר מצופה פולי-L-ליזין.
ther.within-page = "תמיד"> 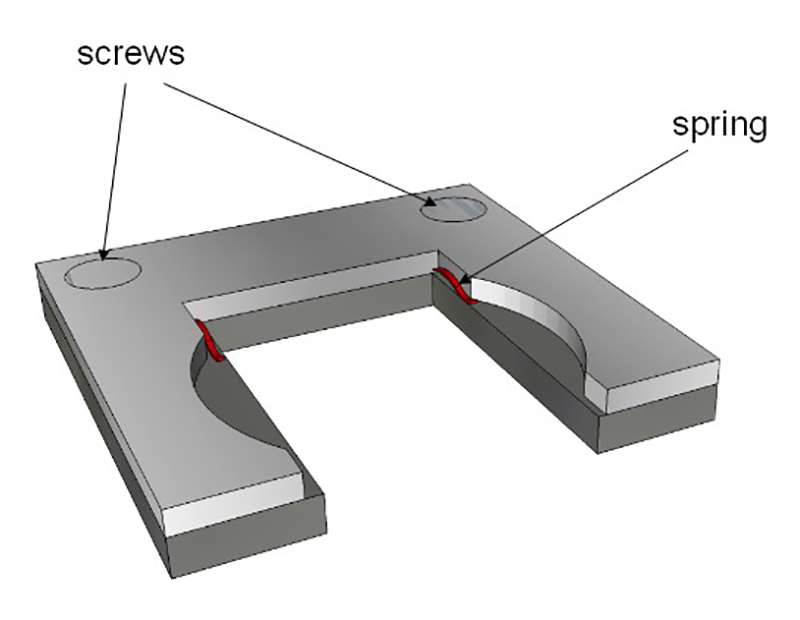
איור 4: בעל מדגם. בעל מתאים לממדים הפנימיים של קובט הזכוכית. שתי מעיינות (באדום) מחזיקות שקופיות הזכוכית (מתוארות באיור 3). בעל זה ואז לשים בתוך קובט הזכוכית.
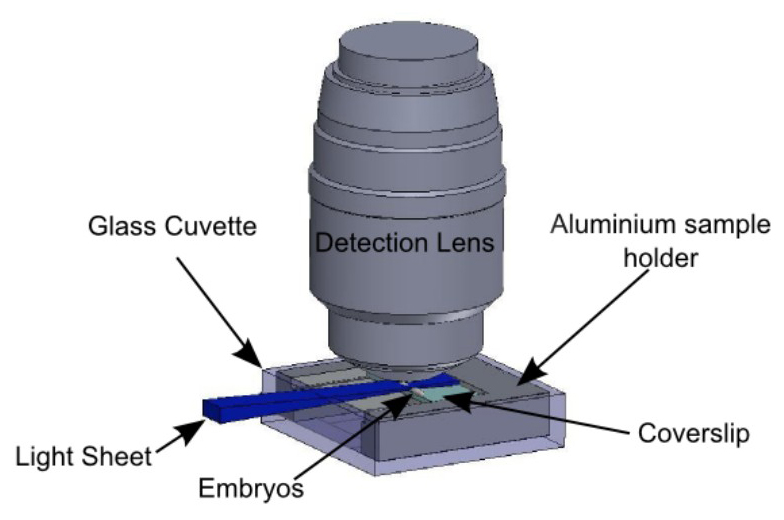
איור 5:... בעל מדגם בהקשר תצפית עוברים הם משותקים בשקופית הזכוכית לפי הפרוטוקול סיכם באיור 3 השקופיות מוחזקות על ידי בעל המדגם המתואר באיור 4 בעל המדגם מוכנס בקובט הזכוכית, הוחזק על ידי המחזיק המתואר באיור 2. גיליון האור הוא אופקי ואניlluminates העוברים מהצד. עדשת מטרת זיהוי היא אנכית, מעל למדגם.
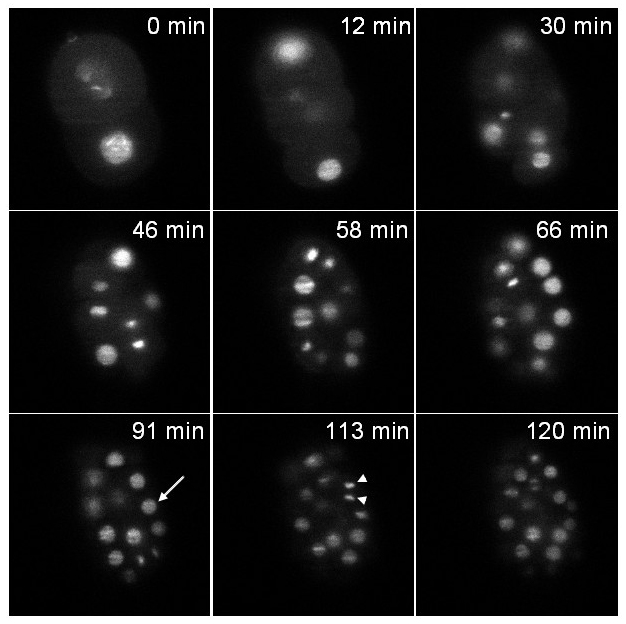
איור 6: הקלטה של ג עובר elegans להביע היתוך היסטון :: ה-GFP תמונות מטוס יחידה של עובר מהונדס מבטא היסטון :: GFP היתוך (zuIs178; stIs10024) בנקודות זמן שונות תמונות שחולצו מן הקלטת הזמן לשגות 3D:.. ערימות עשויות 20 פרוסות ( מרחק בין פרוסות 1 מיקרומטר); זמן חשיפה לכל פרוסה: 30 אלפיות שניים; מרווח זמן בין ערימות: 37 שניות; זמן כולל רכישה: 2 שעות. חץ: גרעין interphasic, ראש חץ: הכרומטין המיטוטי מרוכז. בזמן t = 0 דקות העובר הוא בשלב 2 התאים ובt = 120 דקות העובר מכיל כ 70 תאים כצפוי על פי סעיף התפתחותית נורמליהשתין (שים לב שרק את התאים כלולים במישור אחד נראים בתמונות ולא בכל התאים של העובר). כוחה של תאורה היה 30 μW ב488 ננומטר (נמדד ביציאה של מטרת התאורה). אנא לחץ כאן כדי לצפות בסרטון זה.
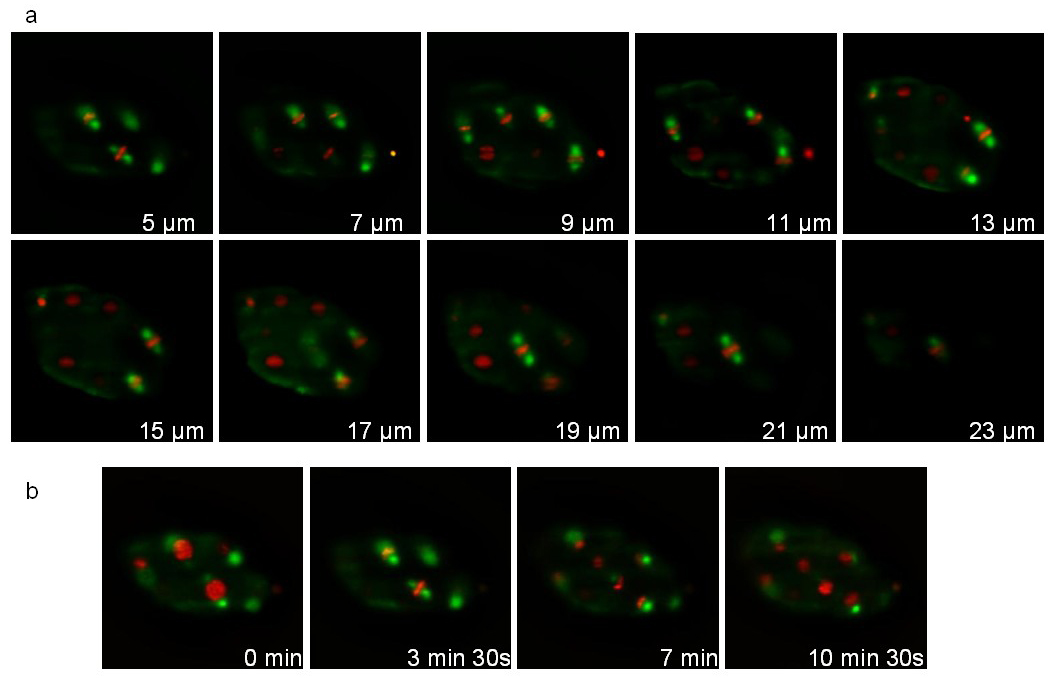
איור 7: הקלטה של ג עובר elegans להביע :: GFP היתוך טובולין והיסטון :: היתוך mCherry. תמונות שחולצו מן הקלטת הזמן לשגות 3D של ג עובר elegans להביע :: היתוך טובולין GFP (ruIs57) והיסטון :: היתוך mCherry (itIs37; stIs10226). תנאי הקלטה: רכישת ערימה של 20 פרוסות (מרחק בין פרוסות 1מיקרומטר) בכל שנייה 105; סה"כ זמן רכישה: 16 דקות; זמן חשיפה: 200 אלפיות שני לכל ערוץ. לוח תערוכות 10 פרוסות אותה הערימה. לוח ב 'מציג את אותו פרוסה כל שניות 210. כוחה של תאורה היה 30 μW ו300 μW, ל488 ו561 לייזרי ננומטר, בהתאמה (שנמדדו ביציאה של מטרת התאורה). אנא לחץ כאן כדי לצפות בסרטון זה.
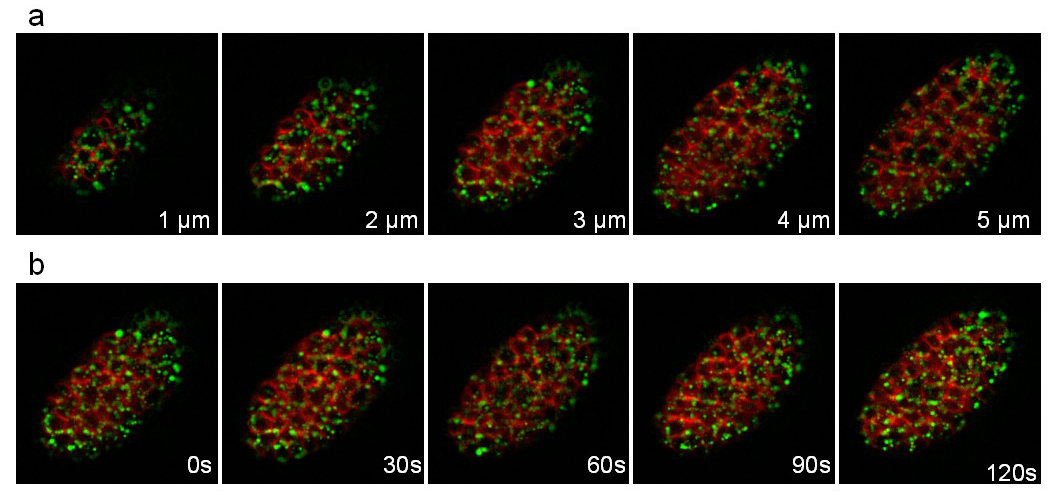
איור 8: הקלטה של ג עובר elegans להביע GFP היתוך VIT-2 :: וממוקד קרום mCherry. תמונות שחולצו מן הקלטת הזמן לשגות 3D של ג עובר elegans להביע היתוך VIT-2 :: GFP (PWIs23) וmCherry ממוקד קרום (ltIs44). תנאי הקלטה: רכישת ערימה של 10 פרוסות (מרחק בין פרוסות 1 מיקרומטר) כל 30 שניות; סך הכל זמן רכישה: 25 דקות; זמן חשיפה לכל ערוץ: 200 אלפיות שניים. לוח מציג 5 פרוסות הראשונות של אותה הערימה. לוח ב 'מציג את אותו פרוסה כל 30sec. אנא לחץ כאן כדי לצפות בסרטון זה.
Discussion
פרוטוקול זה מתאר התקנה קלה של מיקרוסקופיה גיליון אור לin vivo הדמיה של ג elegans עוברים. האלמנטים אופטיים הדרושים כדי ליצור וליישר את גיליון האור, כוללים לייזרים, הרחבה קרן, collimation ועדשות מיקוד, יכולים להיות מותקן בקלות על ספסל אופטי. בשילוב עם מיקרוסקופ זקוף לדרך האיתור והמצלמה, זה מספק פתרון פשוט להתקנה מיקרוסקופ גיליון אור.
גיאומטריה זו הופכת את הסביבה לדוגמא פשוטה. דגימת החיים ממוקמת בקובט זכוכית, המוחזקת, מיקומו ועבר על ידי קבוצה קטנה של חתיכות מכאניות. מיקרוסקופיה תאורת גיליון היא טכניקת שדה רחבה עם חתך יכולת, תנועה היחידה ציר יחיד ממונעות נדרש להדמית 3D. זה מגביל את הדרישה של סנכרון לאלמנט סריקה בודד ומאפשר פיתוח תוכנה. לעומת 6 iSPIM geomet הזקוף שלנור"י מאפשר השימוש בעדשה אובייקטיבית NA גבוהה לצורך זיהוי. בהשוואה להגדרות SPIM עם עדשות אובייקטיביות במישור האופקי ההרכבה של מדגם וההדמיה מסדרה של עוברים הן יותר קלה. בסך הכל, את היישום של טכניקה זו הוא פשוט וניתן להשיג עם מומחיות קטנה בתחום האופטיקה. זוהי אלטרנטיבה זולה יותר למיקרוסקופי confocal עם היתרונות של מהירות גבוהה יותר וphototoxicity אבל חסרון של רזולוציה צירית נמוכה מופחתים.
אנחנו גם פיתחנו דרך קלה ולשעתק לעלות ג עוברי elegans לin vivo הדמיה באמצעות מערכת זו. הליך ההרכבה הוא מהיר (15 דקות) והוא מתאים לניסויים יומיומיים. לג הדמיה elegans, היתרונות של ההתקנה הפשוטה הזה לפחות שני קפלים: (i) בתחום ההדמיה טוטו אפשרית ללא סיבוב ובכך שחזור 3D הוא פשוט; (Ii) הרכבת מדגם קלה ועוברים מרובים יכולים להיות צילמו ברצףבאותה השקופית. הראינו דוגמאות של זמן לשגות סרטים עם רזולוציה של זמן מספיק כדי לבחון חלוקות תא ושינויי צורת תא. כוחה של מיקרוסקופיה גיליון אור ללמוד ג פיתוח elegans יש גם מאויר לאחרונה על ידי אחרים 6, 7, 8. לכן, טכניקה זו תהיה שימושית מאוד ללמוד המורפוגנזה ודפוסים של ג עובר elegans.
מערכת זו יכולה לשמש גם כדי לנתח את ההתפתחות של אורגניזמים מודל אחרים? חשוב להכיר בכך שהיישום של מיקרוסקופיה תאורת גיליון לאורגניזם קטן ושקוף כמו ג elegans הוא פחות חמור משל אורגניזמים גדולים יותר, כמו עוברי דרוזופילה. בהדמית טוטו של דרוזופילה בדרך כלל דורש סיבוב ושחזורים רב להציג 9, 10. עירור משני צדדים עם עדשות אובייקטיביות עירור קוליניאריות יכולים גם הפחית את תופעות הצל שנגרמו על ידי attenuatיון של 11 אור. עם זאת, ההגדרה שהוצגה כאן היא עדיין מותאמת לצד תמונה אחד מעוברי דרוזופילה, עם הלבנת נמוכה וphotoxicity הנמוך. גם הגדרה זו יכולה להיות שימושית לעוברי תמונה קטנים ושקופים כגון ascidians או דג הזברה.
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
אנו מודים לכל חברי Lenne ומעבדות ברטרנד, בפרט אוליבייה בלאן לפיתוח תוכנה וג'רמי Capoulade לדיון. אנו מודים גם למתקן PICsL-IBDM ההדמיה, בפרט קלוד מורטי ורייס Detailleur לקבלת תמיכה טכנית.
עבודה זו נתמכה על ידי מענקים מATIP CNRS (לפ-FL ו-VB), Labex להודיע מענק (לפ-FL ו-VB) ומענק מSanofi-Aventis (לVB). אנו מכירים בתשתית צרפת-bioimaging נתמכת על ידי Nationale de la משוכלל ונדיר סוכנות הידיעות (ANR-10-InSb-04-01, מכנים "Investissements d'Avenir").
Materials
| Name | Company | Catalog Number | Comments |
| SPIM | |||
| Detection | |||
| upright microscope | ZEISS | Axiophot 1 | |
| 100x W objective (NA 1.1, W.D. 2.5mm) | NIKON | ||
| EMCCD back illuminated | ANDOR | DU-885K-CS0-#VP | |
| Illumination | |||
| LASER 488 nm / 60 mW | TOPTICA | iBeam smart | |
| LASER 405 nm / 120 mW | TOPTICA | iBeam smart | |
| LASER 561 nm / 500 mW | COBOLT | JIVE 500 | for time lapse imaging, 50 or 100mW is enough |
| filter Quad line laser rejectionband ZET 405/488/561/638 | AHF | F57-405 | |
| Dichroic 405 | AHF | F38-405 | |
| Dichroic 488 | SEMROCK | Di01-R488 | |
| AOTF | AA | AOTFnC-400.650-TN | |
| mirror | |||
| lens 50 mm | THORLABS | telescope 5X | |
| lens 200 mm | THORLABS | telescope 5X | |
| periscope | THORLABS | RS99/M | |
| cylindrical lens f=100mm | THORLABS | ACY254-100-A | |
| 10X NA 0,3 | NIKON | ||
| xyz stage | NEWPORT | ||
| Sample | |||
| Bacto Agar | Bectkton Dickinson | 214010 | 5% in water |
| Poly-L-Lysine solution | Sigma | P8920 | |
| Capillaries GC100F-10, 1.0mm oD, 0,58mm ID, 100 mm L | Havard Appartus | 30-0019 | |
| Aspiration tube (mouth pipette) | Dutsher | 55005 | |
| M9 medium: | |||
| KH2PO4 (3g/L) | Any supplier | ||
| Na2HPO4 (6g/L) | Any supplier | ||
| NaCL (5g/L) | Any supplier | ||
| MgSO4 (1 mM final) | Any supplier | ||
| cuvette holder | HOME MADE | made by Brice Detailleur | |
| sample holder | HOME MADE | made by Claude Moretti | |
| x stage | NEWPORT | ||
| coverslip 50x20x1 mm | MARIENFELD | cut then in 10x20x1mm | |
| piezo electric stage with amplifier/controller | PI | P-622.ZCD / E-625.CR | |
| cuvette 40mmx40mmx10mm | HELLMA | 704.002-OG.40 mm- 10mm high | |
| Diamond Point Glass Marking Pencil | VWR | ||
| Software | |||
| C++ (Qt) home made software | developed by Olivier Blanc and Claire Chardès, available on request. Alternative solutions: micromanager or labview | ||
References
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305, 1007-1009 (2004).
- Huisken, J., Stainier, D. Y. Selective plane illumination microscopy techniques in developmental biology. Development. 136, 1963-1975 (2009).
- Reynaud, E. G., Krzic, U., Greger, K., Stelzer, E. H. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. HFSP J. 2, 266-275 (2008).
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol. 100, 64-119 (1983).
- Hardin, J. Imaging embryonic morphogenesis in C. elegans. Methods Cell Biol. 106, 377-412 (2011).
- Wu, Y., et al. Inverted selective plane illumination microscopy (iSPIM) enables coupled cell identity lineaging and neurodevelopmental imaging in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 108, 17708-17713 (2011).
- Giurumescu, C. A., Kang, S., Planchon, T. A., Betzig, E., Bloomekatz, J., Yelon, D., Cosman, P., Chisholm, A. D. Quantitative semi-automated analysis of morphogenesis with single-cell resolution in complex embryos. Development. 139, 4271-4279 (2012).
- Gao, L., Shao, L., Higgins, C. D., Poulton, J. S., Peifer, M., Davidson, M. W., Wu, X. F. Noninvasive Imaging beyond the Diffraction Limit of 3D Dynamics in Thickly Fluorescent Specimens. Cell. 151, 1370-1385 (2012).
- Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., Hufnagel, L. Multiview light-sheet microscope for rapid in toto imaging. Nat Methods. 9, 730-733 (2012).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview light-sheet microscopy. Nat Methods. 9, 755-763 (2012).
- Huisken, J., Stainier, D. Y. Even fluorescence excitation by multidirectional selective plane illumination microscopy (mSPIM). Opt Lett. 32, 2608-2610 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved