Method Article
G蛋白偶联受体的基于荧光的钙动员含量表征
摘要
在这里所描述的基于荧光的钙动员测定法是孤儿G蛋白偶联受体(GPCRs)的功能性活化配位体(多个)的识别介质通量相反的药理筛选系统。
摘要
对于超过20年,反向药理学一直是卓越的战略,以发现孤儿G蛋白偶联受体(GPCR)的配体激活。相反药理试验的发作是在蜂窝式系统感兴趣的G蛋白偶联受体的克隆和随后转染。异源表达的受体,然后与候选配位体的化合物文库挑战识别受体激活配体(S)。受体的激活可以通过测量变化的第二信使分子,记者浓度,如钙或营地进行评估。此处所描述的基于荧光的钙动员测定法是一种常用的介质通量反向药理学测定。孤儿G蛋白偶联受体被瞬时表达的人胚肾293T(HEK293T)细胞和混杂Gα16构建体共转染。以下的配体结合,激活的Gα亚基16的诱导的钙F中的释放ROM中的内质网。前配体的筛选中,受体表达细胞被装载用荧光钙指示剂,荧光4乙酰氧基甲基。的Fluo-4的荧光信号可以忽略不计在静止条件下的细胞,但可以被放大超过100倍时与释放受体活化后,钙离子的相互作用。所描述的技术不需要耗时的建立,其中转染的遗传物质整合到宿主细胞基因组中稳定转染的细胞系。相反,一个瞬时转染,产生靶基因的暂时性表达,足以执行的筛选测定。该设置允许数百种化合物的中等通量筛选。共转染的混杂Gα16,其耦合到最GPCR的,使细胞内的信号转导通路被朝释放钙重定向,而不管本地信号通路中内源性塞特的英格斯。在HEK293T细胞中很容易处理,并已证明其功效贯穿于受体deorphanization测定的年。然而,该测定对特定受体的优化可以保持必要的。
引言
G蛋白偶联受体(GPCRs)构成所有细胞表面蛋白中最大和最多样化的家族之一。其在脊椎动物中存在,无脊椎动物,植物,酵母和粘菌,以及在原生动物和最早胚层后生动物表明GPCR是与信号转导1相连的最古老的分子之间。其天然配体的激活包括外部刺激包括肽,生物胺,增味剂,糖蛋白和光子2的广泛的多样性。正因为如此,这些受体 - 配体的信号系统涉及多种多样的生理过程。广泛的功能范围使它们非常适合的治疗药物,涵盖范围广泛的人类疾病的发展。约50-60%的电流药物靶点是通过G蛋白偶联受体3,4来表示。除了在制药行业的重视,G蛋白偶联受体也都在聚光灯下的发展新一代的种属特异性杀虫剂5,6和农药一般。因为很多G蛋白偶联受体的天然配体仍然不明,它们被归类为孤儿G蛋白偶联受体。这些受体的deorphanization将提高生物体的生理作用的认识,可能会发现假定目标为新药申请7。
由于基因组时代,反向药理学策略被广泛应用于对GPCR的8的deorphanization。该方法意味着一个孤儿受体被用来作为一个'钩'到'捞出'它从生物提取物或合成的化合物库激活配体。因此,感兴趣的G蛋白偶联受体被克隆,随后转染的细胞表达系统。在最常用的方法中,受体激活是通过测量变化的第二信使分子的浓度来决定9 。主要受体筛选分析依赖于钙敏感的生物发光蛋白( 如水母)10或荧光钙指标( 例如 ,荧光4)11。基于荧光的测定法,其中,受体表达细胞之前将配位体的筛选装有一个荧光钙指示剂,具有的优点是它们允许高通量筛选,因为它们易于使用,短的读取时间,并检查服务的灵活性多种孤儿受体上的单个板12。
在此,基于荧光的钙动员测定法中全面描述并通过果蝇短神经肽F(sNPF)受体的deorphanization过程示出。这neuropeptidergic信号系统最初是特征Mertens的等 。于2002年13与在中国仓鼠卵巢(CHO)细胞中进行的钙的生物发光测定法14和冯等人在2003年利用电生理测定爪蟾卵母细胞15。该sNPF信号系统的存在似乎只限于节肢动物门,它是牵连广泛的过程,包括摄食,生长,应激反应,运动和昼夜节律16的调节的门。
研究neuropeptidergic信号系统中的昆虫不仅可能导致对杀虫剂的发展新目标,但其运作的知识,也可以向尽可能多的信号系统已普遍非常保守的整个进化过程17其他生物推断。在过去的十年中,巨大的进步已经取得了昆虫神经肽G蛋白偶联受体的deorphanization过程。尽管有这些努力,只有少数的受体已被匹配到它们的同源配体,和序列信息的负荷为新的孤儿G蛋白偶联受体已成为可由于蓬勃发展的基因组学18。的中/高通量筛选的方法,例如,已被证明是一种广泛应用的技术9,18的基于荧光的钙动员测定法的可用性,因此非常宝贵的。
如这里所描述的基于荧光的钙动员测定法中的人胚肾293T(HEK293T)细胞系中进行,并使用荧光探针后,受体活化,以确定改变细胞内钙离子浓度。为了保证高表达与受体的翻译水平,Kozak共有序列19被添加到受体编码序列,它随后被克隆在表达载体中( 例如 ,pcDNA载体系列的哺乳动物细胞系)的5'末端。因为它是难以预料的内源性g的孤儿G蛋白偶联受体的基于序列信息蛋白偶联独自一人,第二信使分子( 如钙或营)正在受体激活后调制经常保持之前的配体识别未知。为了解决这个问题,对G q系列( 如鼠Gα15或人类Gα16 [这里使用])或嵌合G蛋白( 例如 ,Gαqi5)的混杂G蛋白与G蛋白偶联受体大部分互动和诱导钙的释放可共表达20,21,22。根据该配体与其受体的结合,GPCR的发生,导致特定的细胞内途径的激活的构象变化。鸟苷二磷酸(GDP)的分子,休息条件的Gα亚基16的约束下,将通过三磷酸鸟苷(GTP)分子所取代。这激起了异三聚体G蛋白的解离在一个Gα16和Gβγ亚单位。该Gα亚基16激活磷脂酶Cβ (PLCβ),这反过来水解与膜结合的磷脂酰肌醇二磷酸(PIP 2)产生二酰基甘油(DAG)和三磷酸肌醇(IP 3)。 IP 3会扩散到整个细胞质和激活的IP 3依赖性钙通道存在于内质网,其诱导钙释放到细胞质中的膜。
在受体活化的钙释放发生在几秒钟内,并且可以通过筛选试验之前加载的细胞用钙敏感的染料,如荧光4乙酰氧基甲基(AM)11来检测。对AM酯基使荧光穿过细胞膜,并通过细胞质酯酶的细胞一旦内切割掉。因此,在荧光染料的负电荷被屏蔽,防止它扩散出细胞,并允许它与钙离子进行交互。荧光信号Of荧光4是微不足道的细胞中只含有在纳摩尔范围内钙离子浓度静息状态下。然而,当钙被释放后受体激活,信号可以增加浓度依赖性地超过了100倍,因此保证大的信号 - 噪声比。荧光4也表现出大动态范围的报告[钙]周围的K 345 nM的D(钙),使其适用于测量各种细胞的生理有关钙的变化。的Fluo-4的激发发生在488nm和发射的荧光的测量是在525纳米11。象的荧光成像板读数器(FLIPR)23,可以在Novostar或FlexStation(台装置)12是荧光计中/高通量系统,允许同时进行化合物加成并且在受体活化的Fluo-4的信号的检测对于每个井在测定板。这里所描述的钙动员检测依赖于站上设备96孔微孔板的系统。
本的SoftMax Pro软件(软件),用于操作该站装置,以及对数据进行分析。该程序将立即显示的结果为在96 - 孔格式的图形。多个孔可以同时被选择以这些油井的结果比较在相同的曲线图。孔中的每个列的相对荧光单位(RFU)的值是同时测量的两分钟内,开始加入的化合物的各孔中之前和之后的受体激活的荧光信号的测量后继续进行。通常,激动剂曲线的趋势对齐基线直到活化化合物加入到细胞中,从而导致荧光信号的快速增加。的峰值高度相关,在该孔的最终激动剂浓度。高峰期后,荧光信号缓慢下降对基线水平。俄罗斯足协测量CAn为转换成浓度-响应曲线,以确定配体的EC 50值(半数最大有效浓度)。在一般情况下,至少三个独立的屏幕,每一个都包括的浓度系列三个副本,应执行以构成可靠的浓度 - 反应曲线。
建议将包括在实验设计中的几个阳性和阴性对照。首先,一个转染对照, 即用已知的配体的受体的实施,应进行测试。这使得验证转染试剂是否运作。掺入 的对照实验用的激动剂的细胞系和阴性对照( 例如 ,洗涤缓冲液)的内源性受体,也推荐以监测细胞的健康和生存能力,并排除该洗涤缓冲液被污染的可能性这可能引起自动fluore一个因素气味的反应。常用的激动剂是从蛋白酶激活受体-1(PAR 1),它作为一个PAR 1选择性激动剂,或氯化氨甲酰胆碱,激活乙酰胆碱受体的肽。转染空载体的表达也应该进行测试,以排除活性化合物与细胞的内源性受体相互作用。可能需要不同的信令系统在下面的协议描述的几个参数优化。完整的基于荧光的钙动员测定法的概略图是描绘在图1中 。
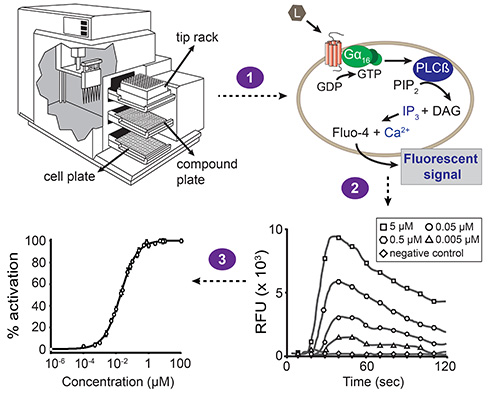
基于荧光的钙动员检测的图1,总体方案。自动化液体处理和同步荧光测量与台执行设备酶标仪,由软件驱动。站设备包含三个抽屉:一个用于使单元板,复合板和吸头机架。积聚在移液器转移化合物从化合物板的一列,以使单元板(步骤1)的相应列中。细胞板的每个孔中包含已被共转染与所关注的GPCR和混杂Gα亚基16的HEK293T细胞的单层。当一种化合物激活受体,使Gα16结合的GDP被替换为GTP。的Gα亚基16随后解离的Gβγ复合物,并激活磷脂酶Cβ(PLCβ),这反过来水解磷脂酰肌醇二磷酸(PIP 2)产生二酰基甘油(DAG)和三磷酸肌醇(IP 3)。 IP 3激活的IP 3依赖性钙通道存在于内质网的膜,诱导钙整数的释放Ø细胞质中。钙与的Fluo-4(与该细胞为化合物加成之前加载)的相互作用导致的荧光信号(步骤2)。软件给出的结果作为相对荧光单元中的时间函数(RFU)的值,以及峰值高度相关与配位体浓度的浓度依赖性。这些数据可以被转换成浓度-响应曲线,以确定配体-受体对(步骤3)的EC 50值。
研究方案
注意:在该细胞参与的所有操作应该由在层流工作的进行,在无菌环境中。
1,维修的HEK293T细胞株
- 在一个5%CO 2加湿培养箱中生长的HEK293T细胞中的T-75烧瓶中,在37℃。
- 通道,当达到80%汇合的细胞。注:这通常需要3至4天。在连续培养细胞允许20-25可用通道接受安检。
- 放置在Dulbecco磷酸盐缓冲盐水(PBS),而不氯化钙和氯化镁,PBS-胰蛋白酶 - 乙二胺四乙酸(EDTA)(500毫升的PBS补充用10毫升胰蛋白酶-EDTA溶液和4.5毫升含4%EDTA)中,生长培养基(500毫升Dulbecco改良的Eagle培养基中 - 高葡萄糖[DMEM]补充有10%胎牛血清[FBS]和1mM青霉素 - 链霉素[PS]),在室温下半小时提前。
- 清除从细胞中旧的培养液。冲洗掉死细胞用3毫升的PBS,再除去PBS。
- 加入3毫升的PBS-胰蛋白酶-EDTA,后,于室温下放置1分钟,除去该溶液注:细胞的形态将改变从星形至球形。
- 从烧瓶中通过轻轻敲击的底部松开细胞和漂洗底部数次用10毫升新鲜生长培养基中收集细胞。
- 传送1毫升细胞培养物的成新的T-75烧瓶中含有14毫升新鲜的生长培养基中,在5%CO 2的加湿培养箱孵育在37℃。
HEK293T细胞2。瞬时转染
- 实际的钙动员检测前3天生长的HEK293T细胞中的T-75烧瓶发生。请务必使用三颗T-75瓶,一个用于转染与受体结构,一个用于转染空表达载体,作为阴性对照,与邻NE的转染对照。注意:如在步骤1.2中所述进行细胞的传代。当多个96孔板必须进行筛选,T-150瓶可以用来获得较高的产量细胞(做到这一点,连所有上市数量的步骤1.2.5,2.3,3.1.3和3.1.4) 。
- 培养瓶中,在37℃,5%CO 2的加湿培养箱中培养20-24小时直至细胞培养物接近50-70%汇合。
- 共转染1细胞群与编码目的和Gα16构建体的G蛋白偶联受体,该第二砂箱用空载体和Gα16构建体,并且第三 与转染对照和Gα16构建体的表达载体的构建。注意:在这个协议中, 果蝇 sNPF受体克隆到的pcDNA3.1哺乳动物表达载体13。 JetPRIME来完成转染,但其他转染试剂可作为良好。
- 添加于OTAL 7.8微克DNA(3.9微克受体构建或空载体和3.9微克Gα16表达构建),以1.5 ml离心管中,加入500μl的JetPRIME缓冲区。通过涡旋管拌匀,和自旋向下不久。
- 加入37.5微升的JetPRIME试剂,旋涡和自旋向下为1分钟,14,000×g的。孵育转染混合物10分钟,在室温下进行。
- 加入转染混合物滴加到细胞培养基中,并确保直接吸取到避免与培养瓶的壁接触的介质。在5%CO2 培养箱为20-24小时的培养瓶在37℃。
3,钙动员检测
- 收集转染的细胞和种子它们在96孔黑壁,透明底的板中。
- 将PBS,PBS-胰蛋白酶-EDTA,并在DMEM转印介质(500毫升DMEM补充有10%透析过的FBS的和1%PS)在室温下半提前一小时。
- 涂层的96孔黑壁,透明底平板用60微升PBS与纤连蛋白(0.0025%),每孔(5.85毫升的PBS并加入150μl纤连蛋白[0.1%]每盘)。培养板在室温下搅拌1小时以上的盖子。从孔中取出溶液并再孵育板1小时,而不盖子在室温下。可替换地,可以使用预涂覆板以增强细胞附着。
- 起飞从细胞老的生长培养基和冲洗死细胞脱落用3ml PBS中,去除PBS。
- 加入3毫升的PBS-胰蛋白酶-EDTA,孵育1分钟,然后取出的解决方案。注:从星形到球状细胞变化的形态。
- 从烧瓶中通过轻轻敲击的底部松开细胞和漂洗几次,用10ml的DMEM转印介质收集它们。将细胞转移到50ml Falcon管中。
- 数一数每毫升细胞数(这里有一个NucleoCounter中进行的,而是一个Burker的腔是可以接受的)。加入100微升细胞培养物在1.5ml微量离心管中。加入100μl裂解液和轻敲管混合。加入100μl稳定缓冲液,并通过点击混匀。
- 填补NucleoCassette中的细胞悬浮液,并用计数器计数细胞。乘法单元的数目由3,如将细胞以因子3增加的溶解和稳定缓冲液,在步骤3.1.6时稀释。
- 稀释细胞以600,000个细胞/ ml的终浓度和种子150微升的包被的板,每孔的细胞,得到每/孔约90,000细胞的细胞密度。避免气泡和挖掘,以获得一个连续的细胞层的板涂布细胞均匀。在一个5%CO 2的加湿培养箱中培养16-24小时,培养板在37℃。
- 加载单元与所述荧光染料和制备的共mpound板。
- 准备汉克平衡盐溶液(HBSS)/ HEPES / Ca 2 +的/牛血清白蛋白(BSA)的缓冲液:加165微升氯化钙股票溶液(1M 氯化钙蒸馏水[DH 2 O] -在室温下存储), 500μLHEPES溶液(1 M羟乙基在DH 2 O,pH值7.4 -在室温下储存)和0.05g BSA至50毫升的HBSS。注意,无脂肪酸BSA的用于钙测定中,作为脂肪酸可激活特异性受体,影响感兴趣的受体的钙信号。
- 制备丙磺舒溶液(100倍,250毫摩尔):溶解0.71克丙磺舒在5ml加入NaOH(1 M),并加入50微升的HEPES储备溶液和5ml的HBSS / HEPES /的Ca 2 + / BSA缓冲液中的-总是准备新鲜溶液。注意:丙磺舒抑制无机阴离子转运蛋白,可以移去的Fluo-4从细胞质中,从而降低了荧光信号。建议在执行染料加载中丙磺舒的存在和不存在,以确定无机阴离子转运是否存在潜在的问题,在所研究的特定的细胞系,如丙磺舒甚至可能降低激动剂介导的信号。
- 制备洗涤缓冲液:加入500μl丙磺舒溶液至50ml的HBSS / HEPES /的Ca 2 + / BSA缓冲液中,调节pH值至7.4,并滤除缓冲溶液。总是准备新鲜的缓冲液,和50毫升缓冲液每板是必需的。
- 制备10%的聚醚酸溶液:混合50μl的聚醚酸(20%w / v的在二甲亚砜[DMSO])与50微升的DMSO - 如果发生结晶,加热至37℃,并一直准备新鲜溶液。
- 制备的Fluo-4AM溶液(1mM的):添加44微升10%的聚醚酸溶液,其中包含50微克的Fluo-4 AM和涡旋直至它完全溶解小瓶中。避免暴露于光线,防止荧光漂白。
- 准备上样缓冲液:添加8.8毫升的DMEM supplementeð有10mM HEPES和2.5mM丙磺舒(pH 7.4)中的的Fluo-4AM溶液(44微升)和涡流。请务必使用新鲜的缓冲液。
- 从这些细胞弃培养基,每孔用200μlPBS洗涤细胞,并除去PBS。
- 加55微升加样缓冲液,每孔孵育1小时,在室温下进行。敷板铝箔,以防止板点燃的风险。
- 确保在屏幕前的干燥的化合物,当它们溶解在溶剂中是有害的( 例如 ,乙腈),用于在蜂窝式系统。
- 溶解肽在洗涤缓冲液中硅化的1.5 ml离心管中。制备系列稀释来执行浓度-反应分析,以确定配体的EC 50值。加70微升的配体中的复合板(V形96孔培养板)的对应以及与包括在每个板正面(内源性激动剂)和阴性对照(洗涤缓冲液)。不 E:如果化合物不溶解在洗涤缓冲液中,人们可以尝试其它溶剂是不有害于所研究的细胞,例如水或乳化,增溶油和其它水不溶性物质( 如 Kolliphor EL)的解决方案。
- 衡量一式三份的所有样本。记住,50微升从化合物板的配体将被转移到一个良好的细胞板的试验过程中加入100μl的洗涤缓冲液,使制备的化合物中的3倍的所需最终浓度。
- 从细胞板丢弃的上样缓冲液,并添加100μl的洗涤缓冲液到每个孔中。孵育板15分钟,在室温下和防止暴露于光。
- 从细胞板丢弃的洗涤缓冲液,并加入100μl的新的洗涤缓冲液到每个孔中。
- 孵育细胞培养板,该复合板,和15分钟的顶端架(96孔,站装置的枪头)在37℃下
- 创建并加载所需的协议文件的软件并激活温度控制单元,用于读出室。这里,测量钙的反应在37℃进行2分钟的一行的时间与连续的读数之间1.52秒的时间间隔(测量一个完整的96孔板约需25分钟)在525纳米。的Fluo-4的激励设置为488纳米和50微升化合物的总体积转移到细胞板,读取开始后18秒内,用分配速度设定为26微升/秒和135微升的移液管高度。
- 定位在站装置的适当的抽屉的化合物和单元板,并且末端架。
- 在端点模式相同的激发和发射波长执行单元板极的单一读出,开始在FLEX模式下的实际屏幕之前。注:本测量得到的相对荧光单位(RFU)值,并允许我们之间的变异检测板的LLS。 20,000和40,000之间的值被认为是可以接受的。
- 开始测定和分析与软件的数据。
结果
浓度系列范围从50微米到0.001 nM的被测试的所有四个果蝇 sNPF肽( 德龙 -sNPF-1:AQRSPSLRLRFamide, 德龙 -sNPF-2:SPSLRLRFamide, 德龙 -sNPF-3:PQRLRWamide, 德龙 -sNPF-4:PMRLRWamide)在HEK293T细胞中的瞬时表达果蝇 sNPF受体和混杂Gα亚基16。的G蛋白偶联受体是由所有四个肽的最终浓度达到0.1 nM的激活,和受体激活是浓度依赖性的。 图2示出对应于德龙 -sNPF-1浓度系列的三个副本1中的图形。阴性对照(洗涤缓冲液)没有诱导的荧光信号,而阳性对照(PAR 1 - 1μM)引起的强烈激活内源性蛋白酶活化受体-1,从而导致高的荧光信号(±30,000 RFU)。应当指出的是,一个偏差典型的曲线可指示异常。例如,一个持续的曲线上升,而无需返回至基线可能与非受体介导的信号,如钙离子载体的存在下,或破坏脂质双层引起钙泄漏。
该软件允许输入公式来确定激活的百分比或不同浓度等等的标准误差。所得到的数据被用来组成初步浓度-反应曲线来估计EC 50值,如为4 德龙 -sNPF肽在图3。图3中的曲线还包括阴性对照,其中浓度系列的数据德龙 - sNPF肽的转染空pcDNA3.1载体HEK293T细胞进行测试。结果表明,在加入肽对这些细胞具有内源性受体没有影响,但确实ACTIV吃感兴趣的受体。基于荧光的钙动员测定法再重复三次独立。基于初始屏幕的初步浓度-反应曲线,测出的浓度进行了调整,以覆盖曲线的动态范围( 图4)。 德龙 - sNPF-1(2.04±1.48 nM的[95%可信区间]), 德龙 - sNPF-2(5.89±3.74纳米), 德龙 - sNPF-3(5.55±3.95 nm)和德龙 - sNPF -的EC50值4(0.50±1.01 nM的)是相似的,表明它们都是同样有效的,激活的受体。
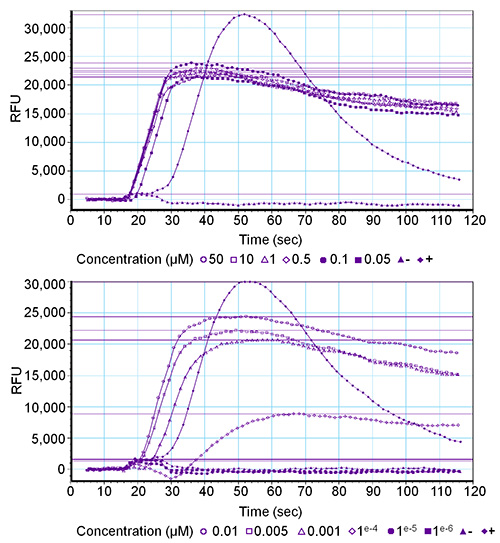
该软件的浓度系列。十二终浓度(范围从50微米到0.001 nm)的邻受体介导的荧光响应图2。图形输出F中的德龙 - sNPF-1肽是在德龙 - sNPF受体进行测试。活化被表示为相对荧光单位(RFU)的值。上图给出了六个含量最高的结果和六个最低浓度较低的曲线图。阳性对照(+)是光合有效辐射1(1μm)和阴性对照( - )是洗涤缓冲液。
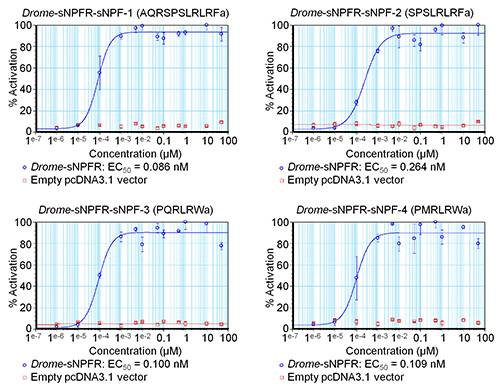
图3由一个单一的基于荧光的钙动员测定法测定果蝇 sNPF肽的初步浓度-反应曲线。 果蝇 sNPF受体瞬时表达在HEK293T细胞中的4 果蝇 sNPF肽的浓度-响应曲线以蓝色显示。对于阴性对照(以红色显示),肽在HEK293T测试转染空pcDNA3.1载体。荧光响应被示出为相对值(%)到最高值(100%活性)。该曲线是一个实验中,每个浓度系列进行测定以一式三份的结果。垂直条代表平均值(SEM),这有时会比所用的符号更小的标准误差(在这种情况下,只有符号被描绘)。
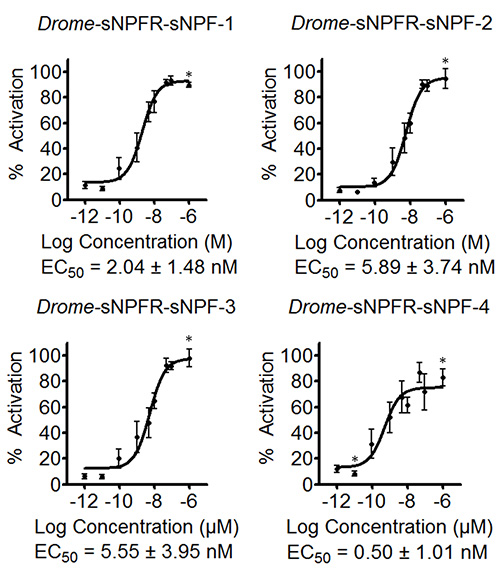
图4的浓度-反应曲线和相应的由三个独立的动员基于荧光的钙测定法测定果蝇 sNPF肽的EC 50值。的Drosopihla sNPF受体的浓度反应曲线中瞬时表达在HEK293T细胞中的4 果蝇 sNPF肽的结果三个独立的我asurements各一式三份(N≥10)。荧光响应被示出为相对值(%)到最高值(100%活性)。星号表示浓度为其中n≤9。误差棒表示SEM,这有时会比使用较小的符号(在这种情况下,只有符号被描绘)。 EC 50值显示其95%置信区间。
讨论
基于荧光的钙动员法已成功应用于确认果蝇 sNPF肽信号系统,这是已经被梅尔滕斯等人进行的功能特性。用生物发光测定法和由Feng 等与电生理测定13,15。在HEK293T细胞中的荧光测定法获得的EC 50值约10倍小于那些在CHO细胞( 德龙 - sNPF-1进行生物发光法获得:荧光= 2.04纳米,LUMI = 51 nM的, 德龙 - sNPF- 2:荧光= 5.89纳米,LUMI = 42 nM的, 德龙 - sNPF-3:荧光= 5.55纳米,LUMI = 31 nM的, 德龙 - sNPF-4:荧光= 0.50纳米,LUMI = 75纳米)。这些变化可以由多种因素,其中包括一个事实,即所用的表达系统中的一个可能更适合用于给定受体的功能性表达,或一些受体的折叠可以在C效率较低来解释ERTAIN细胞类型。所有4 德龙 -sNPF肽的EC 50值在纳摩尔范围时,其受体与两个荧光和生物发光测定中测试,通常支承在体内的肽-受体相互作用的生理学相关性。
请注意,没有转染对照与该配体激活被称为受体被列入这里呈现的画面,因为果蝇 sNPF信号系统通常是在实验设置的转染对照。阳性对照与HEK293T细胞(PAR 1)和阴性对照(洗涤缓冲液)的内源性配体,目的是提供在屏幕上。 PAR 1的结果表明,该细胞在良好的状态。阴性对照(洗涤缓冲液)没有引起荧光信号,这表明在该肽被溶解的介质是免费的,可以INF任何污染物luence结果。
以前表征的果蝇 sNPF信令系统在这里被用来解释基于荧光的钙动员测定。为了这个目的,浓度系列的激活配体,立即进行测试。然而,当一个孤儿受体被带到过表达在筛选测定,以测试含有数百种化合物的文库,建议第一屏具有相对高的最终浓度的配体( 例如 ,10或1μM)的。以下的活化化合物的检测,系列稀释该化合物的可筛选以构成一个浓度-反应曲线,并确定EC 50值。
一旦受体的活化配位体被确定,该细胞内信号转导通路可进一步通过调整协议的影响。如上面描述的测定可以执行,但不共转染的G ^5; 16亚基。当钙响应被测量,这意味着该受体伴侣与细胞表达系统的内源性Gαq亚基。当没有荧光信号观察,协议来测算其他第二信使( 如 。,cAMP)的浓度可以应用。
构效关系(SAR)的研究,也可以进行定义所需的受体活化肽的核心序列。首先,截短的序列被评估来定义的肽,其仍然能够激活该受体的最小氨基酸序列。接着,肽可以被测试,其中每一个系统的氨基酸被取代为丙氨酸残基。对受体测试合成丙氨酸替代系列允许确定每种氨基酸为受体活化24,25的重要性。
尽管其频繁使用和行之有效的efficacy,但必须强调的是,这里描述的测定,可能需要一些适应以获得最佳的结果为感兴趣的特定受体。的Gα亚基16具有它结合到大多数G蛋白偶联受体的优点,但是也有可能对受体的显性负作用内源性夫妇通过Gαq 22。在这种情况下,它可能是有用的新型钙测定法的最优化过程中,测试G蛋白的不同组合和Gα16的存在或不存在的结果GαQ-偶联受体的比较。替代性测定法,是独立的相互作用的G蛋白来检测受体激活也可以执行,例如GFP标记的休止的易位,或改变膜电位( 例如 ,由FLIPR膜电位检测试剂盒)的检测。除了使用的荧光4在这里,其他的钙敏感荧光广泛,每一个都有自己的频谱和CHEMIC人的属性,是可用的。最合适的荧光团可以基于GPCR,细胞类型和可用的板读取器进行选择,但实验验证是必要的。转染的DNA与DNA /转染试剂的比例需要为每个受体的转染试剂的细胞系组合来确定的量。最后,应当牢记的是细胞在连续培养中只允许20-25可用的通道来进行筛选试验。
披露声明
作者什么都没有透露。
致谢
作者承认了研究基金会佛兰德(FWO佛兰德,比利时,G.0601.11)和鲁汶大学研究基金会GOA/11/002。 IB,TJ和LT受益于从FWO佛兰德的奖学金。
材料
| Name | Company | Catalog Number | Comments |
| HEK293T cells | |||
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Trypsin-EDTA solution (0.25%) | Sigma-Aldrich | T4049 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | MP Biomedicals | 195173 | |
| Dulbecco's Modified Eagle's Medium - high glucose (DMEM) | Sigma-Aldrich | D5796 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Penicillin-Streptomycin (P-S) | Sigma-Aldrich | P4333 | |
| jetPRIME | Polyplus transfection | 114-01 | FuGENE HD Transfection Reagent (Promega); Lipofectamine LTX & Plus Reagent (Life technologies) |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392 | |
| Fibronectin from human plasma | Sigma-Aldrich | F0895 | |
| Reagent A100, Lysis buffer | Chemometec | 910-0003 | |
| Reagent B, Stabilizing buffer | Chemometec | 910-0002 | |
| CaCl2 | Sigma-Aldrich | C3881 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| HBSS buffer: Hank's Balanced Salt Solution | Sigma-Aldrich | H8264 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| NaOH (1 M) | Vel | 2781 | |
| Pluronic acid | Invitrogen | P-3000MP | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Fluo-4 AM | Invitrogen | F14201 | Fluo-3, Rhod-2, Fluo-5, Calcium Green-1, ... (Invitrogen) |
| TPP tissue culture flasks (T-75 and T-150) | Sigma-Aldrich | Z707503 and Z707554 | |
| FlexStation device | Molecular Devices | NOVOstar (BMG Labtechnologies); FLIPR (Fluorometric Imaging Plate Reader) (Molecular Devices) | |
| Black-walled polystyrene plates (96 wells) with clear bottom | Greiner Bio-One | 655090 | Corning 96-well flat clear bottom black polystyrene poly-D-lysine coated microplates |
| NucleoCassette | Chemometec | 941-0001 | |
| NucleoCounter NC-100 | Chemometec | ||
| Microcentrifuge tubes, siliconized | BioCision | BCS-2470 | |
| Polystyrene V-shaped 96-well plates | Greiner Bio-One | 651101 | |
| 96-Well, FlexStation pipette tips | Molecular Devices | 9000-0912 | |
| Soft Max Pro software | Molecular Devices |
参考文献
- Bockaert, J., Pin, J. P. Molecular tinkering of G protein-coupled receptors an evolutionary success. EMBO J. 18 (7), 1723-1729 (1999).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21 (1), 90-113 (2000).
- Drews, J. Drug discovery a historical perspective. Science. 287 (5460), 1960-1964 (2000).
- Marinissen, M. J., Gutkind, J. S. G-protein-coupled receptors and signaling networks emerging paradigms. Trends Pharmacol Sci. 22 (7), 368-376 (2001).
- Bendena, W. G. Neuropeptide physiology in insects. Adv Exp Med Biol. 692, 166-191 (2010).
- Van Hiel, M. . B., et al. Neuropeptide receptors as possible targets for development of insect pest control agents. Adv Exp Med Biol. 692, 211-226 (2010).
- Tang, X. . L., Wang, Y., Li, D. . L., Luo, J., Liu, M. . Y. Orphan G protein-coupled receptors (GPCRs): biological functions and potential drug targets. Acta Pharmacol Sin. 33 (3), 363-371 (2012).
- Civelli, O., Reinscheid, R. K., Zhang, Y., Wang, Z., Fredriksson, R., Schiöth, H. B. G protein-coupled receptor deorphanizations. Annu Rev Pharmacol Toxicol. 53, 127-146 (2013).
- Mertens, I., Vandingenen, A., Meeusen, T., De Loof, A., Schoofs, L. Postgenomic characterization of G-protein-coupled receptors. Pharmacogenomics. 5 (6), 657-672 (2004).
- Brough, S. J., Shah, P. Use of aequorin for G protein-coupled receptor hit identification and compound profiling. Methods Mol Biol. 552, 181-198 (2009).
- Gee, K. R., Brown, K. A., Chen, W. N. U., Bishop-Stewart, J., Gray, D., Johnson, I. Chemical and physiological characterization of fluo-4 Ca2+-indicator dyes. Cell Calcium. 27 (2), 97-106 (2000).
- Beets, I., Lindemans, M., Janssen, T., Verleyen, P. Deorphanizing G protein-coupled receptors by a calcium mobilization assay. Methods Mol Biol. 789, 377-391 (2011).
- Mertens, I., Meeusen, T., Huybrechts, R., De Loof, A., Schoofs, L. Characterization of the short neuropeptide F receptor from Drosophila melanogaster. Biochem Biophys Res Commun. 297 (5), 1140-1148 (2002).
- Lu, H. -. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. J. Vis. Exp. (50), e2732 (2011).
- Feng, G., et al. Functional characterization of a neuropeptide F-like receptor from Drosophila melanogaster. Eur. J. Neurosci. 18 (2), 227-238 (2003).
- Nässel, D. R., Wegener, C. A comparative review of short and long neuropeptide F signaling in invertebrates any similarities to vertebrate neuropeptide Y signaling. Peptides. 32 (6), 1335-1355 (2011).
- Grimmelikhuijzen, C. J. P., Hauser, F. Mini-review The evolution of neuropeptide signaling. Regul Pept. 177, S6-S9 (2012).
- Caers, J., Verlinden, H., Zels, S., Vandersmissen, H. P., Vuerinckx, K., Schoofs, L. More than two decades of research on insect neuropeptide GPCRs an overview. Front Endocrinol (Lausanne. 3 (151), 1-30 (2012).
- Kozak, M. An analysis of 5’-noncoding sequences from 699 vertebrate messenger RNAs). Nucleic Acids Res. 15 (20), 8125-8148 (1987).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase. CJ Biol Chem. 270 (25), 15175-15180 (1995).
- Ral Conklin, B., et al. Carboxyl-terminal mutations of Gqα and Gsα that alter the fidelity of receptor activation. Mol Pharmacol. 50 (4), 885-890 (1996).
- Kostenis, E. Is Gα16 the optimal tool for fishing ligands of orphan G-protein-coupled receptors. Trends Pharmacol Sci. 22 (11), 560-564 (2001).
- Robas, N. M., Fidock, M. D. Identification of orphan G protein-coupled receptor ligands using FLIPR assays. Methods Mol Biol. 306, 17-26 (2005).
- Caers, J., Peeters, L., Janssen, T., De Haes, W., Gäde, G., Schoofs, L. Structure-activity studies of Drosophila adipokinetic hormone (AKH) by a cellular expression system of dipteran AKH receptors. Gen Comp Endocrinol. 177 (3), 332-337 (2012).
- Peeters, L., et al. A pharmacological study of NLP-12 neuropeptide signaling in free-living and parasitic nematodes. Peptides. 34 (1), 82-87 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。