Method Article
Caracterización de G receptores acoplados a proteína por un ensayo de movilización de calcio basado en fluorescencia
En este artículo
Resumen
El ensayo de movilización de calcio basado en fluorescencia que aquí se describe es un sistema de cribado de la farmacología inversa medio de rendimiento para la identificación de ligando funcionalmente la activación (s) de G receptores acoplados a proteínas huérfanas (GPCRs).
Resumen
Durante más de 20 años, la farmacología inversa ha sido la estrategia por excelencia para descubrir los ligandos activadores de G receptores acoplados a proteínas huérfanas (GPCR). El inicio de un ensayo de farmacología inversa es la clonación y la posterior transfección de un GPCR de interés en un sistema de expresión celular. El receptor heterólogo expresado se desafió a continuación, con una biblioteca de compuestos de ligandos candidatos para identificar el ligando (s) del receptor activador. La activación del receptor puede ser evaluada por la medición de cambios en la concentración de moléculas de segundo mensajero reportero, como el calcio o AMPc. El ensayo de movilización de calcio basado en la fluorescencia descrito aquí es un medio de rendimiento utilizado con frecuencia inversa ensayo de farmacología. El GPCR huérfano se expresa transitoriamente en células HEK293T) (293T de riñón embrionario humano y una promiscua Gα 16 constructo es co-transfectado. Tras la unión del ligando, la activación de la subunidad Gα 16 induce la liberación de calcio fesde el retículo endoplasmático. Antes de la exploración de ligandos, las células que expresan el receptor se cargan con un indicador de calcio fluorescente, Fluo-4 acetoximetilo. La señal fluorescente de Fluo-4 es insignificante en células bajo condiciones de reposo, pero se puede amplificar más de un 100 veces en la interacción con los iones de calcio que se liberan después de la activación del receptor. La técnica descrita no requiere el establecimiento que consume tiempo de las líneas celulares transfectadas de forma estable en el que el material genético transfectado se integra en el genoma de la célula huésped. En lugar de ello, una transfección transitoria, la generación de la expresión temporal del gen diana, es suficiente para llevar a cabo el ensayo de selección. La configuración permite la detección de mediano rendimiento de cientos de compuestos. La co-transfección de la promiscua Gα 16, que se acopla a la mayoría de los GPCR, permite a la vía de señalización intracelular para ser redirigido hacia la liberación de calcio, independientemente de la vía de señalización nativa en adoquín endógenareuniones. Las células HEK293T son fáciles de manejar y han demostrado su eficacia a lo largo de los años en los ensayos de deorphanization del receptor. Sin embargo, la optimización del ensayo para receptores específicos puede seguir siendo necesario.
Introducción
Receptores acoplados a proteínas G (GPCRs) constituyen una de las familias más grandes y diversos entre todas las proteínas de la superficie celular. Su presencia en los vertebrados, invertebrados, plantas, levaduras y moho del lodo, así como en los protozoos y metazoos el primer diploblastic indica que los GPCR están entre las moléculas más antiguos vinculados con la transducción de señales 1. Sus ligandos activadores naturales comprenden una amplia diversidad de estímulos externos, incluyendo péptidos, aminas biogénicas, odorantes, glicoproteínas, y fotones 2. Como tal, estos sistemas de señalización de receptor-ligando están involucrados en una gran variedad de procesos fisiológicos. El amplio espectro funcional hace idealmente adecuado para el desarrollo de fármacos terapéuticos que cubren una amplia gama de enfermedades humanas. Acerca de 50-60% de los objetivos actuales de la droga están representados por GPCRs 3,4. Además de su gran importancia en la industria farmacéutica, los GPCR están también en el centro de atención para el desarrollo de unnueva generación de insecticidas específicos para cada especie 5,6 y plaguicidas en general. Debido a que los ligandos naturales de los GPCR son muchos aún sin identificar, que se clasifican como GPCR huérfanos. El deorphanization de estos receptores se mejorará la comprensión de sus funciones fisiológicas en los organismos y puede descubrir los supuestos objetivos para nuevas aplicaciones de medicamentos 7.
Desde la era genómica, la estrategia de la farmacología inversa es ampliamente aplicada para el deorphanization de GPCRs 8. El enfoque implica que un receptor huérfano se utiliza como un "gancho" a 'pez fuera' su ligando activando partir de un extracto biológico o a partir de una biblioteca de compuestos sintéticos. Por consiguiente, el GPCR de interés se clona y posteriormente se transfecta en un sistema de expresión celular. En los métodos más comúnmente utilizados, la activación del receptor se determina mediante la medición de los cambios en la concentración de moléculas de segundos mensajeros 9 . Los principales ensayos de selección del receptor se basan en proteínas bioluminiscentes sensibles al calcio (por ejemplo, aecuorina) 10 o indicadores de calcio fluorescentes (por ejemplo, Fluo-4) 11. Los ensayos basados en fluorescencia, en la que las células que expresan el receptor se cargan con un indicador de calcio fluorescente antes de la selección del ligando, tienen la ventaja de que permiten el cribado de alto rendimiento debido a su facilidad de uso, tiempo de lectura corta, y la flexibilidad de cribado múltiples receptores huérfanos en un plato único de 12.
Aquí, el ensayo de movilización de calcio basado en la fluorescencia se describe y se ilustra por el proceso de deorphanization de la Drosophila melanogaster corto neuropéptido F del receptor (sNPF) a fondo. Este sistema de señalización neuropeptidérgico se caracterizó originalmente por Mertens et al. en 2002 13 con un ensayo de bioluminiscencia de calcio realizado en las células (CHO) de ovario de hámster chino14 y por Feng et al. En 2003 con un ensayo electrofisiológico utilizando Xenopus ovocitos 15. La presencia del sistema de señalización de sNPF parece estar limitada al filo de Arthropoda, donde está implicada en una amplia gama de procesos que incluyen la regulación de la alimentación, el crecimiento, las reacciones de estrés, la locomoción, y los ritmos circadianos 16.
La investigación sobre los sistemas de señalización neuropeptidérgico en insectos no sólo puede conducir a nuevas dianas para el desarrollo de insecticidas, pero el conocimiento de su funcionamiento también puede ser extrapolado a otros organismos como muchos sistemas de señalización han sido generalmente bien conservadas durante la evolución 17. En la última década, se han hecho grandes avances en el proceso deorphanization de GPCRs neuropéptido insectos. A pesar de estos esfuerzos, sólo un pequeño número de receptores se han adaptado a su ligando afín, y las cargas de información de secuencia paranuevos GPCR huérfanos se ha convertido en disponible debido al auge de la genómica 18. La disponibilidad de enfoques / selección de alto rendimiento medianas, como el ensayo de movilización de calcio basado en fluorescencia que ha demostrado ser una técnica ampliamente aplicado 9,18, por lo tanto, es de gran valor.
El ensayo de movilización de calcio basado en la fluorescencia como se describe aquí se lleva a cabo en el 293T de riñón embrionario humano (HEK293T) línea celular y utiliza una sonda fluorescente para determinar los cambios en las concentraciones de calcio intracelular después de la activación del receptor. Para garantizar una alta expresión y los niveles de traducción del receptor, una secuencia de consenso de Kozak 19 se añade al extremo 5 'de la secuencia del receptor-codificación, que posteriormente se clona en un vector de expresión (por ejemplo, serie del vector pcDNA para líneas celulares de mamífero). Como es difícil de predecir la proteína G de acoplamiento de un GPCR endógeno huérfano basado en información de la secuenciasolo, el segundo moléculas mensajeras (por ejemplo, calcio o cAMP) que se modulan después de la activación del receptor de frecuencia se desconocen antes de la identificación de ligandos. Para evitar este problema, las proteínas G promiscuas de la familia T q (por ejemplo, murino Gα 15 o Gα humano 16 [utilizado aquí]) o proteínas G quiméricas (por ejemplo, Gα qi5) que interactúan con la mayoría de los GPCR e inducen la liberación de calcio puede ser co-expresados 20,21,22. Tras la unión del ligando a su receptor, el GPCR sufre un cambio conformacional que conduce a la activación de las vías intracelulares específicas. La molécula de difosfato de guanosina (PIB), con destino en condiciones de reposo a la subunidad Gα 16, será reemplazado por un trifosfato de guanosina (GTP) molécula. Esto provoca la disociación de la proteína G heterotrimérica en un Gα 16 y Gβγ subunidad. El Gα 16 subunidad activa la fosfolipasa C &# 946; (PLCß), que a su vez hidroliza el fosfatidilinositol bisfosfato unido a la membrana (PIP 2) resultante en diacilglicerol (DAG) e inositol trifosfato (IP 3). IP 3 se extienda por todo el citoplasma y activa los canales de calcio de PI 3-dependientes presentes en la membrana del retículo endoplásmico, que induce la liberación de calcio en el citoplasma.
La liberación de calcio a la activación del receptor se produce en cuestión de segundos y puede detectarse mediante la carga de las células antes de que el ensayo de cribado con un colorante sensible al calcio, Fluo-4 como acetoximetilo (AM) 11. El grupo éster AM permite que el fluoróforo de cruzar la membrana de la célula y se escinde por esterasas citoplásmicas una vez dentro de la célula. En consecuencia, las cargas negativas de el tinte fluorescente se desenmascarados, evitando que se difunda fuera de la célula y lo que le permite interactuar con iones de calcio. La señal o fluorescentef Fluo-4 es despreciable en las células en condiciones de reposo sólo contienen concentraciones de calcio en el rango nanomolar. Sin embargo, cuando el calcio se libera tras la activación del receptor, la señal puede aumentar dependiente de la concentración a más de un 100 veces, este medio asegurar una gran relación de señal a ruido. Fluo-4 también muestra un amplio rango dinámico para la presentación de informes [calcio] alrededor de una Kd (calcio) de 345 nM, lo que es adecuado para medir los cambios de calcio fisiológicamente relevantes en una amplia gama de células. La excitación de Fluo-4 se produce a 488 nm y la emisión de fluorescencia se mide a 525 nm 11. Fluorímetros como el lector de placas de imágenes de fluorescencia (FLIPR) 23, el Novostar, o la FlexStation (dispositivo de estación) 12 son sistemas de medio / alto rendimiento que permiten la adición del compuesto simultánea y la detección de la señal de Fluo-4 tras la activación del receptor para cada bien en una placa de ensayo. El ensayo de movilización de calcio descrito aquí se basa en la estacióndispositivo de sistema de microplaca de 96 pocillos.
El software SoftMax Pro (software) se utiliza para operar el dispositivo de estación, así como para el análisis de datos. El programa muestra inmediatamente los resultados en forma de gráficos en formato de 96 pocillos. Los pozos pueden seleccionar varios al mismo tiempo para comparar los resultados de estos pozos en el mismo gráfico. Los valores de la unidad fluorescente relativa (RFU) de los pozos en cada columna se miden simultáneamente durante un período de dos minutos, comenzando antes de la adición de compuestos a los pocillos y continuando después de la medición de la señal fluorescente tras la activación del receptor. Típicamente, la tendencia de una curva para el agonista se alinea con la línea de base hasta un compuesto activador se añade a las células, lo que resulta en un rápido aumento de la señal fluorescente. La altura del pico se correlaciona con la concentración de agonista final en el pozo. Después de la cumbre, la señal fluorescente cae lentamente hacia el nivel basal. La mediciones RFU can puede convertir en curvas de concentración-respuesta para determinar el valor de CE 50 (concentración efectiva media máxima) de un ligando. En general, al menos tres pantallas independientes, cada uno con tres réplicas de una serie de concentraciones, se debe realizar para componer una curva concentración-respuesta fiable.
Se recomienda incluir varios controles positivos y negativos en el diseño experimental. En primer lugar, un control de transfección, es decir, la aplicación de un receptor con un ligando conocido, debe ser probado. Esto permite comprobar si el agente de transfección estaba en funcionamiento. Incorporación de un experimento de control con un agonista de un receptor endógeno de la línea celular y un control negativo (por ejemplo, tampón de lavado) también se recomienda vigilar la salud y la viabilidad de las células y para excluir la posibilidad de que el tampón de lavado estaba contaminada con un factor que podría provocar una auto-Fluorerespuesta aroma. Agonistas utilizados frecuentes son un péptido derivado de la proteasa activado del receptor-1 (PAR 1), que actúa como un agonista de PAR 1 selectivo, o carbacol, que activa el receptor de la acetilcolina. Las células transfectadas con un vector de expresión vacío también deben ser probados para excluir que los compuestos activos interactúan con los receptores endógenos de la célula. La optimización de varios parámetros descritos en el protocolo a continuación puede ser necesario para sistemas de señalización diferentes. Una figura esquemática del ensayo de movilización de calcio basado en la fluorescencia completa se representa en la Figura 1.
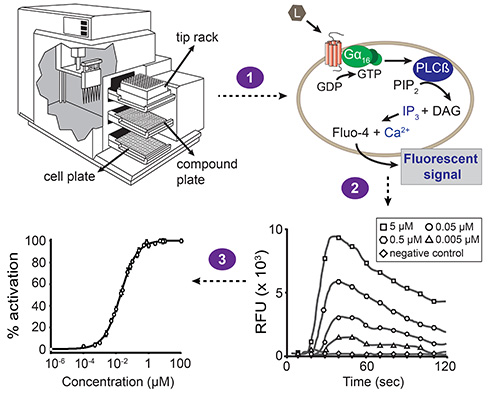
Mediciones de la Figura 1. Esquema general del ensayo de movilización de calcio basado en fluorescencia. Automatizado de manejo de líquidos y de fluorescencia simultánea se llevan a cabo con la estaciónlector de microplacas dispositivo, impulsado por el software. El dispositivo de la estación tiene tres cajones: uno para la placa celular, placa compuesta y de rack punta. Los compuestos transferencias de pipeteadores de construcción a partir de una columna de la placa de compuesto a la columna correspondiente de la placa de células (paso 1). Cada pocillo de la placa de la célula contiene una monocapa de células HEK293T que han sido co-transfectadas con el GPCR de interés y la promiscua Gα 16 subunidad. Cuando un compuesto activa el receptor, el PIB Gα 16 unida-se sustituye por GTP. El Gα 16 subunidad disocia posteriormente desde el complejo de Gβγ y activa la fosfolipasa Cβ (PLCß), que a su vez hidroliza bifosfato de fosfatidilinositol (PIP 2) resultante en diacilglicerol (DAG) e inositol trifosfato (IP 3). IP IP 3 activa los canales de calcio dependiente de 3-presentes en la membrana del retículo endoplasmático, la inducción de la liberación de calcio into el citoplasma. La interacción de calcio con Fluo-4 (con la que las células se cargan antes de la adición del compuesto) da como resultado una señal fluorescente (paso 2). El software presenta los resultados como unidad fluorescente relativa valores (RFU) en función del tiempo, y alturas de pico se correlaciona con la concentración de ligando en una manera dependiente de la concentración. Estos datos pueden ser luego convertidos en una curva de concentración-respuesta para determinar el valor de CE 50 de un par ligando-receptor (paso 3).
Protocolo
Nota: Todas las acciones en las que las células están involucradas deben llevarse a cabo en un ambiente estéril, trabajando en un flujo laminar.
1. Mantenimiento de la línea celular HEK293T
- Cultivar las células HEK293T en un matraz T-75 a 37 ° C en un incubador de CO2 al 5% humidificado.
- Pasaje de las células cuando se alcanza una confluencia de 80%. Nota: Esto toma normalmente de 3 a 4 días. Las células en cultivo continuo permiten 20-25 pasajes utilizables para la detección.
- Coloque salina tamponada con fosfato de la Dulbecco (PBS) sin cloruro de calcio y cloruro de magnesio, PBS--tripsina etilendiaminotetraacético ácido (EDTA) (500 ml de PBS suplementado con 10 ml de solución de tripsina-EDTA y 4,5 ml de 4% de EDTA) y medio de crecimiento (500 ml medio de Eagle modificado de Dulbecco - altos de glucosa [DMEM] suplementado con 10% de suero fetal bovino [FBS] y 1 mM de penicilina-estreptomicina [PS]) a temperatura ambiente media hora de antelación.
- Eliminarel viejo medio de crecimiento de las células. Enjuague las células muertas con 3 ml de PBS y retire la PBS de nuevo.
- Añadir 3 ml de PBS-tripsina-EDTA, se incuba durante 1 min a temperatura ambiente y eliminar la solución Nota: La morfología de las células cambiará de a en forma de esfera en forma de estrella.
- Aflojar las células del fondo del matraz golpeando ligeramente y recoger las células por lavado la parte inferior varias veces con 10 ml de medio de crecimiento fresco.
- Se transfiere 1 ml del cultivo de células en un nuevo T-75 frasco contiene 14 ml de medio de cultivo fresco y se incuba a 37 ° C en un incubador de CO2 al 5% humidificado.
2. Transfección transitoria de células HEK293T
- Cultivar las células HEK293T en un matraz T-75 3 días antes del ensayo real de movilización de calcio se lleva a cabo. Asegúrese de utilizar tres matraces T-75, uno para la transfección con la construcción del receptor, una para la transfección con un vector vacío de expresión, como control negativo, y oNE para el control de transfección. Nota: El paso de las células se realizó como se describe en el paso 1.2. Cuando varias placas de 96 pocillos tienen que ser controlados, matraces T-150 se puede utilizar para obtener un mayor rendimiento de las células (para ello, dobles, todas las cantidades que figuran en los pasos 1.2.5, 2.3, 3.1.3 y 3.1.4) .
- Los frascos se incuban a 37 ° C en un incubador de CO2 humidificado 5% de 20 a 24 horas hasta que los cultivos celulares se acercan a un 50-70% de confluencia.
- Co-transfectar una población de células con el vector de expresión que codifica el GPCR de interés y la Gα 16 constructo, el segundo matraz con el vector vacío y el constructo Gα 16, y el tercero con el control de transfección y la Gα 16 constructo. Nota: En este protocolo, el receptor de Drosophila sNPF fue clonado en un vector de expresión de mamífero pcDNA3.1 13. JetPRIME se utilizó para realizar la transfección, pero otros reactivos de transfección se puede utilizar también.
- Añadir aotal de 7,8 g de ADN (3,9 mg constructo receptor o vector vacío, y 3,9 mg Gα 16 construcción de expresión) a un tubo de microcentrífuga de 1,5 ml y añadir 500 l de la memoria intermedia JetPRIME. Mezclar bien por agitación del tubo y centrifugar brevemente.
- Añadir 37,5 l de reactivo JetPRIME, vortex y centrifugar durante 1 min a 14.000 x g. Incubar la transfección mezcla 10 min a temperatura ambiente.
- Añadir gota a gota la mezcla de transfección al medio de cultivo celular y asegúrese de pipeta directamente en el medio de evitar el contacto con las paredes del matraz de cultivo. Los frascos se incuban a 37 ° C en un incubador de CO2 humidificado 5% de 20-24 h.
3. Ensayo de movilización de calcio
- Recoger las células transfectadas y sembrar en placas de 96 pocillos de paredes negras, claras inferior.
- Coloque el PBS, PBS-Tripsina-EDTA y el medio de transferencia de DMEM (500 ml de DMEM suplementado con 10% FBS dializadoy 1% PS) a temperatura ambiente media hora de antelación.
- Escudo el 96 pocillos, placas de fondo transparente de paredes negras con 60 l de PBS con fibronectina (0,0025%) por pocillo (5,85 ml de PBS y 150 l de fibronectina [0,1%] por placa). Incubar las placas a temperatura ambiente durante 1 hora con la tapa puesta. Eliminar la solución de los pocillos y las placas se incuban de nuevo durante 1 hora sin la tapa en a temperatura ambiente. Alternativamente, es posible utilizar placas de pre-revestidos para mejorar la unión de las células.
- Quítese el viejo medio de crecimiento de las células y las células muertas de enjuague con 3 ml de PBS y retire la PBS.
- Añadir 3 ml de PBS-tripsina-EDTA, se incuba durante 1 min, a continuación, retire la solución. Nota: La morfología de las células cambia de forma de estrella con forma de esfera a.
- Aflojar las células del fondo del matraz golpeando ligeramente y recogerlas por lavado varias veces con 10 ml de medio de transferencia de DMEM. Transferencia de las células en un tubo Falcon de 50 ml.
- Cuente elnúmero de células por ml (realizó con un NucleoCounter aquí, pero de una cámara de Burker es aceptable). Añadir 100 l de cultivo celular en un tubo de microcentrífuga de 1,5 ml. Añadir 100 l de tampón de lisis y mezclar tocando el tubo. Añadir 100 l de tampón estabilizar y mezclar tocando.
- Llenar un NucleoCassette con la suspensión de células y contar las células con el contador. Multiplicar el número de células por tres, como las células se diluyeron por un factor de tres, cuando la adición de la lisis y la estabilización de tampón en el paso 3.1.6.
- Diluir las células hasta una concentración final de 600.000 células / ml y sembrar 150 l de las células por pocillo en las placas recubiertas para obtener una densidad celular de aproximadamente 90.000 células por / pocillo. Evite las burbujas de aire y toque la placa de difundir las células de manera uniforme con el fin de obtener una capa de células contiguas. Incubar las placas a 37 ° C en un incubador de CO2 humidificado 5% durante 16-24 horas.
- Cargar las células con el colorante fluorescente y preparar el coplaca mpound.
- Prepare una solución salina equilibrada de Hank (HBSS) / HEPES / Ca 2 + / albúmina de suero bovino (BSA) de amortiguación: añadir 165 l de solución madre CaCl2 (1 M CaCl2 en agua destilada [DH 2 O] - guárdelo a temperatura ambiente), solución de 500 l HEPES acciones (1 M HEPES en dH 2 O, pH 7,4 - guárdelo a temperatura ambiente), y 0,05 g de BSA a 50 ml de HBSS. Tenga en cuenta que el ácido graso libre de BSA se utiliza para los ensayos de calcio, como ácidos grasos pueden activar los receptores específicos que afecte a la señal de calcio del receptor de interés.
- Preparar la solución de probenecid (100x, 250 mM): disolver 0,71 g de probenecid en 5 ml de NaOH (1 M) y añadir 50 l HEPES solución madre y 5 ml de la / HEPES / Ca 2 + tampón HBSS / BSA - Siempre prepare solución fresca. Nota: El probenecid inhibe transportadores de aniones inorgánicos que se pueden desprender de Fluo-4 desde el citoplasma, reduciendo de este modo la señal fluorescente. Se recomienda llevar a cabo la carga de colorante enla presencia y ausencia de probenecid para determinar si los transportadores de aniones inorgánicos presentan un problema potencial en las líneas de células particulares bajo investigación, como probenecid puede incluso disminuir la señal mediada por el agonista.
- Prepare el buffer de lavado: añadir 500 l de solución de probenecid a 50 ml HBSS / HEPES / Ca 2 + / tampón BSA, ajustar el pH a 7,4 y filtrar la solución tampón. Siempre prepare tampón fresco, y 50 ml de tampón por se requiere placa.
- Preparar la solución de ácido plurónico 10%: mezclar 50 l de ácido plurónico (20% w / v en dimetil-sulfóxido [DMSO]) con 50 l de DMSO - si se produce la cristalización, el calor a 37 ° C y siempre preparar una solución fresca.
- Preparar Fluo-4 AM solución (1 mM): añadir 44 l solución de ácido plurónico 10% a un vial que contiene 50 mg de Fluo-4 a.m. y agitar hasta que se disuelve completamente. Evite la exposición a la luz para evitar la decoloración del fluoróforo.
- Prepare el tampón de carga: añadir 8,8 ml DMEM supplemented con HEPES 10 mM y probenecid 2,5 mM (pH 7,4) a la solución de Fluo-4 a.m. (44 l) y agitar. Utilice siempre tampón fresco.
- Desechar medio de las células, se lavan las células con 200 l de PBS por pocillo, y eliminar PBS.
- Añadir 55 l de tampón de carga por pocillo e incubar durante 1 hora a temperatura ambiente. Envolver la placa en papel de aluminio para evitar la exposición de la placa a la luz.
- Asegúrese de secar los compuestos antes de la pantalla si se disuelven en disolventes que son perjudiciales (por ejemplo, acetonitrilo) para el sistema de expresión celular.
- Solubilizar los péptidos en tampón de lavado en tubos de 1,5 ml de microcentrífuga siliconados. Preparar una serie de diluciones para llevar a cabo un análisis de concentración-respuesta y para determinar el valor de CE 50 de un ligando. Añadir 70 l de ligando en el pocillo correspondiente de la placa de compuesto (placas de 96 pocillos en forma de V) e incluyen controles positivos (agonista endógeno) y negativos (tampón de lavado) en cada plato. No E: Si un compuesto no es soluble en el tampón de lavado, se puede tratar de otros disolventes que no son perjudiciales para las células bajo investigación, tales como el agua o soluciones que emulsionan y solubilizar aceites y otras sustancias insolubles en agua (por ejemplo, Kolliphor EL) .
- Mida todas las muestras por triplicado. Tenga en cuenta que 50 l de un ligando de la placa de compuesto se transferirán a un pozo con 100 l de tampón de lavado de la placa de la célula durante el ensayo, por lo que la preparación de los compuestos a 3 veces la concentración final deseada.
- Desechar el tampón de carga de la placa de células y añadir tampón de lavado 100 l a cada pocillo. Incubar la placa 15 min a temperatura ambiente y evitar la exposición a la luz.
- Deseche el tampón de lavado de la placa celular y añadir 100 nuevo buffer de lavado l a cada pocillo.
- Incubar la placa celular, la placa de compuesto, y un estante de la punta (96 pocillos, puntas de pipetas dispositivo de estación) durante 15 min a 37 ° C.
- Crear y cargar el archivo de protocolo deseado con el software y activar la unidad de control de temperatura para la cámara de lectura. Aquí, medir las respuestas de calcio a 37 ° C durante 2 minutos una fila a la vez con 1.52 segundos de intervalo entre lecturas sucesivas (la medición de una placa de 96 pocillos completa tarda aproximadamente 25 min) a 525 nm. Establecer la excitación de Fluo-4 a 488 nm y transferir un volumen total de 50 l de compuesto a la placa de células, 18 seg después del inicio de lectura, con la velocidad de dispensación fijado en 26 mu l / s y una altura de pipeta de 135 l.
- Coloque el compuesto y la placa de la célula, y la cremallera de punta en los cajones correspondientes del dispositivo de estación.
- Lleve a cabo una sola lectura de la placa de la célula al mismo excitación y emisión de longitud de onda en el modo de punto final, antes de iniciar la pantalla real en modo FLEX. Nota: Esta medición da unidad de los valores de fluorescencia relativa (RFU) y permite la detección de la variabilidad entre noslls de la placa. Los valores entre 20000 y 40000 son considerados como aceptables.
- Inicie el ensayo y análisis de los datos con el software.
Resultados
Concentración series que van desde 50 M a 0,001 nM fueron probados para los cuatro péptidos Drosophila SNPF (Drome-sNPF-1: AQRSPSLRLRFamide, Drome-SNPF-2: SPSLRLRFamide, Drome-SNPF-3: PQRLRWamide, Drome-SNPF-4: PMRLRWamide) en células HEK293T que expresan transitoriamente el receptor de Drosophila sNPF y la promiscua Gα 16 subunidad. El GPCR se activó por todos los cuatro péptidos en concentraciones finales de hasta 0,1 nM, y la activación del receptor fue dependiente de la concentración. Figura 2 representa los gráficos correspondientes a uno de los tres réplicas de la serie de concentración Drome-sNPF-1. El control negativo (tampón de lavado) no indujo una señal fluorescente, mientras que el control positivo (PAR 1 - 1 M) provocó una fuerte activación de la proteasa activado del receptor-1, que conduce a una señal fluorescente de alta (± 30 000 RFU) endógena. Cabe señalar que una desviación dela curva típica puede indicar anormalidades. Por ejemplo, un aumento continuo de la curva sin volver a la línea de base podría estar relacionado con señales no mediadas por el receptor, tales como la presencia de ionóforos de calcio, o una bicapa de lípidos alterado causando fugas de calcio.
El software permite entrar en fórmulas para determinar el porcentaje de activación o los errores estándar de las diferentes concentraciones entre otros. Los datos resultantes se utilizan para componer las curvas de concentración-respuesta preliminar para estimar los valores de CE 50, como se muestra para los cuatro péptidos Drome-sNPF en la Figura 3. Las curvas de la Figura 3 también incluyen los datos para el control negativo donde la serie de concentración de los péptidos Drome-sNPF fueron probados en células HEK293T transfectadas con un vector pcDNA3.1 vacío. Los resultados indican que la adición de los péptidos a estas células no tienen ningún efecto sobre los receptores endógenos, pero de hecho la actividadate el receptor de interés. A continuación, el ensayo de movilización de calcio basado en la fluorescencia se repitió tres veces de forma independiente. Basado en las curvas preliminares de concentración-respuesta de la pantalla inicial, las concentraciones ensayadas fueron adaptados para cubrir el rango dinámico de la curva (Figura 4). Los valores de EC50 de Drome-sNPF-1 (2,04 ± 1,48 nM [intervalo de confianza del 95%]), Drome-sNPF-2 (5,89 ± 3,74 nM), Drome-sNPF-3 (5,55 ± 3,95 nM) y Drome-sNPF- 4 (0,50 ± 1,01 nM) son similares, lo que indica que son igualmente potentes para activar el receptor.
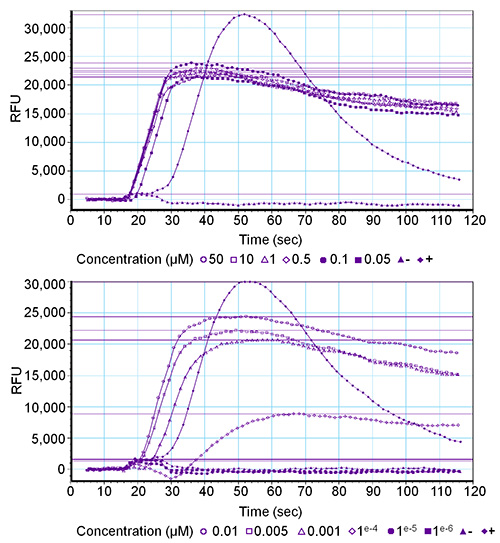
Figura 2. Gráfica de salida del software para una respuesta de fluorescencia mediada por el receptor de una serie de concentraciones. Doce concentraciones finales (que van de 50 M a 0.001 nm) of péptido-Drome sNPF-1 fueron probados en el receptor-Drome sNPF. La activación se expresa en unidad de fluorescencia relativa (RFU) valores. El gráfico superior muestra los resultados de los seis concentraciones más altas y el gráfico inferior de las seis concentraciones más bajas. El control positivo (+) es PAR 1 (1 M) y el control negativo (-) es tampón de lavado.
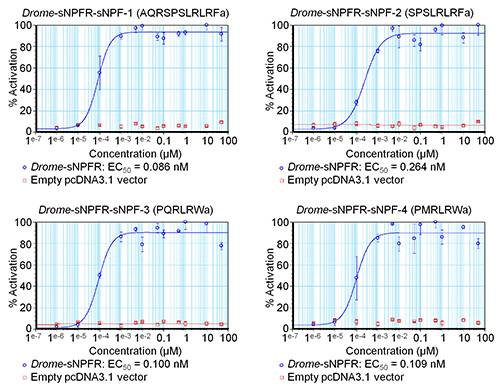
Figura 3. Curvas de concentración-respuesta preliminar de péptidos de Drosophila sNPF determinados por un único ensayo de movilización de calcio basado en fluorescencia. Las curvas de concentración-respuesta del receptor de Drosophila sNPF expresado transitoriamente en células HEK293T para los cuatro péptidos de Drosophila sNPF se muestran en azul. Para los controles negativos (en rojo), los péptidos fueron probados en HEK293Tcélulas transfectadas con un vector pcDNA3.1 vacío. Las respuestas fluorescentes se muestran como relativo (%) al valor más alto (100% de activación). Las curvas son el resultado de un experimento en el que se midió cada serie de concentración por triplicado. Las barras verticales representan los errores estándar de la media (SEM), que a veces son más pequeños que los símbolos utilizados (en ese caso, sólo los símbolos se representan).
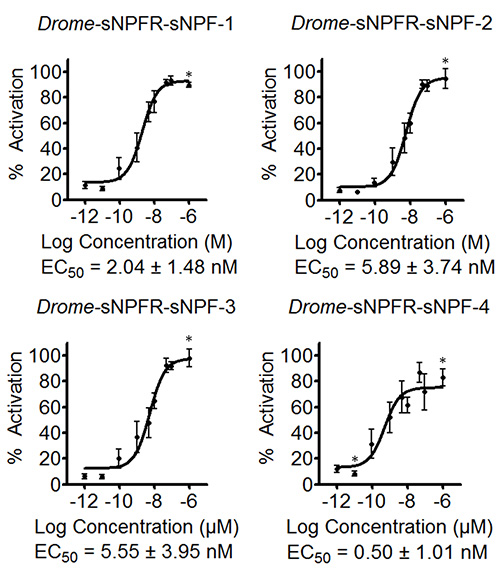
Figura 4. Curvas de concentración-respuesta y la correspondiente CE 50 valores de péptidos de Drosophila sNPF determinados por tres ensayos de movilización de calcio basado en fluorescencia independientes. Las curvas de concentración-respuesta del receptor de Drosopihla sNPF expresados transitoriamente en células HEK293T para los cuatro péptidos de Drosophila sNPF son el resultado de tres me independientehicieron mediciones cada uno realizado por triplicado (n ≥ 9). Las respuestas fluorescentes se muestran como relativo (%) al valor más alto (100% de activación). Los asteriscos indican concentraciones para los cuales n ≤ 9. Las barras de error indican la SEM, que a veces son más pequeños que los símbolos utilizados (en ese caso, sólo los símbolos se representan). CE 50 valores se muestran con sus intervalos de confianza del 95%.
Discusión
El ensayo de movilización de calcio basado en la fluorescencia se aplicó con éxito para confirmar la caracterización funcional del sistema de señalización peptidergic de Drosophila sNPF, que ya fue realizada por Mertens et al. con un ensayo de bioluminiscencia y por Feng et al. con un 13,15 ensayo electrofisiológico. Los valores de EC50 obtenidos con el ensayo de fluorescencia en las células HEK293T son alrededor de 10 veces menos que los obtenidos con el ensayo de bioluminiscencia realizado en células CHO (Drome-sNPF-1: fluo = 2,04 nM, lumi = 51 nM; Drome-sNPF- 2: fluo = 5,89 nM, lumi = 42 nM; Drome-sNPF-3: fluo = 5,55 nM, lumi = 31 nM; Drome-sNPF-4: fluo = 0,50 nM, lumi = 75 nM). Estas variaciones se explican por diversos factores, como el hecho de que uno de los sistemas de expresión utilizados pueden ser más adecuados para la expresión funcional de un receptor dado, o el plegamiento de algunos receptores puede ser menos eficiente en ctipos de células Ertain. Los valores de EC50 de los cuatro péptidos Drome-sNPF están en el rango nanomolar cuando se prueba en su receptor con tanto la fluorescencia y el ensayo de bioluminiscencia, en general, el apoyo a la relevancia fisiológica de su interacción péptido-receptor in vivo.
Tenga en cuenta que ningún control de la transfección con un receptor para el que se conoce el ligando activador se incluyó en la pantalla que se presenta aquí, debido a que el sistema de señalización de Drosophila sNPF es normalmente el control de transfección en configuraciones experimentales. El control positivo con un ligando endógeno de las células HEK293T (PAR 1) y el control negativo (tampón de lavado) se incluyeron en la pantalla. Los resultados de PAR 1 mostraron que las células estaban en un buen estado. El control negativo (tampón de lavado) no indujo una señal fluorescente, que indica que el medio en el que se disuelven los péptidos estaba libre de cualquier contaminante que podrían INFluence los resultados.
Se utilizó el sistema de señalización de Drosophila sNPF caracterizado previamente aquí para explicar el ensayo de movilización de calcio basado en fluorescencia. Para este propósito, la serie de concentración de los ligandos activadores se ensayaron inmediatamente. Sin embargo, cuando un receptor huérfano se lleva a la sobreexpresión en un ensayo de cribado para probar una biblioteca que contiene cientos de compuestos, se recomienda primera pantalla con concentraciones finales relativamente altos de los ligandos (por ejemplo., 10 o 1 mM). Tras la detección de un compuesto activador, una serie de dilución de compuesto que se puede cribar con el fin de componer una curva de concentración-respuesta y para determinar el valor de CE 50.
Una vez que se determina la activación de ligando de un receptor, la vía de señalización intracelular puede investigarse más a fondo mediante la adaptación del protocolo. El ensayo se puede realizar como se describe anteriormente, pero sin la co-transfección del G ^5; 16 subunidad. Cuando se mide una respuesta de calcio, que significa que las parejas receptor con una endógeno Gα q subunidad del sistema de expresión celular. Cuando no se observa ninguna señal fluorescente, los protocolos para medir los cambios en las concentraciones de otros mensajeros secundarios (p. ej., Camp) se pueden aplicar.
Estudios de relación estructura-actividad (SAR) también pueden llevarse a cabo para definir secuencia central del péptido requerida para la activación del receptor. En primer lugar, secuencias truncadas se evalúan para definir la secuencia de aminoácidos mínima del péptido que todavía es capaz de activar el receptor. A continuación, los péptidos se pueden probar en el que sistemáticamente cada aminoácido ha sido sustituido por un residuo de alanina. Prueba de serie-la sustitución de alanina sintético en el receptor permite determinar la importancia de cada uno de los aminoácidos para la activación de los receptores 24,25.
A pesar de su uso frecuente y eficiencia demostradascacia, se ha de destacar que el ensayo descrito aquí puede necesitar algunas adaptaciones para obtener resultados óptimos para los receptores específicos de interés. La subunidad Gα 16 tiene la ventaja de que se une a la mayoría de los GPCR, pero también puede tener un efecto dominante negativo sobre los receptores que endógenamente pareja a través de Gα Q 22. En este caso, puede ser útil para probar diferentes combinaciones de las proteínas G durante la optimización de un ensayo de calcio novela y para comparar los resultados para Gα receptores q acoplado en la ausencia o presencia de Gα 16. Ensayos alternativos que son independientes de la interacción de proteínas G para detectar la activación del receptor también se pueden realizar, tales como la translocación de arrestina GFP marcado, o la detección de cambios en el potencial de membrana (por ejemplo., Por el Kit de Ensayo de Potencial de Membrana FLIPR). Además de la Fluo-04 a.m. utiliza aquí, una amplia gama de otros fluoróforos sensibles al calcio, cada uno con su propia espectral y chemiccol propiedades, disponible. El fluoróforo más adecuado puede ser seleccionado basado en el GPCR, tipo de célula y el lector de placas disponibles, pero la verificación experimental es necesario. Las cantidades de ADN transfectadas y la necesidad de relación de reactivo DNA / transfección que se determine para cada combinación línea de células de reactivo receptor de la transfección. Por último, se debe tener en cuenta que las células en cultivo continuo sólo permiten 20-25 pasajes utilizables para llevar a cabo los ensayos de selección.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a la Fundación de Investigación de Flandes (FWO-Vlaanderen, Bélgica, G.0601.11) y la Universidad Católica de Lovaina Investigación Fundación GOA/11/002. IB, TJ y LT se benefician de una beca de la FWO-Vlaanderen.
Materiales
| Name | Company | Catalog Number | Comments |
| HEK293T cells | |||
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Trypsin-EDTA solution (0.25%) | Sigma-Aldrich | T4049 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | MP Biomedicals | 195173 | |
| Dulbecco's Modified Eagle's Medium - high glucose (DMEM) | Sigma-Aldrich | D5796 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Penicillin-Streptomycin (P-S) | Sigma-Aldrich | P4333 | |
| jetPRIME | Polyplus transfection | 114-01 | FuGENE HD Transfection Reagent (Promega); Lipofectamine LTX & Plus Reagent (Life technologies) |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392 | |
| Fibronectin from human plasma | Sigma-Aldrich | F0895 | |
| Reagent A100, Lysis buffer | Chemometec | 910-0003 | |
| Reagent B, Stabilizing buffer | Chemometec | 910-0002 | |
| CaCl2 | Sigma-Aldrich | C3881 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| HBSS buffer: Hank's Balanced Salt Solution | Sigma-Aldrich | H8264 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| NaOH (1 M) | Vel | 2781 | |
| Pluronic acid | Invitrogen | P-3000MP | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Fluo-4 AM | Invitrogen | F14201 | Fluo-3, Rhod-2, Fluo-5, Calcium Green-1, ... (Invitrogen) |
| TPP tissue culture flasks (T-75 and T-150) | Sigma-Aldrich | Z707503 and Z707554 | |
| FlexStation device | Molecular Devices | NOVOstar (BMG Labtechnologies); FLIPR (Fluorometric Imaging Plate Reader) (Molecular Devices) | |
| Black-walled polystyrene plates (96 wells) with clear bottom | Greiner Bio-One | 655090 | Corning 96-well flat clear bottom black polystyrene poly-D-lysine coated microplates |
| NucleoCassette | Chemometec | 941-0001 | |
| NucleoCounter NC-100 | Chemometec | ||
| Microcentrifuge tubes, siliconized | BioCision | BCS-2470 | |
| Polystyrene V-shaped 96-well plates | Greiner Bio-One | 651101 | |
| 96-Well, FlexStation pipette tips | Molecular Devices | 9000-0912 | |
| Soft Max Pro software | Molecular Devices |
Referencias
- Bockaert, J., Pin, J. P. Molecular tinkering of G protein-coupled receptors an evolutionary success. EMBO J. 18 (7), 1723-1729 (1999).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21 (1), 90-113 (2000).
- Drews, J. Drug discovery a historical perspective. Science. 287 (5460), 1960-1964 (2000).
- Marinissen, M. J., Gutkind, J. S. G-protein-coupled receptors and signaling networks emerging paradigms. Trends Pharmacol Sci. 22 (7), 368-376 (2001).
- Bendena, W. G. Neuropeptide physiology in insects. Adv Exp Med Biol. 692, 166-191 (2010).
- Van Hiel, M. . B., et al. Neuropeptide receptors as possible targets for development of insect pest control agents. Adv Exp Med Biol. 692, 211-226 (2010).
- Tang, X. . L., Wang, Y., Li, D. . L., Luo, J., Liu, M. . Y. Orphan G protein-coupled receptors (GPCRs): biological functions and potential drug targets. Acta Pharmacol Sin. 33 (3), 363-371 (2012).
- Civelli, O., Reinscheid, R. K., Zhang, Y., Wang, Z., Fredriksson, R., Schiöth, H. B. G protein-coupled receptor deorphanizations. Annu Rev Pharmacol Toxicol. 53, 127-146 (2013).
- Mertens, I., Vandingenen, A., Meeusen, T., De Loof, A., Schoofs, L. Postgenomic characterization of G-protein-coupled receptors. Pharmacogenomics. 5 (6), 657-672 (2004).
- Brough, S. J., Shah, P. Use of aequorin for G protein-coupled receptor hit identification and compound profiling. Methods Mol Biol. 552, 181-198 (2009).
- Gee, K. R., Brown, K. A., Chen, W. N. U., Bishop-Stewart, J., Gray, D., Johnson, I. Chemical and physiological characterization of fluo-4 Ca2+-indicator dyes. Cell Calcium. 27 (2), 97-106 (2000).
- Beets, I., Lindemans, M., Janssen, T., Verleyen, P. Deorphanizing G protein-coupled receptors by a calcium mobilization assay. Methods Mol Biol. 789, 377-391 (2011).
- Mertens, I., Meeusen, T., Huybrechts, R., De Loof, A., Schoofs, L. Characterization of the short neuropeptide F receptor from Drosophila melanogaster. Biochem Biophys Res Commun. 297 (5), 1140-1148 (2002).
- Lu, H. -. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. J. Vis. Exp. (50), e2732 (2011).
- Feng, G., et al. Functional characterization of a neuropeptide F-like receptor from Drosophila melanogaster. Eur. J. Neurosci. 18 (2), 227-238 (2003).
- Nässel, D. R., Wegener, C. A comparative review of short and long neuropeptide F signaling in invertebrates any similarities to vertebrate neuropeptide Y signaling. Peptides. 32 (6), 1335-1355 (2011).
- Grimmelikhuijzen, C. J. P., Hauser, F. Mini-review The evolution of neuropeptide signaling. Regul Pept. 177, S6-S9 (2012).
- Caers, J., Verlinden, H., Zels, S., Vandersmissen, H. P., Vuerinckx, K., Schoofs, L. More than two decades of research on insect neuropeptide GPCRs an overview. Front Endocrinol (Lausanne. 3 (151), 1-30 (2012).
- Kozak, M. An analysis of 5’-noncoding sequences from 699 vertebrate messenger RNAs). Nucleic Acids Res. 15 (20), 8125-8148 (1987).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase. CJ Biol Chem. 270 (25), 15175-15180 (1995).
- Ral Conklin, B., et al. Carboxyl-terminal mutations of Gqα and Gsα that alter the fidelity of receptor activation. Mol Pharmacol. 50 (4), 885-890 (1996).
- Kostenis, E. Is Gα16 the optimal tool for fishing ligands of orphan G-protein-coupled receptors. Trends Pharmacol Sci. 22 (11), 560-564 (2001).
- Robas, N. M., Fidock, M. D. Identification of orphan G protein-coupled receptor ligands using FLIPR assays. Methods Mol Biol. 306, 17-26 (2005).
- Caers, J., Peeters, L., Janssen, T., De Haes, W., Gäde, G., Schoofs, L. Structure-activity studies of Drosophila adipokinetic hormone (AKH) by a cellular expression system of dipteran AKH receptors. Gen Comp Endocrinol. 177 (3), 332-337 (2012).
- Peeters, L., et al. A pharmacological study of NLP-12 neuropeptide signaling in free-living and parasitic nematodes. Peptides. 34 (1), 82-87 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados