Method Article
蛍光ベースのカルシウム動員アッセイによるGタンパク質共役受容体のキャラクタリゼーション
要約
ここで説明する蛍光に基づくカルシウム動員アッセイは、オーファンGタンパク質共役受容体(GPCR)の機能的に活性化するリガンド(単数または複数)の同定のための培地スループット逆薬理スクリーニングシステムである。
要約
20年以上、逆薬理学は、オーファンGタンパク質共役受容体(GPCR)の活性化リガンドを発見するため抜群の戦略であった。逆薬理学アッセイの開始は、細胞発現系における関心対象のGPCRのクローニングおよびその後のトランスフェクションである。異種発現された受容体は、その後、受容体活性化リガンドを同定するための候補リガンド化合物ライブラリーを用いてチャレンジされる。受容体活性化は、カルシウム又はcAMPなどのセカンドメッセンジャーレポーター分子の濃度の変化を測定することによって評価することができる。ここで説明する蛍光ベースのカルシウム動員アッセイは、頻繁に使用される媒体スループットは薬理アッセイを逆になります。オーファンGPCRは、一過性ヒト胚性腎臓293T細胞(HEK293T)細胞で発現させ、無差別Gα16構築物を同時トランスフェクトされる。リガンド結合に続いて、Gα16サブユニットの活性化はカルシウムFの放出を誘導小胞体のROMをリガンドスクリーニングに先立って、受容体発現細胞を、蛍光カルシウム指示薬のFluo-4アセトキシメチルがロードされる。のFluo-4の蛍光シグナルは、静止条件下で細胞において無視できる程度であるが、受容体活性化後に放出されるカルシウムイオンとの相互作用によって100倍以上に増幅することができる。記載された技術は、トランスフェクトされた遺伝物質が宿主細胞ゲノムに組み込まれている安定にトランスフェクトされた細胞株の時間のかかる確立を必要としない。代わりに、一過性のトランスフェクションは、標的遺伝子の一時的発現を生成するスクリーニングアッセイを行うのに十分である。セットアップは、数百の化合物の中程度のスループットスクリーニングを可能にします。ほとんどのGPCRに結合するが、関係なく、内因性の敷石でネイティブシグナル伝達経路の細胞内シグナル伝達経路は、カルシウムの放出に向けてリダイレクトすることができ、無差別Gα16の同時トランスフェクションイングス。 HEK293T細胞は、取り扱いが容易であり、受容体脱オーファン化アッセイにおける年間を通じてその有効性を証明されている。しかし、特定の受容体のためのアッセイの最適化が必要に残ることがあります。
概要
Gタンパク質共役受容体(GPCR)は、すべての細胞表面タンパク質の中で最大かつ最も多様なファミリーの一つを構成する。脊椎動物、無脊椎動物、植物、酵母、及び粘菌においてだけでなく、原生動物や初期の二胚葉後生動物での存在は、GPCRは、シグナル伝達1にリンクされ、最も古い分子の一つであることを示しています。彼らの自然な活性化リガンドは、ペプチド、生体アミン、匂い物質、糖タンパク質、光子2を含む外部刺激の広い多様性を含んでいる。このように、これらの受容体 - リガンドのシグナル伝達系は、生理学的プロセスの多種多様に関与している。広いスペクトル機能性は、ヒトの疾患の広い範囲をカバーする治療薬の開発のためにそれらを最適です。現在の薬物標的の約50〜60%がGPCRは3,4で表される。製薬業界では彼らの偉大な重要性に加えて、GPCRは、開発のためのスポットライトにも記載されています一般的には種特異的な殺虫剤5,6及び農薬の新世代。多くのGPCRの天然リガンドはまだ同定されていないため、これらはオーファンGPCRに分類される。これらの受容体の脱オーファン化は生物で、その生理的役割の理解を改善し、新薬申請7のための推定標的を明らかにすることができる。
ゲノム時代以来、逆薬理学戦略は広く8のGPCRの脱オーファン化するために適用される。アプローチは、オーファン受容体は、生物学的抽出物から、または合成化合物のライブラリーから、その活性化リガンドへの「フック」「魚外」として使用されていることを意味します。目的のGPCRは、したがって、クローン化し、続いて細胞発現系でトランスフェクトされる。最も一般的に使用される方法では、受容体活性化は、二次メッセンジャー分子の濃度の変化を測定することによって決定される9 。主な受容体スクリーニングアッセイ( 例えば 、イクオリン)10や蛍光カルシウム指示薬( 例えば 、フルオ-4)11カルシウム感受性生物発光タンパク質に依存しています。受容体発現細胞前リガンドスクリーニングに蛍光カルシウム指示薬を負荷された蛍光ベースのアッセイは、それらが、それらの使いやすさ、短い読み取り時間、およびスクリーニングの柔軟性のハイスループットスクリーニングを可能にするという利点を有する単板12上に複数のオーファン受容体。
ここでは、蛍光ベースのカルシウム動員アッセイを十分に説明し、 キイロショウジョウバエの短いニューロペプチドF(sNPF)受容体の脱オーファン化過程で示されている。このneuropeptidergicシグナル伝達系は、もともとマーテンスらにより特徴付けられた。 2002年には、チャイニーズハムスター卵巣(CHO)細胞で行っカルシウム生物発光アッセイで1314と風水ら。、2003年のアフリカツメガエル卵母細胞に15を使用して電気生理学的ア ッセイとは。 sNPFシグナル伝達系の存在は、それが摂食の調節、増殖、ストレス反応、運動、および概日リズム16を含む広範囲のプロセスに関与している節足動物門の門に限定されると思われる。
昆虫におけるneuropeptidergicシグナル伝達システムの研究は、殺虫剤の開発のための新たな目標につながる可能性だけでなく、その機能についての知識はまた、多くのシグナル伝達系は、一般的によく進化17を通じて保存されている他の生物に向かって外挿することができる。過去10年間では、大きな進歩は、昆虫の神経ペプチドGPCRの脱オーファン化プロセスで行われている。これらの努力にもかかわらず、受容体の少数がその同族リガンドに整合されており、配列情報のための負荷新しいオーファンGPCRは、ゲノミクス18の急成長に利用できるようになりました。広く適用される技術9,18であることが証明された蛍光に基づくカルシウム動員アッセイのような中/高スループットスクリーニングアプローチが利用できるので、非常に貴重である。
蛍光に基づくカルシウム動員アッセイここに記載されるように、ヒト胚性腎臓293T(HEK293T)細胞株で行い、受容体活性化の際に細胞内カルシウム濃度の変化を測定するために蛍光プローブを使用する。受容体の高発現および翻訳レベルを保証するために、コザックコンセンサス配列19は、その後、発現ベクター(哺乳動物細胞株のために、例えば 、pcDNAベクター系)中にクローニングされた受容体コード配列の5 '末端に付加される。その配列情報に基づいて、オーファンGPCRの内因性Gプロテイン - 結合を予測することは困難であるように一人で、受容体の活性化の後に変調されたセカンドメッセンジャー分子( 例えば 、カルシウム又はcAMP)は、多くの場合、事前のリガンド同定には不明のまま。この問題を回避するために、ほとんどのGPCRはと相互に作用し、G qのファミリー ( 例えば 、マウス、Gα15または[ここで使用するヒトGα16)またはキメラGタンパク質( 例えば 、Gαのqi5)の無差別Gタンパク質は、カルシウムの放出を誘導することができる20,21,22共発現させることが。その受容体へのリガンドの結合の際に、GPCRは、特定の細胞内経路の活性化をもたらすコンフォメーション変化を受ける。 Gαサブユニット16に静止条件下で結合したグアノシン二リン酸(GDP)分子は、グアノシン三リン酸(GTP)分子によって置換される。これは、Gα及びGβγサブユニット16内ヘテロ三量体Gタンパク質の解離を引き起こす。 Gα16サブユニットはホスホリパーゼC&を活性化させる#946;今度はジアシルグリセロール(DAG)とイノシトール三リン酸(IP 3)、その結果、膜結合ホスファチジルイノシトールビスリ ン酸(PIP 2)を加水分解する(PLCβ)、。 IP 3は、細胞質全体に拡散し、細胞質へのカルシウムの放出を誘導する小胞体の膜に存在するIP 3依存性カルシウムチャネルを活性化するであろう。
受容体活性化によりカルシウム放出は、数秒以内に発生したFluo-4アセトキシメチル(AM)11のように、カルシウム感受性色素を用いてスクリーニングアッセイの前に細胞をロードすることによって検出することができる。 AMエステル基は、細胞膜を横断するフルオロフォアを可能にし、一旦細胞の内側の細胞質エステラーゼによって切断される。その結果、蛍光色素の負電荷が細胞から拡散し、カルシウムイオンと相互作用することを可能にするのを防ぎ、マスクされていない。蛍光信号OfはのFluo-4は、ナノモル範囲内カルシウム濃度を含有する静止条件下で細胞中にごくわずかである。カルシウムが受容体活性化の際に放出されたときしかし、信号は、本明細書大規模な信号対雑音比を確保し、100倍以上に濃度依存的に増加させることができる。のFluo-4はまた、それが適切な細胞の広範囲の生理学的に関連するカルシウムの変化を測定すること、345 nMでの K d(カルシウム)の周り[カルシウム]を報告するための大きなダイナミックレンジを示す。のFluo-4の励起は488nmで発生し、放出蛍光を525nmで11で測定される。蛍光イメージングプレートリーダー(FLIPR)23、カッセル、又はをFlexStation(基地局装置)12のような蛍光光度は、すべてのウェルについて同時に化合物の添加および受容体活性化の際のFluo-4シグナルの検出を可能にする媒体/ハイスループット系であるアッセイプレート中。ここに記載のカルシウム動員アッセイは、ステーションに依存していますデバイス96ウェルマイクロプレートシステム。
のSoftMax Proソフトウェア(ソフトウェア)は、データ分析のために、並びに局装置を操作するために使用される。プログラムはすぐに96ウェルフォーマットのグラフのような結果が表示されます。複数のウェルは、同じグラフ上に、これらのウェルの結果を比較するために同時に選択することができる。各列のウェルの相対蛍光単位(RFU)値は同時にウェルに化合物を添加する前に開始し、受容体活性化後の蛍光シグナルを測定した後に継続して、2分間の期間にわたって測定される。活性化化合物は、蛍光シグナルの急速な増加をもたらす、細胞に添加されるまで、典型的には、アゴニスト曲線の傾向は、ベースラインと整列する。ピーク高さは、ウェル中の最終アゴニスト濃度と相関している。ピークの後、蛍光シグナルは徐々にベースラインレベルに向かって降下する。 RFU測定のCAnは、リガンドのEC 50値(半最大有効濃度)を決定するために濃度-応答曲線に変換すること。一般に、少なくとも3つの独立したスクリーン、一連の濃度の3つの複製を含む各々は、信頼性の濃度 - 応答曲線を作成するために行われるべきである。
これは、実験計画のいくつかのポジティブ及びネガティブコントロールを含めることをお勧めします。まず、トランスフェクション制御は、既知のリガンドと受容体の実装、つまり 、テストする必要があります。これはトランスフェクション試薬が正常に動作したかどうかを検証することができます。細胞株および陰性対照( 例えば 、洗浄緩衝液)の内因性受容体に対するアゴニストでの対照実験の組み込みはまた、細胞の健康および生存率を監視し、洗浄緩衝液を用いて汚染された可能性を除外するために推奨されている自動fluoreを引き出す可能性が要因香り応答。頻繁に使用される作動薬は、アセチルコリン受容体を活性化するPAR 1選択的アゴニスト、又はカルバコール、として作用するプロテアーゼ活性化受容体-1(PAR 1)由来のペプチドである。空の発現ベクターでトランスフェクトされた細胞は、活性化合物は、細胞の内因性受容体と相互作用することを排除するために試験されるべきである。以下のプロトコールに記載されたいくつかのパラメータの最適化は、異なるシグナル伝達系に必要とされてもよい。完全な蛍光に基づくカルシウム動員アッセイの概略図を図1に示されている。
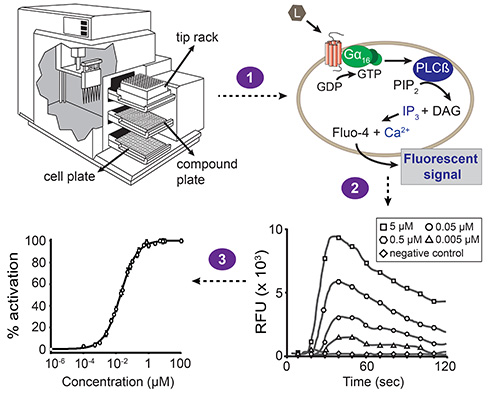
図1。蛍光ベースのカルシウム動員アッセイの全体的なスキーム。自動液体処理と同時蛍光測定は、駅で実施しているソフトウェアによって駆動されるデバイスマイクロプレートリーダー。セルプレートのための1、化合物のプレートとチップラック:局装置は3引き出しが含まれています。ビルドのピペッターを転送し、化合物プレートの1列からセルプレート(ステップ1)の対応する列への化合物。細胞プレートの各ウェルには、目的のGPCRと無差別Gα16サブユニットで同時トランスフェクトされたHEK293T細胞の単層を含んでいます。化合物が受容体を活性化すると、Gα16に結合したGDPは、GTPに置換されます。 Gα16サブユニットは、その後、Gβγ複合体から解離し、今度はホスファチジルイノシトールビスリ ン酸(PIP 2)ジアシルグリセロール(DAG)とイノシトール三リン酸(IP 3)を生じる加水分解するホスホリパーゼCβ(PLCβ)を活性化する。 IP 3は、カルシウムintの放出を誘導する、小胞体の膜に存在するIP 3依存性カルシウムチャネルを活性化する細胞質O。 (細胞は、化合物添加の前にロードされると)のFluo-4カルシウムの相互作用は、蛍光シグナル(ステップ2)をもたらす。ソフトウェアは、相対蛍光単位時間の関数で(RFU)値として結果を提示し、ピーク高さは、濃度依存的にリガンド濃度と相関する。これらのデータは、次いで、リガンド-受容体対(工程3)のEC 50値を決定するために、濃度-応答曲線に変換することができる。
プロトコル
注:細胞が関与するすべてのアクションは層流で働くことによって、無菌環境で行うべきである。
HEK293T細胞株の1。メンテナンス
- 5%CO 2の加湿インキュベーター中、37℃でT-75フラスコ内HEK293T細胞を成長させる。
- 通路80%のコンフルエンスに達した細胞。注:これは、通常3〜4日かかります。連続培養中の細胞は、スクリーニングのために20〜25使用可能な通路を可能にする。
- 塩化カルシウム及び塩化マグネシウムなしにダルベッコのリン酸緩衝生理食塩水(PBS)を配置し、PBS-トリプシン - エチレンジアミン四酢酸(EDTA)(500 mlのPBSを10mlのトリプシン-EDTA溶液および4.5ミリリットルの4%EDTAを補充した)および増殖培地(500ミリリットルダルベッコ改変イーグル培地は - 高グルコース[DMEM中]事前に、室温で10%ウシ胎児血清[FBS]および1 mMのペニシリン - ストレプトマイシン[PS])、半時間で補充。
- 削除する細胞からの古い成長培地。 3ミリリットルのPBSで死細胞を洗い流して、再度、PBSを除去します。
- 3ミリリットルのPBS-トリプシン-EDTAは、室温で1分間インキュベートし、ソリューション(注)を削除し、追加します。細胞の形態は、星型の球状のために変わります。
- 穏やかなタッピングによってフラスコの底から細胞を緩め、新鮮な増殖培地10mlでボトムを数回すすぐことにより細胞を回収。
- 14ミリリットルの新鮮な増殖培地を含有し、5%CO 2の加湿インキュベーター中、37℃でインキュベートする新しいT-75フラスコに転写、細胞培養液1ml。
HEK293T細胞の2。一過性トランスフェクション
- 実際のカルシウム動員アッセイが行われる前にT-75フラスコ3日間でHEK293T細胞を成長させる。空の発現ベクター、ネガティブコントロールとして、そしてOで3のT-75フラスコ、受容体構築物でのトランスフェクションのための1、トランスフェクションのための1つを使用してくださいトランスフェクション制御のためのNE。注:工程1.2に記載のように細胞の継代を行う。複数の96ウェルプレートをスクリーニングしなければならない場合、T-150フラスコ(これを行うには、ステップ1.2.5における二重リストされたすべての量は、2.3、3.1.3および3.1.4)細胞のより高い収率を得るために使用することができる。
- 細胞培養物は、50〜70%コンフルエンスに近づくまで、20〜24時間、5%CO 2の加湿インキュベーター中、37℃でフラスコをインキュベートする。
- 目的のGPCRおよびGα16構築物、空のベクターおよびGα16構築物第二のフラスコ、およびトランスフェクションコントロールおよびGα16構築物で三分の一をコードする発現ベクターを用いた細胞の同時トランスフェつの集団。注意:このプロトコルでは、 ショウジョウバエ sNPF受容体をpcDNA3.1哺乳動物発現ベクターにクローニングした13。 JetPRIMEは、トランスフェクションを行うために使用されたが、他のトランスフェクション試薬も同様に使用することができる。
- に追加7.8μgのDNA(3.9μgの受容体構築物または空のベクター、及び3.9μgのGα16発現構築物)を1.5 mlマイクロチューブにとJetPRIME緩衝液500μlを追加するotal。チューブをボルテックスでよく混ぜ、まもなくスピンダウン。
- 、JetPRIME試薬の37.5μlを加え、ボルテックスし、14,000 X gで1分間スピンダウン。室温でのトランスフェクション混合物を10分間インキュベートする。
- 細胞培養培地にトランスフェクション混合物を滴下を追加し、培養フラスコの壁との接触を避け培地に直接ピペットでするようにしてください。 20〜24時間、5%CO 2の加湿インキュベーター中で37℃でフラスコをインキュベートする。
3。カルシウム動員アッセイ
- トランスフェクトした細胞を収集し、96ウェル黒色壁、透明底プレート中で、それらをシード。
- 10%透析FBSを補充したPBS、PBS-トリプシン-EDTA及びDMEM伝達媒体を配置する(500ミリリットルのDMEM事前に1%PS)を室温で半時間。
- コート96ウェル(プレート当たり5.85ミリリットルのPBSと150μlのフィブロネクチン[0.1%])、ウェル当たりフィブロネクチン(0.0025%)を含むPBS60μlの黒壁、透明底プレート。蓋の上で1時間室温で培養する。井戸から溶液を除去し、室温で蓋なしで1時間、再び培養する。あるいは、それは増強された細胞付着プレコーティングしたプレートを使用することが可能である。
- 細胞からの古い成長培地を外し、3ミリリットルのPBSで死細胞を洗い流してPBSを除去します。
- 、3ミリリットルのPBS-トリプシン-EDTAを追加する1分間インキュベートし、溶液を除去。注意:星型形状の球に由来する細胞に変化の形態を。
- 穏やかなタッピングによってフラスコの底から細胞を緩めて、DMEM伝達媒体10mlで数回すすぐことによってそれらを収集。 50ミリリットルファルコンチューブに細胞を移す。
- カウントミリリットル当たりの細胞数(ここをNucleoCounterを用いて行ったが、ビルケルのチャンバーでも可)。 1.5 mlのマイクロ遠心チューブに細胞培養液100μlを加える。 100μlの溶解バッファーを加え、チューブをタップして混ぜる。 100μlの安定化緩衝液を加え、タップして混ぜる。
- 細胞懸濁液をNucleoCassetteを記入し、カウンターで細胞を数える。溶解を追加し、ステップ3.1.6にバッファを安定させる際に細胞が要因3で希釈したように、3でセルの数を掛けます。
- 600000個/ mlの最終濃度になるように細胞を希釈及び/ウェルあたり約90,000細胞の細胞密度を得るために、コーティングされたプレート中のウェルあたり150μlの細胞を播種する。気泡を回避し、連続した細胞層を得るために細胞を均一に拡散するプレートをタップします。 16〜24時間、5%CO 2の加湿インキュベーター中で37℃で培養する。
- 蛍光色素で細胞をロードし、COを準備mpoundプレート。
- ハンクス液(HBSS)を準備/ HEPES / Ca 2 +を /ウシ血清アルブミン(BSA)バッファー:165μLのCaCl 2ストック溶液を加える(蒸留水中の1MのCaCl 2 [DH 2 O] -室温で保存)、 500μlのHEPESストック溶液(DH 2 O中1MのHEPES、pHが7.4 -室温で保存)、および0.05グラムのBSAから50mlのHBSS。脂肪酸は、目的の受容体のカルシウムシグナルを損なう、特定の受容体を活性化することができるように、その脂肪酸フリーBSAは、カルシウムアッセイのために使用されます。
- (100X、250 mM)をプロベネシド溶液を調製:5ミリリットルの水酸化ナトリウム(1 M)で0.71グラムプロベネシドを溶解し、HBSS / HEPES / Ca 2 +を / BSA緩衝液の50μlのHEPES原液と5ミリリットルを追加-常に新鮮な溶液を調製する。注意:プロベネシド、それによって蛍光シグナルを減らし、細胞質からのFluo-4を除去することができる無機アニオントランスポーターを阻害する。これは、色素のロードを実行することをお勧めしますプロベネシドの存在下および非存在下ではプロベネシドでもアゴニスト媒介シグナルを減少させる可能性があるため、無機アニオントランスポーターは、調査中の特定の細胞株では潜在的な問題を提示するかどうかを判断します。
- 洗浄バッファーを準備します。、50ミリリットルのHBSS / HEPES / Ca 2 +を / BSA緩衝液に500μlのプロベネシドソリューションを追加してpHを7.4に調整し、緩衝液をろ過する。常に新鮮な緩衝液を調製し、プレートを必要とするあたり50mlの緩衝液。
- 10%のプルロニック酸溶液を調製:50μlのDMSOを50μLを混ぜロニック酸(ジメチルスルホキシド20%W / V [DMSO]) - 結晶化が発生した場合、発熱37℃にし、常に新鮮な溶液を調製する。
- のFluo-4 AM溶液(1mMの)を準備し、完全に溶解するまで、50μgののFluo-4 AMおよび渦が含まれているバイアルに、44μlの10%のプルロニック酸溶液を加える。フルオロフォアの退色を防ぐために、光への露出を避けてください。
- ローディングバッファーを準備します。8.8ミリリットルのDMEM supplementeを追加のFluo-4 AM溶液(44μL)および渦に10 HEPESおよび2.5mMプロベネシド(pH7.4)でD。常に新鮮なバッファーを使用しています。
- 細胞から培地を廃棄し、ウェルあたり200μlのPBSで細胞を洗浄し、PBSを除去します。
- ウェル当たり55μlのローディング緩衝液を添加し、室温で1時間インキュベートする。光にプレートの露出を防ぐために、アルミホイルでプレートをラップします。
- これらは細胞発現システムのための有害な( 例えば 、アセトニトリル)である溶媒中に溶解している場合は、画面の前に化合物を乾燥してください。
- シリコン処理を1.5mlマイクロ遠心チューブに洗浄緩衝液中のペプチドを可溶化する。濃度-応答分析を実行し、リガンドのEC 50値を決定するために希釈系列を調製する。化合物プレート(V字型96ウェルプレート)の対応するウェルに70μlのリガンドを添加し、各プレート上で陽性(内因性アゴニスト)および陰性対照(洗浄緩衝液)を含む。しない電子メール:化合物が洗浄緩衝液中に溶解しない場合、一方は、水または油および他の水不溶性の物質( 例えば 、Kolliphor EL)を乳化可溶化溶液として調査中のセルに有害でない他の溶媒を試みること。
- 三連ですべてのサンプルを測定します。化合物プレートからのリガンド50μlのアッセイ中に細胞プレートの100μlの洗浄緩衝液で十分に移すので、その所望の最終濃度を3倍に化合物を製造することに留意してください。
- セルプレートからローディングバッファーを捨て、各ウェルに100μlの洗浄バッファーを追加します。室温でプレート15分間インキュベートし、光への曝露を防ぐ。
- セルプレートから洗浄バッファーを捨て、各ウェルに100μlの新しい洗浄バッファーを追加します。
- 37℃で15分間、細胞プレート、化合物プレート及びチップラック(96ウェル、基地局装置ピペットチップ)をインキュベートする
- 作成およびソフトウェアを使用して、所望のプロトコルファイルを読み込んで、読み出しチャンバのための温度制御ユニットを活性化する。ここで、525nmで(完全な96ウェルプレートを測定するには、約25分かかります)連続する読みの間の1.52秒間隔で同時に2つの行分間、37℃でカルシウム応答を測定する。 26μL/秒、135μLのピペット高さに設定ディスペンス速度で、488 nmまでのFluo-4の励起を設定し、セルプレートへの化合物の全量50μlを転送、読み出し開始後18秒。
- 局装置の適切な引き出し中の化合物とセルプレートと、チップラックを配置します。
- フレックスモードでの実際の画面を起動する前に、エンドポイント·モードで同じ励起および発光波長で細胞プレートの単一の読み取りを実行します。注意:この測定は、相対蛍光単位(RFU)値を与え、私たちの間でのばらつきを検出することができますプレートのLLS。 20,000〜40,000の間の値は許容できると考えられている。
- アッセイを開始し、ソフトウェアを使用してデータを分析する。
結果
50μMから0.001の範囲の濃度シリーズはすべて4 ショウジョウバエ sNPFペプチド(:AQRSPSLRLRFamide、 ドローム -sNPF-2:SPSLRLRFamide、 ドローム -sNPF-3:PQRLRWamide、 ドローム - sNPF-4:PMRLRWamide ドローム -sNPF-1)について試験した一過ショウジョウバエ sNPF受容体と無差別Gα16ユニットを発現HEK293T細胞上。 GPCRは、0.1nMの最終濃度までの全ての4つのペプチドにより活性化し、受容体活性化は、濃度依存的であった。 図2 ドローム -sNPF-1濃度系列の3つの複製の一つに対応するグラフを示す。 ( - 1μMのPAR 1)高蛍光シグナル(30,000 RFUを±)につながる、内因性プロテアーゼ活性化受容体-1の強力な活性化を誘発し、陽性対照は、一方、ネガティブコントロール(洗浄バッファー)は、蛍光シグナルを誘導しなかった。なお、偏差の典型的な曲線が異常を示すことがあります。例えば、ベースラインに戻ることなく、曲線の継続的な上昇は、カルシウムイオノフォアの存在、またはカルシウムの漏れの原因と混乱脂質二重層などの非受容体を介したシグナルに関連する可能性があります。
ソフトウェアは、アクティベーションのパーセンテージや、とりわけ、異なる濃度の標準誤差を決定するために数式を入力することができます。得られたデータを図3の4つのランス -sNPFペプチドについて示されるように、EC 50値を推定するために予備的な濃度-応答曲線を作成するために使用されている。 図3の曲線はまた、一連の濃度の負の制御のためのデータを含むドローム -sNPFペプチドは、空のpcDNA3.1ベクターをトランスフェクトしたHEK293T細胞で試験した。結果は、これらの細胞へのペプチドの添加は、内因性受容体に影響を及ぼさないことを示しているが、実際にACTIV目的の受容体を食べた。蛍光に基づくカルシウム動員アッセイは、次いで、独立して3回繰り返した。初期画面の予備的な濃度-応答曲線に基づいて、試験した濃度曲線( 図4)のダイナミックレンジをカバーするように適合させた。 ドローム -sNPF-1のEC 50値(2.04±1.48 nMの[95%信頼区間])、 ドローム -sNPF-2(5.89±3.74 nM)を、 ドローム - sNPF-3(5.55±3.95 nm)をドローム - sNPF - 4(0.50±1.01 nM)を、それらが受容体を活性化するのに同等に強力であることを示し、同様である。
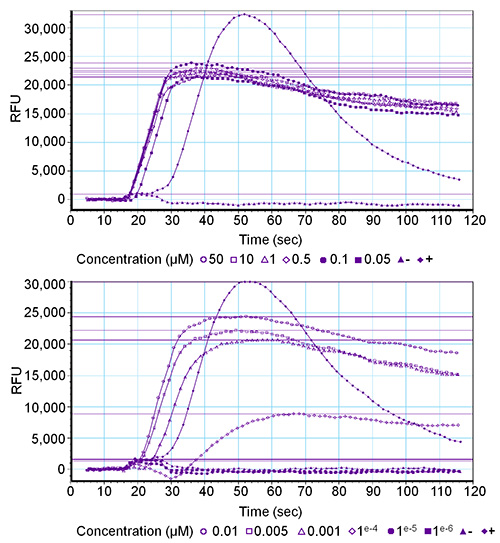
図2。濃度系列の受容体を介した蛍光応答のためのソフトウェアのグラフィカルな出力。十二の最終濃度(50μMから0.001の範囲の)OF ドローム -sNPF-1ペプチドは、 ドローム -sNPF受容体上で試験した。活性化は相対蛍光単位(RFU)値で表される。上のグラフは、6最高濃度と6最低濃度の下のグラフの結果が得られます。ポジティブコントロール(+)は、PAR 1(1μM)であり、陰性対照( - )は、洗浄緩衝液である。
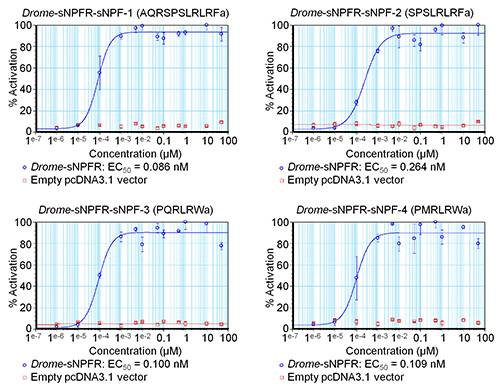
図3単一蛍光ベースのカルシウム動員アッセイによって決定ショウジョウバエ sNPFペプチドの予備的な濃度-応答曲線。一過4 ショウジョウバエ sNPFペプチドについてHEK293T細胞において発現ショウジョウバエ sNPF受容体の濃度-反応曲線は青色で示されている。 (赤で表示)ネガティブコントロールのために、ペプチドは、HEK293T上で試験した空のpcDNA3.1ベクターでトランスフェクトされた細胞。蛍光応答は、最も高い値(100%活性化)に対して(%)として示されている。曲線は、各濃度シリーズは三重に測定されたある実験の結果である。垂直バーは時々使用される記号(その場合、唯一のシンボルが描かれている)よりも小さい平均(SEM)の標準誤差を表す。
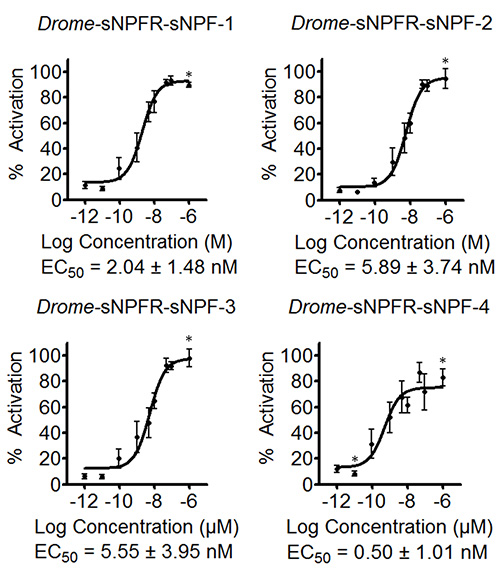
図4濃度応答曲線を3つの独立し蛍光ベースのカルシウム動員アッセイによって決定ショウジョウバエ sNPFペプチドのEC 50値を対応する。一過4 ショウジョウバエ sNPFペプチドについてHEK293T細胞において発現Drosopihla sNPF受容体の濃度応答曲線は結果である3独立した私のトリプリケート(nは≥9)で行わasurements各。蛍光応答は、最も高い値(100%活性化)に対して(%)として示されている。アスタリスクは、n≤9。エラーバーは時々(その場合、唯一のシンボルが描かれている)に使用される記号よりも小さい、SEMを示している濃度を示している。 EC 50値は、それらの95%信頼区間と共に示されている。
ディスカッション
蛍光に基づくカルシウム動員アッセイは、既に正常にマーテンスらによって行われたショウジョウバエ sNPFペプチド作動性シグナル伝達系の機能的特徴を確認するために適用した。生物発光アッセイとと風水ら 。電気生理学的ア ッセイ13,15と。 ドローム -sNPF - ;フルオ= 2.04 nMで、ルミ= 51 nMの:HEK293T細胞における蛍光アッセイを用いて得られたEC 50値は、約CHO細胞( ドローム -sNPF-1で行われる生物発光アッセイを用いて得られたものよりも10倍である2:フルオ= 5.89 nMで、ルミ= 42 nMで、 ドローム -sNPF-3:フルオ= 5.55 nMで、ルミ= 31 nMで、 ドローム - sNPF-4:フルオ= 0.50 nMで、ルミ= 75 nM)を。これらの変動は、使用される発現系のいずれかが所定の受容体の機能的発現に適してもよく、またはいくつかの受容体の折り畳みがcあまり効率的であることができるという事実を含むいくつかの要因によって説明することができるertain細胞型。一般的には、生体内でのペプチド-受容体相互作用の生理的関連性を支持し、蛍光および生物発光アッセイの両方とそれらの受容体で試験した場合にすべての4 ドローム -sNPFペプチドのEC 50値は、ナノモル範囲内にある。
ショウジョウバエ sNPFシグナリングシステムが正常に実験装置でのトランスフェクション対照であるため、活性化リガンドが既知の受容体とのトランスフェクション制御は、ここで紹介する画面に含まれていないことに注意してください。 HEK293T細胞(PAR 1)及び陰性対照(洗浄緩衝液)の内因性リガンドと陽性対照は、スクリーンに含まれた。 PAR 1の結果は、細胞が良好な状態であることを示した。陰性対照(洗浄緩衝液)をペプチドが溶解している媒体はinfを可能性のある汚染物を含まなかったことを示す蛍光シグナルを誘発しなかった結果をluence。
以前に特徴付けショウジョウバエ sNPF信号システムは、蛍光ベースのカルシウム動員アッセイを説明するために、ここで使用された。この目的のために、活性化リガンドの濃度系列を直ちに試験した。オーファン受容体は数百の化合物を含むライブラリをテストするためのスクリーニングアッセイにおいて過剰発現させた場合しかし、それはリガンド( 例えば 、10または1μM)の比較的高い最終濃度で最初の画面にお勧めします。活性化化合物の検出に続いて、その化合物の希釈系列を、濃度-応答曲線を構成し、EC 50値を決定するためにスクリーニングすることができる。
受容体の活性化リガンドが決定されると、細胞内シグナル伝達経路は、さらにプロトコルを適合させることにより調べることができる。アッセイは上述のように実施するが、G ^同時トランスフェクトすることができるなし5、16ユニット。カルシウム応答を測定する場合には、細胞発現系の内因性Gαq個のサブユニットを有する受容体に結合することを意味する。まだ蛍光シグナルが観察されない場合に、他の二次メッセンジャー( 例えば 、cAMP)の濃度の変化を測定するプロトコルを適用することができる。
構造活性相関(SAR)の研究はまた、受容体活性化のために必要なペプチドのコア配列を定義するために行うことができる。まず、切断型シーケンスは、依然として受容体を活性化することができるペプチドの最小アミノ酸配列を定義するために評価される。次に、ペプチドは、体系的にすべてのアミノ酸がアラニン残基に置換された試験することができる。受容体上の合成アラニン置換シリーズのテストは、受容体の活性化のための24,25アミノ酸の各々の重要性を決定することができます。
その頻繁な使用実績のある効率にもかかわらず、cacyは、ここに記載されるアッセイは、目的の特定のレセプターに対して最適な結果を得るためにいくつかの適応を必要とすることができることを強調しなければならない。 Gαサブユニット16は、ほとんどのGPCRに結合するという利点を有するが、また、そのGαqを22を介して内在的に結合する受容体に対するドミナントネガティブ効果を有することができる。この場合には、新規なカルシウムアッセイの最適化の間のGタンパク質の異なる組み合わせを試験するとGα16の存在下または非存在下で、Gαqの共役受容体についての結果を比較するために有用であり得る。受容体活性化を検出するために相互作用するGタンパク質とは無関係である代替的なアッセイはまた、( 例えば 、FLIPR膜電位アッセイキットによって)、例えばGFP-標識されたアレスチンのトランスロケーション、又は膜電位の変化を検出するように、行うことができる。のFluo-4 AMが、ここでは他のカルシウム感受性蛍光プローブの広い配列を使用し、独自のスペクトルとのそれぞれとchemicのほからのプロパティは、提供されています。最も適切なフルオロフォアは、GPCR、細胞の種類や利用可能なプレートリーダーに基づいて選択することができますが、実験的検証が必要である。トランスフェクトされたDNAと各受容体トランスフェクション試薬、細胞株の組合せについて決定されるべきDNA /トランスフェクション試薬比必要量。最後に、連続培養中の細胞が20-25のみ使用可能な通路がスクリーニングアッセイを実行できることに留意すべきである。
開示事項
著者らは、開示することは何もありません。
謝辞
著者らは、研究財団フランダース(FWO-ブラーンデレン、ベルギー、G.0601.11)およびKuルーベン研究財団GOA/11/002を認める。 FWO-ブラーンデレンからフェローシップからのIB、TJとLTの利点。
資料
| Name | Company | Catalog Number | Comments |
| HEK293T cells | |||
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Trypsin-EDTA solution (0.25%) | Sigma-Aldrich | T4049 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | MP Biomedicals | 195173 | |
| Dulbecco's Modified Eagle's Medium - high glucose (DMEM) | Sigma-Aldrich | D5796 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| Penicillin-Streptomycin (P-S) | Sigma-Aldrich | P4333 | |
| jetPRIME | Polyplus transfection | 114-01 | FuGENE HD Transfection Reagent (Promega); Lipofectamine LTX & Plus Reagent (Life technologies) |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392 | |
| Fibronectin from human plasma | Sigma-Aldrich | F0895 | |
| Reagent A100, Lysis buffer | Chemometec | 910-0003 | |
| Reagent B, Stabilizing buffer | Chemometec | 910-0002 | |
| CaCl2 | Sigma-Aldrich | C3881 | |
| HEPES | Sigma-Aldrich | H4034 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A4503 | |
| HBSS buffer: Hank's Balanced Salt Solution | Sigma-Aldrich | H8264 | |
| Probenecid | Sigma-Aldrich | P8761 | |
| NaOH (1 M) | Vel | 2781 | |
| Pluronic acid | Invitrogen | P-3000MP | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Fluo-4 AM | Invitrogen | F14201 | Fluo-3, Rhod-2, Fluo-5, Calcium Green-1, ... (Invitrogen) |
| TPP tissue culture flasks (T-75 and T-150) | Sigma-Aldrich | Z707503 and Z707554 | |
| FlexStation device | Molecular Devices | NOVOstar (BMG Labtechnologies); FLIPR (Fluorometric Imaging Plate Reader) (Molecular Devices) | |
| Black-walled polystyrene plates (96 wells) with clear bottom | Greiner Bio-One | 655090 | Corning 96-well flat clear bottom black polystyrene poly-D-lysine coated microplates |
| NucleoCassette | Chemometec | 941-0001 | |
| NucleoCounter NC-100 | Chemometec | ||
| Microcentrifuge tubes, siliconized | BioCision | BCS-2470 | |
| Polystyrene V-shaped 96-well plates | Greiner Bio-One | 651101 | |
| 96-Well, FlexStation pipette tips | Molecular Devices | 9000-0912 | |
| Soft Max Pro software | Molecular Devices |
参考文献
- Bockaert, J., Pin, J. P. Molecular tinkering of G protein-coupled receptors an evolutionary success. EMBO J. 18 (7), 1723-1729 (1999).
- Gether, U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors. Endocr Rev. 21 (1), 90-113 (2000).
- Drews, J. Drug discovery a historical perspective. Science. 287 (5460), 1960-1964 (2000).
- Marinissen, M. J., Gutkind, J. S. G-protein-coupled receptors and signaling networks emerging paradigms. Trends Pharmacol Sci. 22 (7), 368-376 (2001).
- Bendena, W. G. Neuropeptide physiology in insects. Adv Exp Med Biol. 692, 166-191 (2010).
- Van Hiel, M. . B., et al. Neuropeptide receptors as possible targets for development of insect pest control agents. Adv Exp Med Biol. 692, 211-226 (2010).
- Tang, X. . L., Wang, Y., Li, D. . L., Luo, J., Liu, M. . Y. Orphan G protein-coupled receptors (GPCRs): biological functions and potential drug targets. Acta Pharmacol Sin. 33 (3), 363-371 (2012).
- Civelli, O., Reinscheid, R. K., Zhang, Y., Wang, Z., Fredriksson, R., Schiöth, H. B. G protein-coupled receptor deorphanizations. Annu Rev Pharmacol Toxicol. 53, 127-146 (2013).
- Mertens, I., Vandingenen, A., Meeusen, T., De Loof, A., Schoofs, L. Postgenomic characterization of G-protein-coupled receptors. Pharmacogenomics. 5 (6), 657-672 (2004).
- Brough, S. J., Shah, P. Use of aequorin for G protein-coupled receptor hit identification and compound profiling. Methods Mol Biol. 552, 181-198 (2009).
- Gee, K. R., Brown, K. A., Chen, W. N. U., Bishop-Stewart, J., Gray, D., Johnson, I. Chemical and physiological characterization of fluo-4 Ca2+-indicator dyes. Cell Calcium. 27 (2), 97-106 (2000).
- Beets, I., Lindemans, M., Janssen, T., Verleyen, P. Deorphanizing G protein-coupled receptors by a calcium mobilization assay. Methods Mol Biol. 789, 377-391 (2011).
- Mertens, I., Meeusen, T., Huybrechts, R., De Loof, A., Schoofs, L. Characterization of the short neuropeptide F receptor from Drosophila melanogaster. Biochem Biophys Res Commun. 297 (5), 1140-1148 (2002).
- Lu, H. -. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. J. Vis. Exp. (50), e2732 (2011).
- Feng, G., et al. Functional characterization of a neuropeptide F-like receptor from Drosophila melanogaster. Eur. J. Neurosci. 18 (2), 227-238 (2003).
- Nässel, D. R., Wegener, C. A comparative review of short and long neuropeptide F signaling in invertebrates any similarities to vertebrate neuropeptide Y signaling. Peptides. 32 (6), 1335-1355 (2011).
- Grimmelikhuijzen, C. J. P., Hauser, F. Mini-review The evolution of neuropeptide signaling. Regul Pept. 177, S6-S9 (2012).
- Caers, J., Verlinden, H., Zels, S., Vandersmissen, H. P., Vuerinckx, K., Schoofs, L. More than two decades of research on insect neuropeptide GPCRs an overview. Front Endocrinol (Lausanne. 3 (151), 1-30 (2012).
- Kozak, M. An analysis of 5’-noncoding sequences from 699 vertebrate messenger RNAs). Nucleic Acids Res. 15 (20), 8125-8148 (1987).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase. CJ Biol Chem. 270 (25), 15175-15180 (1995).
- Ral Conklin, B., et al. Carboxyl-terminal mutations of Gqα and Gsα that alter the fidelity of receptor activation. Mol Pharmacol. 50 (4), 885-890 (1996).
- Kostenis, E. Is Gα16 the optimal tool for fishing ligands of orphan G-protein-coupled receptors. Trends Pharmacol Sci. 22 (11), 560-564 (2001).
- Robas, N. M., Fidock, M. D. Identification of orphan G protein-coupled receptor ligands using FLIPR assays. Methods Mol Biol. 306, 17-26 (2005).
- Caers, J., Peeters, L., Janssen, T., De Haes, W., Gäde, G., Schoofs, L. Structure-activity studies of Drosophila adipokinetic hormone (AKH) by a cellular expression system of dipteran AKH receptors. Gen Comp Endocrinol. 177 (3), 332-337 (2012).
- Peeters, L., et al. A pharmacological study of NLP-12 neuropeptide signaling in free-living and parasitic nematodes. Peptides. 34 (1), 82-87 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved